オミクロン株は、ヒトの初代鼻上皮培養物中で急速な複製を示し、エンドソームの侵入経路を効率的に利用(2021年12月)
※2022年5月に version.2 投稿。
The SARS-CoV-2 variant, Omicron, shows rapid replication in human primary nasal epithelial cultures and efficiently uses the endosomal route of entry.
SARS-CoV-2 の変異体であるオミクロンは、ヒトの初代鼻上皮培養物中で急速な複製を示し、エンドソームの侵入経路を効率的に利用します。
元→2021.12.31.474653v1.full.pdf (biorxiv.org)

Abstract
2021年の終わりに、新しいSARS-CoV-2の亜種であるオミクロンが出現し、世界中に急速に広まりました。
オミクロンの多数のスパイク変異は、ポリクローナル抗体反応からの部分的な免疫回避につながり、頻繁な再感染とワクチンの突破を可能にすることが実証されています。
しかし、これらの抗原の違いだけでその急速な成長を説明することはありそうにないようです。 ここでは、オミクロンが人間の初代気道培養で急速に複製することを示しています。これは、以前は主流だった懸念すべき変異株であるデルタよりもはるかに優れています。
オミクロンスパイクは、他の変異体よりも強く結合する主要な受容体として、引き続きヒトACE2を使用しています。
オミクロンスパイクは、さまざまな家畜の鳥類、馬蹄形のコウモリ、マウスなど、いくつかの異なる動物のACE2を発現する細胞への侵入の強化を仲介します。人獣共通感染症の傾向が高く、以前の亜種よりもSARS-CoV-2の動物貯蔵庫を確立する可能性が高いことを示唆しています。
ただし、他のSARS-CoV-2バリアントとは異なり、オミクロンスパイクはシンシチウム形成を誘発する能力が低下しています。
さらに、オミクロンは、エンドソーム経路を介して、TMPRSS2に依存しない方法で細胞に効率的に侵入することができます。
これにより、オミクロンは呼吸上皮内のより多くの細胞に感染し、より低い被ばく線量でより感染性が高くなり、内因性の伝染性が向上すると考えられます。
Introduction
SARS-CoV-2のパンデミックの2年目は、抗原性が変化したり、伝染性が強化されたりしたSARS-CoV-2「変異体」が繰り返し出現したことで特徴づけられました。
5番目の「懸念される変異株」であるオミクロン(パンゴ系統BA.1)は、南アフリカで最初に検出されました。最初の検出からわずか1か月以内に、英国を含む多くの国でSARS-CoV-2症例の大部分を占める世界中に急速に広がっています。
オミクロンは、スパイク糖タンパク質遺伝子の前例のない33の変異を含む、ゲノム全体で合計51の変異によって特徴づけられます。
オミクロンと現在のワクチンで使用されている武漢のようなスパイクタンパク質との間に生じる大きな抗原距離は、オミクロンに対するワクチンの有効性が低く、再感染の頻度が高いことと相関しています。
ただし、ワクチンブレイクスルーと再感染だけで、オミクロンの急速な成長とデルタバリアントの置き換えを完全に説明できるかどうか、または人間の気道に感染する能力の本質的な増加が症例数の増加に寄与する可能性があるかどうかは不明です。
Results
Omicron replicates more rapidly in primary cultures of human nasal epithelial cells but is attenuated for entry in many cell lines
オミクロンは、ヒトの鼻上皮細胞の初代培養でより迅速に複製しますが、多くの細胞株への侵入については弱毒化されています
ヒトACE2およびTMPRSS2プロテアーゼを過剰発現するVeroE6細胞(Vero-AT細胞)では、デルタ変異体とオミクロン変異体の両方がプラークを形成しましたが、オミクロンのプラークははるかに小さく、はっきりしていませんでした(図1A)。

各バリアントのウイルスストックには、E遺伝子のウイルス量とプラーク力価で測定した場合と同様のウイルスRNAと感染力の比率が含まれていました。
各バリアントの等力価を使用して、ヒト鼻上皮細胞(hNEC)の初代培養物のトランスウェルに接種するか、Vero E6-ACE2 / TMPRSS2(Vero-AT)細胞、または不死化ヒト肺細胞であるCalu-3細胞(豊富なACE2とTMPRSS2を表現しています)に感染させました。
気道培養物の頂端表面、または単一培養物を覆う上澄みに放出されたウイルスは、感染後3日間毎日収集され、ウイルス量は、E遺伝子のRT-qPCRとVero-AT細胞の感染性ウイルスのプラークアッセイによって決定されました (図1B)。

ヒト鼻上皮細胞(hNEC)では、オミクロンは初期の複製に大きな利点を示し、感染後24時間までにデルタよりも約100倍高いウイルス力価をもたらしました。
感染後48時間と72時間では、ウイルス力価はデルタと比較して低く、72時間では、オミクロンに感染したウェルから収集されたRNAに含まれるE遺伝子のコピーが少なくなりました。
これは、72時間の光学顕微鏡による観察と一致し、オミクロンに感染したウェルは完全な繊毛静止を示し、細胞死を示唆しましたが、デルタに感染したウェルでは繊毛の鼓動が依然として観察されました。
Vero-AT細胞では、オミクロンがこれらの細胞でより小さなプラークを形成したという観察にもかかわらず、2つの変異体の複製は同等でした(図1A)。
Calu-3細胞では、オミクロンのウイルス収量は、すべての時点でデルタよりも低かった。
Omicron outcompetes Delta in primary cultures of human nasal airway epithelial cells
オミクロンは、ヒトの鼻気道上皮細胞の初代培養でデルタを凌駕します
次に、hNEC、Vero-AT、またはCalu-3細胞の同じウェルに等量の各バリアントを接種する混合競合アッセイを実行しました。
もう一度、初代培養の頂端表面から放出されたウイルスまたは不死化した細胞に重なる上澄みに放出したウイルスは毎日収集され、E遺伝子RT-qPCRによってウイルスの総複製が評価されました(図2Aの黒い点線)。また、オミクロンまたはデルタスパイクのaa210-215領域に存在する、または存在しない固有の挿入/削除ペアを利用した、新しいバリアント固有のPCRプロトコルを使用した各バリアントのRNA収量についても説明します(補足図S1Aを参照)。

最初に、各バリアントからRNAの一連の人工混合物を作成することにより、特定のRT-qPCRを検証しました(補足図S1B)。
一次hNECの混合感染中、オミクロン分離株はデルタを急速に凌駕したため、感染後24時間の頂端洗浄から検出可能なRNA産物を産生する唯一のウイルスでした。
対照的に、混合感染の両方のウイルスは、Vero-AT細胞で同程度の量を維持し、Calu-3細胞では、デルタがオミクロンを凌駕し、感染後72時間で優勢になりました(図1A)。
重要なのは、完全に異なるデルタ対オミクロン分離株のペアを使用して、競合実験を繰り返したことです(図1B)。

2番目のDelta分離株は、サブリネージAY.4.2でした。これは、2021年秋に英国で出現し、他のDeltaサブリネージを凌駕していました。
以前と同様に、AY.4.2は、プライマリhNECではオミクロンの2番目の分離株に急速に打ち負けましたが、Vero-ATでは打ち負かされませんでした。
Calu-3では、AY.4.2がオミクロン分離株を急速に上回り、これらの細胞でのオミクロンの深刻な減衰を再び示唆しています。

Omicron continues to use ACE2 for cell entry rather than other protein receptors
オミクロンは、他のタンパク質受容体ではなく、ACE2を細胞侵入に使用し続けています
オミクロンが鼻細胞でこのような急速な複製を示す理由を説明する1つの仮説は、受容体結合ドメイン(RBD)の変異が多数あるため、オミクロンは、他の季節性またはエピデミックコロナウイルスによって使用されるものなど、異なる、またはより広範囲のタンパク質受容体を使用する場合があるというものです。
これをテストするために、アンジオテンシン変換酵素2(ACE2)、アミノペプチダーゼN(APN)、ジペプチジルペプチダーゼ-4(DPP4)などのさまざまな標準的なヒトコロナウイルス受容体を発現する293T細胞へのオミクロンスパイク含有レンチウイルスシュードタイプの侵入を調査しました(図3A)。

229EおよびMERSのスパイクタンパク質を発現する偽ウイルスは、それぞれの標準的な受容体であるAPNまたはDPP4が発現すると、より効率的に侵入しましたが、NL63およびOmicronを含むすべてのSARS-CoV-2バリアントは、ACE2が過剰発現した場合にのみ効率的に侵入しました。これは、他の人によって確認されているように、これがOmicronの標準的なタンパク質受容体のままであることを意味します。
さらに、フローサイトメトリーベースの方法を使用して、オミクロンスパイクタンパク質とヒトACE2の相互作用を確認し、可溶性ヒトACE2とさまざまな膜結合スパイクタンパク質の相互作用を測定しました(図3B)。

このアッセイは、HEK 293Tの表面でスパイク全体を発現させ、可溶性の蛍光ACE2への結合を測定することに基づいているため、RBDのみの生物物理学的手法とは異なり、スパイクの動的なコンフォメーション変化の影響を組み込むことができるという利点があります。
オミクロンスパイク全体は、アルファまたはデルタバリアントのスパイクタンパク質よりもヒトACE2に結合することがわかっています。
ただし、追加の置換Q498Rを含むように設計されたAlpha Spikeは、Omicron Spikeと同様の結合を示し、OmicronSpikeでのN501YとQ498Rの組み合わせがヒトACE2への結合の強化に関与している可能性があることを示唆しています。
Omicron shows an extended ACE2 host range above other variants
オミクロンは、他の亜種よりも拡張されたACE2ホスト範囲を示しています
スパイクRBD内の置換は、SARS-CoV-2の宿主指向性を変化させ、マウス、フェレット、またはミンクでの複製を強化することが示されています。
これとは別に、米国の最近の研究では、オジロジカがウイルスの貯蔵庫として機能する可能性があることが立証されており、パンデミックの潜在的な将来の問題が浮き彫りになっています。
人獣共通感染症のリスクと、この亜種の継続的な高い症例数が組み合わさって、オミクロンの宿主範囲が大幅に異なるかどうかを調査することになりました。
オミクロンスパイクを含む偽ウイルスは、他のSARS-CoV-2変異体、特に家禽、馬蹄形コウモリ、マウスでは効率的に使用されていないいくつかの種のACE2タンパク質を使用して、細胞に著しく侵入することができました(図3C、補足図S2)。

実際、上記のフローサイトメトリーベースの結合アッセイを使用すると、既知のマウス適応N501Y19を含むAlpha Spike(図3D)よりも、全長OmicronSpikeタンパク質がマウスACE2に結合する効率がはるかに高いことがわかりました。
Despite containing mutations that enhance Spike cleavage, Omicron causes reduced syncytia formation compared to previous SARS-CoV-2 variants
スパイク切断を強化する変異が含まれているにもかかわらず、オミクロンは以前のSARS-CoV-2バリアントと比較してシンシチウム形成を減少させます
最初の波の分離株とその後のすべてのVOCからのSARS-CoV-2スパイクタンパク質は、細胞の表面に発現し、ACE2を発現する標的細胞と混合すると、シンシチウム形成を誘導します。
効率的なシンシチウム形成、およびSARS-CoV-2の細胞表面への侵入には、S1 / S2接合部の多塩基性フューリン切断部位でプロデューサー細胞でスパイクが事前に切断されている必要があります。
デルタバリアントのスパイク変異であるP681Rは、切断を促進するだけでなく、シンシチウム形成を増加させることが知られています。
オミクロンには、フューリン切断部位に隣接する2つの変異、N679KとP681Hが含まれており、野生型スパイクで見られるよりもフューリン切断を増加させる可能性があります(図4A)。

野生型スパイク(D614G)を発現するプラスミドに個別に導入されたこれらの変異はそれぞれ、実際にS1 / S2切断の増加をもたらしました(図4B、C)。
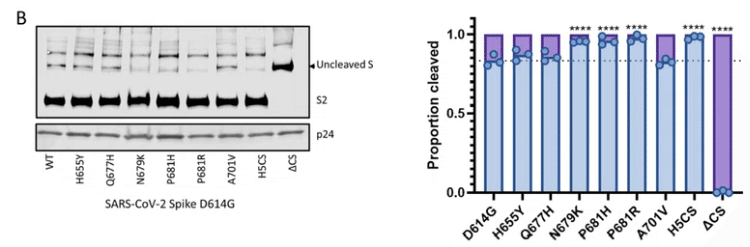
不可解なことに、オミクロンスパイク全体は、非常に効率的なシンシチウム形成をもたらしたD614Gまたはデルタスパイクと比較して、293TまたはBHK標的細胞との効率的な細胞融合を仲介しませんでした(図4D、E)。

これは、分割を強化するはずの変異を持っているにもかかわらず、オミクロンの細胞表面融合が以前の株と比較して弱められたことを示唆しています。
Omicron can efficiently enter cells by the endosomal entry pathway
オミクロンはエンドソーム侵入経路によって効率的に細胞に侵入することができます
オミクロンが異なる、または追加の細胞侵入経路を使用していたかどうかを判断するために、いくつかの異なる細胞株:293T-ACE2細胞・H1299s(非小細胞肺癌細胞)・Caco-2(豊富なACE2およびTMPRSS2を発現する不死化したヒト腸細胞)・Calu-3細胞への偽ウイルスの侵入を測定しました。
293T-ACE2およびH1299細胞では、オミクロンスパイクを含む偽ウイルスが効率的な侵入を媒介し、アルファまたはデルタスパイクよりも優れていましたが、Caco-2およびCalu-3では、オミクロン疑似ウイルスは他のすべての変異体よりも侵入が不十分でした(図5A)。

私たちと他の人は以前に次のことを示しています。つまり、S1 / S2接合部にフューリン切断部位が存在するため、SARS-CoV-2の初期の分離株は、IFITMタンパク質などの先天性因子によって大幅に制限されるエンドソームへの侵入を避けるために、細胞表面でTMPRSS2依存的に細胞に優先的に侵入します。
オミクロン偽ウイルスは、TMPRSS2発現を欠く細胞(293T-ACE2およびH1299)に最も効率的に侵入しましたが、豊富なTMPRSS2(Calu3およびCaco-2)を発現する細胞では、他のVOCと比較して侵入が弱まりました。
オミクロンがエンドソーム経路を介してより効率的に細胞に侵入したかどうかを調査するために、オミクロンスパイクを含むシュードウイルスの細胞表面侵入阻害剤(カモスタット、TMPRSS2などのセリンプロテアーゼの広範な阻害剤)またはエンドソーム侵入阻害剤(E64d、エンドリソソームカテプシン阻害剤)に対する相対感度をテストしました。
野生型スパイクを有するが、S1/S2 フリン切断部位 (ΔCS) を欠く対照シュードウイルスを含めました。これは、エンドソームを介して優先的に細胞に侵入することを以前に示しました。
TMPRSS2依存または非依存の両方の方法でSARS-CoV-2の侵入を可能にするCaco-2細胞では、オミクロンの疑似ウイルスの侵入は、他の亜種よりもE64dに対する感受性が高く、カモスタットに対する感受性が低く、ΔCSと同様に動作しました。
さらに、内因性発現を欠く293TにTMPRSS2を導入することにより、オミクロン偽ウイルス侵入の媒介におけるTMPRSS2の役割を評価しました(図5C)。

TMPRSS2の発現により、D614G、アルファ、デルタスパイクを含むシュードウイルスの侵入が25〜150倍に大幅に増加しましたが、オミクロンの疑似ウイルスの侵入はわずかに改善され、ΔCSと同程度に増加しました(約10倍)。
これは、オミクロンスパイクが細胞侵入のためにTMPRSS2にはるかに依存しておらず、エンドソーム経路を使用してより効率的にいくつかの細胞型に侵入できることを示唆しています。
私たちや他の人々は、エンドソームを介して侵入するSARS-CoV-2ウイルスが、IFITM2 / 3などの侵入エンドソームIFITM制限因子の阻害に対してより敏感であることを以前に示しました。
ただし、この制限は、アムホテリシンB(AmphoB)を追加することで解除できます。
Calu-3細胞とCaco-2細胞の両方で、ΔCSスパイクを伴う疑似ウイルスで見られるように、オミクロン疑似ウイルスの侵入はAmphoBの追加によって大幅に強化されましたが、他のバリアントとWTスパイクは強化されませんでした(図5D)。

最後に、ヒトの初代気道細胞における生オミクロンウイルスの侵入経路を調査しました。
hNECをカモスタットまたはAmphoBで前処理し、デルタまたはオミクロン分離株のマルチサイクル複製速度を比較しました。
以前と同様に、未処理のhNECでは、オミクロンウイルスはデルタウイルスよりもはるかに迅速に複製されました(図6、図1B)。

カモスタットの存在下では、デルタウイルスの複製は完全に阻害され、実験全体で力価の検出可能な増加は見られず、この変異体がTMPRSS2などのセリンプロテアーゼに完全に依存していることが再度確認されました。
対照的に、カモスタットの存在下で複製されたオミクロン分離株は、最終的には薬物なしの対照と同等の力価に達しました(図6)。
カモスタットの存在下での複製の遅延は、オミクロンの複製がTMPRSS2によって強化されているものの、この経路は必須ではないことを確認しています。
興味深いことに、AmphoBの追加は、どちらのバリアントの複製にもほとんど影響しませんでした。
これは、初代気道細胞での生ウイルス感染の状況では、デルタもオミクロンもIFITMタンパク質によって実質的に阻害されていないことを示唆しています。
これは、エンドソームのみを介して細胞に侵入したフューリン切断部位を欠く初期のベロ細胞適応SARS-CoV-2変異体の気道培養物のAmphoB処理後のウイルス複製の大幅な増強を以前に示したため、特に興味深いものです。
オミクロンウイルスは、エンドソームIFITM制限を回避しながら、エンドソーム経路を生産的に利用できるようになりました。
Discussion
オミクロンの世界的な蔓延に関するデータは、この亜種がこれまでに観察された中で最も急速に蔓延しているSARS-CoV-2亜種の1つであることを示しています。
再感染率の上昇とワクチンブレイクスルーは、間違いなくこの急速な成長に貢献していますが、伝染性の本質的な増加などの他の要因も一因となっている可能性があります。
ここでは、オミクロンウイルスが鼻上皮細胞の初代培養内で非常に迅速に複製することを示しています。これはデルタよりもさらに高速です。 デルタ株自体、以前に特徴付けられたどのバリアントよりも速く複製されてました。
オミクロンは、細胞向性の観点から専門性が低くなることで、この急速な複製率を達成したと考えています。
以前のSARS-CoV-2分離株は、TMPRSS2プロテアーゼを使用した細胞表面への侵入が必要なため、向性が制限されていました。その後の亜種、たとえばアルファやデルタは、さらに依存度が高くなったようです。
ただし、上気道の細胞のごく一部のみがACE2とTMPRSS2の両方を発現しています(表1)。
ここでは、オミクロンが、侵入のために遍在するエンドソーム経路をさらに使用するように適応していることを示しています。したがって、感染できる細胞型の数が増えます。単一細胞RNA seqデータは、ACE2とTMPRSS2を共発現するよりも、鼻の7倍多くの細胞がACE2と遍在するエンドソームカテプシンプロテアーゼの両方を発現することを示しています(図7)。

エンドソーム経路を使用したが、IFITMタンパク質などのエンドソーム制限因子によって厳しく制限されていた、フューリン切断部位を欠く以前のSARS-CoV-2変異体とは異なり、オミクロンはこの阻害に抵抗性があるようです。
侵入経路の切り替えにより固有の伝達率が向上しましたが、オミクロンスパイクタンパク質による細胞表面TMPRSS2の使用効率が低下したため、シンシチウム形成の傾向も低下しました。
COVID症例の剖検でシンシチウムが報告されており、シンシチウム形成の根底にあるフューリン部位での効率的な切断が動物モデルの疾患重症度の増強と関連しているため、これにより疾患の重症度が低下する可能性があります。
さらに、気管支腺癌に由来するCalu-3細胞におけるデルタウイルスの優勢と、初代鼻気道細胞におけるオミクロンウイルスとの対比は、次のことを示唆しています。つまり、オミクロン株は、感染部位で複製される可能性が高く、肺の深部では複製されない可能性があります。したがって、現在一部の動物モデルで見られているように、ウイルスを効率的な伝染に向けて、重篤な病気から遠ざけるように駆り立てます。
この研究では、他のいくつかの研究と一致して、オミクロンスパイクタンパク質がスパイクタンパク質全体のコンテキストで高いACE2結合をもたらし、これも伝達の増加に寄与する可能性があることを発見しました。
さらに、他のいくつかの報告にあるように、オミクロンスパイクは以前のどの亜種よりもマウスACE2によく結合し、一部の家禽種や特定のコウモリ種のACE2タンパク質にも結合することがわかりました。
これにより、オミクロンの宿主範囲がさらに拡大し、逆人獣共通感染症の可能性が高まり、将来のSARS-CoV-2変異体または組換え体が出現する可能性のある新しい野生動物または家畜の貯水池が確立される可能性があります。
ただし、ACE2が現在宿主範囲の可能性を制限している唯一の種特異的要因であるかどうかは明らかではありません。たとえば、以前は、ヒトACE2を発現するようにトランスフェクトした場合でも、鳥の細胞に感染することはできませんでした。
このデータはまた、人気のある仮説であるオミクロンの潜在的な動物起源についての暫定的な手がかりを与える可能性があります。
要約すると、オミクロンVOCは、以前のSARS-CoV-2バリアントと比較して重要な生物学的変化を示しており、伝染性は高くなりますが、本質的に重症度の低いウイルスにつながる可能性があります。
固有の重症度の低下は、広範囲にわたる感染に起因する非常に高い症例数との関連で考慮する必要があります。これは、脆弱な個人が死亡するため、必然的に高い医療負担につながります。
オミクロンの亜種の出現は、ウイルスの進化に対応して感染拡大と病気の重症度を制限するためのワクチン接種戦略の継続的な必要性を強調しています。
さらに、オミクロンは他の動物に貯水池を確立する可能性が高いことを示しており、これにより、SARS-CoV-2が根絶される可能性はさらに低くなります。
以下省略。
version.2
The altered entry pathway and antigenic distance of the SARS-CoV-2 Omicron variant map to separate domains of spike protein
SARS-CoV-2 オミクロン変異体の侵入経路と抗原距離の変化は、スパイクタンパク質の別々のドメインにマッピングされる
Abstract
SARS-CoV-2 オミクロン/BA.1 系統は 2021 年後半に出現し、急速にデルタ亜種に取って代わり、2022 年初頭にはオミクロン/BA.2 系統に世界的に追い抜かれました。
ここでは、オミクロン BA.1 および BA.2 が、スパイク遺伝子に特異的にマッピングされる病原性のハムスター モデルにおいて、どのようにしてより低い重症度の表現型を示すかを説明します。
さらに、オミクロンは肺細胞株では弱毒化されるが、ヒト初代鼻細胞ではピーク力価は低いにもかかわらず、より迅速に複製されることを示します。
この複製表現型はスパイク遺伝子にもマッピングされます。
オミクロン株スパイク (新興のBA.4 を含む) は、融合誘導性が減弱し、エンドソーム経路を介した細胞侵入を優先します。
我々は、変化したオミクロン株スパイク侵入経路をマッピングし、より低い融合誘発性をS2ドメイン、特に置換N969Kに部分的にマッピングしました。
最後に、よりデルタ株様の細胞侵入経路を与えるために S2 ドメインで操作されたオミクロン スパイクを持つシュード ウイルスが、オミクロンの抗原特性を保持していることを示します。
これは、これら 2 つの重要なオミクロン表現型の遺伝的決定因子が明確に区別されていることを示しており、現在流行している株やワクチン株から抗原的に遠く離れた将来の変異株が、オミクロン感染時に見られるより低い固有の重症度を必ずしも示さない可能性が懸念されます。
Summary
SARS-CoV-2 パンデミックの 2 年目は、抗原性が変化した、および/または感染力が強化された SARS-CoV-2 変異株が繰り返し出現したことを特徴としていました。
5 番目の懸念種 (VOC) であるオミクロンは、アフリカ南部で最初に検出されました。
最初の検出からわずか 1 か月以内に、オミクロンは世界中の SARS-CoV-2 症例の大部分を占めるまでに広がりました。
主要な オミクロン系統である BA.1 および BA.2 (および新興 BA.4 および BA.5) は、ゲノム全体にわたる合計 50 を超える変異によって特徴付けられます。 これには、スパイク糖タンパク質遺伝子における前例のない > 25 個の変異が含まれます。
オミクロンと初期のパンデミックスパイクタンパク質との間の大きな抗原距離は、中和力価の損失、オミクロンに対するワクチン有効性の低下、および再感染の頻度の高さと相関しています。
オミクロン系統ウイルスによる感染は、以前に感染していない人やワクチン接種を受けていない人も含め、以前の VOC、デルタと比較して疾患の重症度を軽減しました。
また、オミクロン系統分離株は、ハムスターなどのげっ歯類モデルにおいて、以前の VOC よりも本質的な重症度が低いことを示します。
ex vivo システムでは、Omicron は下気道由来のヒト細胞では複製が弱められていますが、上気道上皮では急速な複製を示しています。
インビトロでは、オミクロンはシンシチウムを誘導せず、スパイクタンパク質の融合原性は低いです。
COVID感染者の解剖でシンシチウムが報告されています。そして、シンシチウム形成の基礎となるスパイクタンパク質のS1/S2 FCSでの効率的な切断は、動物モデルにおける疾患の重症度の増加と関連しています。
さらに、オミクロン株は、以前の変異体と比較して、エンドソーム経路を通じて効率的に細胞に侵入する能力を備えています。
これらの表現型特性は関連しており、細胞侵入経路と融合誘導性が重症度の指標/代用である可能性があります。
ここで我々は、生体内での低重症度の分子基盤をオミクロンスパイク遺伝子にマッピングします。
われわれは、オミクロン株スパイクが、エンドソーム制限により、Calu-3 肺細胞の複製を弱めることを発見しました。
しかし、オミクロン株スパイクは、エンドソーム制限がそれほど強力ではない初代ヒト鼻上皮培養物において迅速な複製をもたらします。
我々は、キメラおよび変異組換えスパイクタンパク質を使用して、オミクロン株スパイク N969K の S2 ドメインにおける単一置換がエンドソーム侵入をもたらし、融合原性の低下につながることを実証しました。
重要なことに、これは、オミクロンの細胞侵入経路の決定因子 (S2 ドメイン) が、その極端な抗原距離を与える決定因子 (S1 ドメイン) とは異なることを意味します。
したがって、我々は、オミクロン株と同様の抗原距離を持つが、本質的な重症度の低下は生じない将来の変異体が発生する可能性があることを強調します。
Results
The Omicron variants BA.1 and BA.2 show lower pathogenicity in a hamster model
オミクロン株 BA.1 および BA.2 は、ハムスター モデルにおいてより低い病原性を示す
オミクロン分離株の内在性毒性を以前の変異株と in vivo で比較するために、少なくとも 4 匹のナイーブハムスターのグループに SARS-CoV-2 変異株ーWT/D614G (パンゴ系統 B.1)、アルファ (B.1.1.7)、デルタ (B.1.617.2)、オミクロン/BA.1 (BA.1) または オミクロン/BA.2 (BA.2)ーを鼻腔内接種しました。病原性と相関する体重減少が観察されました (図 1A)。

すべての動物は増殖的に感染し、鼻から感染性ウイルスを排出しました (図 1A、拡張データ図 1A)。
一方、WT(D614G)、アルファおよびデルタウイルスに感染したハムスターは、感染後最初の週に最大平均9%から14%の体重減少を示しました。
対照的に、BA.1 または BA.2 に感染した動物は、模擬感染した動物と同等の速度で実験中に体重が増加しました。
これは、他の人が示したように、BA.1 および BA.2 ウイルスがハムスター モデルにおいて弱毒化された病原性表現型を示すことを裏付けています。
BA.1スパイクを発現するシュードウイルス(PV)がハムスターACE2を発現する細胞に効率的に侵入することを確認しました。これは、病原性の欠如が非効率的な細胞侵入によるものではないことを示しています(拡張データ図1B)。
The pathogenicity phenotypes of both the Delta and Omicron BA.1 variants map to the spike protein
Delta および Omicron BA.1 変異体の両方の病原性表現型は、スパイクタンパク質にマッピングされます。
この病原性表現型の遺伝的基盤をマッピングするために、最近の研究で説明したように、参照株である Wuhan-Hu-1 (図 1B) の遺伝的バックボーンに Delta または Omicron/BA.1 のスパイク遺伝子を持つ組換えウイルスを使用しました (図 1B)。

4匹のハムスターのグループに、等量の各ウイルスを鼻腔内接種しました。
体重減少とウイルス排出を、以前に使用した対応する全ウイルス分離株によって誘導されたものと比較しました (図 1A)。
デルタまたはオミクロンのスパイクを保有する組換えウイルスに感染したハムスターは、完全な分離株と同様の体重減少と脱落を示しました。

これは、病原性表現型がハムスター モデルのスパイク遺伝子に主にマッピングされていることを示唆しています (図 1C、拡張データ図 1C)。
BA.1 スパイクキメラに感染した動物は、接種後 1 ~ 3 日目に、完全に BA.1 に感染した動物よりも、有意ではないもののわずかに体重が減少し、有意に高い力価の感染ウイルスを排出しました。スパイク以外のウイルス遺伝子がオミクロンの病原性表現型の弱毒化に寄与している可能性があることを示唆しています(図 1C、拡張データ図 1C)。
Omicron is attenuated for replication in Calu-3 lung cells but replicates more rapidly than Delta in primary cultures of human nasal epithelial cells
オミクロンは、Calu-3 肺細胞では複製が弱められていますが、ヒト鼻上皮細胞の初代培養ではデルタよりも速く複製されます。
インビトロでのデルタとオミクロン(BA.1)の複製を比較するために、各変異体は、Calu-3 細胞(SARS-CoV-2 侵入因子 ACE2 および TMPRSS2 を発現する不死化ヒト肺細胞株)、または気液界面で増殖した初代ヒト鼻上皮細胞(hNEC)のトランスウェルに接種するために使用されました。
ヒト ACE2 および TMPRSS2 (Vero-AT) 細胞を過剰発現する Vero E6 細胞にも接種したところ、これらの細胞における 2 つの変異体の複製が同等であることが判明しました (図 2A)。

Calu-3 細胞では、オミクロンのウイルス収量はすべての時点でデルタよりも低く、ハムスターで見られるパターンを反映しています。
興味深いことに、これは hNEC には当てはまらず、BA.1 は複製初期に大きな利点を示し、感染後 24 時間までにデルタよりも約 100 倍高い感染力価の頂端ウイルスを放出しました (図 2A、拡張データ図 2A)。
しかし、感染後 48 時間および 72 時間までには、ウイルス収量はデルタと比較して低下しました。
また、Vero-AT 細胞、Calu-3 細胞、または hNEC で混合競合アッセイも実行しました。
2 つの変異体のゲノムと RNA の比は、変異体特異的 PCR プロトコールを使用して 50:50 混合物の接種後に経時的に測定されました (拡張データ図 3A ~ C を参照)。
ここでも、Calu-3 細胞では BA.1 が減弱され、 デルタに負けました。
Vero-AT 細胞では両方のウイルスのゲノム コピーがすべての時点で同等であったのに対し、hNEC では BA.1 分離株が急速に Delta を上回りました (図 2B)。

デルタおよびオミクロン分離株の独立したセットを使用して競合実験を繰り返したところ、異なる細胞系で反対の複製表現型の同じパターンが見られました(拡張データ図 2B)。
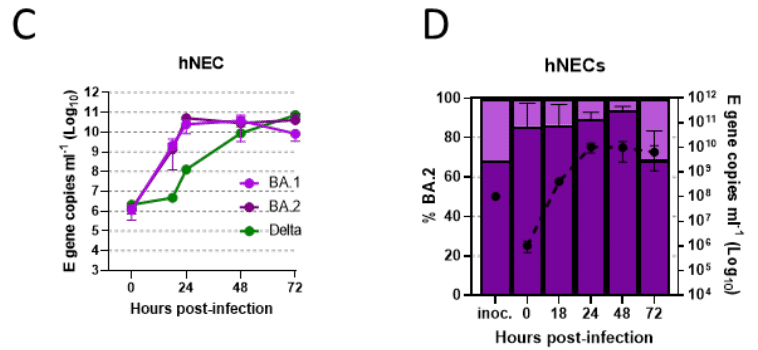
さらに、hNEC における Omicron/BA.1 および BA.2 分離株の複製を比較したところ、BA.2 が 24 時間でピークに達する同様の初期の急速な複製を示したことがわかりました (拡張データ図 2C)。
hNEC における BA.1 と BA.2 間の直接競合アッセイでは、BA.2 ゲノムコピーは感染後最初の 48 時間にわたって増加する傾向がありましたが、どちらのウイルスも他方のウイルスを上回って増殖することはありませんでした (拡張データ図 2D)。
The attenuation of Omicron/BA.1 in Calu-3 and rapid replication in primary human nasal cells maps to the spike protein
Calu-3 における Omicron/BA.1 の減弱と初代ヒト鼻細胞における急速な複製は、スパイクタンパク質にマッピングされます。
オミクロンとデルタの複製における細胞型特異的な違いを決定する際のスパイク遺伝子の役割を評価するために、スパイクのみが異なる組換えウイルスの複製動態を測定し、それらを親の全ウイルス分離株と比較しました。
各キメラウイルスはそのスパイクドナー親のパターンを再現しており、スパイク遺伝子がCalu-3細胞におけるBA.1の複製の減弱、およびhNEC培養におけるそのより迅速ではあるが切断された複製の主要な決定因子であることを示唆している (図 2C、拡張データ図 2E)。

Omicron spike protein shows enhanced human ACE2 binding but attenuated fusogenicity
オミクロン スパイク タンパク質はヒト ACE2 結合の増強を示すが、融合原性は減弱
SARS-CoV-2 のスパイクタンパク質は、宿主の ACE2 受容体に結合することによりウイルス付着タンパク質として、また標的細胞へのゲノムの転移を促進することによりウイルス融合タンパク質として機能します。
さらに、スパイクタンパク質は、SARS-CoV-2の主要抗原であり、現在認可されているすべてのワクチンの一次免疫原でもあります。
オミクロン スパイクには、ACE2 受容体への結合を強化すると予測されるいくつかのアミノ酸置換が含まれており、多くのグループが、WT D614G スパイク受容体結合ドメイン (RBD) または D614G スパイク タンパク質全体と比較して、ACE2 結合が約 2 ~ 3 倍増加することを示しています。
また、WT D614G スパイク結合と比較して、BA.1 スパイクとヒト ACE2 間の相互作用の増加も測定しました (拡張データ、図 4A)。

ヒト ACE2 受容体への結合の増加は、ヒト気道細胞で観察されたより速い複製を説明する可能性があります。
しかし、代替細胞モデルにおいて、オミクロンがなぜ複製の減弱を示し、重症度の低い疾患をもたらすのかは不明です。
細胞侵入を媒介するには、ウイルスと宿主細胞膜間の融合を可能にするために、細胞プロテアーゼによる S2’ 部位での切断を通じてスパイクタンパク質を活性化する必要があります。
私たちや他の研究者は、S1/S2 接合部にフリン切断部位 (FCS) が存在するため、SARS-CoV-2 ビリオンがすでに S2 切断の準備ができているプロデューサー細胞から出現することを示してきました。そして、TMPRSS2依存的に気道細胞の細胞表面または初期エンドソームに迅速に侵入することにより、複製と伝達の利点を獲得します。
細胞表面でのこの融合の副産物はシンシチウム形成であり、これは疾患の重症度と相関すると仮説が立てられています。
オミクロンは、デルタなどの以前の変異体の融合誘発性を欠いていることが示されています。
実際、WT/D614G またはデルタウイルス分離株の感染とは対照的に、Omicron/BA.1 の 2 つの独立した分離株による Vero-AT 細胞の感染では合胞体形成が起こらないことが観察されています (図 3A)。

スパイクタンパク質が細胞の表面に発現され、ACE2を発現する標的細胞と混合された定量的融合アッセイの場合、BA.1、BA.2、BA.4 スパイクタンパク質はいずれも標的細胞との効率的な細胞融合を媒介しませんでしたが、D614G または デルタ スパイクは広範な融合を促進しました (図 3B、拡張データ図 4B、C)。

したがって、ACE2 受容体結合強度が増加しているにもかかわらず、Omicron スパイクの細胞表面融合能力は以前の株と比較して減弱しています。
これは、オミクロンのスパイクが別の経路を介して細胞への侵入を媒介する可能性が高いことを示唆しています。
Omicron enters cells more efficiently through the endosomal route
オミクロンはエンドソーム経路を通じてより効率的に細胞に侵入します
SARS-CoV-2は、TMPRSS2を介した細胞表面/早期エンドソーム侵入に加えて、カテプシンなどのエンドリソソームプロテアーゼによってスパイクタンパク質が切断され活性化されるエンドソーム侵入経路を使用して細胞に侵入することもできます。
SARS-CoV-2 スパイク変異体が細胞侵入経路の異なる利用をどのように媒介するかを調査するために、これらのスパイクを有する PV の侵入を Caco-2 内の経路遮断薬の存在下で測定しました;この細胞株は、TMPRSS2 とカテプシンを介した侵入の両方を許容することが以前に発見されました。
WT(D614G) およびデルタスパイクを持つ PV は、カモスタット (TMPRSS2 などのセリンプロテアーゼの広範な阻害剤) によって効率的に阻害され、E64d (カテプシン阻害剤) によってはほとんど阻害されませんでした。
これは、Caco-2 では、これらの PV が細胞表面または初期エンドソームに侵入することを示唆しています。
対照的に、BA.1、BA.2、および BA.4 PV は反対の表現型を示し、E64d に対して感作され、カモスタット阻害に対して抵抗性でした (図 3C)。
これは、Omicron スパイクが以前の変異体よりもエンドソーム侵入を促進できること、およびこの特性が 3 つの主要な Omicron 系統 (BA.1、BA.2、および BA.4/BA.5) すべてにわたって保存されていることを示しています。

また、hNEC (図 3D、E) または Calu-3 細胞 (図 3G) における本物の Omicron または Delta ウイルスの複製に対する Camostat の効果も調査しました。


カモスタットは両方の細胞株でデルタウイルスの複製を完全に無効にし、デルタウイルスがTMPRSS2などのセリンプロテアーゼに完全に依存していることを示しました。
対照的に、Omicron/BA.1 分離株は、Camostat の存在下で hNEC 内で複製されましたが、薬剤の非存在下よりもゆっくりではありましたが、最終的には感染後 48 時間までに同等の力価に達しました (図 3D、E)。
これは、hNEC における Omicron の高度な初期複製が TMPRSS2 媒介であることを示唆していますが、BA.1 も複製にエンドソーム経路を効率的に使用できます (拡張データ、図 5A)。
上気道細胞の単一細胞配列分析により、ACE2+/TMPRSS2+ の細胞よりも ACE2+/TMPRSS2- の細胞が約 2 倍存在することが明らかになりました(補足表S1)。
エンドソーム経路によりACE2+/TMPRSS2-細胞の感染が可能となるため、hNECにおけるOmicronの早期複製の利点が、感染の開始に利用可能な標的細胞の数の拡大によってもたらされるかどうかを検討しました。
我々は、比較侵入経路(カモスタット感受性対カモスタット非感受性)をモデル化し、オミクロンのエンドソーム侵入がhNECにおけるより迅速な複製を説明できないことを確立した。
代わりに、Omicron は、この細胞タイプで Delta よりも TMPRSS2 依存ルートを効率的に使用しているようです (補足表 S2、拡張データ図 6A ~ D)。
私たちや他の研究者は、SARS-CoV-2 ウイルスがエンドソームを介して侵入すると、IFITM2/3 などのエンドソーム IFITM 制限因子による阻害に対して感受性が高まることを以前に示しています。
ただし、この制限はアムホテリシン B (AmphoB) を添加することで解除できます。
実際、BA.1 および BA.2 PV の侵入は、ΔCS スパイク (エンドソーム侵入に限定されているフリン切断部位を持たない変異体スパイク) を持つ PV で見られるように、AmphoB によって大幅に増強されました。一方、他の変異体のスパイクタンパク質を有する PV の侵入はありませんでした (図 3F)。

AmphoB 処理により、Calu-3 における BA.1 または BA.2 の収量も増加しましたが、デルタ力価は増加しませんでした (図 3G)。

我々は、組換えキメラスパイク担持ウイルスを使用して、これをスパイク遺伝子へのマッピングで再度実証した。
興味深いことに、hNEC では、AmphoB は Omicron のウイルス収量に影響を与えず (図 3D、E)、これは上気道細胞では Omicron が IFITM タンパク質によってあまり阻害されないことを示唆しています。
我々は以前、気道培養におけるAmphoB処理後にエンドソームを介してもっぱら細胞に侵入するFCSを欠くSARS-CoV-2変異体(ΔCS)のウイルス複製がかなり増強されることを示しました。
Omicron スパイクの置換により、ウイルスはエンドソーム IFITM 制限を回避しながら、hNEC のエンドソーム経路を生産的に利用できるようになります。
The altered entry route and antigenic distance of SARS-CoV-2 Omicron map to separate domains of the spike protein
SARS-CoV-2 オミクロンの侵入経路と抗原距離の変化は、スパイクタンパク質の別々のドメインにマップされる
Omicron 変異体の侵入経路の変化と低融合性の分子基盤を調査するために、WT(D614G) と Omicron/BA.2 の間のスパイクタンパク質キメラを操作しました。
McCallumらは最近、S2ドメイン内のいくつかの残基を同定しました。これは、BA.1 のスパイク プロトマー内およびスパイク プロトマー間に追加の静電接触を導入し、タンパク質を安定化し、融合を潜在的に妨げる可能性があると考えられます。
この領域では、BA.1、BA.2、および BA.4 の間で 4 つの変異が保存されており、これらはすべて Caco-2 のエンドソーム侵入経路に対する優先性を共有していることがわかりました (図 3C)。
したがって、S1/S2 切断部位の後にブレークポイントを備えたキメラ スパイク発現コンストラクト (4 つの一般的な変異 N764K、D796Y、Q954H、および N969K を含む; 図 4A) を作製しました。

BA.2のS2を保持するキメラスパイクタンパク質を発現するPVは、主にエンドソーム経路を介して侵入したが、WT S2ドメインはBA.2 S1によるスパイクへのTMPRSS2依存性細胞表面侵入を与えた(図4B)。

このパターンは合胞体形成アッセイにも部分的に反映されており、融合誘導性の低下は BA.2 の S2 ドメインによって決定されました (図 4C、D、拡張データ図 5B)。これは Willett らの最近の報告と一致しています。

さらに、単一アミノ酸置換である N969K に対する侵入表現型と融合表現型をマッピングしました (図 4B、D)。
Omicron 様変異 N969K を持つ WT スパイクを含む PV は、完全な BA.2 スパイク PV と同様のカテプシン依存性侵入を示しました。
一方、唯一の復帰 K969N を備えた BA.2 スパイクを有する PV はカテプシン感受性を失い、代わりに WT スパイクを有する PV と同様にカモスタット感受性になりました (図 4B)。
興味深いことに、PV におけるスパイクの S1/S2 切断の程度の分析により、Omicron (BA.1、BA.2 および BA.4) スパイクが効率的に切断され、濃縮された PV では全長スパイクがほとんど検出されないことが明らかになりました (図 4E)。

これは、これまでのいくつかの報告とは異なりますが、メスナーらによる最近の報告と一致しています。
これは、Omicron の FCS に隣接する単一アミノ酸の変化、特に N679K および P681H の変化とも相関しており、それ自体が切断を促進します (拡張データ図 5C、D)。
残基 969 を含む S2 の置換は、スパイク FCS 切断に影響を与えませんでした (図 4E)。
オミクロンの急速な蔓延は、固有の感染力の潜在的な増加の組み合わせによって説明できます。 しかし、以前の変異体や現在広く使用されているワクチンのスパイクタンパク質との抗原性の距離も大きく、再感染やワクチン突破感染が頻繁に発生する可能性があります。
スパイクタンパク質の抗原決定基は主に S1 ドメインにマッピングされており、エピトープは NTD と RBD の両方にあります。
S1/S2キメラの抗原性がS1の配列によって決定されたことを実証するために、2回目の投与後のワクチン抗血清を用いてPV中和アッセイを実施しました(図4F)。

予想通り、S2 ドメインはスパイクタンパク質の抗原特性に影響を及ぼさず、Omicron の侵入/融合表現型および抗原表現型が個別のスパイク置換にマッピングされることが確認されました。
Discussion
オミクロンは、これまでで最も急速な SARS-CoV-2 変異種の世界的な乗っ取りの 1 つを示しました。
その急速な成長は、以前の免疫からの部分的な回避と、その出現と同時に多くの国で非医薬品介入が段階的に廃止されたことの組み合わせに由来しています。
オミクロンは、デルタよりも連続間隔が短く、以前の変異体よりも本質的に感染力が高いと考えられますが、重症度の低い疾患とも関連しています。
重要な問題は、抗原性の距離、高い伝播性、重症度の低さというこれら 3 つの特徴が関連しているかどうかを確立することであり、これは将来の変異株の重症度の必然的な軽減を意味します。
ここで、これらの表現型はスパイク遺伝子内の異なる領域に起因すると考えられます。ウイルスがオミクロンを超えて進化し続けるにつれて、それらが分岐する可能性が高いことを示唆しています。
我々は、Omicronの侵入経路の変化がS2ドメインの置換、特にプロトマー間の相互作用を安定化し融合を妨げる可能性が高い置換N969Kによって部分的に与えられていることを示します。
これにより、侵入の変化が遅くなり、疾患の重症度と関連しているプロセスである細胞表面融合が減少します。
高いACE2受容体結合と効率的なS1/S2切断にもかかわらず、Omicronによるシンシチウム形成の欠如は、S2変異によってもたらされる融合の遅延によって説明される可能性があります。
さらに、自然免疫応答が強力な肺細胞では、後期エンドソームからの侵入が遅いため、ウイルスが制限因子に対してより脆弱になります。そして、その結果として生じる複製の減弱も、疾患の重篤度の軽度化に寄与している可能性が高い。
対照的に、上気道の細胞の自然免疫反応は弱まり、侵入が遅くなっても複製が損なわれることはありません。
Omicron の感染増加に関する初期の仮説の 1 つは、TMPRSS2 を発現していない細胞に Omicron が侵入する能力によって、感受性のある細胞の数が増加するというものでした。
今回我々は、モデル化を用いて初代鼻細胞における急速な複製が依然として主にTMPRSS2依存性であることを示すことにより、この仮説を反証した。
Barutらによる最近の報告と一致して、Omicronの重症度の低い表現型は主にスパイクタンパク質にマッピングされることが示されていますが、Omicronにはこの遺伝子の外側にさらに弱毒化変異が存在する可能性があります。
例えば、BA.1のスパイク遺伝子の大部分とデルタ由来の残りのゲノムが含まれており、オミクロン全体よりも毒性が高い株である、最近登場したBA.1(スパイク)×デルタ組換えXDと、Wuhan-Hu-1 バックボーンに BA.2 スパイクを持つ組換えウイルスは、ハムスター モデルでより高い病原性を示しました。
オミクロンの病原性に対する非スパイク変異の正確な寄与を特定するには、リバースジェネティクスを使用したさらなるマッピングが必要となります。
抗原距離は、スパイクタンパク質の S1 領域内にある主要エピトープの置換によってコードされます。
この領域は、Omicron の ACE2 結合の強化もコードしており、Omicron のより高い伝達率に部分的に関与している可能性があります。
逆に、Omicron のより遅い侵入とより低い融合誘導性は、主にスパイクの S2 ドメインにマッピングされます。
ここ数か月で、スパイク内にブレークポイントを持つものも含め、いくつかの Delta x BA.1 組換え体が報告されました。
まだ検出されていませんが、私たちは、Omicron の S1 ドメイン (BA.1 または BA.2) と Delta の S2 ドメイン (または別の非 Omicron 変異体) を含む組換え体が、Omicron の抗原回避特性および侵入経路、したがっておそらくデルタの本質的な重症度の表現型を持っている可能性があることを示唆しています。
このような組換え体の出現を迅速に同定できるようにするためには、最大限の努力が払われなければなりません。
結論として、この研究は、両方の特性がスパイクタンパク質の個別の領域にマッピングされるため、将来の変異体は、抗原性は遠いが、デルタ様の重症度の表現型を持って発生する可能性があることを示唆しています。
世界の多くの地域で SARS-CoV-2 の流行が依然として増加している一方で、将来的に重症化の波が押し寄せる可能性は無視できません。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
