オミクロン株の機能喪失変異は、スパイクタンパク質の発現を減少させ、SARS-CoV-2感染を軽減(2023年7月)
Loss-of-function mutation in Omicron variants reduces spike protein expression and attenuates SARS-CoV-2 infection
オミクロン株の機能喪失変異は、スパイクタンパク質の発現を減少させ、SARS-CoV-2感染を軽減します

Abstract
SARS-CoV-2 オミクロン株は、スパイクタンパク質だけで 30 を超える新規アミノ酸変異を伴って 2022 年に出現しました。
ほとんどの研究は受容体結合ドメインの変化に焦点を当てていますが、フリン切断部位に隣接する S1 の C 末端 (CTS1) の変異はほとんど無視されてきました。
この研究では、CTS1 の 3 つの オミクロン変異(H655Y・N679K・P681H)を調べました。
SARS-CoV-2 三重変異体 (YKH) を生成すると、H655Y および P681H それぞれについての以前の報告と一致して、この変異体がスパイク プロセシングを増加させることがわかりました。
次に、単一の N679K 変異体を生成しました。 in vitro でのウイルス複製の減少と in vivo での疾患の減少を発見しました。
機構的には、N679K 変異体は野生型と比較して、精製ビリオン中のスパイクタンパク質が減少していました;スパイクタンパク質の減少は、感染細胞溶解物ではさらに悪化しました。
重要なことに、外因性スパイク発現により、N679K が感染とは無関係に全体のスパイクタンパク質収量を減少させることも明らかになりました。
機能喪失型突然変異ではあるが、ハムスターではN679Kが野生型SARS-CoV-2よりも上気道で複製に有利であり、伝播性に影響を与える可能性があることが伝播競合により実証されました。
まとめると、データは、N679K が Omicron 感染中の全体的なスパイクタンパク質レベルを低下させることを示しています。これは感染、免疫、伝染に重要な影響を及ぼします。
Introduction
SARS-CoV-2はその導入以来、継続的に進化し、スパイクタンパク質1に多様な変異を持つ複数の懸念変異体(VOC)を生み出しました(拡大図1A)。

ビリオン上に三量体として存在するスパイクは、それぞれ受容体結合と膜融合を担う S1 サブユニットと S2 サブユニットで構成されています。
S1 サブユニットには、N 末端ドメイン (NTD)、受容体結合ドメイン (RBD)、および SARS-CoV-2 のフリン切断部位 (FCS) を有する S1 サブユニットの C 末端 (CTS1) が含まれています。
受容体結合後、スパイクは宿主プロテアーゼによって S1/S2 部位で切断され、融合機構が露出して侵入します。
スパイクタンパク質の多様な変異(拡大図 1B)により、Omicron の研究のほとんどは RBD とワクチンまたは感染によって誘発される免疫への影響に焦点を当ててきました。

しかし、FCS および S1/S2 切断部位周囲の変異が SARS-CoV-2 の病因を引き起こすことが実証されてますが、オミクロン株に関してはほとんど研究されていません。
これを念頭に置いて、我々は感染と病因に対する オミクロン CTS1 変異の役割を評価することに着手しました。
オミクロンは、FCS および S1/S2 切断部位に隣接して 3 つの変異、H655Y、N679K、および P681H を維持しています (拡大図 1B)。
H655Y と P681H はいずれも、ガンマ型とアルファ型の変異体で以前に観察されています; 対照的に、N679K はすべてのオミクロン株に固有であり維持されます。
これらの変異の役割を評価するために、我々は逆遺伝学を利用して、2020年初頭から元のWA1骨格に3つのCTS1変異(YKH)すべて、またはN679Kのみを持つSARS-CoV-2変異体を生成しました。
YKH は in vitro でウイルスの複製とスパイク処理をわずかに増加させますが、 N679K は機能喪失型変異を引き起こし、in vitro でのウイルス複製と in vivo での疾患を弱める一方、スパイクタンパク質発現の低下により複製を上気道に偏らせます。
免疫に対するスパイクタンパク質の重要性を考えると、我々の発見はワクチンの有効性とブレイクスルー感染症に大きな影響を与える可能性があります。
Results
H655Y, N679K, and P681H together increase viral replication and spike processing
H655Y・N679K・P681H は共に、ウイルスの複製とスパイク処理を増加
オミクロンが獲得した 30 を超えるスパイク変異の大部分は RBD に局在していますが、H655Y、N679K、および P681H の 3 つはフリン切断部位に隣接する CTS1 に保持されています (図 1A)。

H655Y と P681H はいずれも、ガンマ変異体とアルファ変異体で個別に観察されており、スパイク処理の増加に関連しています。
対照的に、N679K はオミクロンに固有の突然変異であり、ゆらぎコドンの位置に 1 つのヌクレオチドの変化 (T/C から A/G へ) が含まれているにもかかわらず、その後のすべてのオミクロン株で維持されています。
重要なことに、N679K は T678 の重要な O 結合グリコシル化部位に隣接しています; 私たちのグループは、このグリコシル化が SARS-CoV-2 感染とプロテアーゼの使用に重要であることを以前に示しました。
フューリン切断部位や上流の QTQTN モチーフなど、CTS1 スパイク ドメイン内のいくつかのモチーフは、SARS-CoV-2 の感染と病因を引き起こすスパイク切断と宿主プロテアーゼ相互作用の鍵となります。
CTS1、H655Y、N679K、および P681H の 3 つのオミクロン変異はすべて、これらのモチーフに隣接または内部にあり、その機能に影響を与える可能性があります (図 1A および 1B)。

これを評価するために、元のWA1バックボーン(YKH)にH655Y、N679K、およびP681Hを含む変異SARS-CoV-2を生成しました(図1C)。
YKH 変異体によって生成されたプラークは、親 WA1 (WT) と比較して小さかった (図 1D)。
しかし、YKH 変異体は、野生型 (WT) SARS-CoV-2 と比較して、Vero E6 細胞のストック力価も複製速度も低下させませんでした (図 1E および 1F)。
注目すべきことに、Calu-3 2B4細胞では、YKHのエンドポイント力価は、WTと比較して複製が24 hpiでわずかに減少したが、48 hpiで増加しました(図1G)。


この結果は、3 つの変異の組み合わせにより感染動態が変化し、ヒト呼吸器細胞におけるオミクロン株に何らかの利点をもたらす可能性があることを示唆しています (図 1G)。
H655Y および P681H は個別にスパイク処理を増加させることが示されているため、次に、YKH および WT 感染からの精製ビリオンのスパイク処理を評価しました。
デルタおよびオミクロンと同様に、YKH スパイクは WT よりも処理されました (図 1H および 1I)。

24 hpi では、S1/S2 切断比と全長スパイク比は、YKH スパイクで約 2.4:1 でした (55% S1/S2 生成物、23% 全長);対照的に、WT はほぼ同量の S1/S2 産物と全長を持っていました。
全体として、YKH 変異体における H655Y、N679K、および P681H の組み合わせにより、ヒト呼吸器細胞におけるウイルスエンドポイント収量が増加し、オミクロンの強化されたスパイク処理に貢献しました。
N679K mutation attenuates SARS-CoV-2 infection
N679K 変異は SARS-CoV-2 感染を弱める
YKH 変異体で見られるスパイク処理の増加は、H655Y および P681H 変異を個別に調べた以前の研究と一致しています;ただし、N679K の寄与はまだ評価されていませんでした。
重要な O 結合グリコシル化部位に隣接するその位置に基づいて、N679K が SARS-CoV-2 感染に影響を与える可能性があるという仮説を立てました (図 2A)。
潜在的な変化を評価するために、WA1 バックボーンに N679K のみを持つ SARS-CoV-2 変異体 (N679K) を生成しました (図 2B)。

我々の最初の特徴付けでは、N679K プラークサイズが感染後 2 日および 3 日で明らかに小さくなり (図 2C)、ストック力価も WT よりわずかに低いことがわかりました (図 2D)。
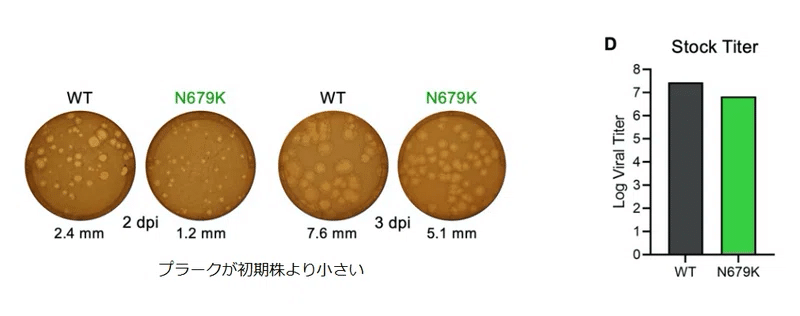
プラークサイズとストック力価のこれらの違いは、ほとんどの Omicron 株の他の観察結果と一致しています。
注目すべきことに、YKH複製動態で見られる最小限の違いとは異なり、N679K変異体は24hpiでVero E6細胞とCalu-3 2B4細胞の両方で複製を減弱させました(図2Eおよび2F)。

N679K ウイルス力価は 48 hpi までに回復しましたが、結果は、N679K が両方の細胞株の複製の観点から機能喪失型変異であることを示唆しています。
次に、生後 3 ~ 4 週間のゴールデン シリアン ハムスターに感染させて N679K を in vivo で評価し、体重減少と病気を 7 日間モニタリングしました (図 2G)。

N679K に感染したハムスターは、WT に感染したハムスターと比較して、体重減少が大幅に軽減されました (図 2H)。
体重減少で見られる顕著な減衰にもかかわらず、肺におけるN679Kウイルス力価は、2 dpiおよび4 dpiでWTと同等でした(図2I)。
同様に、N679K ウイルス力価は、鼻洗浄液の 2 dpi で WT に匹敵しました; ただし、変異ウイルスでは、4 dpiで複製が減少しました(図2J)。

さらに、肺の組織病理学の分析では、対照と比較して、N679K感染ハムスターの疾患がわずかではあるものの、有意ではない減少を示した(拡大図2)。
まとめると、我々の結果は、N679K が in vitro と in vivo で異なる機能喪失表現型を持つことを示しています。
N679K mutation results in decreased spike protein expression
N679K 変異により、スパイクタンパク質の発現が減少
次に、N679K 変異体で観察された機能喪失を引き起こすメカニズムを解明しようとしました。
FCSに隣接するN679Kの位置を考慮して、我々はまず、タンパク質分解スパイク処理に対するN679Kの効果を評価しました。
ビリオンは、WT、N679K、またはオミクロン株 BA.1 (Omicron) から精製され、スパイク処理のためにブロットされました。
YKHとほぼ同一であるN679K変異体は、24 hpiでWTの1:1の比と比較して、全長スパイクに対するS1/S2切断産物の比が約2.5:1でスパイクプロセシングを増加させました(図3Aおよび3B)。

ただし、ヌクレオキャプシドタンパク質のレベルは同程度であるにもかかわらず、N679K および Omicron では、WT と比較して総スパイクタンパク質に明確な違いがあることに気付きました。
デンシトメトリー分析により、N679K ビリオンおよび Omicron ビリオンの総スパイク対ヌクレオカプシド (S/N) 比が、WT と比較してそれぞれ 21% および 36% 減少していることが明らかになりました (図 3C)。

全体として、我々の結果は、N679K 変異体とオミクロン株がビリオンに取り込むスパイクタンパク質が少ないことを示しています。
次に、ビリオンスパイクの変化が細胞内の総タンパク質発現の変化によるものなのか、それとも粒子へのスパイクの取り込みによるものなのかを判定しようとしました。
スパイクタンパク質の発現を調べるために、感染した Vero E6 細胞溶解物からのヌクレオカプシドに対する総スパイクを 24 hpi で測定しました (図 3D および 3E)。
N679K は WT よりも 66% 低い S/N 比をもたらし、精製ビリオンの減少と比較してスパイクタンパク質のさらなる減少を示しました。
さらに、同様の S/N 比の低下が オミクロンで観察されました。表現型がすべてのオミクロン変異の文脈で維持されていることを示しています(図3Dおよび3E)。
重要なのは、WT と N679K の感染後のスパイクと N の両方の RNA 転写率がほぼ同一であったことです。
これは、変異体におけるスパイクのRNA発現に欠陥がないことを示しています(図3F)。
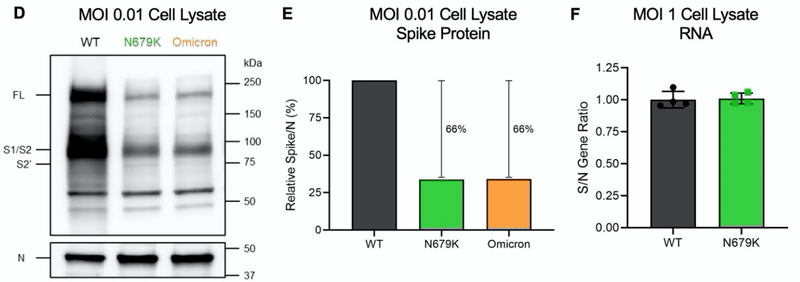
まとめると、結果は、N679K 変異が感染後の WT と比較して オミクロン株スパイクタンパク質レベルを低下させることを示しています。
N679K の状況でスパイクタンパク質の減少を確立したので、次に、この減少がウイルス感染の状況でのみ発生するのか、それともタンパク質に固有のものなのかを判断したいと考えました。
したがって、Spike HexaPro プラスミドに突然変異を導入して、スパイクタンパク質を外因的に発現させ、N679K による変化をウイルス感染の他の側面から分離しました。
Vero E6 細胞を WT または N679K 変異体スパイク HexaPro でトランスフェクトし、トランスフェクション後 24 時間および 48 時間 (hpt) で回収しました。
ウイルス感染で観察されたのと同様に、N679K スパイクは 24 hpt で 43%、48 hpt で 46% 減少しました (図 3G および 3H)。

全体として、ビリオン、細胞溶解物、および過剰発現系にわたる結果は、スパイクタンパク質の減少が、ウイルス感染とは独立してN679K変異によって支配されることを実証しています(図3I)。

N679K mutation results in preference for the upper airways
N679K 変異により上気道が優先される
スパイク発現の減少がウイルス感染に影響を与えることが分かっているので、 次に、SARS-CoV-2 の感染力に対する N679K の役割を評価しました。
伝達競合を利用して、ドナーハムスターを1:1の比率のWT:N679K SARS-CoV-2、合計105 pfuで感染させました(図4A)。

24 hpi の時点で、ドナーとナイーブのレシピエントをペアにし、8 時間共同飼育してから分離し、ドナーの鼻を洗浄しました。
鼻洗浄液、気管、および肺を収集し、ドナーについては感染後 2 日および 4 日 (dpi)、レシピエントについては接触後 (dpc) のウイルス RNA 集団を測定しました。
驚くべきことに、 両方のウイルスが感染する一方で、WT と N679K は気道に沿った異なる複製部位を示しました (図 4B)。

N679K は鼻洗浄液と上気道を支配しましたが、WT は主に肺と下気道に播種しました。
気管は中間点として機能し、ウイルス間の明確な境界線はありません (図 4B)。
この段階的変化を観察した後、我々は以前のハムスターの研究に戻り、肺の抗原染色を調べた(図4C)。
総抗原には有意な差は認められなかったが、N679K 感染におけるウイルス抗原の局在は明確であり、太い気道に集中していました。
対照的に、WT は実質および気道により均一に分布していました (図 4D)。


全体として、結果は、N679K 変異がウイルス複製を気道複製にシフトさせることを示しています。
Discussion
オミクロン株の研究のほとんどは、RBD 変異が免疫回避に及ぼす影響を特定することに焦点を当てており、CTS1 などの他のスパイク ドメインの変異はほとんど見落とされています。
FCS および S1/S2 切断部位を有する CTS1 は、変異の減弱と増加の両方のホットスポットとして実証されています。
オミクロン の 3 つの CTS1 変異(H655Y、N679K、および P681H)に焦点を当て、SARS-CoV-2 WA1 バックグラウンドで 3 つすべて(YKH)または N679K のみを含む感染性クローンを生成しました。
YKH の併用により、ヒト呼吸器細胞の感染後にエンドポイント力価がわずかに増加し、スパイク処理が強化されました。これは、H655Y と P681H の効果を個別にテストした以前の研究と一致しています。
しかし、N679K変異体は、in vitroでのウイルス複製とin vivoでの体重減少を軽減させました。
機構研究により、N679K とオミクロンは両方とも、ビリオンに組み込まれるスパイクタンパク質が減少し、感染細胞溶解物中のスパイクタンパク質が減少し、外因性スパイクタンパク質発現システムを使用した場合の生産が劣ることが判明しました。
私たちの結果は、N679K変異がOmicron株を弱めるという文脈でのスパイクタンパク質の減少は、スパイク抗原を減少させて免疫認識をシフトさせることにより、SARS-CoV-2免疫に影響を与える可能性があると主張しています。
さらに、N679K 変異は in vivo でウイルスを弱毒化しましたが、我々の研究は上気道の複製への移行を示しています。
全体として、データは、N679K が SARS-CoV-2 オミクロン の感染、病因、および伝染力学に重大な影響を与える機能喪失型変異として機能することを主張しています。
N679K は、スパイクタンパク質の産生が減少するため、おそらく弱毒化されています。
ビリオンのスパイクが約 20 ~ 30% 減少することから始まり、可能性の 1 つはスパイクの取り込みの変化でした。
しかし、感染した Vero E6 細胞溶解物ではスパイクタンパク質のさらに大きな減少 (66%) が見られ、全体的なスパイクタンパク質レベルが影響を受けたことが示されました。
さらに、N 転写産物に対するスパイク メッセージの比率に変化は見られず、N679K 変異がタンパク質自体に影響を与えることが示唆されました。
スパイクの減少がウイルス感染や宿主の免疫相互作用の産物ではないことを確認するために、スパイクタンパク質を外因的に発現させて、N679K スパイクタンパク質自体が WT コントロールよりも安定していないことを実証しました。
考えられるメカニズムの 1 つは、アスパラギンからリジンへの変化により、スパイク分解を引き起こす可能性のあるユビキチン化部位が導入されるということです。
もう 1 つの考えられるメカニズムは、N679K 変異自体がタンパク質の構造を不安定にする可能性があることです。
さらに、N679K 置換により、フリン切断部位を含むストレッチに別の塩基性アミノ酸が追加されます;追加の正電荷リジンは、多塩基性切断モチーフを拡張し、追加の宿主プロテアーゼによる切断を促進する可能性があります。
全体として、正確なメカニズムは不明ですが、N679K 変異により安定性の低いスパイクタンパク質が生じ、SARS-CoV-2 の感染と病因に影響を及ぼします。
驚くべきことに、N679K は、ゆらぎ位置の 1 つのヌクレオチドの変化にもかかわらず、GSAID の オミクロン配列の 100% で一様に見られます。
N679K は in vitro で弱毒化されていますが、ハムスターの肺内および 2 日目の鼻洗浄液内で WT と同様の力価まで複製します。
特に、直接伝播競争において、N679K は上気道において WT を上回ります。
これらの結果は、伝染に欠陥がないことを示唆しており、上気道でのウイルスの複製が新たな感染を引き起こす可能性が高いため、蔓延が増大する可能性がある。
これらの結果は、SARS-CoV-2 感染が明らかに減弱したにもかかわらず N679K が維持される理由も説明できる可能性があります。
特に、YKH変異体にH655YとP681Hを追加すると、Calu-3細胞の複製がレスキューされ、他のOmicron変異がN679Kを補う可能性があることが示唆されました。
ただし、オミクロン株で N679K を元に戻すことが、in vitro での複製や in vivo での病因の点で利益をもたらすかどうかは不明です。
SARS-CoV-2 WA1 の N679K は明らかな機能喪失を引き起こしますが、スパイク変異とエピスタティック相互作用の組み合わせにより、Omicron 株の欠損が軽減される可能性があります。
重要なのは、Omicron における N679K の完全な保存は、フィットネス上の利点も示唆していることです。
我々のデータから、N679Kによる上気道複製への移行は、全体的なスパイクタンパク質の発現が低下しているにもかかわらず、N679Kがどのように維持されるかを説明する可能性があります。
一次感染への影響に加えて、スパイクタンパク質の減少は、SARS-CoV-2 とヒトの免疫に重要な影響を与える可能性があります。
WT と比較して、N679K 変異体は感染時に生成するスパイクタンパク質が少なく、スパイクとヌクレオカプシドを標的とする抗体の比率を歪める可能性があります。
SARS-CoVに関するこれまでの研究では、スパイク/ヌクレオカプシド抗体比の変化が高齢マウスにおけるワクチン接種の失敗に寄与することが示されていました。
したがって、オミクロン株に感染すると、スパイク抗体を犠牲にして N ターゲティング抗体が増加する可能性があります。
その結果、中和抗体の防御力が低下し、さらなるブレイクスルー感染を促進する可能性があります。
さらに、オミクロンスパイクに基づく SARS-CoV-2 ワクチンは、N679K 変異により生成するスパイクタンパク質が少ない可能性があります。
mRNA 2 価ワクチンのコンテキストでは、N679K 変異は WT と Omicron スパイクタンパク質の 1:1 の比率を変更する可能性があります;N679K は、免疫応答を両方のスパイクタンパク質間で等しくではなく、WT スパイクタンパク質に偏らせる可能性があります。
さらに、生成されるスパイクタンパク質の総量は以前のワクチン製剤よりも少ない可能性があり、そのため全体的な抗体反応が低下します。
これらの要因は、新しい二価ワクチン製剤にもかかわらず、オミクロン株に対する免疫力の増加が予想よりも少ないことに寄与している可能性があります。
今後は、ワクチン中の K679 を N679 に戻すことでスパイクタンパク質の収量が向上し、その後、Omicron 変異体に対するワクチンの反応が改善される可能性があります。
まとめると、私たちの結果は、オミクロン N679K がサブバリアントで一貫して維持されている機能喪失変異であることを示しています。
機構的には、N679K 変異はスパイク分解を増加させることにより、in vitro および in vivo でウイルスを弱毒化します。
N679K 変異は単独では弱毒化していますが、H655Y や P681H などの他の Omicron 変異は、スパイク処理と感染を増幅することで N679K の機能喪失を補っている可能性があります。
ただし、N679K によるスパイクタンパク質発現の減少は、感染症やワクチンによって誘導される免疫に影響を与える可能性があります。
さらに、N679K はウイルスの病因を弱めましたが、上気道複製への移行により伝播性が高まり、オミクロンの出現に寄与した可能性があります。
全体として、データは、オミクロンCTS1 変異が SARS-CoV-2 感染に重大な影響を及ぼしており、継続的な研究と監視に値することを強調しています。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
