免疫学の新たな視点を探る(2024年3月)
Exploring new perspectives in immunology
免疫学の新たな視点を探る
元→Exploring new perspectives in immunology: Cell
Summary
クローン選択理論、抗原受容体の多様性、免疫記憶、適応免疫の自然制御など、いくつかの概念的な柱が現代免疫学の基礎を形成しています。
しかし、免疫学的現象の中には現在の枠組みでは説明できないものもあります。
したがって、特定の病原体に対して長期持続する防御免疫を提供するワクチンをどのように設計するか、なぜ自己免疫応答が一部の抗原を標的とし他の抗原を標的としないのか、なぜ感染に対する免疫応答が時々善よりも害を及ぼすのか、私たちはまだわかっていません。
これらの謎の一部を理解するには、既存の仮定に疑問を投げかけ、別の説明を開発し、テストする必要があるかもしれません。
免疫学は、再び新たな視点を探求することがますます必要になる時期にきています。
Introduction
免疫系は病原体に対する重要な防御を提供します。脊椎動物では、免疫系は 2 つの主要な要素、つまり先天的要素と適応的要素で構成されます。
自然免疫系は、微生物特有の起源の分子構造など、病原性の脅威を示すさまざまな合図を検出します。さらに、2 種類のリンパ球が無顎脊椎動物と有顎脊椎動物で独立して進化し、最終的に適応免疫系を生み出しました。
リンパ球の出現によってもたらされる主要な進化的革新は、抗原受容体に基づく独特の免疫認識モードです。
これにより、リンパ球が特定の微生物抗原を認識し、自然免疫エフェクター機能を活用して、特異性、増幅、記憶の発達を通じて病原体を排除できるようになりました。
抗原受容体の明確な特徴は、その特異性が遺伝的に決定されるのではなく、VDJ 組換え、遺伝子変換、塩基編集、抗原受容体サブユニットのランダムなペアリングなどのいくつかのランダムなプロセスによって生成されることです。
これらのランダムなプロセスが受容体の特異性にどの程度寄与するかによって、達成できる受容体の多様性の程度が決まります。
ただし、抗原受容体の多様性には、これらの受容体が解釈できる情報が犠牲になります。
したがって、抗原受容体の多様性が最も高いリンパ球(ほとんどのαβT細胞と大部分のB細胞。用語集についてはボックス1を参照)は、それらが特異的な抗原の起源を決定することができません(抗原が自己抗原か微生物抗原かを含む)。 また、体内のどこで同種の抗原に遭遇するかを予測することもできません。
これらの制限は、いくつかのメカニズムによって部分的に解決されます。
自己抗原に特異的な一部の T リンパ球と B リンパ球は、発生中にそれぞれ胸腺と骨髄で削除されます。
ただし、この剪定プロセスは不完全であるため、自己反応性リンパ球のサブセットが成熟細胞への発達を完了することができます。
潜在的に破壊的な自己反応性リンパ球の活性化は、通常、2 つのメカニズムによって回避されます。
第一に、リンパ球の活性化は、自然免疫系による微生物の認識に応じて生成されるシグナルに依存します。
第二に、自己抗原、共生微生物および非微生物環境抗原に対する有害な免疫応答の活性化は、通常、制御性 T (Treg) 細胞によって阻止されます。
抗原受容体の多様性のもう 1 つの結果は、各受容体特異性がナイーブリンパ球のごく一部で発現されることです。
この制限により、血液と二次リンパ器官の間の再循環による「抗原性空間」の継続的なサンプリングの必要性が生じます。このプロセスはリンパドレナージシステムによって可能になります。
ナイーブリンパ球は、自然免疫系からの指令シグナル(および Treg の祝福)と組み合わされた同族抗原に遭遇すると、クローン選択、増殖、およびエフェクター細胞への分化を受けます。
さらに、このように活性化されたリンパ球の小さなサブセットが記憶細胞となり、宿主が将来同じ病原体に遭遇する準備をします。
免疫システムがどのように機能するかに関するこのパラダイムは、過去 30 年間この分野で役に立ってきましたが、新しい発見は現在の枠組みに適合させることがますます困難になっています。
これにより、新しいアイデアや観点を探求することで得られるいくつかの基本的な前提、ルールの例外、矛盾について疑問が生じます。
ここでは、これらの問題のいくつかについて議論し、現在の免疫学的パラダイムでは説明できない免疫学的現象を調和させるための可能な視点を提案します。
まず、免疫応答の活性化の要件、つまりさまざまな免疫部門の活性化に必要または十分な、必要なシグナルとそれらが運ぶ情報を確認します。
次に、免疫記憶について説明し、感染後に保存される可能性のある免疫に関連する情報の種類に基づいて、概念の拡張の可能性を提案します。
そして、感染サイクルの基本段階とワクチン開発への影響という観点から、防御免疫に関する理解の現在の限界を検討します。
最後に、摘出による免疫系機能の拡張された視点を探求し、恒常性と免疫病理学における概念としての免疫相互受容を提案します。
このトピックの選択は確かに包括的ではありません。
ここで議論するアイデアは、免疫学の現在のパラダイムにおける矛盾に対処するための私たちの試みです。
ここでの私たちの目標は、最終的にこれらの矛盾を解決するための議論を引き起こすことです。
リチャード・ファインマンの言葉を借りれば、「質問できない答えがあるよりも、答えられない質問があるほうがよい」からです。
Immunogenicity
免疫原性
免疫学における重要な問題の 1 つは、免疫応答の活性化の要件に関するものです。
応答を開始するにはどのような信号が必要または十分ですか?
抗原特異的免疫応答と自然免疫応答の要件は明らかに異なるため、この質問は免疫応答のタイプによって解析する必要があります。 一次応答と記憶応答の要件も同様です。
要件には、それほど明白ではない不明確な違いもあります;したがって、Th1 および Th17 応答と比較して、T ヘルパー 2 型(Th2)を誘導するのに十分なシグナルがより多く存在すると考えられ、前者に必要なシグナルの同定が困難となっています。
複雑さのもう 1 つの層は、特定のタイプの免疫応答(現在の定義に基づく) が、それを開始したシグナルに応じて異なる定性的特性を持つ可能性があるかどうかです。
たとえば、(特定の病原体に対する)免疫応答が、感染によって誘導されたものであっても、生弱毒化ワクチン・不活化ワクチン・mRNAワクチン・サブユニットワクチンによって誘導されたものであっても( 4 つのワクチンすべてが同等の抗体力価を誘導すると仮定)、同等であると期待できるでしょうか?
ほとんどの場合、答えはおそらくノーですが、なぜ、どのように反応が異なるのか、また 5 つの課題のどの特性がこれらの違いを説明しているのかは完全には理解できません。
さらに進んで、感染/免疫の部位、抗原の用量または病原体の複製速度、アジュバントの物理的特性などの追加の変数を含めることもできます。
実際、これらのパラメーターはすべて過去数十年にわたって研究されてきましたが、必要かつ十分な信号の量的および定性的特性と、それらが引き起こす応答の質とをどのような「規則」が関連付けているのかについて、一貫した全体像がまだわかっていません。
この問題は、以下で説明するように、私たちの理解がとりわけ限られている防御免疫の問題に特に関連しています。
この問題を正式に定義する前に、感覚生理学からの類推を考えてみましょう:私たちは、視覚、嗅覚、味覚、聴覚の経路を含むいくつかの情報チャネルを通じて外界に関する情報を受け取ります。
それぞれが異なる種類の情報を提供し、私たちの対応はこれらの入力の処理と統合に基づいています。
したがって、私たちは食べ物の風味を嗅覚と味覚の組み合わせとして認識します。
特に、異なるチャネルを通じて提供される情報は同等ではありません:見た目が良くて匂いが良ければ、私たちはそれを食べますが、見た目が良くて匂いが悪ければ食べません。見た目や匂いは良くても味が悪い場合も、私たちは食べません。
これは、一部の情報チャネルが他の情報チャネルよりも信頼できるためです (ここでは、外観よりも味の方が品質を示す優れた指標です)。
さらに、あるチャネルの情報不足は、別のチャネルの情報によってある程度補うことができます:食べ物が疑わしいように見えても、そのような見た目のものだと言われれば、私たちはそれを食べるかもしれません。
重要なのは、決定を下すためには完全な情報が必要であるということです。
私たちが不完全な情報に基づいて行動するかどうかは、間違いのコストによって決まります。コストが高ければ高いほど、不確実性の下での意思決定において冒険心がなくなります。
同様の方法で、免疫応答開始に必要な信号の問題を、さまざまな感覚チャネルからの入力で構成できる完全な情報のパケットとして組み立てることができます。
これらの入力にはさまざまな種類の情報が含まれており、一部のものは他のものよりも信頼性が高くなります。
情報パケットを完成させるものは応答のタイプによって異なります。一部の応答は他の応答よりも多くの情報を必要とします。
たとえば、ほとんどの感染症は腫瘍壊死因子 (TNF) 反応を誘発します。 ただし、I 型インターフェロン (IFN-I) またはインターロイキン (IL)-17 応答をそれぞれ誘導するには、感染の種類 (ウイルス対真菌など) を指定する必要があります。
間違った反応を誘発すると、感染を除去できなくなります。
大まかに言うと、免疫反応にどの程度の情報が必要かは、偽陽性と偽陰性のエラーのコストの比率によって決まります。 (必要のないときに応答するコストと、必要なときに応答しないことのコスト)。
そこで問題は、特定の免疫反応を誘発するために必要なさまざまな種類の情報は何なのか、あるいは、入手可能な一定量の情報でどのような種類の反応を誘発できるのか、ということです。
この枠組みは、抗原特異的な「適応」免疫応答と抗原非特異的な「自然」免疫応答の従来の分類よりも、より一般的な視点に導くことができます。
必要かつ十分なシグナルについての詳細な議論には、より対象を絞った研究と分析が必要ですが、ここでは、いくつかの身近な例を使用して、免疫系によって認識される情報をさまざまな意味論的カテゴリーに解析する概念を提案します (ボックス 2)。
単語の意味と同様に、これらのカテゴリは階層構造を持っています (たとえば、微生物は病原体よりも一般的なカテゴリです)。
これらの特性の一部の役割は明確に定義されており、それらが自然免疫系または適応免疫系によってどのように検出されるかがわかっています。
つまり、微生物起源の保存された構造はパターン認識受容体 (PRR) によって検出されます。 いくつかの病原性因子はインフラマソームによって検出されます。 細菌の生存能力は、mRNA の認識によって解釈できます。 そして、微生物の量は、それらが誘発する炎症反応の規模によって単純に報告される可能性があります。
細胞外 (Th17)、液胞 (Th1)、および細胞質 (細胞傷害性 T リンパ球) 病原体によって誘導される異なる応答によって示されるように、病原体の細胞内での位置は関連しています。
免疫系がこれらの場所をどのように区別するかは完全には理解されていません。ただし、細胞質のウイルスおよび細菌感染が IFN-I 応答を引き起こすことは理解されています。
共生細菌と侵入細菌は、上皮細胞上のいくつかのToll様受容体(TLR)の頂端発現によって部分的に区別することができます。
また、経口寛容現象によって示されるように、抗原曝露の部位が重要であることもわかっています。 消化器系を介して抗原が導入されると、摂取した抗原に対して長期間無反応になります。
抗原認識の面では、抗原の構造が B 細胞に関連する因子である可能性があることが知られています: たとえば、微生物表面抗原の特徴である高密度反復エピトープは、T 非依存性 II 型 B 細胞応答に関与する可能性があります (図 1)。

これは、追加情報 (エピトープ配置) がパターン認識と T 細胞の助けをどのように補うことができるかの例です。
同様に、抗原の化学構造も関連する可能性があります。 これは、例えば、シトルリン化抗原を標的とする自己抗体の傾向によって示されます。
しかし、この情報が対応の開始時に感知され解釈されるかどうか、またどのように解釈されるかは不明です。
上記に挙げた他の特徴も関連しているように見えますが、それらが検出されるかどうか、どのように検出されるか、またそれらのさまざまな組み合わせが免疫応答にどのように影響するかはわかっていません。
これらの特性の一部に関連する情報は、自己免疫やがん免疫だけでなく、ほとんどの感染症に対する防御免疫の規則に対する理解の欠如を説明する隠れた変数である可能性があります。
感染症やワクチン接種におけるそのような入力特徴の体系的な研究は、それらを免疫応答出力に結び付けるパターンを明らかにする必要があります。
上で述べたように、ランダムな抗原受容体を持つ T リンパ球と B リンパ球は、それらが特異的な抗原の起源を決定することができません。 —ランダム性により受容体の多様性が許容されますが、受容体が解釈できる情報が犠牲になります。
不足している情報は自然免疫系によって提供されます。 そしてこれが、適応免疫応答が自然免疫認識に依存する理由です。
ただし、抗原受容体のランダム性の程度は、NKT 細胞や粘膜関連不変 T (MAIT) 細胞によって発現される不変受容体から、一部の γδT 細胞や B-1 B 細胞の限られた多様性までさまざまです。 および辺縁帯B細胞は、ほとんどのαβT細胞およびB-2 B細胞のほぼ完全にランダムな受容体に反応します。
抗原受容体の多様性やランダム性が低いほど、それらを発現するリンパ球が特異的な抗原の起源を決定するために必要とする追加情報は少なくなります(図 1)。

したがって、B-2 B 細胞の活性化には、特定の B 細胞クローンを選択する T 細胞の助けが必要です。
一方、B-1 細胞と辺縁帯 B 細胞は、抗原受容体の多様性が低いため、T 細胞の助けなしでもポリクローナル様式で活性化できます。
同様に、T 細胞受容体 (TCR) の多様性が制限された T 細胞では、その局在と応答を特定する情報が少なくて済みます (多様なTCR特異性を持つナイーブαβT細胞との比較)。
その理由は、繰り返しになりますが、これらの細胞集団は、特定の組織にホーミングし、リガンドが存在する場合には常に特定の方法で反応するようにあらかじめプログラムされているためです。
したがって、一般原則として、応答に必要な情報の総量はほぼ同じままです。 しかし、遺伝的にコード化された情報と他の経路(自然免疫系や抗原構造による指示など)を通じて受け取った情報との間で情報がどのように分割されるかは、抗原受容体の多様性の程度によって異なります(図1)。
多様な抗原受容体を持つリンパ球による情報処理の追加層は、クォーラム センシングによって実装される「群集インテリジェンス」に関連する原理に基づいています。
クォーラム センシングは 2 つの異なる役割を果たすことができます。1 つは、特定の機能に必要なセルの臨界量が確実に存在することです。
もう 1 つは、意思決定を最適化することです。個々のセルが不完全な情報を持っている場合、「多くの不完全な推定値をプールする」ことで意思決定の精度を向上させることができます。
この原理は、個々の細胞が受け取る入力の推定における「信頼度」の程度に比例した量のシグナル(自己誘導物質)を生成することに基づいています。
自己誘導物質の濃度は細胞集団の「集合知」を反映し、それによってエラー率が減少します。
クオラムセンシング現象は免疫系で説明されており、分泌された IL-2 が CD4+ T 細胞の自己誘導物質の役割を果たします。 一方、IL-2を消費するTregは、応答の活性化に必要な閾値を制御できる「仲裁者」の役割を果たす可能性があります。
集合知につながるこの戦略のマイナス面は、「フェイクニュース」が世論に及ぼす影響に見られるように、誤った情報への信頼を高めることで「群集心理」を生み出す可能性があることに注意すべきです。
免疫系の文脈では、不完全な情報に基づいて十分な自己反応性 T 細胞がランダムに「興奮」した場合(感染がない場合など)、自己免疫反応のリスクが生じる可能性があります。
このような影響は通常、Treg 細胞によって防止されますが、Treg 細胞が存在しない場合には発現する可能性があります。
さらに、集団内の少数の強い意見を持つメンバーが集団の意思決定に不均衡な影響を与える可能性があるのと同様に、少数の高反応性 T 細胞「影響力者」が IL-2 の高産生によって「世論」を揺さぶる可能性があります。
これは、応答が望ましい場合には有益ですが、そうでない場合(たとえば、応答が自己抗原に向けられている場合)には有害である可能性があります。
後者のシナリオの極端なケースは、おそらく、自己抗原に対して特に強い親和性を持つ T 細胞のネガティブ選択によって防止されると考えられます。
感覚システムは多くの場合、入力の絶対値ではなく、入力の変化を検出するように設計されています。
感覚系の特に一般的な機能は、倍数変化の検出です。
このような感覚適応と他の形態の感覚適応は生物学では一般的であり、免疫系も例外ではありません。
実際、変化の検出、より一般的には特定の変化パターンの検出は、免疫認識の必須の特徴であると提案されています。
このメカニズムは個々のリンパ球または細胞集団のレベルで機能します。 これは、クォーラム センシングおよび関連メカニズムに代わるものではなく、直交しているためです。
入力の変化率は、細菌やウイルスに関連する「複製」抗原を区別する特に重要な特徴である可能性があります。 もう1つは、アレルゲンや寄生虫に関連する非複製型(免疫応答の時間スケールでは複製率が事実上ゼロ)です。
不活化ワクチンとサブユニットワクチンは非複製抗原も提供するため、以下で説明するように、ワクチンが引き起こす反応の質に影響を与える可能性があります。
要約すると、自然免疫認識と適応免疫認識の間の標準的な区別は、免疫系による意思決定に関連するあらゆる情報で補完される必要があります。
ある意味カテゴリ内の情報の欠如は、T 非依存性 II 型 B 細胞応答に見られるように、別のカテゴリからの同義のシグナルによって補うことができます。 ここでは、微生物抗原に特徴的なエピトープ配置の検出により、自然免疫系によるパターン認識の欠如が補われます。
完全な指示がない場合、免疫系は入手可能な情報に一致する定型的な反応のみを行います。
利用可能な情報が多ければ多いほど、より適切な応答が生成されます。
さらに、クオラムセンシングやリンパ球間のコミュニケーションに関わるその他のメカニズムは、現在のパラダイムでは説明できないいくつかの現象を説明できる可能性があります。
Memory
記憶は適応免疫の重要な特性の 1 つです。
記憶は、情報の長期保存として定義できます。
この基本的な観点から、次の 3 つの質問を明確にする必要があります:免疫記憶にはどのような情報が保存されているのでしょうか?どのように保存され、取得されるのでしょうか?「長期」ストレージがメモリとして認定されるには、どれくらいの期間が必要ですか?
伝統的に、免疫記憶は抗原特異性の観点から考慮されてきました: 抗原選択されたリンパ球のクローン選択と増殖、それに続く長命の記憶細胞への分化は、適応免疫の特徴です。
このプロセスを通じて、抗原の同一性に関する情報は、拡張された数の抗原特異的記憶細胞の形で保存されます。
さらに、免疫記憶には感染の種類と経路に関する情報が保存されます。
この情報は、記憶リンパ球のエフェクタークラス特異的な分化状態およびその常駐位置の形で保存されます。
しかし、それ以上に、特定の感染症に関する他の情報が免疫メモリに保存されているかどうかはわかりません。
上で述べたように、感染する病原体とその抗原に関連するいくつかの種類の情報が免疫応答の誘導に関連します。 そのどれかが免疫記憶にも保存されているのか、もし保存されている場合はどのように保存されるのかという疑問が生じます。
反応の開始に関連する情報を検出し、免疫記憶に保存することは、形式的には連想学習に似たプロセスですー微生物の起源、病原体の種類、侵入経路などを報告するシグナルは、記憶細胞を含むリンパ球のクローン選択と分化を制御するために、抗原の同一性と関連付けることによって学習されます。
免疫システムも強化学習を利用しており、それによって免疫応答の結果に関する情報も評価および記録されるのではないかと思う人もいるかもしれません。
反応が感染の除去に成功した場合、反応のパラメーター (エフェクターの種類、局在化、大きさなど) は強化されますか;また、応答が何らかの形で失敗した場合、関連するパラメータは調整されていますか?
これはまさに進化の時間スケールで起こっていることですが、個々の生物のレベルでも起こるのでしょうか?
強化学習の平凡なケースは、適切なリンパ球のクローン選択に基づいています (ナイーブ プールから、またはアフィニティ成熟中のいずれか): 正しいクローンが選択され、その反応によって病原体が除去されれば、まさにそのクローンが記憶細胞を生み出すことになります。
それほど平凡ではない例としては、感染を除去するのにかかる時間に基づいた応答効率の調整が含まれる場合があります。
この原理を示唆するエレガントな研究では、病原体または特定の抗原の持続時間が記憶生成の効率と負の相関があることが示されました; したがって、急性感染症は慢性感染症よりも優れた記憶を生成します。これは、おそらく病原体の持続性が反応の失敗を意味しているためと考えられます。
メカニズム的には、慢性感染症は、記憶 T 細胞の分化よりもエフェクターに有利な炎症性サイトカインの影響を介して記憶形成を抑制します。
応答の成功は、病原体除去の効率と応答の適応コストという 2 つの変数の関数です。
広範な免疫病理を犠牲にして病原体を除去した場合、反応のパラメーターは強化されない可能性があります。
免疫反応の適応コストが記録されるかどうか、またどのように記録されるかは不明です。 しかし、炎症反応の大きさが適応度コストの代用として使用される場合、適応度コストを記憶生成に変換するメカニズムは、病原体の持続性を評価するために使用されるメカニズムと同じになるでしょう。
クローン選択に基づく標準的な記憶メカニズムを超えて、追加の種類の免疫記憶が示されている証拠が蓄積されています。これには、マクロファージと上皮幹細胞の両方で実証されたクロマチンリモデリングによって可能になる遺伝子発現の安定した変化、活性化受容体の特定の組み合わせを発現するNK細胞の選択的増殖、および一次感染後のNK細胞の組織特異的保持が含まれます。
これらのメカニズムは異なるタイムスケールで動作しますが、それらはすべて免疫記憶のさまざまな側面に寄与する可能性があります。
これらの追加の記憶機構は、記憶リンパ球に保存されている情報と相補的な情報を保持している可能性があると考えられます。
免疫学的記憶は、中枢神経系にも記録され、保存される場合があります: 島皮質の神経回路は、臓器固有の炎症反応に関する情報を保存および検索することが実証されました。
この例は、感染症に関連する情報の検出、解釈、保存に神経系が関与する可能性がはるかに広いことを示唆しています。
この情報が下行性運動経路を介して免疫系にどのように伝達されるかは、今後の研究にとって非常に興味深い分野です。
結局のところ、免疫系による学習と記憶は、進化を通じてであれ、個人の生活史を通じてであれ、現在はとらえどころのない防御免疫の原理の基礎となっており、これについては次に説明します。
Host-pathogen interactions: Some ground rules
宿主と病原体の相互作用: いくつかの基本原則
病原体にとって最終的に重要なのは、宿主内でうまく定着し、複製し、次の宿主に伝達できるかどうかです。
これらは病原体の生活史特性、つまり自然選択によって直接作用する特性です。
これらの目標はそれぞれさまざまな方法で達成でき、その特定の組み合わせによって病原体の生活史戦略が決まります。
たとえば、一部の病原体は複製と伝達速度を最大化し、宿主内での滞留時間が短いため、宿主のニッチに精巧な適応を進化させない可能性があります。
例には、インフルエンザウイルスやコロナウイルスなどの季節性呼吸器ウイルスが含まれます。
これらは通常、病原体の排除または宿主の死をもたらす急性感染症を引き起こします。
他の病原体は宿主への適応を最適化する可能性があります。 これは、多くの場合、遅い複製速度と、宿主の適応度に深刻な負担を与えない伝達メカニズムに関連しています。
B 型および C 型肝炎ウイルス、結核菌、ヘリコバクター ピロリなどのこれらの病原体は、慢性感染症を引き起こします。
この戦略の極端なバージョンは、単純ヘルペス ウイルス、水痘帯状疱疹ウイルス、エプスタイン バー ウイルスなどのヘルペスウイルス科の大型二本鎖 DNA (dsDNA) ウイルスに代表される、複製と伝達の長期停止を伴う潜伏感染です。
さらに、病原体の観点から見ると、宿主は 3 つのコンパートメントで構成されており、これらは重なっている場合もあればそうでない場合もあります。 これらは、侵入、複製、および伝播の場所です(一部の病原体は、長期滞留するための追加の区画を持っている場合があります)。
これは、病原体の侵入部位が複製、居住、または伝播に最適な部位ではない可能性があるためです。
この場合、病原体は感染サイクルの追加のステップ、つまり宿主内での播種を進化させて、これらの区画間の移行を可能にします。
コンパートメント間の内部障壁の有無と病原体の組織指向性に応じて、これらの部位間の移行は受動的に起こる可能性があります (例えば、ウイルス粒子が循環によって運ばれる場合)。 あるいは、複雑な寄生虫によく見られるように、精巧な適応が必要な場合もあります。
最後に、これらのテーマに関する追加のバリエーションと精緻化は、さまざまな種類のベクターによって運ばれる中間宿主を持つ病原体、または感染サイクルを最適化するために宿主の生理機能や行動を操作する病原体で行われます。
宿主のフィットネスに対する感染の影響は通常、病原体の複製、適応、伝播戦略の副産物であり、生命を脅かすものから軽度のもの、有益なものまでさまざまです。
後者の場合、「感染」と「病原体」という用語は「定着」と「共生」に置き換えられます。 しかし、これらのシナリオはすべて、異なる「入口、複製、適応、出口」戦略の特定の組み合わせによる生殖成功の最適化という同じテーマのバリエーションを表しています。
逆に、宿主にとって最終的に重要なのは、感染から生き残ることと、フィットネスへの悪影響を最小限に抑えることです。
原則として、これは、抵抗と寛容の 2 つのカテゴリに大別されるさまざまな防御戦略を組み合わせることによって達成できます。
この文脈において、寛容とは、病原体を標的にすることなく感染に適応して生き残る宿主の能力を指します。 一方、抵抗は免疫防御によって病原体を排除することを目的としています。
これらの戦略が交わる重要な点は、抵抗力のコスト、つまり付随的損害や免疫防御のその他の適応コストを最小限に抑えることと関係しています。
これらのコストは、罹患率と死亡率の主な要因となる可能性があります。 したがって、免疫防御の全体的な質を考慮する際には考慮する必要があります。
最小の適応度コストでの生存は、宿主集団に作用する自然選択の究極の「読み出し」であるため、防御効率はこれらの結果を念頭に置いて評価する必要があるということになります。
ここで「防御免疫」という概念が浮上します —おそらく最も理解されていないが、免疫防御の最も重要な側面です。
Protective immunity
防御免疫
免疫応答の他の特性(大きさ、エフェクタークラス、動態など)とは異なり、防御免疫は応答の結果によって定義されます—感染によって引き起こされるであろう病気や死から宿主を守ることに成功したかどうか。
したがって、防御免疫とは、防御の有効性、調整、コスト、結果を考慮した防御の最終的なパフォーマンスを指します。
望ましい結果 (上記で定義したとおり) には、病原体の除去が含まれる場合と含まれない場合があります。一部の病原体を破壊することは、その存在を許容するよりもコストがかかる場合があります。
ここでは、話を簡単にするために、病原体の除去が防御免疫の重要な結果である急性感染症の一般的なシナリオに焦点を当てます。
原則として、免疫防御は病原体の感染サイクルのあらゆる段階(侵入、複製、異なる区画間の移行)を標的にすることができます。
感染した宿主に利益をもたらさないため、送信ステップは明示的にターゲットにされることは期待されません。 ただし、複製段階を標的にした場合の副産物として発生する可能性があります。
病原体のライフサイクルの各段階は、病原体に応じてさまざまな程度で宿主に悪影響を及ぼす可能性があります。
逆に、防御 (免疫病理の段階) の適応コストは、防御の対象となる段階に応じて変化する可能性があります。
したがって、障壁組織で病原体の侵入をブロックすると、宿主へのダメージが 肝臓や脳で殺すよりも少なくなることが期待されます。
付随的損傷に対する組織の感受性の違いを考慮して、適応コストの高い防御は、通常、防御のコストが高すぎる脆弱な組織には導入されません。
この原則の極端なバージョンは、いわゆる免疫特権部位であり、高度に破壊的な免疫反応が禁止されているように見えます。
したがって、一般に、防御免疫のパラメーターは、標的となる病原体の侵入、複製、または蔓延に配備される適切な防御モジュールの選択によって定義できるようです。 その結果、病原体制御と最小限の免疫病理学の両方の観点から最も効果的な結果が得られます。
この一般的な観点を念頭に置いて、さまざまなワクチンが防御免疫を誘発する成功と失敗の考えられる理由について説明します。
Vaccines and protective immunity
ワクチンと防御免疫
免疫学における極めて重要な成果は、さまざまな感染因子に対するワクチンの作成です。
免疫系の細胞および分子の特徴の正確な測定を可能にする新技術の出現により、免疫細胞サブセットおよびエフェクター機能の前例のないレベルの特性評価が可能になりました。
しかし、上で議論したように、特定の病原体に対する防御免疫の規則や、ワクチン接種によってそれを確実に確立する方法はまだ理解されていません。
ワクチンの目覚ましい成功の多くは、免疫システムを理解する前の試行錯誤の結果です。
天然痘ワクチンは、近縁の牛痘ウイルスの接種に基づいて 1700 年代後半に開発されました。
麻疹、おたふく風邪、風疹(MMR)に対する広く使用されており非常に効果的な小児ワクチンは、自然免疫と適応免疫が理解される前に開発された生弱毒化技術に依存しています。
これらの歴史的なワクチンの成功の多くは、以下の事実の組み合わせによるものであることが判明しています。①生ワクチンと弱毒化生ワクチンは強力で持続的な抗体反応を誘発、② 保護は循環 IgG に依存、③これらの病原体は急速な突然変異や急速な伝播を起こさず、ほとんどが単一の血清型で構成されています。
たとえば、麻疹、おたふく風邪、風疹、天然痘は、まず気道内でゆっくりとした複製速度で増殖し、ウイルス血症とその後のさまざまな器官への播種によって病気が引き起こされます。
これにより、ワクチンによって誘発された循環抗体と記憶リンパ球によって誘発された既往反応が、病気を引き起こす前にウイルスと交差することが可能になります(図2)。

対照的に、COVID-19パンデミックは、潜伏期間が短く急速に変異する呼吸器病原体に対するワクチンを開発する方法についての理解のギャップを浮き彫りにしました。
これらの急速に複製および伝染する呼吸器ウイルスには、パンデミックとなるコロナウイルスや季節性コロナウイルス、インフルエンザ ウイルス、呼吸器合胞体ウイルス (RSV) が含まれます。
このクラスの呼吸器ウイルスによる自然感染は、免疫逃避変異体の出現または短命の耐性のいずれかにより、再感染を防ぐことはできません。
したがって、ワクチンが防御免疫を与えるためには、自然感染よりも優れた効果を発揮する必要があります。
根本的な問題は、このクラスのウイルスに対する防御免疫を構成するものを正確に特定できないことにあります。
SARS-CoV-2 に関する私たちの経験に基づくと、たとえ強力な mRNA ワクチンを使用したとしても、ワクチンによって誘導される抗体は数か月以上防御できるほど十分なレベルに維持されない可能性があります。
さらに、再感染してから既往反応が現れるまでの遅延が長すぎて、これらの呼吸器ウイルスの複製を制御できない可能性があります。
しかし、 ワクチンが、侵入ウイルスに反応してこれらの抗体を迅速に上昇させるのに十分に高いレベルで鼻および呼吸器粘膜表面に分泌される長期持続型 IgG または分泌型 IgA (S-IgA) を産生する局所形質細胞、または組織常駐抗体分泌細胞を生成する場合、これらの急速に複製および伝播するウイルスに対する防御免疫が可能である可能性があります。
速やかに誘発される既往歴のある分泌型 IgA 応答は、SARS-CoV-2 のさらなる伝播を防ぐ鍵となります。
このような望ましい免疫応答は、mRNAワクチンプライミングとそれに続くアジュバントまたはアデノウイルスベクター化スパイクワクチンの非存在下での組換えスパイクタンパク質の経鼻投与の組み合わせによって誘導することができます。
最近の研究では、経鼻または吸入ワクチンおよび追加免疫戦略が、ヒト以外の霊長類において実際にSARS-CoV-2攻撃に対してほぼ滅菌免疫を達成できることが実証されました。
これらの有望な粘膜ワクチン戦略に基づいて、将来的には防御の相関関係を確立できる可能性があります。
防御の相関関係をより正確に定義し、強力な粘膜ワクチン戦略と組み合わせることで、集団ベースの免疫を達成できる可能性があります。
上で述べたように、集団を保護するために感染を阻止するメカニズムは、感染した個人も保護しない限り、進化的に安定していません。
しかし、公衆衛生対策は、伝染段階を妨げるワクチンを通じて集団ベースの免疫をもたらすことができます。
防御免疫に関する私たちの理解におけるもう 1 つのギャップは、病原体に対する十分なレベルの循環抗体を提供できる長命形質細胞 (LLPC) を生成するメカニズムです。
LLPC は、多くの弱毒化生ワクチン、さらには 1918 年インフルエンザ ウイルスなどの一部の呼吸器感染症でも実証されています。
ただし、自然の SARS-CoV-2 感染と mRNA ワクチンは骨髄で形質細胞を誘導することが示されていますが、 これらの細胞が十分な数で確立されているかどうか、またそれらが長年にわたって防御中和抗体の分泌に寄与しているかどうかは不明のままです。
一部の感染症やワクチンが LLPC を誘発するメカニズムと、そうでないものがあるメカニズムも不明です。
抗原量、抗原存在期間、投与経路、樹状細胞、病原体関連分子パターン(PAMP)、炎症の程度、胚中心(GC)の関与、T細胞の助け、または他の要因が LLPC の設立に寄与する可能性があります。
漸増用量の抗原をゆっくりと放出すると、長期的な GC 応答が誘導され、その結果、抗体応答が強化されます。
より良いLLPC反応を誘導するというパズルを解くことは重要な課題であり、将来のワクチン開発には多大な努力が必要です。
これまでの議論は、感染からの宿主防御における免疫系の標準的な機能に焦点を当ててきました。
次に、同じコア操作手順を利用するものの、「ドメスティック」問題に適用される可能性のある非正規な機能に目を向けます。
Immune system: What is it good for?
免疫システム: それは何に良いのですか?
1 つの機能を実行するために進化した生物学的形質は、後に追加の機能を獲得するために進化する可能性があります。 元のものよりも卓越している可能性さえあります。
この現象は外適応と呼ばれ、その古典的な例は、最初は体温調節のために進化し、後に初めて飛行に使用できる特性を獲得した羽毛の進化の歴史です。
複雑な多機能システムの場合、外適応が一般的です。
どの機能がオリジナルで、どの機能が拡張によるものであるかを判断することは常に可能であるとは限りませんが、拡張を可能にするシステムの特性を分析することで明らかになる可能性があります。
これには、関心のある機能が、たとえ最も顕著な例であっても、特定の例を通じてではなく、最も一般的な方法で、第一原理に基づいて定義されることが必要です。
ここでは、免疫系の構成要素の基本的な機能の一部を、宿主防御を超えたその有用性を強調するために、より一般的な方法でどのように見ることができるかについて簡単に説明します。
感染症からの防御は免疫系の重要かつ十分に確立された機能ですが、それは免疫系の機能レパートリーの発現の 1 つにすぎません。
実際、免疫系のさまざまな構成要素は、抗菌防御とは関係のない追加の機能を実行する可能性があり、実際に実行しています。
これはマクロファージにとって最もよく評価されています。マクロファージは、アポトーシス細胞の除去、細胞外マトリックスの再構築、組織内の他の細胞型への成長因子の提供など、組織の恒常性と維持において多くの機能を果たします。
これらの恒常性維持機能は、ある意味、感染からの宿主防御におけるマクロファージの機能と同じくらい重要です。
マクロファージの中核となる機能は、次の 4 つの主要なカテゴリに分類されます:組織微小環境のセンシング (酸素、浸透圧、pH、細胞外マトリックス (ECM)、病原体の存在など);食作用とリソソーム分解; 傍分泌信号を介したコミュニケーション;ECMリモデリングを含む細胞外分解のための酵素の分泌。
これらの中核機能を通じて、マクロファージは宿主防御、組織修復、リモデリング、および発達を促進します。
マクロファージは多機能な何でも屋です。
その兄弟 (樹状細胞) といとこ (顆粒球) は、次の機能のサブセットを実行することに特化しています:樹状細胞とマスト細胞はセンシングとコミュニケーションに焦点を当てますが、好中球は食作用、リソソーム、および細胞外分解に特化します。
感染症に関連してこれらの機能を研究することに焦点が当てられてきましたが、それらの多く、そしておそらくすべてが組織生物学においても重要な役割を果たしています。
視野を広げるには、「病原体」や「感染症」などの特定の用語を、「不要な貨物」や「組織の状態の変化」などのより一般的な用語に置き換える必要があります。
したがって、補体や抗体を含むオプソニンは、微生物、死んだ細胞や損傷した細胞、またはシナプスなどの不要な物質(不要な理由に関係なく)を食作用による除去のために「タグ付け」します。
同様に、樹状細胞は、組織内の病原体を感知することに加えて、感染によって引き起こされるかどうかに関係なく、組織恒常性の変化の他の側面を感知する可能性があります。
組織状態の関連する変化を検出すると、樹状細胞はこの情報をリンパ球 (自然リンパ球 [ILC] および T 細胞) に伝えます。
ILC と T 細胞がこの情報を使って行うことは、ここでも主に感染症に関連して研究されていますが、同じ原理が他の機能にも当てはまります。
これを理解するには、より一般的な観点から T 細胞の機能を考慮する必要があります。
たとえば、細胞傷害性リンパ球は、不要な細胞にアポトーシスを誘導します。
繰り返しますが、細胞はさまざまな理由で不要になる可能性があります。感染、損傷、間違った場所で見つかった、または単に過剰に生成された可能性があります。
これらの状態は、細胞固有の死プログラム (アポトーシス、ネクロトーシスなど) を引き起こす可能性もあります。
細胞傷害性リンパ球は、細胞固有の細胞死の条件が満たされない場合、または適切に実行できない場合に、これらのプログラムを補完します。
したがって、重要な問題は、細胞傷害性リンパ球の観点から見て、何が細胞を「不要」にするのか、そして細胞傷害性リンパ球は排除の対象となる可能性のあるこの状態をどのように感知するのかということです。
一部の癌細胞はこれらの基準を満たし、他の癌細胞は満たさないのでしょうか?
私たちの観点からは、どのようながん細胞も不要なものですが、細胞傷害性リンパ球による排除の基準を満たすのは一部の種類のがん細胞のみであるようです。
現時点では、これらの基準が何であるかを完全に理解していないため、なぜ一部のがんが免疫系の標的となり、他のがんが標的にならないのかも理解できません。
この一般的な観点から考えると、リンパ球の中核機能は、組織細胞に作用して細胞の運命や行動を変える分泌シグナルまたは膜結合シグナル (サイトカイン、成長因子など) の局所的な提供として定義できます。
本質的に、リンパ球は、組織監視を実行し、組織の機能状態の変化を強制する移動性パラクリン/ジュクストラクリン細胞として機能します。
リンパ球のこの機能は、組織固有の恒常性維持機構を補足または置き換える必要がある場合に必要となる場合があります。 これは、内分泌系や自律神経系からの信号が組織の恒常性維持回路に重ね合わされて、組織の機能状態に影響を与えるのと似ています。
リンパ球の出現と多様化は脊椎動物の複雑さの増加と相関しているため、可能性の 1 つは、組織監視機能が脊椎動物特有のイノベーションに特に関連しているということです。
リンパ球の恒常性維持機能の理解は現在、主に ILC および自然様リンパ球 (ILL; γδT 細胞を含む多様性が限られた TCR) 集団を含む例に限定されています。
ただし、リンパ球の種類に関係なく、その動作モードは同じ原理に従います:つまり、樹状細胞、マクロファージ、上皮細胞、感覚ニューロンなど、感覚機能を備えた細胞から情報を収集します。
この情報はシグナルにエンコードされており、IL-1、IL-12、IL-33、IL-25 などのサイトカインが最もよく知られています。
これらのシグナルによる刺激を受けると、ILC は独自のサイトカインのセット (IL-13、IL-17、IL-22、および IFN-γ を含む)および成長因子(アンフィレグリン、ケラチノサイト成長因子、IGF1などを含む)を生成します。感覚細胞によって報告されたあらゆる課題に対する組織の適応を調整します。
これには感染症が含まれますが、限定はされてません。
このような感染に依存しない機能は、組織リモデリング、代謝制御、および熱産生に関与していることが判明した ILC の場合によく評価されています。
同様に、脱落膜 NK 細胞は胎児と母体の境界面で特殊な機能を持ち、そこで栄養膜浸潤と胎盤の発達を制御します。
リンパ球は 2 種類の入力を使用します:1 つは感覚細胞タイプによって生成されるサイトカインおよびその他のシグナル、もう 1 つは免疫受容体チロシンベースの活性化モチーフ (ITAM) 共役受容体または関連受容体によって通常検出される細胞表面シグナルです。
ITAM ベースの受容体のテーマの 1 つのバリエーションは、TCR です。
γδT 細胞や NKT 細胞など、TCR の多様性が制限された T 細胞は、組織の監視と適応、および代謝調節において多様な役割を果たすことがわかっています。
これらの T 細胞サブセットの TCR は多様性が限られており、したがって定義された一連の非古典的主要組織適合性複合体 (MHC) リガンドに特異的であるため、 これらは、サイトカインやTCRリガンドによる刺激時に特定の組織監視機能を実行するように、発生段階で事前にプログラムすることができます。
多様な TCR レパートリーを持つ αβT 細胞の場合、恒常性維持機能の既知の例は依然として限られており、ほとんどが Treg 細胞に関するものです。
組織常在性 Treg は、脂肪組織における組織修復、幹細胞維持、代謝調節において役割を果たすことが示されています。
したがって、除脂肪組織に浸潤するTregの集団は、炎症性メディエーターの合成と脂肪細胞によるグルコース取り込みに直接影響を与えるサイトカインを分泌します。
このようなクローン増殖したTregは内臓脂肪組織(VAT)で特異的なTCRを発現し、そのようなTCRを有するTregはまず脾臓でプライミングされ、次にVATに動員されて組織特異的な表現型を獲得します。
同様に、損傷した筋肉組織内の Treg はアンフィレグリンを分泌し、アンフィレグリンは筋肉サテライト細胞に直接作用して筋肉の修復を促進します。
Treg は、造血幹細胞の維持と腸幹細胞の分化の調節にとって重要であることも実証されました。
従来の T 細胞も恒常性維持機能を果たすことが示されています。
ニューロンの発達と機能の調節における T 細胞の役割は、いくつかの研究によって説明されています。
重度の複合免疫不全マウスとヌードマウスでは、海馬における成体神経新生が著しく損なわれています。
ミエリン塩基性タンパク質 (MBP) 特異的 CD4 T 細胞の移入により、神経新生が増加し、空間学習および記憶課題が強化されました。
CD4 T細胞は、歯状回における脳由来の神経栄養因子の分泌にも必要でした。 これは、海馬の可塑性の維持と再生におけるこれらの細胞の役割に関係しています。
別の研究では、成体マウスにおいて、CD8 T細胞やB細胞ではなく、CD4 T細胞の枯渇が海馬の神経新生の減少をもたらし、学習障害につながることを示し、これらの発見を裏付けました。
T細胞は正常な社会的行動の維持、そして前頭皮質脳領域内の適切な神経接続する上でも重要な役割を果たします。
髄膜の T 細胞は IFN-γ を分泌し、抑制性ニューロンに作用して GABA 作動性電流を誘導します。
IFN-γ が存在しない場合、マウスは社会的欠陥を発症し、前頭皮質脳領域の過剰な接続性を示します。
対照的に、髄膜 T 細胞から分泌される IL-4 は学習と記憶に寄与します。
これらの神経認知機能を調節する T 細胞の特異性は不明です。
神経系を超えて、CD4 T 細胞が出生後の器官形成を調節することが示されました。
乳腺内では、局所の樹状細胞が MHC クラス II 上の抗原ペプチドを提示し、CD4 T 細胞からの IFN-γ 分泌を誘導します。
IFN-γは乳腺上皮層に作用して管腔前駆細胞の分化を阻害し、乳腺の成長と分枝の減少につながります。
対照的に、Th2 細胞と乳腺 APC の相互作用は逆の結果をもたらし、分岐が増加しました。
CD4 T細胞が存在しない場合、リンパ節栄養細動脈の平均直径が野生型マウスよりも構成的に大きかったため、従来のCD4 T細胞も血管機能を定常状態に維持している可能性があります。
αβT 細胞のこの種の恒常性維持機能の例は、今後数年間で蓄積される可能性があります。 しかし、すでに明らかになりつつあるのは、多様なTCRレパートリーを持つT細胞が、おそらく自己抗原の認識に基づいてTCR依存性の恒常性維持機能を実行できるということです。
これにより、いくつかの重要な疑問が生じます。自己反応性 T 細胞および Treg によって検出される自己抗原の性質は何でしょうか?
自己反応性 T 細胞を活性化するための要件は何ですか?
これらは、抗菌機能を実行するナイーブ T 細胞の活性化とは区別されますか?
最後に、エフェクター T 細胞と Treg 細胞の両方が恒常性維持プロセスに関与しているとすると、それらは別個の機能または関連する機能を制御しているのでしょうか?
Interoception of the immune system
免疫系の内受容感覚
Treg を含む自己反応性 T 細胞の恒常性維持機能の例は、外部環境を感知する適応免疫系の十分に評価されている機能に加えて、 内部環境のいくつかの側面を感知して調節することを目的とした内受容機能を備えている可能性があります。
これらの観察から生じる重要な疑問は、これらの T 細胞の自己反応性がその機能様式にどのように関連しているのかということです。
ILC と γδT 細胞が内部事情にどのように関与しているかを想像するのは容易ですが、多様な TCR レパートリーを持つ T 細胞はどのように、そしてなぜそのような機能に関与するのでしょうか?
リンパ球生物学のこの側面についてはまだ不明な点が多すぎますが、ここでは、少なくとも何らかの議論を引き起こす可能性があることを期待して、仮説のシナリオを提案します。
私たちは、標準的な防御機能に関与するエフェクター T 細胞に加えて、恒常性の内部受容機能を実行するために、設計により負の選択を回避する自己反応性 T 細胞のクラスが存在すると提案します。
従来のエフェクター T 細胞や Treg と区別するために、ここではそれらを Tx 細胞と呼びます。
これらが別個の T 細胞集団を表すかどうかは現時点では不明であるため、この指定は現時点では便宜上のものに過ぎませんが、以下に示す議論はその可能性を示唆しています。
私たちは、Tx細胞が細胞型または細胞状態特異的に発現するタンパク質に由来する自己抗原のサブセットに特異的であることを示唆しています。これにより、Tx細胞は細胞および組織の恒常性および機能状態をモニタリングできる可能性があります。
胸腺上皮細胞における組織特異的抗原の発現は、AIRE によって可能になる可能性が高く、さらに、胸腺の組織模倣細胞は、発生および分化の特定の段階で発現される抗原に特異的な Tx 細胞を選択する可能性があります (図 3)。

この概念と一致して、自己反応性 T 細胞は健康な人間の循環中に存在します。
これらの自己反応性 T 細胞の少なくとも一部は Tx 細胞である可能性があります。
Treg はおそらく細胞型特異的自己抗原に対する比較的高い TCR 親和性によって選択されるため、異なる自己抗原特異性または関連する自己抗原特異性を有する可能性があります。
Tx 細胞の恒常性機能は、標準的な T 細胞によって利用されるのと同じエフェクター機構に少なくとも部分的に基づいているようです。
実際、上で引用した例では、Tx 機能は IL-4 および IFN-γ によって媒介されており、細胞傷害性 Tx 細胞はおそらく不要な細胞の恒常的な剪定を行っていると考えられます。
実際、T 細胞由来のサイトカインは多数の組織機能を制御することができ、細胞型または状態特異的な抗原依存性のこれらのサイトカインの産生により、Tx 細胞と Treg 細胞がその効果を組織の機能状態に依存させることができると考えられます。
Tx 細胞と Treg 細胞の両方が組織調節機能を実行するとすると、それらの違いは何ですか?
これらの細胞間の機能的関係は、宿主防御に関与するTregと標準的なTエフェクター細胞の関係に類似していると考えられます。
具体的には、Tx 細胞によって産生されるサイトカインは組織に何らかの機能変化を強制し、Treg はこれらの変化に反対します (図 4)。
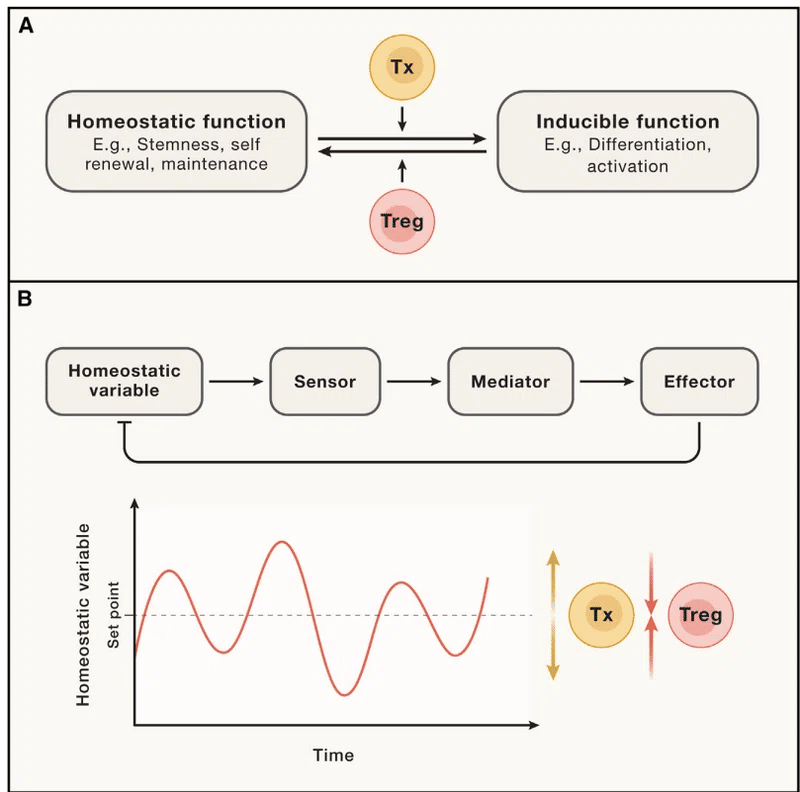
したがって、たとえば、Tx 由来のサイトカインが幹細胞の分化への移行を促進する場合、Treg 細胞はその効果に対抗し、幹細胞プールを維持します。
Tx細胞が何をするとしても、それがコラーゲン産生の促進、代謝変化の誘導、組織再構築などであっても、Treg細胞は単にこれらの機能を抑制または反対するだけです。 したがって、抗菌防御の文脈でエフェクター T 細胞が行うのと同じように、バランスを維持します。
このような機能は、一般に恒常性に対する炎症性および抗炎症性シグナルの影響とまったく同じであると考えられます。
さらに、Tx 機能の調節不全が自己免疫疾患を含む免疫介在性疾患のクラスターを引き起こすことを示唆します。
実際、自己免疫疾患は、正常な発達および恒常性維持機能の誇張されたバージョンと考えることができます。
たとえば、滑膜マクロファージは通常、RANKL および線維芽細胞によって産生されるコロニー刺激因子 1 の制御下で破骨細胞に分化します。
これは通常、マトリックスの堆積と侵食のバランスを維持するのに役立ちます。
自己反応性 T 細胞は、TNF と IL-1β で滑膜線維芽細胞を刺激することにより、破骨細胞の分化を促進します。
このメカニズムは、関節リウマチの文脈で誇張された場合にのみ理解されますが、それがあまり目立たない通常の条件下では、はるかに小規模で起こっていると考えられます。
したがって、自己反応性 T 細胞は単に Tx 細胞の調節不全バージョンである可能性があり、通常は恒常性 Treg がその活性を抑制している可能性があります。
同様に、多発性硬化症における自己反応性の病的 CD4 T 細胞は、ミクログリア細胞によって媒介される正常な脱髄プロセスを制御する Tx 細胞の調節不全バージョンである可能性があります。
実際、MBP 反応性 CD4 T 細胞は、多発性硬化症患者と同様の頻度で健康なヒトの脳脊髄液中に存在します。
Tx 細胞によるミエリン抗原の認識は、希突起膠細胞によって形成されるミエリン鞘の形成と除去の恒常性バランスの要件を監視する方法である可能性があります。
この機能の過剰なパフォーマンスが病的な脱髄につながる可能性があります。
この観点から、一部の自己抗原は恒常性維持機能のために Tx 細胞によって認識される自己抗原であり、自己免疫疾患の病理学的結果をもたらす Tx 細胞の活性調節異常です。
これは、自己免疫疾患が一部の臓器を標的にし、他の臓器を温存する理由を説明するでしょう。
この観点は、免疫系が一部のがんを攻撃し、他のがんを攻撃しない理由を最終的に説明する可能性もあります。
関連するシナリオには、内分泌細胞の分泌機能を報告する変異自己抗原の検出が含まれ、過剰分泌変異体クローンの排除を目的としています。
このメカニズムの重要な側面は、過剰分泌変異体クローンの増殖を可能にする制御機構の有無に基づいて、なぜ一部の内分泌組織が自己免疫疾患の標的となるのか、他の内分泌組織が標的にならないのかを説明しているということです。
他の自己抗原は、病原体または共生生物に由来する微生物抗原との交差反応性、または細胞表面タンパク質複合体による微生物の反復エピトープ配列の模倣など、無関係なメカニズムによって標的化される可能性があります。 重症筋無力症における抗体によるアセチルコリン受容体標的化の場合も同様です。
Tx 細胞の B 細胞相当物として我々が提案する Bx 細胞も自己反応性であり、アポトーシス細胞やその他の不要な物質の除去などの恒常性維持機能を実行します。
Bx 細胞の例としては、B-1 細胞 (またはそのサブセット) が挙げられます。 これらは、アネキシン IV やホスファチジルコリンなどのアポトーシス細胞によって発現される抗原に対する反応性を含む自己反応性によって選択され、死んだ細胞のクリアランスに関与します。
狼瘡患者のdsDNAまたはカルジオリピンを認識する天然IgMは、腎炎の欠如と相関しています。 このような抗体の保護的役割を示唆しています。
一方、同じ特異性を持つ IgG 抗体は、全身性エリテマトーデスにおける特徴的な病理学的自己抗体です。
したがって、抗体媒介自己免疫は自己反応性抗体の恒常性維持機能の異常版である可能性があり、場合によっては「間違った」アイソタイプへのクラススイッチが原因である可能性があります。
一部の説明不能な現象は、ここで示した観点から解釈できますが、直接的な実験的テストが必要です。
希少な組織常在性 T 細胞とその TCR の分析を可能にする新興技術は、自己反応性 T 細胞のユニークな特徴を明らかにするのに役立ちますが、 究極の「欠失試験」では、Tx 細胞の特異的除去の結果を調査する必要があるでしょう。 リンパ球が完全に欠如した変異動物は、感染症に対する重篤な感受性によって混乱しており、ほとんどの恒常性機能の研究には適さないためです。
Conclusions and future outlook
免疫システムには依然として多くの謎が残されています。
これらの謎の一部は間違いなく、細胞集団のレベルで作用する非線形現象から生じる創発的な特性を反映しているため、それらのすべてが従来の還元主義的なアプローチで解決できるわけではありません。
個々の昆虫を研究することによってシロアリがどのように塚を築くのかを理解することが不可能であるのと同様に、個々のコンポーネントを個別に研究することによってこれらの特性を理解することは不可能です。
実際、免疫システムは群集知性を備えたシステムとみなすことができます。 ここでは、個々の細胞の集団的な行動と相互作用が、脅威(微生物など)を認識してこれと闘い、内部秩序を維持する際のシステム全体の適応性と有効性に貢献します。
従来の「一度に1細胞」の断面アプローチから、縦断ライブイメージング技術と機械学習解析を組み合わせたような集合的な細胞挙動研究への移行により、免疫学的設計原理を理解する能力がさらに変化するでしょう。
もう 1 つの重要な考慮事項は、免疫応答の個人差です。
特定の感染症に起因する疾患結果に対する個人の感受性の不可解さは、医学的に重要な謎のままです。
システム免疫学の分析により、ワクチンに対するヒトの免疫応答の不均一性は、主に個人のベースライン免疫サインによって左右されることが明らかになりました。
双子の研究に基づくと、成人のワクチン接種結果におけるこの不均一性は遺伝学だけでは説明できません。
目標は、ベースラインの免疫学的調子の重要なパラメーターを理解し、病気の感受性を予測し、医療介入後の健康状態を予測する際にこの情報を活用することです。
さらに、免疫学と人工知能、代謝、栄養、神経系、マイクロバイオームが交わる新たな分野は、免疫システムがどのように機能するかについて新たな洞察をもたらすと期待されています; 誤作動の原因は何か;そして感染症、自己免疫、神経変性疾患などの病気と闘うためにそれをどのように操作できるのか。
最後に、COVID-19パンデミックは、いわゆる急性呼吸器病原体がさらに多くのことを引き起こす可能性があることを私たちに教えてくれました—複数の臓器に侵入し、ウイルスの貯蔵庫を確立し、潜伏ヘルペスウイルスの再活性化を誘発し、凝固亢進を誘発し、臓器に損傷を与え、ホルモンの不均衡を引き起こし、神経疾患、神経変性疾患、肺疾患、心血管疾患、および自己免疫疾患のリスクを高めます。
感染者の約 10% はロングCOVIDとして知られる長期的な健康上の問題を発症します。
何世紀にもわたって、他の病原体がロングCOVIDに似た急性感染症後の疾患を引き起こしてきましたが、これらの医学的に説明のつかない症候群は十分に受け入れられておらず、広く研究されていませんでした。
ロングCOVIDはパンデミックに次ぐパンデミックであり、6,500万人以上が苦しんでおり、依然として未解決の医学的謎であり、免疫学を含むあらゆる角度から研究する必要があります。
仮説を検証し、概念的な基礎を洗練することは、免疫学がこれらの緊急かつ永続的な課題に取り組む方法です。
以下省略。
///////////////////////////////////////////////////////////////////////////
Box 1. Glossary
用語集
BCR:
B 細胞受容体 (B 細胞の抗原受容体) は、2 つの重鎖と 2 つの軽鎖で構成される膜貫通複合体です。抗体はBCRの分泌型です。
B-1 cells:
これらの B 細胞は、病原体に対する初期の免疫応答に役割を果たす胎児由来 B 細胞の異なる系統に属しています。 B-1 細胞は IgM を発現し、さまざまな体腔に存在し、自発的に天然抗体を産生します。天然の抗体は多様性が限られており、細菌性およびウイルス性の病原体、さらには自己抗原のクラスに対して幅広い反応性を持っています。
B-2 cells:
B-2 細胞は「従来の」B 細胞で、出生後に骨髄で発生し、非常に多様な B 細胞受容体を発現し、感染症やワクチンによって誘導される抗体反応を担当します。 T 細胞の助けにより、B-2 細胞は体細胞超突然変異を起こし、BCR 配列をさらに多様化することができます。高親和性 B 細胞受容体を持つ B-2 細胞が胚中心内で選択され、親和性が成熟します。
Bx cells:
これらは、設計上自己反応性であり、さまざまな組織において内受容恒常性機能を実行する B 細胞の仮説的なサブセットです。 B-1 細胞のサブセットが Bx 細胞の候補となる可能性があります。
Conventional T cells: 従来の T 細胞
これらの T 細胞は、MHC 分子によって提示されるペプチドを検出する非常に多様な TCRab 鎖を持っています。 CD8 T細胞は、MHCクラスIに存在する細胞内タンパク質に由来するペプチドを認識し、ウイルス感染細胞やその他の不要な細胞を死滅させますが、CD4 T細胞は、MHCクラスIIに存在する細胞外タンパク質または膜貫通タンパク質に由来するペプチドを認識します。 CD4 T 細胞には、それぞれ細胞内病原体、細胞外寄生虫、細胞外細菌および真菌と戦う T ヘルパー 1 型 (Th1)、Th2、および Th17 サブセットなど、さまざまな種類があります。
Exaptation: 外適用
この特性は、最初は 1 つの機能のために進化し、後で新しい機能に再利用される可能性があります。
δγT cells:
これらは、リン酸化抗原、脂質抗原、およびストレス誘導性リガンドを検出する TCRg および TCRd 鎖を発現する自然様リンパ球です。
Innate lymphoid cells:
これらのリンパ細胞には、さまざまな臓器に初期の免疫応答と恒常性維持機能を提供する抗原受容体がありません。 ILC は、異なるサイトカインを分泌する能力を持つ 3 つのサブセットに分類されます: グループ 1 ILC=ILC1 および NK 細胞 (IFN-g) 。グループ 2 ILC=ILC2 (IL-4/IL-5/IL-13)。グループ 3 ILC=ILC3 および LTi (IL-17/IL-22)。
Innate-like lymphocytes: 自然様リンパ球
これらのリンパ球グループは、不変または限られた多様性の抗原受容体を発現します。これらには、NKT 細胞、MAIT 細胞、gdT 細胞、B-1 細胞、および辺縁帯 B 細胞が含まれます。
Interoception:
内受容は、体内からの信号を知覚、解釈し、作用することを意味し、恒常性の維持に重要な役割を果たします。
Mucosal-associated invariant T (MAIT) cells: 粘膜関連不変 T (MAIT) 細胞
これらの自然様リンパ球は、MHC クラス I 様分子 MR1 上に存在するビタミン B 代謝産物を認識する半不変 TCR を発現します。
Naive lymphocytes:
これらの T および B リンパ球はまだクローン選択を受けておらず、特定の抗原受容体を発現し、抗原を求めてさまざまな二次リンパ球を循環します。
Natural killer T (NKT) cells:
これらの自然様リンパ球は、多様性が限られた TCR を発現し、非古典的な MHC クラス I 分子である CD1d によって提示される脂質抗原を検出します。
Pattern-recognition receptors: パターン認識受容体
これらの受容体は、進化的に保存された病原体関連分子パターン (PAMP) を認識します。 PRR の例には、細胞外および空胞 PAMP (リポ多糖、ペプチドグリカン、および二本鎖 RNA [dsRNA]) を検出する膜貫通型の Toll 様受容体や細胞内核酸センサーが含まれます。 これには、サイトゾルのウイルス RNA を検出する RIG-I と MDA5、およびサイトゾルの DNA を検出する cGAS が含まれます。
Semantic feature:
ここで、「意味論的特徴」は、免疫システムにとっての意味に基づいて情報を個別のカテゴリーに解析することを示すために使用されます。
T help:
濾胞性ヘルパーT (TFH) 細胞として知られる二次リンパ組織内の CD4 T 細胞は、B 細胞が活性化、増殖、分化する「助け」を提供します。B 細胞がクラススイッチ (IgM から IgG、IgA、または IgE へ移行するなど) と親和性成熟 (B 細胞受容体は体細胞超突然変異とより高い親和性 BCR の選択を受ける) を受けるには、補助が必要です。 そして記憶B細胞と抗体分泌細胞になります。
Thymic selection: 胸腺の選択
これは、発生中の T 細胞が一連の選択プロセスを受けるプロセスです 胸腺内で自己抗原の認識を回避しながら(ネガティブ選択による)MHC分子によって提示される外来抗原を認識できる(ポジティブ選択)機能的なT細胞受容体を確実に保有するようにするためです。
Treg:
これらは過剰な免疫反応を抑制し、免疫寛容を維持する制御性 T 細胞です。
Tx cells:
これらは、設計により自己反応性であり、さまざまな組織において内受容恒常性機能を実行する、T 細胞の仮説的なサブセットです。例には、組織監視の制御、不要な細胞の刈り込み、細胞の活性化、分化、および組織のリモデリングが含まれます。このサブセットは胎児由来の T 細胞を含む可能性があります。
VDJ recombination:
免疫グロブリン(B細胞内)およびT細胞受容体(T細胞内)の可変(V)、多様性(D)、結合(J)領域をコードする遺伝子セグメントを再構成することによって、リンパ球の発生中に抗原受容体を生成する重要なプロセスです。 このランダムな組換えプロセスにより、リンパ球における多様な抗原受容体の発現が可能になります。
//////////////////////////////////////////////////////////////////////////
Box 2
免疫応答の生成に重要となる可能性のある、自然免疫認識および適応免疫認識のための可能な入力変数の例。これらの変数は、意味論的な特徴に基づいて分類されます。各変数は免疫システムにとって異なる意味を持ちます。アスタリスクは自己抗原に特有の特徴を示します。
INNATE IMMUNE RECOGNITION 自然免疫の認識
Microbial or not 微生物かどうか
Pathogenic or not 病原性があるかどうか
Type of pathogenicity 病原性の種類
Viability 生存可能性
Quantity 量
Site of entry エントリーの場所
Site of replication 複製の場所
Site of transmission 感染場所
Location—intra- or extra-cellular 場所 - 細胞内または細胞外
Replication rate レプリケーション速度
ANTIGEN-BASED RECOGNITION 抗原ベースの認識
Self or non-self 自己か非自己か
Valency 結合価
Epitope spacing and density エピトープの間隔と密度
Chemical nature 化学的性質
Abundance and stability 豊富さと安定性
Rate of change in quantity 数量の変化率
Ubiquitous or tissue-restricted* 遍在性または組織限定*
Expression dynamics (constitutive, inducible)
発現ダイナミクス (構成的、誘導的)
Factors that control expression level 発現レベルを制御する因子
Expression in the thymus* 胸腺における発現*
///////////////////////////////////////////////////////////////////////////
この記事が気に入ったらサポートをしてみませんか?
