XBBからJN.1への抗原シフトに対する抗体反応の進化(2024年6月)
Evolving antibody response to SARS-CoV-2 antigenic shift from XBB to JN.1
SARS-CoV-2抗原のXBBからJN.1へのシフトに対する抗体反応の進化
元→Evolving antibody response to SARS-CoV-2 antigenic shift from XBB to JN.1 | bioRxiv
Abstract
SARS-CoV-2 の継続的な進化、特に XBB 系統に代わる BA.2.86/JN.1 系統の出現により、現在のワクチン組成の再評価が必要になります。
ここでは、XBB および JN.1 のヒト曝露に対する体液性免疫応答の包括的な分析を提供し、JN.1 系統ベースのブースターの必要性を強調します。
我々は、SARS-CoV-2 未感染者における XBB および JN.1 系統の抗原特性の違いを実証しましたが、以前にワクチン接種または感染した者では違いが見られませんでした。また、JN.1 感染は、その亜変異体に対して優れた血漿中和力価を引き起こします。
我々は、KP.3 の強力な免疫回避および受容体結合能力を強調し、その予見可能な普及を裏付けています。
ディープ ミューテーション スキャン (DMS) によって特徴付けられる標的エピトープを持つ約 2000 個の RBD 特異的モノクローナル抗体 (mAbs) を分離する BCR レパートリーの広範な分析は、JN.1 誘導記憶 B 細胞 (MBC) の体系的な優位性を強調しています。
特に、クラス 1 IGHV3-53/3-66 由来の中和抗体 (NAbs) は、JN.1 に対する野生型 (WT) 反応性 NAbs 内で主に寄与しています。
しかし、KP.2 と KP.3 は、JN.1 によって誘導されたものも含め、かなりのサブセットを回避しているため、最適化された濃縮のために KP.3 へのブースター更新が推奨されます。
JN.1 によって誘導された Omicron 特異的抗体も、すべての Omicron 系統にわたって高い効力を示します。
これらの NAbs の回避ホットスポットは主に Omicron RBD で変異しており、以前に回避された NAbs が回復する可能性が高いことを考慮すると、回避に対する免疫障壁が高くなります。
さらに、広範囲に反応する IGHV3-53/3-66 をコードする抗体と MBC の普及と、それらがすべてのオミクロン特異的 NAbs と競合する能力は、それらがオミクロン特異的ナイーブ B 細胞の de novo 活性化を阻害する役割を担っていることを示唆しています。mRNA ワクチン接種を受けた個人における重度の免疫刷り込みを説明できる可能性があります。
これらの発見は、オミクロン抗原のXBBからJN.1へのシフトに対する抗体反応の進化を描写し、現在および将来のSARS-CoV-2変異体に対する体液性免疫を強化するために、JN.1系統、特にKP.3ベースのワクチンブースターを開発することの重要性を強調しています。
Main
2023 年 7 月に SARS-CoV-2 BA.2.86 系統が出現して以来、その亜種、特に JN.1 は急速に広まり進化を続け、以前から流行していた XBB 亜種に打ち勝ちました。
2024 年 6 月までに、JN.1 系統は新たに観察された配列の 93% 以上を占めました (図 1a)。

重要なのは、BA.2.86 と JN.1 は、R346S/T、F456L/V、A475V/S など、ウイルススパイク糖タンパク質の受容体結合ドメイン (RBD) に収束的に変異を蓄積していることです (拡張データ図 1a)。
KP.3 と命名された新たに検出された亜種は、前例のない Q493E 変異も持っています。
JN.1 亜変異体で変異したこれらの部位のほとんどは、受容体結合モチーフ (RBM) の近くにあります (拡張データ図 1b)。
このため、SARS-CoV-2 感染とワクチンによって確立された現在の体液性免疫バリアを回避する能力を調査することが重要です。
以前の研究では、XBB ベースのワクチンブースターの JN.1 有効 NAbs を誘発する能力が実証されています。
ただし、JN.1 の独特の抗原性を考慮すると、JN.1 免疫が現在の変異体と将来の潜在的な変異体に対して大幅に優れているかどうかを調査することが重要です。
この原稿では、血清と MBC エンコード抗体の両方の解像度で、ヒト感染における XBB と JN.1 系統間の体液性免疫応答を体系的に比較しました。
Results
Immunogenicity of JN.1 exposure
XBB および JN.1 系統の抗原性と免疫原性を評価するために、まず、ナイーヴマウスに変異体 Spike mRNA の 2 回投与免疫を実施しました (拡張データ図 2a)。

観察により、XBB 系統と JN.1 系統の抗原性には顕著な違いがあることが明らかになりました (図 1b および拡張データ図 2b)。

特に、JN.1 ファミリー内では、KP.3 は、KP.2 スパイクで免疫した場合でも、JN.1 および KP.2 とはかなり異なる抗原性を示しました。
少なくともナイーヴマウスにおけるこれらの抗原性の違いは、SARS-CoV-2 ワクチンの組成を XBB ファミリーから JN.1 ファミリーに変更することを検討するきっかけとなります。
将来の SARS-CoV-2 変異体の蔓延は、ワクチン組成評価の重要な指針となります。
ウイルス RBD のヒト ACE2 (hACE2) 結合親和性はウイルスの適応度と密接に関連しており、これまでの研究では、RBD L455-F456 変異が Q493 を介した ACE2 受容体結合親和性に及ぼす相乗効果を強調しています。
これらの部位は BA.2.86 系統、特に JN.1 でも収束的に変異していることから、表面プラズモン共鳴 (SPR) を使用して JN.1 サブバリアント RBD の hACE2 への結合親和性をテストしました (拡張データ図 1c)。

興味深いことに、F456L (KD = 12 nM) と R346T + F456L (KD = 11 nM) は JN.1 (KD = 13 nM) の hACE2 結合親和性に大きな影響を及ぼしませんでした。これは、HK.3 の L455F とは異なり、L455S による JN.1 の ACE2 親和性の低下は F456L では補えないことを示しています。
重要なのは、KP.3 の Q493E 変異により、JN.1 + F456L を基準として受容体結合親和性が大幅に改善され、KD = 6.9 nM を示したことです (図 1c および拡張データ図 1d)。

これは、BQ.1.1 および XBB.1.5 RBD に基づく ACE2 結合に関する以前の DMS 結果と一致しません。Q493E は ACE2 結合を阻害しており、これらの pre-BA.2.86 バリアントと比較して、Q493E と KP.3 の他の変異との間の非加法的エピスタシス相互作用を示しています。
実際、Q493E 変異は、JN.1 RBD (KD = 51 nM) の状況で ACE2 結合親和性を大幅に低下させますが、F456L 変異と組み合わせると、予想外に親和性を高めます (図 1d)。

A475V は、JD.1.1、HK.3.14、JN.4、KP.2.3.1 などの複数の系統で収束的に出現した RBM 変異です。
ACE2 親和性を低下させ、NAbs を回避するため、ACE2 に対する親和性が高い変異体によってのみ適応できます。
KP.3 のエピスタシスによる高い親和性は、KP.3 + A475V の KD が 22 nM であることを考えると、さらなる免疫回避のために A475V を組み込むことを可能にする可能性があります (図 1c)。
全体として、並外れた ACE2 結合親和性は、KP.3 の急速な伝播と蔓延を促進し、追加の免疫回避変異を獲得する可能性を高めます。
ヒト血清抗体回避は、SARS-CoV-2 ウイルスの適応性に関する最も重要な決定要因です。
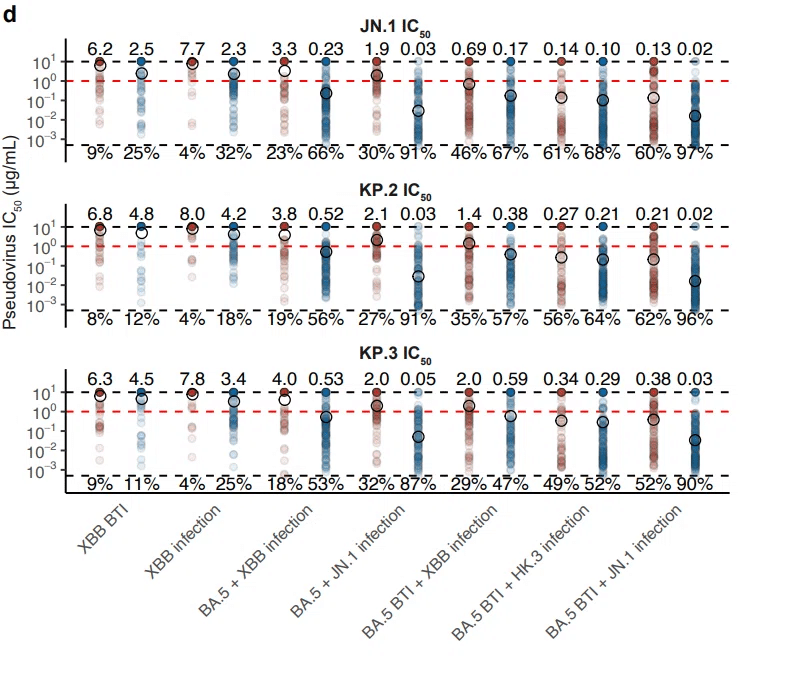
JN.1 系統の体液性免疫回避能力と免疫原性を分析するために、SARS-CoV-2 への曝露歴のない XBB* (n=11) または JN.1 (n=4) に感染した人、不活化ワクチンを 3 回接種した後に XBB 感染を経験した人、BA.5/BF.7 と XBB* (n=14)、または BA.5/BF.7 と JN.1 (n=29) の連続感染を経験した人、および 3 回不活化ワクチン接種後に BA.5/BF.7 ブレイクスルー感染 (BTI) を発症し、その後 XBB (主に XBB + S486P)、HK.3、または JN.1 に再感染した人 (それぞれ n=54、18、29) を含む 8 つのコホートから血液サンプルを採取しました (図 2a および拡張データ図 3)。

感染株は、サンプル採取領域で検出された配列の大部分が対応する株であったときのサンプリング時間に基づいて推定されました(補足表1)。
SARS-CoV-2感染は、抗原検査またはPCR検査のいずれかによって確認されました。
血漿サンプルを分離し、SARS-CoV-2変異スパイク擬似型水疱性口内炎ウイルス(VSV)に対する中和力価を検査します。
ナイーブなヒトにおける XBB および JN.1 によるプライミングでは、観察可能な交差系統反応性のない個別の NAbs が誘導されました。これは、XBB と JN.1 がヒトとマウスの両方で抗原的に異なることを確認し、XBB 系統から JN.1 系統への抗原シフトが異なる血清型をもたらすことを示しています (図 2b)。

対照的に、BA.5(またはBF.7、以下省略)の事前感染は、XBBまたはJN.1の再感染によって誘導された抗体の交差系統反応性を改善しました。
これは、BA.5/BF.7プライミングが、XBBおよびJN.1系統の両方に有効なOmicron交差反応性NAbsを誘導できることを示唆しています(図2c)。

注目すべきことに、再感染を伴う 3 つの BTI コホートでは、「BA.5 BTI + XBB 感染」が JN.1 系統変異体に対する NT50 を最も低くしました (図 2d)。

平均すると、JN.1 の再感染は、XBB の再感染と比較して、JN.1 に対する NT50 が 5.9 倍、KP.2 に対する NT50 が 4.9 倍、KP.3 に対する NT50 が 4.8 倍高くなりました (図 2e)。

JN.1 BTI の HK.3 BTI に対する改善はそれほど顕著ではありませんでしたが、これはおそらく、XBB 再感染コホートでの 2 回の感染間隔が短いことと、HK.3 の「FLip」変異 (L455F + F456L) に起因する免疫原性の変動が原因です。
再感染コホート 5 つすべてにおいて、JN.1 + R346T、JN.1 + F456L、KP.2、KP.3 など、RBD 変異を持つ 4 つの JN.1 亜種すべてが顕著な免疫回避を示しました。
KP.3 は一貫して最も強力な回避者として機能し、JN.1 と比較して NT50 が 1.9 ~ 2.4 倍減少しました。
最近出現した NTD S31 の欠失は、KP.2.3、LB.1、KP.3.1.1、LF.2 を含む複数の独立した JN.1 サブ系統で収束的に検出され、わずかではあるが有意な回避をもたらし、これは、SARS-CoV-2 に繰り返し曝露した 6 つのコホートすべてにおいて NTD を標的とする NAbs の寄与を示しています (図 2c-d および拡張データ図 3)。
血漿中和データの抗原地図作成により、SARS-CoV-2 変異体の抗原の違いが視覚化されました。
血漿中和データの抗原地図作成により、SARS-CoV-2 変異体の抗原の違いが視覚化されました。
再感染コホートを含む BTI のサンプルは、D614G 株付近の点の集合によって示されるように、強い祖先株の刷り込みを示しました (図 2g)。
それにもかかわらず、JN.1 BTI コホートは現在循環している変異体との距離が近いことが示されており、ワクチンブースターを JN.1 系統に切り替えるという考えを裏付けています。

まとめると、これらの観察結果は、SARS-CoV-2 XBB系統とJN.1系統間の重要な抗原性の違いを強調し、特にKP.3とKP.3 + S31del(KP.3.1.1)などの新興JN.1亜変異体の顕著なACE2親和性とNAb回避能力を浮き彫りにしています。
結果は、ワクチンブースター戦略の焦点を XBB から JN.1 ファミリーに移すための現象学的でありながら説得力のある証拠を提供します。
JN.1-induced memory B cell repertoire
次に、JN.1 系統の感染によって誘発される血漿ポリクローナル抗体 (pAbs) で観察される広範囲の中和の原因となる特定の分子成分を分析することを目指します。これにより、BA.5 による事前のワクチン接種または感染が、XBB/JN.1 感染後の系統間 NAbs の発生をどのように促進するかを理解できるようになります。
MBC レパートリーを分析することで、将来の変異体への曝露に対する反応を予測することもできます。
したがって、多様な交差反応性を示し、特に NAbs が標的とする最も免疫原性の高いドメインであるウイルス RBD 上の複数のエピトープを標的とする抗体の役割を解明することは、必須かつ説得力のあることです。
そのため、我々は蛍光活性化細胞選別(FACS)を用いて、前述のヒトドナーの末梢血単核細胞(PBMC)からRBD特異的CD20+ CD27+ IgM− IgD− B細胞を分離しました。
これらの個人は、XBB感染、XBB BTI、BA.5 + XBB感染、BA.5 + JN.1感染、BA.5 BTI + XBB感染、BA.5 BTI + HK.3感染、およびBA.5 BTI + JN.1感染という7つの異なるSARS-CoV-2関連免疫履歴を有していました。
選別では、各コホートについて、最終曝露SARS-CoV-2株に対応する変異RBD(XBB.1.5、HK.3、またはJN.1)を使用しました(補足データ図1)。
以前に確立した方法論に従って、単一細胞 V(D)J シーケンシング (scVDJ-seq) を使用して mAb 重鎖および軽鎖可変ドメインの配列を決定し、それらをヒト IgG1 Fc バックボーンで発現させました。
得られた mAb は、酵素結合免疫吸着法 (ELISA) を使用して特性評価され、WT および対応する Omicron RBD に対する結合特異性が評価されました。
血漿分析の結果、BA.5 BTI + 再感染は、D614G に対するものよりも BA.5 に対して一貫して高い中和力価を示し、WT と交差反応しない Omicron 特異的 NAbs の大きな寄与を示しました (図 2d)。

これは mAb 分析によって検証されており、オミクロンの繰り返し感染により、祖先株に基づく不活化ワクチンの刷り込みが緩和される可能性があるという以前の発見と一致しています。
しかしながら、祖先株に基づく mRNA ワクチンを接種した後にオミクロン再感染した個人を対象とした最近の研究では、顕著な免疫刷り込みが明らかになりました。その結果、オミクロンに 2 回曝露した後でも、オミクロン特異的 MBC はほとんど検出されませんでした。
興味深いことに、XBB感染、BA.5 + XBB感染、BA.5 + JN.1感染などのワクチン未接種コホートでも、40~50%のWT反応性抗体が生成されます。
BA.5 + JN.1 感染コホートは、BA.5 BTI + JN.1 感染と比較して、WT 反応性 mAbs の割合が高くなっています (図 3a)。
ただし、対応する血漿サンプルでは、D614G 擬似ウイルスに対する中和力価は上昇しておらず、非中和エピトープを標的とする交差反応性 mAbs が濃縮されていることを示しています (図 2c)。
注目すべきことに、BA.5 BTI + HK.3 コホートでは、研究対象グループの中で最も高い 74% の Omicron 特異的 mAbs が誘発されています。

WT に対する反応性が異なり、免疫歴の違いによって誘発される mAbs 間では、VDJ 遺伝子の使用にかなりのばらつきが見られます。
BA.5 BTI + 再感染コホートでは、WT 反応性 mAbs で IGHV3-53/3-66 が顕著に使用されています。これは、一般免疫応答の一部であり、主に RBM を標的とするクラス 1 NAbs として認識されています。
しかし、このタイプの mAbs はワクチン接種を受けていないコホートではほとんど見られず、IGHV5-51 と IGHV4-39 の利用率が高くなっています (拡張データ図 4a)。

オミクロン特異的 mAbs に関しては、IGHV2-5 はすべてのコホートで普及していますが、興味深いことに、JN.1 感染回復期患者では優勢ではなく、IGHV5-51 由来の mAbs の割合が高くなっています (拡張データ図 4b)。
注目すべきことに、IGHV5-51 は WT 反応性抗体でも広く使用されており、特に JN.1 感染の文脈でその重要性を強調しています。

予想通り、mAb の重鎖と軽鎖の両方における体細胞超変異 (SHM) の率は、抗原曝露回数と密接に関連しています。
具体的には、ワクチン接種を受けた個人では WT 反応性 mAb の方がオミクロン特異的 mAb よりも SHM が多く見られますが、ワクチン接種を受けていない個人ではそうではありません。
BA.5 BTI + HK.3/JN.1 コホートは、BA.5 BTI + XBB 感染と比較して SHM 率の高いオミクロン特異的 mAb を生成しますが、これは前者のグループでは 2 回のオミクロン曝露の間隔が長く、BA.5 感染によって開始されたオミクロン特異的 B 細胞のさらなる成熟が可能になるためと考えられます (図 3b および拡張データ図 4c)。

さらに、派生した mAbs の変異体擬似ウイルスに対する中和能力を評価しました。
一般的に、Omicron 特異的 mAbs は、変異体 JN.1、KP.2、および KP.3 に対して、WT 反応性 mAbs と比較して優れた中和活性を示しました。
XBB 感染および XBB BTI によって誘導された mAbs は、血漿中和力価が低いことと一致して、強力な NAbs の割合が非常に低いことが示されました (図 2a および拡張データ図 3a)。
特に、BA.5 + JN.1 および BA.5 BTI + JN.1 感染では、それぞれ 30% および 60% の JN.1 有効 WT 反応性 NAbs が誘発されましたが、有効な Omicron 特異的 mAbs の割合は両方のコホートで 90% を超え、XBB/HK.3 再感染で観察された割合を上回りました (拡張データ図 4d)。
これらの結果は、JN.1 系統に基づくワクチンブースターの開発の潜在的な利点をさらに実証しています。
Epitope mapping of JN.1-induced mAbs
JN.1 誘導 mAbs の中和活性は期待できるものの、さまざまなエピトープを標的とする抗体は多様な RBD 変異によって回避される可能性があり、将来のウイルス抗原ドリフトに対して潜在的に脆弱であることが示唆されています。
XBB/JN.1 感染によって誘導される広域中和抗体 (bnAbs) の基礎となる分子成分とメカニズムを単一アミノ酸エピトープの解像度でさらに解明するために、高スループット酵母ディスプレイベースの DMS アッセイを実施し、単離された mAbs の回避変異プロファイルを分析しました。
具体的には、XBB.1.5 および JN.1 RBD に基づいて変異体ライブラリを構築しました。
最初に、FACS を使用して酵母表面でのこれらの変異体の発現レベルを評価し、その後シーケンシング (Sort-seq) を行いました (拡張データ図 5a-d)。
興味深いことに、JN.1 RBD の発現は BA.2 RBD と比較して変異に対してより耐性があるように見えましたが、XBB.1.5 RBD よりは耐性が低いようでした (拡張データ図 5e)。
確立したプロトコルに従い、磁気ビーズベースのソーティングを使用して mAb 結合能力の DMS をハイスループット方式で実施し、各 mAb のエスケープ変異を特定して、それらの標的エピトープをマッピングしました。
我々は、少なくとも 1 つの RBD 変異体に基づいて、合計 2,688 個の mAb のエスケープ変異プロファイルを分析することに成功しました。これには、本研究で使用した XBB/JN.1 感染コホートから分離された 1,874 個と、比較のために他のグループまたは我々が以前に特定した 814 個の mAb が含まれます (拡張データ図 6a)。
グラフベースの教師なしクラスタリングアルゴリズムを使用して 22 個の mAb クラスターを特定し、各クラスターに対応するエピトープグループを以前の定義に基づいて注釈付けしました (図 3c および拡張データ図 6b)。

簡単に言うと、エピトープグループ A1/A2 (クラス 132,33)、B (クラス 1/2、COV2-219634 および REGN1093335 に類似)、D2/D3/D4 (REGN1098735 および LY-CoV140436 に類似)、および F3 (クラス 1/4、SA5537 および ADG-2/VYD22238 に類似) は、一般に受容体 ACE2 と競合し、ウイルスを効果的に中和する可能性が高くなります。
簡単に言うと、エピトープグループ A1/A2 (クラス 132,33)、B (クラス 1/2、COV2-219634 および REGN1093335 に類似)、D2/D3/D4 (REGN1098735 および LY-CoV140436 に類似)、および F3 (クラス 1/4、SA5537 および ADG-2/VYD22238 に類似) は、一般に受容体 ACE2 と競合し、ウイルスを効果的に中和する可能性が高くなります。
逆に、E1/E2 グループ (クラス 3、S309 で例示)、E3 (「クラス 5」とも呼ばれ、S2H9739 で例示)、および F1 (クラス 4、S304 で例示) は、ACE2 と競合する可能性が低く、強力な中和作用を示します (図 3d および拡張データ図 6c-d)。

特に、従来の F1.1 に隣接しているが RBM にわずかに近いエピトープを標的とする、F1 の新しいサブグループ (F1.2 と指定) を発見しました (拡張データ図 6e)。
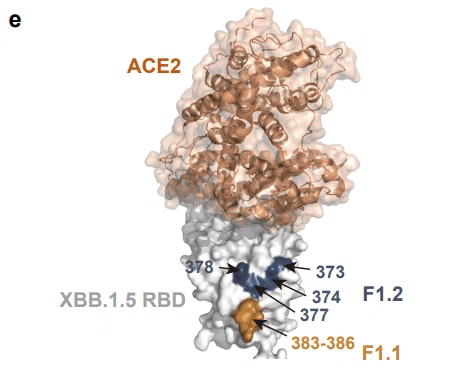
この包括的なエピトープマッピングにより、さまざまな免疫履歴を持つヒトドナーから分離された mAbs のエピトープ分布を調べることができます (図 3e)。

A1 mAbs の割合は SARS-CoV-2 への曝露回数と相関しており、BTI を経験した後に再感染したコホートで最も高いレベルに達していることが観察されました。
ただし、これらの抗体は XBB 感染のみの場合に顕著に見られず、このような mAbs の開発には以前の変異体への最初の曝露が重要であることを強調しています。
F1.2 と F1.1 を区別することで、WT ベースのワクチン接種が従来の F1.1 非中和抗体の誘発に不可欠であると推測できます。
対照的に、Omicron のみで免疫すると F1.2 mAbs のみが誘発されます。これは、RBD 位置 371-376 での Omicron 変異によって引き起こされる免疫原性シフトが原因で、F1.2 が免疫優位になり、F1.1 エピトープがマスクされるためと考えられます。
また、JN.1 感染では E1/E2 mAbs が誘発されないことも注目に値します。これは、BA.2.86 系統の K356T 変異に起因する N354 グリコシル化に起因する可能性があります。
特に、HK.3 の再感染では、かなりの割合で F3 mAbs が誘発されます (図 3e)。
エピトープグループのうち、A1、D2、E1/E2/E3、F1.1 は主に WT に対して交差反応性を示しますが、A2、B、D3/D4、F1.2、F3 は主にオミクロン特異的 mAbs で構成されています (図 3f)。

グループ F3、A1、B、D3 には JN.1 サブバリアントに対する潜在的な bnAbs が含まれますが、A2、D2、D4、E1/E2.1 は大部分が回避されます (図 3g)。
しかし、BA.2.86 以前の SARS-CoV-2 変異体に対して弱い中和効果を示した新しい F1.2 mAbs は、JN.1 系統に対しては前例のないほど強力な効力を発揮します (図 3h)。

さらに、E1/E2.1、E2.2、F1.1、および F1.2 グループは、それぞれ IGLV1-40、IGLV3-21、IGKV1-39、および IGLV6-57 に富み、軽鎖 V 遺伝子に対する顕著な優先性を示しています。
さらに、E1/E2.1 および F1.1 は、それぞれ IGHV1-69 および IGHV3-13/3-30 重鎖を利用して、対応する軽鎖と対になる傾向があります (拡張データ図 6f)。
Class 1 mAbs dominate WT-reactive bnAbs
mRNA ワクチン接種を受けた集団内ではオミクロン特異的 NAbs が不足している可能性があることを考慮して、現実世界の JN.1 系統の進化と集団レベルの体液性免疫との相互作用を調査し、JN.1 感染が JN.1 サブバリアントを中和する WT 反応性 NAbs を効率的に誘導できるかどうかを判断するために、3 つの BA.5 BTI + 再感染コホートによって誘発された WT 反応性 mAbs の特性に焦点を当てます。
上記の血漿中和および全体的な mAb 中和分析と一致して、HK.3 および JN.1 感染からの WT 反応性 mAbs は、JN.1、KP.2、および KP.3 に対して XBB 感染からの WT 反応性 mAbs よりも大幅に効果的でした (図 4a)。

次に、各ソースコホートから各エピトープグループの「有効性スコア」を計算しました。これは、特定の変異に対する IC50 値で重み付けされた各エピトープグループの mAbs の数として定義されます。
この指標により、各エピトープグループの中和への貢献を判別できました (図 4b)。
注目すべきことに、エピトープグループ A1 は、JN.1 だけでなく、L455S、F456L、Q493E など A1 エピトープまたはそのエスケープ ホットスポットに複数の変異を蓄積する KP.2 および KP.3 に対する有効性にも一貫して大きく貢献しました (図 4b-c および拡張データ図 6d)。

エピトープグループ B および D3 からの WT 反応性 mAbs も、HK.3 および JN.1 再感染コホートにおける JN.1 系統に対する広範な中和に部分的に寄与しています。 これらのコホートでは、それぞれのエピトープの T478K および Q498R/N440K 変異がすべての Omicron 系統で収束的に発見されているため、Omicron 特異的 mAbs の割合が高いにもかかわらずです (図 3f および 4b-c)。
これまでの研究結果と一致して、グループ A1 またはクラス 1 mAbs は主に IGHV3-53 または IGHV3-66 生殖細胞系列に由来しており、これは SARS-CoV-2 に対する一般的なまたは収束的な体液性免疫応答としてよく知られています。
これらの mAbs は IGKV1-33 軽鎖と対になる傾向がありますが、BA.5 BTI + XBB 再感染コホートからの A1 mAbs の特別なサブセットは、IGHV3-7 を IGKV1-NL1 とともに利用します。
3 つの BTI + 再感染コホートからの WT 反応性 A1 mAbs は、XBB.1.5 および HK.3.1 に対して同様の重鎖 SHM 率および同様の中和活性を示します (図 4e-f)。

それにもかかわらず、HK.3 および JN.1 によって誘発されるものは、JN.1 サブバリアントに対する中和効果が著しく向上しています。
特に、KP.2 および KP.3 は、XBB 再感染によって誘発される mAbs のそれぞれ 31% および 52% を回避 (IC50 > 1 μg/mL) しますが、JN.1 再感染によって誘発される mAbs の回避率は 2% および 20% に過ぎません。
XBB によって誘発されたものと比較して、JN.1 誘発 A1 mAbs は、JN.1、KP.2、および KP.3 に対して平均 7 ~ 10 倍高い中和活性を示し、血漿中和力価で観察されたものよりもさらに大きな差があります (図 4f および拡張データ図 7a)。
したがって、WT 交差反応性抗体のコンテキストでは、JN.1 感染は、現在の JN.1 由来株に対する中和活性を高めるだけでなく、有効なクラス 1 またはエピトープ グループ A1 受容体模倣抗体をコードする MBC をより多く濃縮します。
しかし、JN.1 誘発 WT 反応性 A1 NAbs は、KP.2 および KP.3 に対する反応性がそれぞれ 3.2 倍および 10 倍減少しています。
最も顕著なのは、KP.3 + A475V に対する中和活性を維持しているのはわずか 24% であることです (図 4f)。
この感受性は、進行中のウイルス進化に対抗する JN.1 ブースターの有効性に関する懸念を引き起こし、現在の変異体と将来の抗原ドリフトの両方に対する強力な防御のために KP.3 系統由来のワクチンが必要であることを示しています。
試験した 6 種類の株に対する A1 NAbs は、少なくとも 1 つの変異体によって回避された A1 NAbs と比較して、SHM 率が著しく高くなく、重鎖および軽鎖生殖細胞系列の使用において有意な優先性も示さないことが観察されました (拡張データ図 7b-c)。
回避された A1 mAbs は、対象変異に対して、広く中和する A1 mAbs よりも高い DMS 回避スコアを示します。たとえば、456L と 475V は両抗原ベースで、455S と 493E は XBB.1.5 ベースでのみ中和します。
JN.1 結合は、455S によって回避される A1 mAbs をフィルタリングし、Q493E は、上記の ACE2 結合特性で述べたように、F456L とのエピスタシスによって大きく影響を受ける可能性があります (拡張データ図 7d-e)。
以前の構造解析では、IGHV3-53/3-66 mAbs は主に CDR-H1 と CDR-H3 の一部を使用して RBD 残基 A475 と相互作用することが示されましたが、CDR-H1 パターンに顕著な違いは見られませんでした (拡張データ図 7f)。
したがって、IGHD 遺伝子の使用傾向から示唆されるように、これらの A1 bnAbs は、広範囲の中和のために、特徴的なコア CDR-H3 と高度に成熟した軽鎖に依存しているという仮説を立てています (拡張データ図 7g-h)。
ただし、mAbs の数が限られているため、広範囲の中和の原因となる詳細なモチーフを具体的に特定することはできません。
A1 エピトープに変異を持つ JN.1 亜変異体の最近の成長の利点は、世界中の集団内にそのような NAbs が驚くほど豊富であることを示しています。
これは、中和重み付け、コドン認識方式で mAb DMS プロファイルを集約して平均免疫圧力を評価することによっても明らかになりました。
我々は、BTI + 再感染によって誘発された WT 反応性 NAbs を採用しており、これは現実世界のコンセンサス シナリオを反映するはずです。
A1 エピトープでのエスケープ変異の蓄積と検証された有意な回避にもかかわらず、保持された A1 bnAbs は、403・420・455・475・493 などのエピトープ ホットスポット内の残基に依然として圧力をかけています (図 4g-i)。

当然のことながら、KP.2 および KP.3 の F456L 変異により、JN.1 重み付けで観察された L456 ホットスポットが排除されます;ただし、残基 E493 のスコアは、KP.3 重み付けでさらに顕著になります。これは、この変異により、この部位で Ala、Asp、Gly、および Val を含む 4 つの新しい 1 ヌクレオチド アクセス可能なアミノ酸変異が可能になるためです。
JN.1 ベースでは ACE2 結合 DMS データがないため、XBB.1.5 ベースの結果を使用して、強力なエピスタシスが存在する場合にアーティファクトを導入する可能性のある ACE2 減衰変異を計算から除外しました。
要約すると、WT 反応性 NAbs の中で、エピトープ グループ A1 は、最近のウイルス進化中にそのエピトープに複数の回避変異が発生したにもかかわらず、JN.1 サブバリアントに対して最も顕著なままです。
したがって、bnAbs をより効果的に誘発し、特に免疫応答が主に WT 反応性抗体を誘発する mRNA ワクチンを接種した個人において、将来の潜在的な免疫回避変異に抵抗できる効果的な MBC を濃縮するために、JN.1または JN.1 + F456L・KP.2・KP.3 に基づくブースターの開発を検討する必要があります。
Potential of Omicron-specific NAbs
mRNAワクチン接種とは異なり、不活化ワクチンによって引き起こされる免疫刷り込みは、相当量のオミクロン特異的抗体を誘発するオミクロン再感染によって緩和されるようです。
世界的なワクチン接種戦略がWT成分から最新の変異体にシフトするにつれて、このようなmAbsが将来的に免疫圧力の主な要因になる可能性があります。
注目すべきことに、JN.1 感染は、XBB または HK.3 感染と比較して、JN.1 系統に対する中和幅が大幅に拡大したオミクロン特異的 NAbs も誘導します (図 5a)。

エピトープ グループ F3 は、広範な中和で最も顕著ですが、A2、B、D3、および F1.2 もわずかに寄与しています (図 5b)。

A2 NAbs は、グループ A1 とエピトープの重複度が高いため、回避される可能性が高い。
興味深いことに、グループ B と D3 には、WT 反応性および非反応性の bnAbs の両方が含まれている (図 4b および 5b)。
当然のことながら、BTI コホートはワクチン未接種コホートよりも WT 反応性 B/D3 mAbs を多く誘発し、これらの交差反応性 B/D3 mAbs はオミクロン特異的抗体よりも高い SHM 率を示します (拡張データ図 8a-b)。
これらの知見は、これらの交差 B/D3 mAbs の少なくとも一部がプレオミクロン記憶の想起に由来する可能性があることを示唆しています;ただし、高い SHM 率は、オミクロン特異的抗体におけるランダム交差反応性の選択の結果にすぎない可能性もあります。
これらの抗体は WT との交差反応性があるにもかかわらず、D614G と比較して BA.5 に対する中和活性がはるかに高く、Omicron に適応した成熟の可能性を示しています (拡張データ図 8c)。
WT 反応性および Omicron 特異的 B mAbs は、大きく異なる重鎖および軽鎖遺伝子に由来していますが、D3 mAbs は交差反応性にかかわらず主に IGHV5-51 を利用します (拡張データ図 8d-e)。
特定のグループ B mAbs は残基 478 と 486 で DMS エスケープ スコアが高く、D3 は残基 440 でスコアが高く、これらはオミクロン系統の変異部位です (拡張データ図 8f-g)。
多くのオミクロン特異的 B NAbs (D3 は除く) は、486 変異に対する脆弱性のため、ポスト BA.5 バリアントで見つかった F486V/S/P 変異を持たない BA.1 と BA.2 を中和しません (拡張データ図 8h)。
以前の不活化ワクチン接種後に再感染を経験した個人には強力なオミクロン特異的 NAbs が豊富に存在するにもかかわらず、これらの NAbs からの逃避を可能にする変異の証拠はほとんど観察されていません。
このような NAbs に対する逃避変異の欠如は、人口の大多数が BA.5/BF.7 BTI と組み合わせた不活化ワクチンを接種しているか、またはさらに多くの再感染を経験している中国で特に顕著であり、これは、逃避変異の出現を制限する弱い選択圧または固有の進化的制約を示唆しています。
オミクロン特異的 NAbs の DMS プロファイルを集約した結果、G504 を除くすべてのエスケープ ホットスポットが、オミクロン変異体で変異した RBD の残基に位置していることがわかりました (図 5c)。
以前にエスケープした NAbs の中和回復の可能性を考慮すると、これらの変異部位がさらに変異する可能性は低いと考えられます。

特に、G504 の変異は、血清中和を高めることが最近報告されていますが、これはおそらく、スパイク糖タンパク質のアップダウンダイナミクスに対する調節的影響によるものと思われます。
予想通り、残基 403、405、504、505 を含む 4 つの最も顕著なホットスポットはすべて、エピトープ F3 によって標的化されます (図 5d)。

また、JN.1 によって誘導された NAbs は、テストされたすべての JN.1 サブバリアントに対して顕著な中和幅を示し、XBB および HK.3 によって誘導されたものよりも優れています (図 5e)。

この優位性は驚くべきことではありません。なぜなら、BA.2.86 の R403K 変異に続いて、それらのエスケープ ホットスポットで追加の変異が発生していないからです。
HK.3 および JN.1 誘導 F3 mAbs で観察された SHM 率は、XBB 誘導率よりも高く、XBB と HK.3 が同様の中和能力を示すことを示す中和結果とは矛盾しています。
この矛盾は、成熟が F3 の広範な中和効果を決定する主な要因ではないことを示唆しています (図 5f)。

その代わりに、F3 mAbs は重鎖および軽鎖 V 遺伝子の利用において興味深いパターンを示します。
XBB 感染や XBB BTI コホートなどの単一の Omicron 曝露によって誘発される F3 抗体は、ほぼ独占的に IGHV2-5 と IGKV3-15 のペアリングから生じます (拡張データ図 9a)。
しかし、これらの NAbs は JN.1 系統に対して弱い中和効果を示します (拡張データ図 9b)。
対照的に、オミクロン感染の繰り返しは F3 mAbs の生殖細胞系利用を多様化し、ワクチン接種の有無にかかわらず同等の幅の F3 mAbs を生成します (図 5g および拡張データ図 9c-d)。

特に、JN.1 感染では、IGHV5-51 の使用が強調され、特に IGKV1-39 と組み合わせると顕著になります。
ソース コホートに関係なく、IGHV5-51 F3 抗体は、IGHV2-5 由来の抗体よりも JN.1 系統に対して大幅に効果的であることを示しています (図 5h)。
しかし、残基 403 の DMS スコアが低いことは観察されませんでした。これは、すべての BA.2.86 サブバリアントに存在することを考えると、直感的にわかります。

逆に、これらの IGHV5-51 F3 ブロード bnAbs は、残基 405 と 504 でより高いエスケープ スコアを示します (図 5i)。

IGHV5-51 は、JN.1 系統の抗原性と免疫原性の観点から、注目すべき生殖系列重鎖 V 遺伝子であると思われます。
具体的には、IGHV5-51 には、軽鎖の使用パターンが異なる 3 つの主要なエピトープ グループ (E3、D3、F3) が含まれます。
E3 と F3 はそれぞれ IGLV1-44 と IGKV1-39 を優先しますが、IGHV5-51 D3 mAbs は、幅広い軽鎖 V 遺伝子を利用します (拡張データ図 9e)。
これらのグループの SHM 率には大きな違いはなく、中和能力はそれぞれのエピトープ グループの特性と密接に一致しています (拡張データ図 9f-g)。

SARS 回復者から分離されたよく知られた mAb CR3022 と、最近報告された祖先株回復者から分離された 2 つの bnAbs も IGHV5-51 生殖細胞系列によってコード化されていますが、ここでは強調されていない軽鎖生殖細胞系列と対になっています。
これらの知見は、JN.1 誘発性 Omicron 特異的 NAbs の優れた有効性を強調し、これらの NAbs、特に IGHV5-51 をコードする F3 NAbs がすべての Omicron 変異体に対して強力であることを強調しており、ワクチン開発の潜在的なターゲットとして検討されるべきです。
Clash of Class 1 and Omi-specific NAbs
最近の研究では、mRNAワクチンを接種した個体では、オミクロンに複数回曝露した後でもオミクロン特異的抗体反応を起こさないことから、非常に強い免疫刷り込みが明らかになりました。
しかし、この現象は不活化ワクチンを接種した個体やmRNAワクチンを接種したマウスでは観察できません。
オミクロン特異的抗体の包括的な特性評価の結果、RBD 上のすべてのオミクロン特異的中和エピトープが、IGHV3-53/3-66 生殖系列の収束的使用でよく知られている A1 mAbs と競合することが驚くべきことに判明しました (図 6a-b)。

この競合は、SPR ベースの競合アッセイによって確認されました (図 6c)。

これらの結果から、IGHV3-53/3-66 収束応答の存在がこの強力な刷り込みにとって極めて重要であると仮定します。
本質的に、不活化ワクチンは、mRNAワクチンに比べて収束反応が弱い。
私たちの研究で研究された個人は、2021年から2022年にかけて中国で「ゼロCOVID」期間を経験し、抗体が大幅に減少しました。
その結果、オミクロンに有効な IGHV3-53/3-66 NAbs と対応する MBC の濃度は、オミクロンへの最初の曝露時に抗原を効果的にマスクするには不十分だった可能性があります。
このシナリオでは、オミクロンに固有のナイーブ B 細胞が活性化され、成熟が促進されます。
これらの活性化 B 細胞は、その後のオミクロンへの曝露によって呼び戻され、広範なオミクロン特異的 MBC および抗体の生成につながる可能性があります。
対照的に、mRNA ワクチン接種を受けた個体の強力な収束反応は、最初のオミクロンとの遭遇中にすべてのオミクロン特異的エピトープを効率的に隠す可能性があります。
有効な IGHV3-53/3-66 パブリック抗体をコードする MBC は、オミクロンに曝露されるたびに繰り返し活性化され、顕著な免疫インプリンティングを示します。
重要なのは、これらの抗体の ACE2 模倣能力も非常に重要であり、ウイルスの進化を制限し、これらの mAbs が完全に回避されないようにします。
IGHV3-53/3-66 生殖細胞系列を欠くマウスに関しては、mRNA ワクチンを投与しても、大量の ACE2 模倣 NAbs で収束反応を生成することはできません。
これらの分析は予備的で直感的なものであり、さらに厳密な実験検証が必要であることに留意することが重要です (拡張データ図 10)。

Discussion
本研究では、SARS-CoV-2 XBB および JN.1 系統の抗原性と免疫原性を血漿から mAb 分解まで体系的に比較しました。
本研究では、SARS-CoV-2 XBB および JN.1 系統の抗原性と免疫原性を血漿から mAb 分解まで体系的に比較しました。
ACE2 結合および回避に関する同様のエピスタシスは、XBB の「FLip」変異体および他の以前の変異体でも報告されています。
JN.1 サブバリアントの進化は進行中で、特に A1 エピトープに変異を持つサブバリアントは、受容体結合能力に影響を及ぼし、KP.3 で見られるようなエピスタシス効果を引き起こす可能性が高く、注意深い監視が必要です。
同時研究でも報告されているクラス 1 またはエピトープ A1 WT 反応性 NAbs の重要性を強調します。
さらに、オミクロン再感染コホートによって誘発された F3 オミクロン特異的 NAbs が、JN.1 系統に対する広範な中和を達成する可能性を強調します。
特に、JN.1 感染は、XBB と比較して、より効果的な NAbs だけでなく、両方のエピトープ グループで MBC も誘発します。
これらの結果は、ブースターとしての XBB によって引き起こされる重大な系統間反応性にもかかわらず、JN.1 由来のブースターは、既存の JN.1 サブバリアントと新たに出現する JN.1 サブバリアントの両方に対して優れた保護を提供できる可能性があることを裏付けています。
将来の抗原ドリフト(KP.3 + A475Vなど)に対する効果的なbnAbsの生成を強化するには、ACE2に対する親和性の向上と免疫回避能力により近い将来に主流になると予想されるKP.3系統に基づく将来のワクチンブースターの開発を検討することをお勧めします。
mRNAワクチンを接種した人の場合、これらのブースターによるエピトープグループA1のWT交差反応性bnAbsの誘導は、現在のSARS-CoV-2変異体と新たに出現するSARS-CoV-2変異体の両方に対する広範囲の保護を達成するために特に重要です。
さらに、重度の免疫刷り込みのメカニズムに関する私たちの仮説が検証されれば、A1 mAbsからの大幅な回避を示す変異体の使用により、免疫刷り込みの影響を軽減し、オミクロン特異的NAbsを効果的に誘発できる可能性があります。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
