RBD455-456上の XBB系統の収束進化は抗体回避とACE2結合を相乗的に強化(2023年8月)
Convergent evolution of SARS-CoV-2 XBB lineages on receptor-binding domain 455-456 synergistically enhances antibody evasion and ACE2 binding
受容体結合ドメイン455-456上のSARS-CoV-2 XBB系統の収束進化は抗体回避とACE2結合を相乗的に強化する

Summary
重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV-2) XBB 系統は世界中で優勢になり、進化し続けています。
受容体結合ドメイン (RBD) L455F および F456L 上での XBB 系統の収束進化が観察され、EG.5、FL.1.5.1、XBB.1.5.70、HK.3 などの変異体が生じてます。
今回我々は、中和抗体(NAb)回避がF456Lの収束進化を促進する一方で、F456Lによって引き起こされるエピスタティックシフトがその後のACE2結合強化とさらなる免疫回避を通じてL455Fの収束を可能にすることを示します。
L455F および F456L はクラス 1 NAb を回避し、XBB 突破感染 (BTI) および再感染回復期血漿の中和効果を低下させます。
重要なことに、L455F の単一置換は受容体の結合を大幅に弱めます; ただし、L455F と F456L の組み合わせは隣接残基の反転を形成し、NAbs 耐性と ACE2 結合親和性の強化につながります。
構造解析によって明らかになったように、受容体結合モードの乱れにより、例外的な ACE2 結合と NAb 回避が引き起こされます。
私たちの結果は、エピスタシスによってもたらされる進化の柔軟性を過小評価することはできず、SARS-CoV-2 RBD の進化の可能性が依然として高いことを示しています。
Introduction
重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV-2) は世界中で継続的に流行し、進化しています。
2022 年後半以降、XBB* 変異体、特にウイルス スパイク糖タンパク質 (S) の受容体結合ドメイン (RBD) 上の残基 486 (486P) にプロリンを持つ XBB.1.5 およびその他の XBB 誘導体が優勢になり始めました。 これは、体液性免疫を回避する非常に強力な能力を維持しながら、ヒトACE2への結合が強化されたことを実証しました。
これらの免疫回避系統は、R403K、V445S、L455F、F456L、K478R などのさらに多くの S 変異を継続的に蓄積し続けています。 それは抗原性のさらなる変化につながり、ワクチン接種と感染の繰り返しによって誘発される中和抗体から逃れる可能性があります。
F456L に代表されるいくつかの免疫回避変異は、最近、EG.5、XBB.1.5.10、FE.1、FD.1.1 などの複数の独立した XBB 派生株にも集中的に出現しました。 これは、集団免疫による強い選択圧力を示しています (図 1A)。
2023 年 10 月までに、新たにアップロードされた SARS-CoV-2 配列の 70% 以上に F456L 変異が含まれるようになります。
さらに、F456L と L455F の両方を含む複数の独立した XBB 系統がさまざまな国で急速に成長しています。 ブラジル、米国、カナダの XBB.1.5.70/GK.*、中国の HK.3 (EG.5.1.1.3) などです (図 1B-C)。


しかし、L455F 突然変異はあるが F456L は持たない系統は、成長上の利点を示しませんでした。
興味深いことに、L455 と F456 は、SARS-CoV-2 RBD の受容体結合モチーフ (RBM) 上の 2 つの隣接する残基です。 この変異体は、L455-F456 から F455-L456 への 2 つの残基の単なる「反転」であり、「FLip」変異体としても知られています (図 1B)。
これら 2 つの部位は、パブリック IGHV3-53/3-66 クラス 1 NAb の標的となる重要なエピトープ上にも位置しています。
これらの部位の変異は、ワクチン接種を受けた人や回復期の人に豊富に存在するこのタイプの NAb を回避する可能性があり、防御効率の大幅な低下につながります。
特にXBBの画期的な感染症から回復した最近の回復者に対する、免疫回避と感染効率への影響を調査することが重要です。そして、XBB* + F456L 系統に基づく L455F 変異の予期せぬ利点を可能にするこのような相乗効果の根底にあるメカニズムを調査し、このような系統の並外れた成長上の利点を説明することが重要になります。
L455F and F456L evade convalescent plasma from XBB BTIs and reinfections
L455F および F456L は、XBB BTI および再感染による回復期血漿を回避
L455F、F456L、およびそれらの組み合わせがワクチン接種と感染によって誘発される中和抗体に対する耐性の強化につながるかどうかを調べるために、異なるSARS-CoV-2予防接種歴を持つ3つのコホートから血漿サンプルを収集しました。
3つのコホートの参加者全員は、感染が判明する前にCoronaVacまたはBBIBP/WIBP/CCIBP-CorV(それぞれSinovacとSinopharmが開発したSARS-CoV-2祖先株に基づく不活化ワクチン)の3回投与を受けていました。
最初のコホートには、BA.5 または BF.7 にブレイクスルー感染した参加者 (66サンプル) が含まれます。2 番目のコホートは S486P を含む XBB* 感染者です (主に XBB.1.9.1/XBB.1.9.2、27 サンプル)。3 番目のコホートは XBB*+486P 再感染前に BA.5/BF.7 BTI を経験しました (主に XBB.1.9.1/XBB.1.9.2、54 サンプル)。
感染株は疫学データから推測され、感染中に患者が募集された中国の北京と天津でSARS-CoV-2配列がアップロードされました(表S1)。
次のスパイク偽型水疱性口内炎ウイルス(VSV)に対する中和活性を評価しました。SARS-CoV-2 D614G (B.1)、BA.5、XBB.1.5、XBB.1.16 (XBB.1+E180V+K478R+S486P)、XBB.1.5+F456L (EG.5 で表される)、EG.5.1 (EG.5+Q52H)、XBB.1.5+F456L+K478R (FL.1.5.1 で表される)、および XBB.1.5+L455F+F456L (XBB.1.5.70/GK.* および HK.3 で表されます)。
以前の研究と一致して、単一の BA.5/BF.7 または XBB BTI は、免疫インプリンティングにより、すべての XBB サブバリアントを効率的に中和する NAb を誘発できません。 50% 中和力価 (NT50) が 100 未満です (図 2A および S1)。
対照的に、再感染コホートからの回復期血漿サンプルは、BA.5 に対して D614G よりも高い力価を示し、XBB サブバリアントをよく中和することから、Omicron への 2 回目の曝露がインプリンティングの軽減に役立つことを示しています。
特に、Omicron の再感染によって誘発される多くの NAb を回避することが知られている F456L と比較して、 追加の L455F 置換により、再感染コホートからの血漿の実質的な回避がさらに引き起こされます。
具体的には、XBB.1.5+F456L または EG.5 に基づく追加の L455F 変異は、XBB BTI および再感染コホートにおいて血漿 NT50 をそれぞれ 1.2 倍および 1.3 倍減少させます (図 2B)。

これらの所見は、L455F と F456L が互いに補完し合い、それらの線形的および空間的隣接にもかかわらず NAb を回避する最大の能力を達成することを示しています。
L455F, F456L, and their combination specifically escape the majority of Class 1 NAbs
L455F、F456L、およびそれらの組み合わせは、クラス 1 NAb の大部分を特に回避
RBD の残基 455 および 456 は主にクラス 1 抗体(以前の研究では「グループ A1/A2」とも呼ばれていた)によって認識されるため、私たちは、XBB.1.5 に効果的な RBD を標的とするモノクローナル NAb のパネルの偽ウイルス中和活性をテストしました。 以前の研究で分離された、これらの新しく出現した XBB サブバリアントを対象としました(図S2)。
選択された mAb は、深部突然変異スキャン (DMS) によって決定されるように、L455/F456 を標的とすることが予想されます (図 3A)。
L455 および F456 の変異は、これらの NAb を回避する相関的だが明確な能力を示します (図 3B および S3)。

グループ A1 NAb は一般に IGHV3-53/3-66 を利用し、初期 D614G (B.1) 株を交差中和することができますが、グループ A2 NAb は通常 Omicron 系統に特異的です (図 S4A)。
その結果、L455F および F456L の単一置換は、それぞれ 34 個のグループ A1/A2 NAb のうち 11 個および 8 個を回避します。
それらの組み合わせはより強力な回避を示しますが、それに対して有効なのは 8 つの NAb だけです。

特に、11 個の NAb は L455F または F456L のいずれかによって完全に回避されませんでしたが、組み合わせによって回避され、2 つの変異の相乗効果が示されました (図 3C および S4B)。

また、緊急使用が承認された 3 つを含む、薬剤候補として報告された中和 mAb の活性も評価しました。
試験されたクラス 1 NAb 3 つのうち 2 つ、BD57-0129 および Omi-42 は、L455F および L455F+F456L によって部分的に回避されましたが、BD56-1854 は依然として強力です。
クラス 3 抗体 S309 (ソトロビマブ) の活性は実質的に影響を受けず、弱い中和が残ります。
変異体の変異残基が SA55 および S3H3 によって直接認識されないことを考慮すると、予想通り、SD1 を標的とする抗体 S3H3 と、以前に報告されたクラス 1/4 (グループ F3) RBD を標的とする治療用中和抗体 SA55 は、テストされたすべての XBB サブバリアントに対して引き続き強力です(図 3D)。

Epistatic interactions of L455F and F456L on receptor binding affinity
受容体結合親和性における L455F と F456L の上位相互作用
上記の結果は、L455F 変異と F456L 変異の両方が、主にクラス 1 NAb のエスケープによって媒介される回復期血漿による中和に対する顕著な耐性を与える可能性があることを示しています。
しかし、自然進化において、さまざまな系統が一貫して独立して F456L を進化させ、続いて L455F 変異が発生する一方、L455F が最初に獲得されるケースはほとんど観察されない理由は不明のままです。
残基 455 ~ 456 も RBD の RBM に位置するという事実により、 私たちは、L455F と F456L の組み合わせの効果は、ウイルス侵入のための細胞表面受容体であるヒト ACE2 (hACE2) への親和性への影響に起因すると仮説を立てています。
以前の DMS データは、L455F または F456L の個々の置換どちらともが、BA.2 バックグラウンド内での hACE2 親和性の大幅な低下につながることを示しています。
ただし、これら 2 つの変異の組み合わせは本質的に隣接残基の反転を引き起こすため、hACE2 結合に対する局所的な補償効果がある可能性があります。
BA.2 から XBB.1.5 への抗原の大幅な変化も、受容体結合に対する 2 つの変異の影響を変化させる可能性があります。
仮説を検証するために、XBB.1.5、XBB.1.5+L455F、XBB.1.5+F456L、および XBB.1.5+L455F+F456L (「FLip」) の組換え RBD サブユニットを構築しました。そして、表面プラズモン共鳴(SPR)アッセイによってhACE2に対するそれらの結合親和性を決定した。
解離平衡定数 (KD) は、4 つの変異体についてそれぞれ 6.4 nM、25 nM、11 nM、および 2.0 nM を示します (図 4A)。

DMS の結果と一致して、L455F は XBB.1.5 RBD の hACE2 結合親和性を大幅に弱め、F456L も hACE2 への結合をわずかに弱めます。
驚くべきことに、2 つの変異はどちらも単独では hACE2 親和性を増加させませんが、 XBB.1.5+L455F+F456L の組み合わせは、XBB.1.5 よりも大幅に高い親和性を示します。
反応速度に関しては、L455F または F456L 単独では結合速度定数 (ka) に大きな影響はありませんが、L455F は解離 (kd) を大きく速めます (図 S5)。
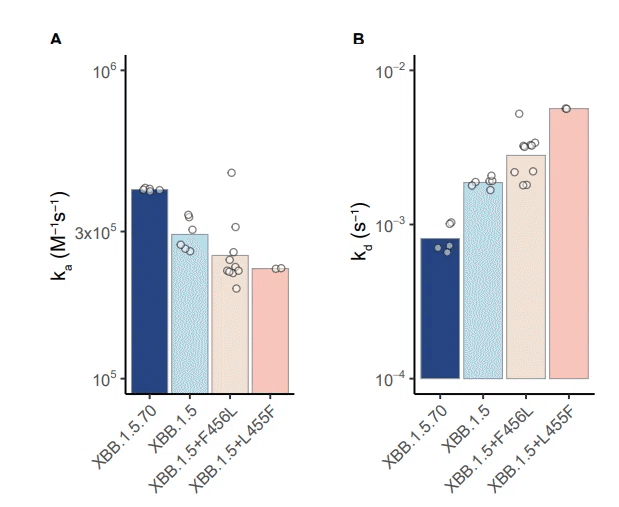
対照的に、「FLip」は、加速された解離を救済するだけでなく、結合を促進し、熱力学的レベルと速度論的レベルの両方で受容体の結合を相乗的に改善します(図4BおよびS5)。

Structural basis of the enhanced ACE2-binding affinity and antibody evasion in “FLip” variants
「FLip」変異体におけるACE2結合親和性の強化と抗体回避の構造基盤
XBB.1.5、XBB.1.5+F456L、および XBB.1.5+L455F+F456L (「FLip」) スパイクタンパク質と ACE2 との結合親和性の相違を解明するために、私たちは、hACE2 と複合体を形成したこれら 3 つのスパイクタンパク質の構造を個別に決定し、RBD-ACE2 結合界面の構造変化を調べました。
予想どおり、3 つのスパイク三量体は両方とも、2 つの「RBD オープン」構造と 1 つの「RBD クローズド」構造を同様に示しました (図 5A)。
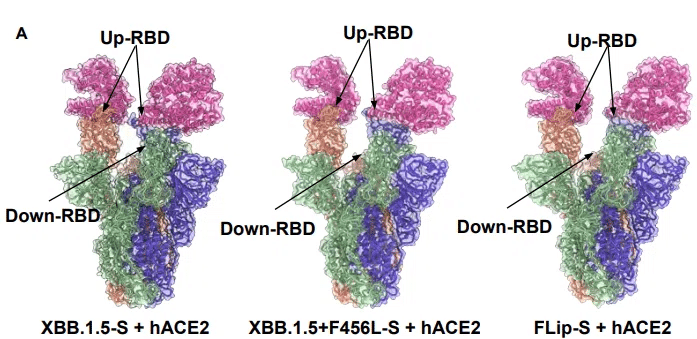
残基 455 および 456 の変異が界面に及ぼす影響をさらに明らかにするために、これら 3 つの変異体の ACE2 と複合体の RBD の高分解能構造を、それぞれ 3.3 Å、3.0 Å、および 3.0 Å の分解能で決定しました (図 5B)。

明確な電子密度が観察されると、相互作用界面の信頼できる分析を実行できます (図 S6)。
XBB.1.5 と比較して、F456L 変異は RBD-ACE2 インターフェース上の相互作用に実質的な影響を与えません。RBD-L455、RBD-L/F456、およびACE2-D30/K31の間で疎水性パッキングが維持されており、これはF456LのACE2結合親和性に対する無視できる影響と一致しています(図5CおよびS7)。
この独自のパターンにより、RBD 上の Q493 と ACE2 上の H34 に、より柔軟なスペースが与えられるため、XBB.1.5 または XBB.1.5+F456L では実現できない、RBD Q493 と S494 の間の H34 側鎖の挿入が可能になります。
その結果、2 つの追加の水素結合、H34-Q493 (3.57 Å) および H34-S494 (2.57 Å) が導入され、「FLip」RBD の ACE2 に対する親和性が強化されます (図 5D)。
対照的に、XBB.1.5 および XBB.1.5+F456L の Q493 と H34 間の距離は、それぞれわずか 4.78 Å および 4.86 Å であり、相互作用が非常に弱いことを示しています (図 5C)。

さらなる分析により、F456L が「FLip」の適合性の前提条件であると結論付けられました。
「Flip」RBDにF456を重ね合わせたものは、F455 と F456 の間に顕著な立体衝突が形成される可能性があります。それによって「FLip」RBD-ACE2 界面の結合モードが乱される可能性があります (図 5E)。

とりわけ、L455 と F456 の反転により、周囲の残基が相乗効果をもたらし、「FLip」RBD と ACE2 の間の界面が再構築され、結合親和性が向上します。
並行して、クラス 1 NAb を回避する L455F/F456L 能力のメカニズムを調査するために、 私たちは、NAb Omi-42の中和活性の変化に対する「FLip」変異の影響の分析を実施しました。NAb Omi-42はXBB.1.5を効率的に中和しますが、「FLip」変異体は中和しません。
ベータスパイク複合体(PDB:7ZR7)におけるOmi-42の公開された構造モデルにより、残基455および456がその重鎖によって厳密に認識されることが明らかになりました(図6A)。
ベータ RBD と複合体を形成した mAb Omi-42 の構造に 3 つの RBD を重ね合わせると、XBB.1.5+F456L の疎水性パッチのわずかな減少が明らかになります。一方、Omi-42 CDR-H3 の Y110 は、「FLip」RBD における疎水性相互作用にアクセスすることができません。その結果、以前の結論と一致して、相互作用が弱くなりました (図 6B ~ D)。

特に、異なるクラス 1 NAb は、RBD、特に L455/F456 領域間で著しく異なる相互作用パターンを示す可能性があります。 なぜなら、この領域は一般に、ほとんどのクラス 1 NAb、特に公的 IGHV3-53/3-66 抗体の非常に可変性の高い CDR-H3 ループの標的となるためです。
Discussion
この研究では、複数の XBB 亜系統で集中的に発生する 2 つの頻繁に出現する隣接する変異である L455F と F456L が抗体の中和と受容体結合に及ぼす影響を評価しました。
我々は、L455FがXBB.1.5+F456Lベースでクラス1 NAbをさらに回避する一方、単一のF456LまたはL455F置換がACE2結合を弱めることを実証します。
驚くべきことに、これらの組み合わせはまさに「フリップ」、すなわち、ACE2結合界面上の隣接する残基間の「Leu-Phe」から「Phe-Leu」への反転であり、ACE2に対する親和性を劇的に強化します。
これらの結果を総合すると、F456L と L455F が連続して進化する XBB サブバリアントの収斂進化が説明されます。
エピスタシスは、ある突然変異の影響が他の突然変異の存在に依存し、特定の機能に対する突然変異の非相加的な影響をもたらす遺伝現象です。
RBD Q498Rおよび N501Y 上の 2 つの初期 SARS-CoV-2 RBD 変異間のエピスタティックな相互作用も、以前の研究で報告されています。
祖先の SARS-CoV-2 RBD に基づくと、Q498R 単独では ACE2 結合親和性がわずかに低下しましたが、N501Y (アルファ VOC の RBD) に基づく Q498R では親和性の強い増強が観察されました。
ここで説明されているエピスタティックな変化はさらに顕著です。
L455F は XBB.1.5 に対して強い親和性低下を引き起こしましたが、XBB.1.5+F456L の hACE2 結合親和性を大幅に改善しました。
L455 と F456 は両方とも RBD-hACE2 界面のコア上にあり、ACE2 上の D30 および K31 とコンパクトな立体構造を形成しています。
我々の構造解析により、「FLip」がRBD-hACE2結合界面の実質的な構造変化を媒介していることが明らかになりました。 これには、455/456 だけでなく、RBD 上の Q493 および hACE2 上の H34 のリモデリングも含まれます。
BA.1 や BA.2 などの以前の Omicron 系統では、RBD の残基 493 でグルタミン (Q) がアルギニン (R) に置換されると、ACE2 親和性が大幅に減少しました。
「FLip」がQ493の役割をさらに強調し、別のエピスタティック効果をもたらす可能性があるかどうかを調査することは興味深いでしょう。
ACE2 模倣は、広域スペクトルの SARS-CoV-2 中和結合剤および抗体を同定および設計するための有用な戦略であると考えられています。
Omi-42 などのクラス 1 パブリック NAb は、RBD 上のフットプリントが部分的に重複しているにもかかわらず、通常、ACE2 とは異なる方法で重鎖 CDR3 を含む RBD L455/F456 と相互作用します (図 6A-B)。

同様に、XBB.1.5 に有効なクラス 1 NAb のほとんどは、ACE2 の結合モードを模倣できず、XBB.1.5+L455F+F456L「FLip」変異体によって回避されました。
L455F+F456L の出現は、そのような受容体の模倣が非常に困難である可能性があることを示しています。
中和剤から逃れた変異体は受容体への親和性も失うというゴールに到達するには、バインダーは受容体が標的とする残基と同じ残基を標的とするだけでなく、受容体の結合様式を模倣する必要があります。
このような現象をさらに調査して説明するには、これら 2 つの変異と ACE2 の複合体を含む XBB.1.5 RBD の詳細な実験的構造解析と計算機シミュレーションが将来的に必要になるはずです。
全体として、私たちの研究は、F456L に続いて L455F 変異を伴う XBB 亜系統の出現と循環を合理化しました。 そして、受容体結合親和性の強化と中和抗体の回避が強調されており、これが伝染率の上昇と、ブレイクスルー感染と再感染のリスクにつながる可能性があります。
これらの変異体の割合が継続的に増加していることを考慮すると、NAb 薬やそれらに対するワクチンの開発の有効性を慎重に評価する必要があります。
エピスタシスはSARS-CoV-2 RBDの進化の柔軟性を大幅に拡張し、感染力を大きく損なうことなくNAbを回避する極めて高い能力を備えた新規変異体をもたらす可能性があります。
実際、A475V を含むいくつかの追加の免疫回避性変異が、「FLip」株に基づいて集中的に出現しています。
SARS-CoV-2 RBD の進化の可能性は依然として高く、過小評価すべきではありません。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
