スパイク糖タンパク質の進化における構造ダイナミクス(2023年3月)
Structural dynamics in the evolution of SARS-CoV-2 spike glycoprotein
SARS-CoV-2 スパイク糖タンパク質の進化における構造ダイナミクス
元→Structural dynamics in the evolution of SARS-CoV-2 spike glycoprotein | Nature Communications

Abstract
SARS-CoV-2 スパイク糖タンパク質は、受容体結合とその後の膜融合を媒介します。
ACE2受容体に結合できない閉じた状態、および結合するがより露出した抗原表面を示す開いた状態を含む、さまざまな立体構造で存在します。
懸念されるバリアント (VOC) のスパイクは、毒性の増加と免疫回避に関連するアミノ酸の変化を獲得しました。
ここでは、HDX-MS を使用して、クローズド コンフォメーションからオープン コンフォメーションへの移行、ACE2 結合、および VOC の特定の変異に関連するスパイク ダイナミクスの変化を特定しました。
RBD関連サブドメインがスパイクの開口部に役割を果たすのに対し、NTDは免疫回避を促進するVOCスパイクの立体構造発散のホットスポットとして機能することを示しています。
アルファ、ベータ、デルタのスパイクは主に開いたコンフォメーションを想定しており、ACE2 の結合はそれらのコア ヘリックスのダイナミクスを増加させ、スパイクに融合のプライミングを与えます。
逆に、オミクロンスパイクの置換は、主に閉じたコンフォメーションにつながり、おそらく抗体を逃れることができます。
同時に、そのコア ヘリックスは、ACE2 の非存在下でも融合の準備が整っているという特徴を示します。
これらのデータは、SARS-CoV-2 の進化と omicron バリアントの出現に関する情報を提供します。
Introduction
重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV-2) は、進行中の COVID-19 パンデミックの原因となる病原体です。
宿主細胞に結合して融合するために、SARS-CoV-2 は、気道の細胞の表面に発現するヒト受容体アンギオテンシン変換酵素 2 (ACE2) に結合する膜貫通糖タンパク質スパイクを利用します。
受容体の結合とプロテアーゼの切断により、スパイクは宿主細胞膜との融合を促進し、感染細胞のサイトゾルへのウイルス成分のその後の放出を促進するコンフォメーション変化を受けます。
スパイクは、現在市場に出回っているすべてのワクチンの抗原でもあり、ワクチン接種および感染者に強力な免疫応答を誘発します。
スパイクは、S1 と S2 の 2 つのサブユニットで構成される各スパイク モノマーを持つ大きなクローブ形のホモ三量体です。
S1 は ACE2 結合を仲介し、S2 を部分的に覆い、膜融合イベントの原因となる大きならせん状の茎を形成します。
S1 サブユニットは、N 末端ドメイン (NTD)、受容体結合ドメイン (RBD)、および RBD 関連および NTD 関連サブドメイン (RBD-s および NTD-s、それぞれ SD1 および SD2 とも呼ばれます) を含みます。
S1サブユニットとS2サブユニットは、フリンによって切断できる多塩基性プロテアーゼ切断部位を含む柔軟な無秩序リンカーによって接続されています。
追加の切断部位は、融合ペプチド (FP) の上流の S2 サブユニット (S2' サイト) にあります。
SARS-CoV-2 感染の初期段階では、スパイクはいくつかの構造変化を起こします。
ウイルス表面では、スパイクは S1 サブユニットと S2 サブユニットが相互作用する準安定な融合前状態に存在し、スパイク三量体は閉じたコンフォメーションと開いたコンフォメーションの間で遷移します。
閉じたコンフォメーションは露出したウイルス抗原表面を最小限に抑えるため、スパイクは中和抗体を逃れることができますが、ACE2 への結合は防ぎます。
開いたコンフォメーションでは、スパイクは露出した抗原表面を増加させながら、ACE2 を認識することができます。
開いた立体構造と閉じた立体構造の間の遷移は、三量体の開口部と大きなドメインの動き、特に受容体に関与するために直立するRBDの大きなドメインの動きに関連しています。
受容体が結合すると、スパイクは融合の準備が整い、その後、主要な構造の再編成が行われます。融合時に S1 脱落とその S2 コアの主要なリフォールディングです。
スパイクの開口部と融合は、フリン、TMPRSS2、カテプシンなどのプロテアーゼによるタンパク質分解切断によって強化されます。
パンデミックの初期に、スパイクは NTD-s で D614G 置換を獲得しました。これにより、元の武漢分離株の D614 スパイクと比較して、G614 スパイクがより開いた、したがって受容体にアクセス可能なコンフォメーションを採用することが促進されます。
D614G 置換は、隣接するモノマーの融合ペプチド近位領域 (FPPR) で K854 との塩橋を破壊します。 これは、受容体結合後の融合前から融合後のコンフォメーションへのスパイク遷移を駆動するための重要な領域であると提案されています。
「630ループ」(残基620〜640)と名付けられた、隣接するモノマーのFPPRの近くに位置するNTD-sの構造要素は、G614スパイクで秩序化されますが、武漢スパイクでは無秩序に見えます。
構造化されると、630 ループは同じプロトマーの NTD と RBD-s の間のギャップに挿入でき、NTD-s を安定化します。
したがって、G614 での RBD の開口は、630 ループと相関し、FPPR は武漢スパイクで採用された位置から離れます。
630 ループも S1/S2 境界の近くに位置しており、NTD-s と RBD-s が FPPR とともに、融合時にコンフォメーションの再編成を受ける可能性があることを示唆していますが、それらの性質は不明のままです。
D614G置換は、ウイルスに適応度の利点とより高い伝染性を与え、さらなる突然変異の獲得を容易にしました。
したがって、いくつかの SARS-CoV-2 株は D614G を背景に発生し、そのうちのいくつかは病原性が高く、懸念されるバリアント (VOC) として分類されました。
VOC には、B.1.1.7 (アルファ)、B.1.351 (ベータ)、P.1 (ガンマ)、B.1.617.2 (デルタ)、および B.1.1.529 (オーミクロン) が含まれます。それぞれに固有の変異セットを持ちながら G614 を共有するスパイクがあります (補足図 1)。
VOC のスパイクの多数のクライオ EM 構造が判明されており、正確な高解像度の構造情報を提供し、さまざまなバリアントの開口部の程度を説明しています。
クライオ EM 構造だけでは、スパイクの開口部、ACE2 受容体結合の根底にある構造ダイナミクスを明らかにすることはできません。また、これが融合のための S2 三量体コアの露出を先祖のスパイクおよび VOC のスパイクでどのように開始するかを明らかにすることはできません。
スパイクのサイズとそのコンフォメーションの不均一性に関連する内部の課題により、これまでにその構造ダイナミクスを調べた研究はほんの一握りです。
したがって、VOCの変異がスパイクのコンフォメーションランドスケープに引き起こす摂動と、それらがスパイク機能とそのエピトープのダイナミクスにどのように影響するかについての明確な理解が不足しています。
質量分析と結びついた水素-重水素交換 (HDX-MS)は、タンパク質とその複合体の構造ダイナミクスを調査するための高感度な手法です。
MS によってペプチド レベルで測定された経時的なタンパク質の重水素取り込みは、局所的な構造ダイナミクス、全体的なコンフォメーションの変化、および結合イベントについて通知します。
ここでは、HDX-MS を実行して、元の武漢分離株のスパイクと、以前および現在循環している VOC (アルファ、ベータ、デルタ、およびオミクロン) のスパイクの構造ダイナミクスを比較しました。同時に、それらがACE2とどのように相互作用するか、および融合のプライミングに関連する動的イベントも研究しました。
VOCのすべてのスパイク間で共有される支配的なD614G置換をもつG614スパイクを、スパイクバリアントとオープン(またはクローズ)コンフォメーションの好みを比較するための参照状態として利用しました。
RBD-s がスパイク開口部の調節に関与するサブドメインであることを示します。 一方、NTD の柔軟性の向上は、元のスパイクからの VOC のスパイクの進化的分岐を特徴付け、それらの免疫回避の根底にあります。
さらに、アルファ、ベータ、およびデルタ株のスパイクは、主に開いた受容体アクセス可能な状態を想定していること、および ACE2 への結合が S2 コア ヘリックスのダイナミクスを増加させ、スパイクを融合のためにプライミングすることを示します。
対照的に、オミクロン株のスパイクは、おそらく免疫を逃れるために、閉じた状態を好むように進化しましたが、ACE2 が存在しなくても、すでに融合の準備が整っています。これにより、最小限の受容体結合で融合後状態への移行が可能になる可能性があります。
まとめると、私たちのデータは、元の武漢分離株から現在優勢なオミクロンバリアントへの SARS-CoV-2 スパイク糖タンパク質の構造進化に光を当てています。
Results
この作業の実験結果はすべて HDX-MS データに基づいており、ペプチド セグメントの解像度でのタンパク質のダイナミクスを通知します。
タンパク質 HDX からの洞察の完全な深さは、他の構造研究、特にクライオ EM を参照することによって最もよく活用できます。
ここで報告されている HDX データセットは、元の武漢ウイルスからのアポおよび ACE2 結合スパイクと、同じ HDX 条件下で研究された D614G、アルファ、ベータ、デルタ、およびオミクロンのバリアントです。
これらの条件は、多かれ少なかれクライオ EM 研究で使用される条件とは必然的に異なることに注意することが重要です。
スパイクの構造ダイナミクスと受容体結合イベントを研究するために、スパイクの融合前のコンフォメーションのみに焦点を当てることにしました。
したがって、すべての分析で、多塩基性切断部位における R682S・R685S 置換、およびK986P・K987P(2P)置換によって安定化されたスパイク外部ドメインのバージョンを使用しました。これらの組み合わせにより、スパイクはフリン切断不能になり、融合後のコンフォメーションに移行できなくなります。
以下のセクションは HDX-MS データのサブセットとして提示され、原稿の論理的な説明を助けるために他の構造研究と比較されます。
The spike open conformation shows a characteristic HDX profile
スパイクの開いたコンフォメーションは、特徴的な HDX プロファイルを示す
以前の構造研究では、武漢スパイクの D614G 置換が開いたコンフォメーションを促進することが示されています。
したがって、三量体の開口部に直接関連する動的イベントをマッピングするために、まず G614 スパイクと武漢 (D614) スパイクの HDX を比較しました。
スパイク配列の約82%に及ぶ308個のペプチドのHDXを追跡しました(図1および補足図2)。

G614 スパイクの HDX プロファイルは、スパイクが開いた立体構造にあるときに溶媒にさらされ、受容体がアクセス可能になる RBD の領域で HDX が増加していることを示しました (PDB: 7BNN18)。そして、RBD領域407〜422および456〜471など、スパイクが閉じた構造(PDB:6ZGE11)にある場合、閉塞または部分的に閉塞されます(図1および補足図3)。
武漢スパイクでは、FPPR にまたがるセグメント 834–851 は、非常に早い時点でのみ HDX からの保護を示しました。これは、閉じたコンフォメーションの武漢スパイクの構造に規則正しく出現したにもかかわらず、非常に動的であることを示しています (図 1c)。
特に、このセグメントは、D614-K854 塩橋の破壊の結果として、G614 スパイクで HDX の増加を示したため、武漢スパイクと比較してさらにダイナミックに見えました。
G614 スパイクは、セグメント 621 ~ 627 および 628 ~ 643 でそれぞれ HDX の減少と増加を示しました。これは、閉じた立体配座から開いた立体配座へのスパイク遷移に関連する 630 ループの構造再編成の兆候として解釈しました。
さらに、S2 ストークのヘリックス (HR1、FP、および CH 領域) で HDX の増加が見られました。これは、G614 三量体を一緒に保持する相互作用の緩みに関連しています。
これは、武漢スパイクと比較した場合、特にG614スパイクの閉じたコンフォメーションで、モノマー間相互作用領域の減少を示す以前の構造研究と一致しています。
最後に、RBD-s は、武漢スパイクよりも G614 スパイクで著しく低い HDX を示しました。これにより、このサブドメインのダイナミクスの低下が、開いたコンフォメーションを想定したスパイクと相関することが明らかになりました。
Early VOC spikes show increased opening, omicron spike is mostly closed
初期の VOC スパイクは開口部の増加を示し、オミクロン スパイクはほとんど閉じています
オープン コンフォメーションの HDX の特徴を確立したので、この知識を使用してスパイク バリアントを分析し、アルファ、ベータ、デルタ、およびオミクロン株のスパイクの HDX を G614 スパイクと比較しました。
我々の知る限り、 これは、最も優勢なバリアントのスパイクが、同じサンプリング条件下で並行して研究される最初の分析であり、構造ダイナミクスに対するアミノ酸変化の推定上の影響を理解し、開口度を包括的に比較することを可能にします。
平均で 275 のペプチドを追跡し、各スパイク バリアントで約 80% のシーケンス カバレッジに達しました (補足図 5 ~ 8)。
スパイクバリアントの HDX に対する化学交換定数 (kch) の違いの影響が調べられ、HDX 効果の定性的評価では無視できると見なされました (補足図 4 および補足データ 1)。
それらの RBD、RBD-s、および 630 ループの HDX を観察して、G614 スパイクに対する開状態または閉状態の好みに関する情報を推測しました。
アルファ、ベータ、デルタのスパイクは、G614スパイクと比較して、RBDでHDXの増加、RBD-sでHDXの減少、630ループの2つの隣接するセグメントでHDXの減少/増加を示しました(図2および補足図9〜11)。 3つすべてが、これらのスパイクバリアントが開いたコンフォメーションに対してより高い優先度を示していることを示しています。

ベータ スパイクは、開放状態への完全な移行を示したクライオ EM 研究と一致して、これらの効果の最大の大きさを示しました。
具体的には、データは、特にK417N置換(残基400〜427)のレベルで、ベータスパイクRBDのHDXが大幅に強化されたことを示しました(図2および補足図10)。
残基 417 は三量体の RBD-RBD 界面に位置するため、N417 はおそらく K417 と比較して密な構造の単量体に疎な界面パッキングを付与します。したがって、ベータスパイクの完全な開口を支持します。
アルファ、ベータ、およびデルタスパイクとは対照的に、630ループのHDXプロファイルとオミクロンスパイクのRBD-sは、武漢スパイクのプロファイルと類似していました(図2および補足図12)。G614 スパイクよりも閉じていることを示します。
ただし、G614 スパイクと比較して、オミクロン スパイクは、RBD の次の置換のレベルで HDX の増加を示しました:K417N はベータ スパイクと共有されており、セグメント 400 ~ 427 に柔軟性を与えます。 一方、S477NとT478K(デルタスパイクと共有)、E484A(ベータスパイクと共有)は、セグメント456〜471と487〜506に柔軟性を与えました(図2および補足図12)。
これらの特徴は、オミクロン スパイクの RBD の内部柔軟性の増加を示しています。 武漢スパイクよりもコンパクトな閉じた状態を採用していることを示唆しています。
特に、アルファ、ベータ、およびオミクロンスパイク間で共有されるN501Yは、アルファおよびベータスパイクにはセグメント495〜506で受容体結合モチーフ(RBM)の安定化(HDXの減少)を誘導しましたがオミクロンスパイクは安定化は誘導されませんでした(図2および補足図9、10)。おそらく、HDXの増加をもたらす後者(Q493R、G496S、Q498R、およびY505H)の隣接置換の存在によるものです(図2および補足図12)。
N501Y は、アルファスパイクおよびベータスパイクで ACE2 に対するスパイク親和性を高めることが示されています。一方、我々が現在観察しているこの不安定化効果は、以前に説明されたオミクロンスパイクにおける限定的な親和性の増強を説明する可能性が高い。
Spikes of all VOCs show increased dynamics in the NTD and S2
すべての VOC のスパイクは、NTD と S2 のダイナミクスの増加を示す
VOCの個々の変異は、ほとんどの場合、スパイク三量体に明確な動的変化を引き起こし、それらのローカルHDXに影響を与えました(補足図9〜12)。
ただし、個々の変異では説明できないが代替の置換と削除のセット全体によっては説明できる、すべてのスパイクバリアントに共通の効果を特定しました。
まず、 NTD における残基 92-110 (β5 ~ β6 ループ、β6、および β6 ~ β7 ループ)、136- 153 (β9 および β9 ~ β10 ループ)、177-191 (β10 ~ β11 ループ)、および 242 -264 (β14 および β14-β15 ループ) にまたがる領域で HDX の増加がすべてのスパイクバリアントで見られました(図2bおよび補足図9〜19)。

これらの効果はマークされており、武漢スパイクと G614 スパイクの HDX プロファイルを比較したときに強調表示されなかったため、強化されたオープンコンフォメーションと関連付けることはできません。それらはオミクロンスパイクにも存在していました。 (図 2b)。
これは、アルファ、ベータ、デルタ、およびオミクロンのスパイク変異のコンフォメーション進化が、すべての VOC の周辺 NTD サイトの柔軟性の著しい増加を特徴とする共通のコンフォメーション ランドスケープに収束したことを示唆しています。
第二に、VOCのすべてのスパイクのHR1のコアS2ヘリックスは、G614スパイクのHDXよりも高いHDXを示しました(図2および補足図9〜12)。
さらに、ユニークな変異セット (Q954H、N969K、および L981F) を持つオミクロン スパイクの HR1 は、スパイク バリアントの中で最もダイナミックに見えました。CH 領域 (残基 945 ~ 1006) まで伝達される HDX の劇的な増加を示します (補足図12)。
HR1 と CH はスパイク融合機構の一部であるため、それらの強化されたダイナミクスは、すべての VOC スパイク、特に omicron スパイクが融合イベントのために事前準備されていることを示唆しています。武漢およびG614スパイクと比較して、ACE2が存在しない時にも同様です。
Early VOC spikes, alpha, and beta, show the highest avidity towards ACE2
初期の VOC スパイク、アルファ、およびベータは、ACE2 に対して最も高い結合力を示す
次に、単独およびスパイク三量体 (1:2 スパイク三量体: ACE2) および分離された祖先 RBD (3:2 RBD: ACE2) との複合体である ACE2 外部ドメインの HDX を研究することによって、ACE2へのスパイク結合によって誘導されるHDX効果(ΔHDX)の大きさを測定しました。
単離された RBD の集団全体が結合能を持ち、ACE2 結合部位を完全に占有します。一方、スパイク内に埋め込まれた RBD の一部だけが直立しており、受容体と結合することができます。
観察された ΔHDX は、結合化学量論 (結合する ACE2 の数) とスパイクと ACE2 の間の水素結合ネットワークの安定性の累積効果(これはスパイク受容体結合親和性に関連している可能性があります)から生じ、スパイク受容体の結合力をランク付けすることができます(すなわち、個々の RBD-ACE2 相互作用の親和性と、一度に0-3個の ACE2 分子と結合する各スパイク三量体の化学量論から生じる結合の全体的な強度)。
ACE2配列の81%に及ぶ167個のペプチドのHDXを追跡しました(補足図20)。
スパイクRBDと接触する残基にまたがるACE2領域(セグメント23〜45、327〜356、および80〜83)と、G614、アルファ、ベータ、およびデルタスパイクを含むACE2セグメント58〜72でHDXの減少が観察されました (図3aおよび補足図21〜27)。

さまざまなスパイクによって誘導される累積ΔHDXは、アルファ>ベータ>デルタ> G614 > Wuhan ≈ omicronで変化しました(図3bおよび補足図28)。

これらの ΔHDX 値は一般に、分離された RBD によって誘導される値よりも低く、ACE2 分子の一部がスパイク:ACE2 状態で結合していないままであることを示しています。したがって、三量体内のすべての結合可能なRBDがおそらく完全に占有されていることを示唆しています。
具体的には、ΔHDX によって測定された G614 スパイクへの ACE2 結合は、武漢スパイクの 3 倍 (および単離された祖先 RBD の 2.5 倍低い) です。
D/G614 は ACE2 との相互作用に直接関与しないため、固定化スパイクを用いた表面ベースのアフィニティ アッセイを使用した以前の研究では、これら 2 つのスパイクのアフィニティは類似していると報告されています。この違いは、オープン状態に対するG614スパイクのより高い優先度によって引き起こされる結合化学量論の増加のみによるものであると解釈しました。
アルファ、ベータ、およびデルタ スパイクは、G614 と比較して、ΔHDX がそれぞれ 2.7、2.4、および 2.2 倍増加し、ACE2 へのさらに高い結合を示すように見えました。
それらの場合、我々はそれを、これらのスパイクで観察されたより高い開放状態の量と相関する結合化学量論と、以前の研究で報告されたACE2に対するより高い親和性の両方の増加に起因すると考えています。
対照的に、オミクロン スパイクは、G614 スパイクよりもはるかに低い ΔHDX を示し、全体的に武漢スパイクに匹敵します。
これは、オミクロンスパイクが主に閉じた状態を想定しているという我々の観察と一致しており、RBDの置換によって誘導される親和性の増加がないか、わずかしか増加しないことを示しています。
ACE2 binding stabilizes the open state and shows signs of cooperativity
ACE2結合は開放状態を安定させ、協調性の兆候を示す
次に、スパイク三量体の HDX と、ACE2 と複合体を形成している単離された祖先 RBD の HDX を観察して、それらの結合メカニズムについてさらに洞察を得て、スパイクバリアントの変異がこの相互作用にどのように影響するかを理解しました。
複合体のHDX分析は、スパイクタンパク質配列の平均77%に及びました(補足図29〜33)。
まず、受容体結合スパイクは、RBD領域442〜506および400〜427でHDXに対する顕著な保護を示し、さまざまなバリアントでさまざまな大きさと効果の拡張を示しました(図4および補足図34〜40)。

これは、ACE2 によるこれらの領域の直接的な関与によるものであり、スパイクと ACE2 の界面が RBM (残基 438 ~ 506) と残基 417 によって構成されていると説明した以前の構造研究と一致しています。
第二に、RBD-s の HDX の減少を観察しました。これは、開口部の増加と関連しており、すべての受容体結合スパイクに現れています。この効果は、武漢スパイク(残基569〜582)およびオミクロンスパイク(残基552〜567および575〜583)で最も顕著です(図4および補足図34、39)。
受容体と会合した際の開いたコンフォメーションのこの顕著な安定化は、これら 2 つのスパイクを特徴付ける閉じたコンフォメーションの優先性と一致します。
対照的に、ACE2 の非存在下でも開いたコンフォメーションを支持する他のバリアント スパイク (G614、アルファ、ベータ、およびデルタ) は、ACE2 結合時に RBD-s の HDX のわずかな減少のみを示しました(図4および補足図35〜38)。
まとめると、これらの観察結果は、RBD-s が閉じた状態から開いた状態へのスパイクの遷移に重要な役割を果たしているという考えを裏付けており、受容体結合時のさらなる硬化を示しています。
さらに、ACE2 結合状態のスパイク三量体 (残基 495 ~ 503) の RBM にまたがるすべてのペプチドの HDX プロファイルがバイモーダル同位体分布を示し、したがって高質量と低質量の集団を示したことを観察しました。一方、単一の単峰分布がアポ状態を特徴付けました(図5および補足図41〜45)。

これらのデータは、バインドされたスパイクの RBD が、2 つの異なる同位体分布を生じさせて交換する 2 つの異なるゆっくりと相互変換する集団を探索できることを示唆しています。
あまり交換されていない (低質量) 集団は、バインドされた RBD を持つオープンなプロトマーを占めています。
より多く交換された (高質量) 集団は、ACE2 の存在によって摂動された RBD を表しますが、結合していない可能性があります:これは、交換反応の過程で ACE2 が一時的に RBD から解離するか、完全に直立していない中間状態を想定しているためです。
前者の仮説は、非結合 RBM の HDX と一致する母集団の証拠が初期の時点でスパイク結合状態に現れなかったという観察によって支持されています。
ただし、分離された先祖RBDのACE2結合状態(3:2 RBD:ACE2)は、未結合集団のかなりの割合(33%)を含み、研究された条件下でRBMにバイモーダル同位体分布を示しませんでした (補足図41)。これは、RBD の結合集団と非結合集団の単純な混合物は、スパイク三量体のコンテキストであっても、HDX 二峰性では現れないことを示唆しています。
したがって、バイモーダル HDX プロファイルの高質量集団を、閉じた状態と完全に直立した状態の受容体結合コンピテント構造の間の中間状態にある RBD と関連付けました。
無秩序な RBD によって特徴付けられるこのような集団は、クライオ EM 研究で以前に観察され、説明されています。
したがって、我々は、以前の研究で報告されたスパイク受容体結合様式にも基づいて、この集団が、ACE2が隣接するものに結合する際に追加のRBDを構築する三量体能力、すなわち協力的な開口の兆候を報告していると合理化する。
2 つの同位体分布を正確にデコンボリューションできないため、低質量および高質量の部分母集団の正確な相対比率をデータから導き出すことはできません。
それにもかかわらず、高質量集団の見かけの豊富さは、上記のように、特定のスパイクが開いたコンフォメーションを採用するという全体的な好みと相関しているようです。
そのため、G614 とデルタ スパイクは、武漢スパイクと比較してより強力な高質量集団を示し、したがって ACE2 結合のより高い協同性を示しました。一方、ベータスパイクは、アルファスパイクと比較して、より強い高質量集団を示しました。
対照的に、主に閉じたコンフォメーションを想定しているオミクロンスパイクは、最小限の高質量集団を示し、ACE2結合の協同性が低いことを示しています(図5)。
これらのデータから、受容体への結合時に直立RBDに加えられる結合エネルギーは、部分的に他のまだダウンRBDに向けられていると結論付けます。ACE2の相互作用により、三量体の積極的な協調的開放につながります。
ACE2 engagement mobilizes the S2 subunit, priming spike for fusion
ACE2の関与はS2サブユニットを動員し、融合のためのスパイクを刺激
ACE2受容体の結合は、融合のためのスパイクを準備する動的イベントのカスケードを開始します。
ACE2 関与時のスパイクの HDX 増加を測定することにより、ACE2 結合がスパイク構造を不安定化する方法を分析し、さまざまなバリアントのスパイク三量体が融合のためにプライミングされる方法を推測しました。
ACE2 が結合すると、すべてのスパイクの 630 ループと FPPR セグメントが、閉から開への遷移で以前に観察したものと同じ HDX 変化を示すことがわかりました。 これら2つの要素が結合していない三量体の位置からずれていることを示唆しています(補足図34〜39)。
さらに、ACE2 結合時に、さまざまなタンパク質ドメインで、HDX の増加によって証明されるように、すべてのスパイクがダイナミクスの増加を示しました。NTD-s および RBD-s の上部 (残基 304 ~ 387) ・フリン切断部位のレベル (672 ~ 703 の間) ・RBD の ACE2 結合に直接関与していない部分 (516–534)・FP(764〜790の間)、HR1およびCH(923〜1001)に見られるすべてのスパイクに共通の影響がありました;一方、オミクロンとアルファスパイクは、FP-HR1セグメント875〜922でHDXの増加をさらに示しました(図6aおよび補足図34〜39)。

各スパイク三量体は、ACE2 に対して異なる感受性を示しましたが、ACE2 結合による HDX の最も顕著な変化は、オミクロン スパイクで観察されました。ここで、HR1全体がすべてのスパイクバリアントの中でHDXの最大の増加を示しました(図6bおよび補足図39)。
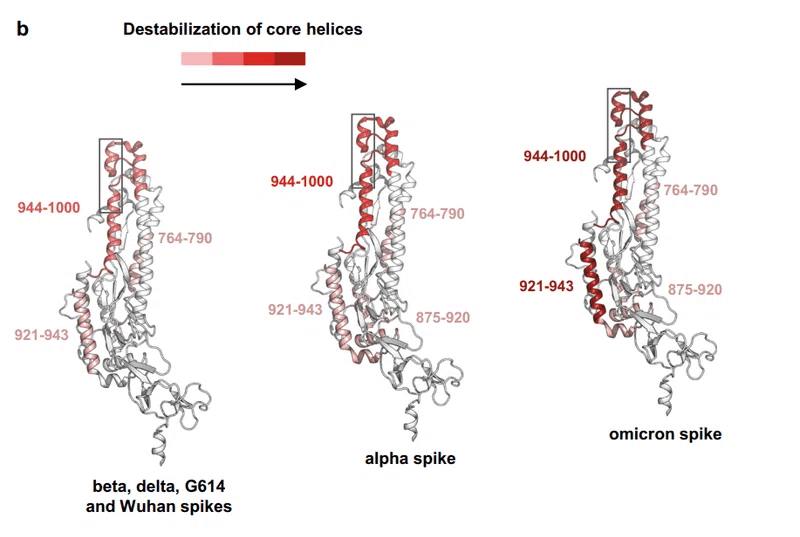
特に、残基962〜982にまたがるペプチドは、スパイクがACE2に関与すると、バイモーダル同位体エンベロープの形でHDXの増加を示しました(図6cおよび補足図46)。

このセグメントは、融合後の状態への移行時に大きな立体構造の再編成を受ける HR1 ヘリックスを含みます。私たちの分析が、融合のスパイクを準備するHR1の再配向につながる特定の動的イベントをキャプチャしたことを示唆しています。
この HDX バイモダリティの幅は、オミクロン > アルファ > ベータ > G614 ≈ 武漢スパイクによって異なり、ACE2 が存在しない場合でもオミクロン スパイクが事前に現れます (図 6c および補足図 46)。
これらの結果はまた、ACE2 結合からのエネルギー獲得は、静止した RBD (協同的開口部) を立てるために利用されるだけでなく、主に S2 コアヘリックスに沿って分布し、融合後のコンフォメーションへの移行のためのスパイクを準備することも示唆しています。
注目すべきは、ACE2 結合時に HR1 で観察された不安定化 (HDX の増加) の大きさは、さまざまなスパイク三量体の協同的な開始の程度と逆相関していたことです。
たとえば、G614スパイクは武漢スパイクよりも高いΔHDXでACE2に結合しましたが(図3bおよび補足図28)、HR1のHDXで観察された増加はG614と武漢スパイクで類似していました (図6および補足図34、35)。 おそらく、G614スパイク結合エネルギーの余剰が三量体モノマーの協同的な開口に向けられているためです(図5)。
同様に、ベータスパイクとアルファスパイクは同様のΔHDXでACE2に結合しました(図3bおよび補足図28)が、アルファスパイクで観察されたHR1の不安定化はベータスパイクよりも高かった(図6および補足図36、37)。ベータスパイクは、より多くの結合エネルギーを協同効果に向ける可能性が高いためです(図5)。
最後に、オミクロンスパイクは、武漢スパイクと同様にΔHDXでACE2に関与しました(図3bおよび補足図26)。 そのHR1は結合時に非常に不安定になりました。武漢スパイクよりもはるかに高いレベルです(図6および補足図34、39)。
オミクロンのスパイクが RBM で低強度の高質量集団を示したため、武漢のスパイクよりもはるかに強度が低かった (図 5)。オミクロンスパイクは、協同効果を促進してさらなる開放と受容体結合を促進するのではなく、結合エネルギーの大部分を三量体コアヘリックスに向けると考えられます。
また、オミクロンスパイクのコアヘリックスは、ACE2がなくてもすでに非常に動的であるように見えたことを考えると(補足図12、46)、オミクロンは、融合に伴うコンフォメーションの再編成をより「準備」する構造的特徴を進化させたと提案します。一方、以前に循環したバリアントのスパイクは、受容体の開放とより強力な関与を促進するために進化しました。
Discussion
SARS-CoV-2 VOC のスパイクの HDX-MS 分析により、ヒトに感染する能力を改善する多くの適応が明らかになりました。
まず、さまざまな VOC のスパイクが NTD に非常に異なるセットの変異を持っているにもかかわらず、これらがタンパク質のコンフォメーション レベルで発揮する効果が収束することを示します。その結果、NTDの周辺部分の柔軟性が大幅に向上しました(図2b)。
以前の研究では、モバイル ループとβ-ヘアピンで構成される NTD のこの部分が、武漢スパイクの疎水性および静電相互作用のネットワークによって安定化されていることが示されています。これは、VOC のスパイクで中断されることを示しています。
ここで特定されたこの発散ホットスポットは、NTD 抗原スーパーサイトと強く重複しているため、アルファ、ベータ、デルタ、およびオミクロン株によって獲得された柔軟性の向上により、NTD を標的とする抗体の回避が可能になり、これらの株に進化上の利点がもたらされると私たちは仮定します。
スパイクにおける NTD の機能はまだよくわかっていませんが、私たちの結果は、ウイルスが RBD ではなく NTD に対する宿主の免疫応答をそらすことを可能にする、大きくて容易に変更可能な抗原表面として使用できることを示唆しています。これは、ウイルスサイクルにおいて重要な役割を果たしています。
この NTD サイトのコンフォメーションの可塑性により、おそらく抗体に脆弱なコンフォメーション エピトープの構成が時折ポピュレートされたままになり、抗体を介した保護が減少しますが、完全に排除されるわけではありません。
同時に、線形 NTD エピトープは、VOC の NTD の異なる立体構造の側面よりも、スパイク バリアントの残基の変化によってより影響を受ける可能性があります。
多くの構造研究で示されているように、SARS-CoV-2 スパイクがオープン受容体結合コンピテント構造に移行する能力は、ウイルスの進化を通じて変化しています。
武漢スパイクによる D614G 置換の獲得はターニング ポイントでした。これは、三量体の開口部とウイルスの伝染性を高め、すべての VOC の出現を促進したためです。
G614 スパイクの HDX を武漢スパイクと比較することで、クローズからオープンへの状態遷移を支える動的イベントを特定することができました。
私たちのデータは、RBD-s (SD1) サブドメインが三量体の開口を調節するレバーとして機能する開口メカニズムを明らかにしています。RBD、NTD-s (SD2) の D/G614、および隣接するモノマーの FPPR 間のアロステリック クロストークを調整することによってです。
要約すると、D614-K854 塩橋が破壊されると、FPPR がより動的になることがわかります。
FPPR は、RBD に隣接する RBD-s に隣接します。
順序付けられた FPRR は、開いたコンフォメーションのプロトマーの RBD-s と衝突するため、 G614 スパイクでは、より柔軟な FPPR により、RBD がより適切に硬化し、RBD が直立できる最適な構造を採用できるようになります。
このアロステリック軸は双方向であることがわかりました。これは、受容体が RBD に結合する際に開いたコンフォメーションが安定化されると、これらの要素も配置が変化するためです。
このアロステリック軸は、スパイクが G614 を共有し、開いた状態を支持するため、初期の VOC で保存されますが、オミクロン スパイクでは保持されなくなります。
むしろ、オミクロンスパイクが優先的に閉じていることを観察しました。これは、以前のクライオEM研究、特に融合前安定化変異を欠くスパイクコンストラクトを使用したものと一致しています。
2P オミクロン スパイク (この研究で使用された構造体) のほとんどのクライオ EM 分析では、武漢スパイクと比較した場合に開放状態が優勢であることが報告されています (ただし、必ずしも G614 スパイクとは異なります);ただし、これらの各研究によって報告された特定のコンフォメーションと結論は大きく異なりました。
ここでは、オミクロン置換 N856K(RBD-s32のS2とD568およびT572の間の相互作用のネットワークを変更) が RBD-s の閉じた三量体位置を回復し、RBD/RBD-s/FPPR クロストークを妨げていることを示唆しています。
さらに、オミクロンスパイクの HDX を観察することにより、NTD-s の 630 ループの構造構成も RBD-s の位置に依存していると推測されます。
これらの観察結果は、融合前安定化変異のないオミクロンスパイクに関する最近の構造研究と一致しており、RBD-sがスパイク開口メカニズムで中心的な役割を果たしていると信じるように促します。
これに沿って、ごく最近の報告では、RBD-s のエピトープを認識するモノクローナル抗体がスパイクの開口を誘導し、アルファ、ベータ、デルタ、およびオミクロンの VOC を中和できることが実証されています。 したがって、RBD-s は、SARS-CoV-2 に対する治療用抗体の有望な標的にもなります。
開いたコンフォメーションの場合、スパイクは ACE2 に結合し、その後の融合イベントの準備を整えます。
融合後状態への移行には、三量体構造の劇的な再編成が含まれ、S1 サブユニットが解離し、S2 の HR1 および CH サブドメインが解離します。 融合前の状態では、短い別々の逆平行ヘリックスを含み、再配向して長い連続したステムヘリックスを形成します。
融合前に安定化されたスパイクに関する HDX 研究により、融合後の状態に完全に移行する前に、ACE2 関連付けのダイナミクスとエネルギー論、およびスパイク三量体に対する結合イベントの初期の影響をよりよく理解することができました。
ACE2 結合エネルギーが S1 サブユニットと S2 サブユニットの両方に分散していることを明らかにします。
1 つの S1 サブユニットに結合する ACE2 は、追加のプロトマーが協調的に開くのを促進し、RBD-s の硬化と、結合していない三量体の位置からの 630 ループの排除を引き起こします。これは、隣接する S1–S2 切断部位を露出させて、プロテアーゼ切断を容易にする可能性があります。
S2サブユニットでは、FPPRがより動的になり、融合ペプチドが宿主細胞膜に関与できるようになり、切断のために近位S2 '部位も露出します。
したがって、630 ループと FPPR は、開いたコンフォメーションへの移行に関与するだけでなく、融合性移行につながるイベントにも直接関与しているように見えます。
HR1 と CH の S2 コア ヘリックスは、受容体が結合すると非常に不安定になり、その後の主要な構造変化に備えます。
S1サブユニットとS2サブユニットの間の結合エネルギーの分布は、VOCによって異なることを示しています。
アルファ、ベータ、およびデルタ バリアントは、スパイクのオープン コンフォメーションを優先し、高い結合エネルギーを使用して ACE2 を高い結合力で結合し、より多くのプロトマーを開き、融合のためにトリマーをプライミングします。
逆に、オミクロンスパイクは優先的に閉じられ、ACE2 に対して武漢スパイクと同様の結合力を示しますが、S1 でさらにプロトマーが開くことなく、ほとんどの結合エネルギーを S2 に向けます。したがって、融合の準備が最適化されます。
これは、ACE2 がなくても S2 コア ヘリックスを非常に動的にするオミクロン スパイクの HR1 のユニークな一連の置換と組み合わされます。オミクロンは、他の VOC と比較してそのスパイクを利用するための異なるメカニズムを進化させ、接着機能ではなく融合を最適化したことを示唆しています。 これにより、他のスパイクバリアントよりも融合の準備が整い、受容体結合が最小限に抑えられます。
したがって、私たちの観察は、SARS-CoV-2の進化の軌跡が最近逸脱したことを示唆しています。
以前に流行していた株は、オープン スパイクが受容体結合を促進したために選択された可能性があります。一方、勃起した RBD を標的とする抗体は、集団免疫の状況ではまだまれでした。
対照的に、オミクロン株が選択されたのは、その閉じたスパイクが、ワクチン接種と以前に循環していたアルファ、ベータ、およびデルタ株によって誘発されたこれらの抗体によって現在認識されている RBD エピトープを隠しているためであると提案します。感染性を維持しながら、おそらく融合反応を開始するためのエネルギーコストが少ないためです(図7)。

ただし、VOC のスパイクのコンフォメーションの進化は、NTD のレベルで収束を示します。これは、ウイルスの進化を通じてコンフォメーションの側面が保存されていることを示しています。
最後の観察に基づいて、バリアントベースのワクチンが、現在循環しているVOCに適応した抗体を誘発し、潜在的には新たなVOCにも適応できると推測するのは合理的です。
最近、ベータスパイクをモデルにしたCOVID-19ブースター候補は、武漢スパイクベースのブーストよりも、オミクロンを含む複数のSARS-CoV-2バリアントに対してより高い中和抗体力価を誘発することが示されました。
これに沿って、ベータ スパイクは、その VOC-NTD 機能に加えて、RBD のレベルでアルファ スパイクとオミクロン スパイクの両方に類似したコンフォメーション機能を示すことを観察しました。他のすべての VOC スパイクと比較して開口度が高いため、おそらく効率的な S1 エピトープ露出が可能になります。
したがって、我々はの HDX-MS 分析は、VOC のスパイクの構造生物学とダイナミクスへの洞察を提供し、次世代の SARS-CoV-2 ワクチンの研究をサポートします。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
