
非糖尿病患者の低血糖症の評価・原因疾患
糖尿病患者の低血糖はほとんどが薬剤性ですが、非糖尿病患者の低血糖は背景疾患が隠れている可能性があるので一度評価してみてもよいかもしれません。
EJE Review 2017(PMID: 28381450)、JCEM guidelines 2009(PMID: 19088155)より
【ポイント】
・Whippleの3徴を確認して低血糖症の診断を行う
・敗血症、飢餓状態、肝硬変、副腎不全、アルコール、薬剤性、胃手術歴などの明らかな原因がないか確認
・原因がはっきりしない場合は低血糖時に血漿のグルコース、インスリン、Cペプチド、プロインスリン、β-ヒドロキシ酪酸を測定する(施設で測定可能なもの)
・内因性高インスリン性低血糖症と判明すれば、インスリン抗体陰性を確認してインスリノーマの局在診断を行う
総論
<低血糖症の診断>
・低血糖の症状は自律神経症状と神経糖低下症状に分けられる
○自律神経症状
・血漿グルコース濃度 約60mg/dL以下で出現する
・アドレナリン症状:動悸、頻脈、不安、振戦
・コリン作動性症状:発汗、熱感、吐き気、空腹感
○神経糖低下症状
・血漿グルコース濃度 約50mg/dL以下で出現する
・衰弱、行動の変化、視覚の変化、錯乱、構音障害、めまい/立ちくらみ、記憶喪失、無気力、発作、意識喪失/昏睡
・低血糖が長引くと脳死に至る
・これらの症状の存在は低血糖の存在を強く示唆するがいずれの症状も非特異的である
・Whippleの3徴を確認し、その症状が低血糖によるものかを確認することが重要
①低血糖に一致する臨床症状があること
②低血糖が疑われる時に血漿グルコース濃度が低いこと
③低血糖が是正された時に臨床症状が改善すること
・低血糖と食事の関係は、病因を決定する上では重要ではない
・これはインスリノーマの患者が空腹時、食後、または両方のタイミングで症状を来すことがあるため
<低血糖症のワークアップ>
・敗血症、飢餓状態、肝硬変、副腎不全、アルコール、薬剤性、胃手術歴などの明らかな原因がないか確認
・上記原因がなさそうであれば低血糖時に血漿のグルコース、インスリン、Cペプチド、プロインスリン、β-ヒドロキシ酪酸を測定する
・これらを測定した後にグルカゴン1mg静注し、低血糖の改善を確認する
「内因性高インスリン性低血糖症」の診断は、
血漿グルコース濃度<55mg/dL(3mmol/L)の時に、
・血漿インスリン濃度 ≧ 3.0μU/mL(18pmol/mL)(➔高インスリン血症)
・血漿Cペプチド ≧ 0.6ng/mL(0.2nmol/mL)(➔内因性インスリン)
・プロインスリン濃度 ≧ 5.0pmol/L (➔内因性インスリン)
・β-ヒドロキシ酪酸 < 2.7mmol/L (➔インスリン作用)
を満たすこと
※グルカゴン静注後の⊿血糖≧25mg/dL
➔インスリン(またはIGF2)作用による低血糖を示す
※内因性高インスリン性低血糖症が判明すればかなり特異的であり鑑別疾患はわずかになります!(インスリノーマ、インスリン自己免疫性低血糖症候群、NIPHS、肥満手術後低血糖、ダンピング症候群、経口血糖降下薬のうちどれか)
※施設によって出せる検査は限られているので全て検査する必要はないと思います
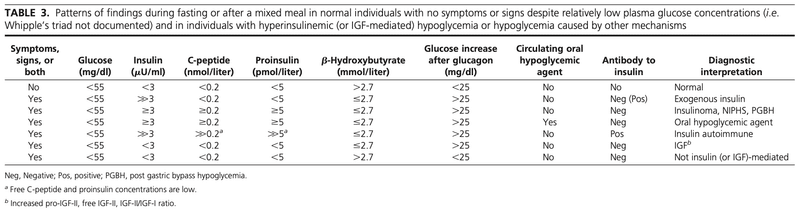
・低血糖の評価では、インスリン自己免疫性低血糖症候群と経口血糖降下薬による低血糖をそれぞれ除外するために、インスリン抗体の検査と低血糖時の経口血糖降下薬(インスリン分泌促進物質)をスクリーニングすることが不可欠である
・内因性高インスリン性低血糖症が確認され、経口血糖降下薬の内服がなく、抗インスリン抗体が陰性の患者はインスリノーマの局在診断を行う
・検査としては、CT、MRI、腹部エコー、内視鏡エコー
・必要に応じて選択的膵臓動脈カルシウム注射を行い肝静脈インスリンレベルの測定を行う
各論
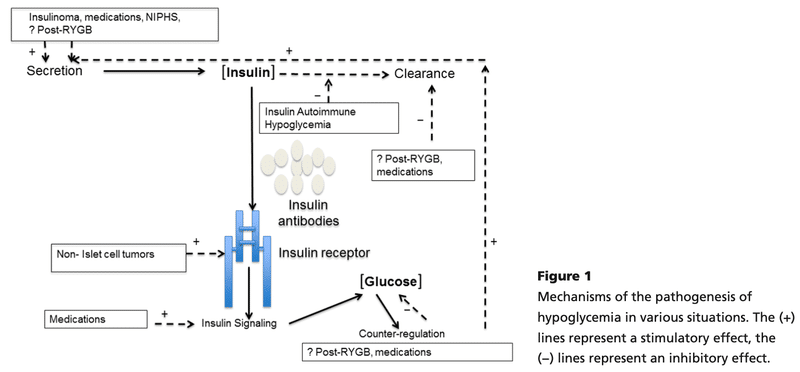
<インスリノーマ>
・インスリノーマは1927年に最初に報告された、膵臓の最も一般的な機能性神経内分泌腫瘍
・人口ベースの研究によると、100万人年あたり4人の発生率
・血漿グルコース濃度に対して不適切なインスリン濃度を伴う内因性高インスリン性低血糖症を特徴とする
・高インスリン性低血糖症を支持する生化学的所見が得られたら、局在診断を行う
・画像診断は、腫瘍の位置、広がりを特定し、転移の有無を評価するために不可欠
・非侵襲的画像診断には、CT、MRI、腹部超音波がある
・侵襲的検査としては、ソマトスタチン受容体シンチグラフィー、穿刺吸引を伴う内視鏡的膵臓超音波、経肝門脈サンプリング、選択的血管造影、選択的膵動脈カルシウム刺激がある
・最近では、68Ga-DOTA-exendin-4を用いたPET-CTがインスリノーマの位置を特定するために使用されている
・腫瘍摘出が可能であれば、腹腔鏡手術などの外科的治療が行われる
・外科治療の対象にならない患者では、ジアゾキシド、オクトレオチド、ランレオチドなどの長時間作用型ソマトスタチンアナログの使用、エタノールアブレーションが使用されてきた
<肥満手術後低血糖>
・Roux-en-Y胃バイパス術(RYGB)および幽門を迂回する、または上部消化管機能を変更する際の合併症
・RYBG法の低血糖の有病率は不明だが、患者の0.2~1%に発生すると推定されており、男性よりも女性に多い
・手術後の発生時期は様々だが、患者は通常食後に症状を呈する
<非インスリノーマ膵原性低血糖(NIPHS)>
・1999年にserviceらが報告した稀な疾患
・画像検査(エコー、CT、MRI、EUSなど)はすべて陰性となる
・胃バイパス術後の低血糖と間違われることがあるが、通常は手術歴はない
・したがって、NIPHSは胃バイパス術の既往がなく、内因性高インスリン性低血糖を示す患者で、局在画像診断が陰性である場合に考慮する
・低血糖は通常、食後に発生する
・外科標本では、nesidioblastosisの特徴を認める
・しかし、これらの患者では先天性骨軟化症に関する遺伝子変異(KCNJ11およびABCC8)は検出されなかった
・場合によっては、ジアゾキシドがNIPHSの管理に使用される
・症状が重度である場合や難治性である場合は、膵尾部切除術が推奨される治療となる
<インスリン自己免疫性低血糖症候群>
・1972年にHirataによって最初に報告された
・臨床的、生化学的にインスリノーマによる低血糖と類似した所見を示すが、抗インスリン抗体が存在し、血漿インスリン濃度は典型的には>1000pg/Lとなる
・アジア人や自己免疫疾患の患者に多いとされる
・HLA-DR4と関連があることが示されている
・これらの抗体の出現は、薬物やウイルスによって引き起こされる可能性がある
・抗体はインスリンとプロインスリンに結合する
・これにより、初期の高血糖がさらにインスリン分泌を促進させる
・ある時点で、抗体の結合能を超え、インスリンが遊離し、低血糖が引き起こされる
・低血糖の治療にはステロイドがよく使用される
・ステロイド抵抗性の場合は、アザチオプリン、6メルカプトプリン、リツキシマブ、血漿交換などの治療が行われてきた
・リツキシマブはインスリン抗体を減少させ、効果は3年間持続した
・過去の報告では、膵臓手術もある
<薬剤性低血糖>
・インスリンやインスリン分泌促進薬は、低血糖を引き起こす最も一般的な薬剤
・高血糖の治療として使用されない薬剤も低血糖の原因となり、キニーネ、ジソピラミド、サリチル酸塩、ペンタミジン、プロプラノロールなどの非選択的βブロッカー
・最近のシステマティックレビューによると、糖尿病治療薬以外では、キノロン、ペンタミジン、キニーネ、βブロッカー、ACEi、IGFが低血糖を引き起こす最も一般的な薬剤であった
・しかし、これらの薬剤と低血糖との関連を支持するエビデンスは中等度〜非常に低いというものだった
・薬剤性低血糖の素因となるものは、制限された食物へのアクセス、年齢、肝疾患、腎疾患
・リスクのある薬剤を肝疾患、腎疾患のある患者に処方する際には注意が必要
・ポリファーマシーは薬剤性低血糖のリスク因子となる
・アルコールは低血糖を引き起こすとともに薬剤性低血糖のリスク因子となる
<非膵島細胞腫瘍>
・まれに腫瘍随伴症候群として良性または悪性腫瘍の患者に再発性低血糖を来す場合がある
・これらの腫瘍は、高分子IGF2(Big IGF2)を発現する
・これはIGF2の不完全な翻訳後前駆体
・IGF2はインスリンと構造式が似ており、インスリン受容体を刺激する
・そのようなBig IGF2はインスリン受容体とIGF受容体に結合し、肝臓からのグルコース産生が低下し、筋肉および末梢組織における体循環からのグルコースの取り込みが増加し、結果的に低血糖となる
・非膵島細胞腫瘍による低血糖は、通常、低インスリン、低C-ペプチドレベル、および抑制されたβヒドロキシ酪酸を伴う低血糖で特徴づけられる
・成長ホルモン、IGF1、IGFBP3も低い
・Big IGF2のインスリン様作用によりグリコーゲン分解が阻害されるため、グルカゴンに対する正常な反応を示す
・Big IGF2濃度は高く、IGF2 / IGF1 > 10は診断となる
・可能であれば腫瘍の完全摘出が治癒的である
・腫瘍の完全切除が困難な場合は、投薬が行われる場合もある
・ダイアクソジド、ソマトスタチンアナログ、グルココルチコイド、成長ホルモン、イマチニブなどの治療報告がある
<敗血症と低血糖>
・重症患者では、グリコーゲン貯蔵量の減少、糖新生障害、末梢グルコースの利用亢進が低血糖の素因となる
・重症であることは身体ストレスを増大させる
・敗血症または様々な原因による血小板減少は、副腎不全を引き起こす両側副腎出血or梗塞を来すリスクがある
・重症患者での低血糖は、死亡率増加と関連するため見つけて治療する必要がある
<副腎不全による低血糖>
・コルチゾールは、低血糖から保護する逆調整メカニズムにおいて重要な役割を果たす
・インスリン伝達を阻害し、糖新生、脂肪分解、ケトン産生、タンパク質分解を促進させ、グルコース利用を減少させる
・原発性副腎不全の最も一般的な原因は自己免疫疾患であるが、発展途上国では結核などの感染症が重要な原因となっている
・原発性副腎不全の他の原因には、副腎出血や梗塞もある
・低血糖は二次性副腎不全の患者に多く見られ、治療には1日2~3回に分割された経口コルチコステロイドの生理的容量での補充が行われる
・副腎クリーゼの場合には、高用量の静注ハイドロコルチゾンが投与される
<人工的な低血糖>
・人工的な低血糖は証明することが困難な場合があり、経口血糖降下薬へのアクセスを証明する詳細な病歴が必要
・理想的には、低血糖時の薬物スクリーニングを行うことが必要
・人工的な低血糖は通常、インスリンまたはスルホニルウレア、グリニド系などインスリン分泌促進薬の不適切使用によるもの
・高齢者の場合は、パートナーの経口血糖降下薬の不注意による使用や管理ミスが原因のこともある
その他Reviewで挙げられていなかった原因としては、
・アルコール
・肝硬変
・飢餓状態
・ダンピング症候群
<コメント>
・稀な疾患が多いですが、明らかな原因の見当たらない繰り返す低血糖を見た際は評価をしてみてください
この記事が気に入ったらサポートをしてみませんか?
