脳内に入るためのキーです。 炭素ベースのナノ材料は、薬物が中枢神経系に到達するのを容易にする可能性がある。
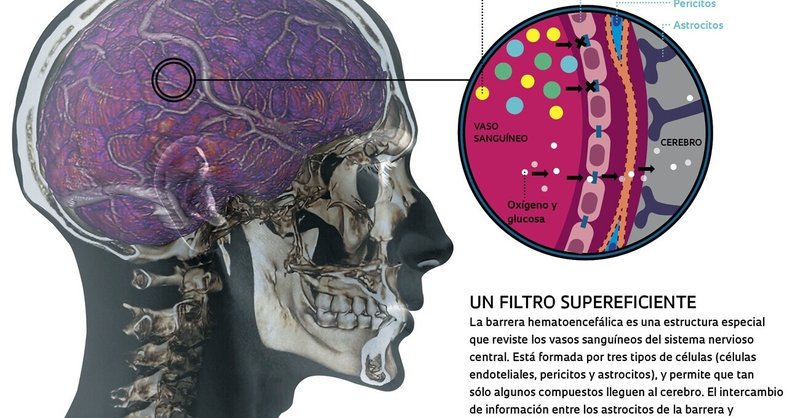
脳に薬を入れるのは簡単ではありません。中枢神経系に供給される血管は、3種類の細胞で構成された特殊な構造をしており、これらの細胞が一緒になって非常に選択的なフィルターとして機能しています。血液脳関門と呼ばれるこの構造は、栄養素、ホルモン、ガスなど、脳の機能を正常に保つために必要な特定の化合物のみを通過させます。この選択性により、血液中に含まれる毒性分子から中枢神経系を保護するとともに、経口摂取した薬剤や血中に注射した薬剤が、必要な場合でも脳に到達しないようになっている。カンピーナス大学(Unicamp)では、生物学者のマリア・アリス・ダ・クルス-ヘフリングが率いるグループが、炭素原子でできたナノ構造の化合物である還元型酸化グラフェンを使ってこのバリアを開き、現在使用されている化合物による副作用を抑えながら特定の薬剤を脳に到達させる可能性を検証している。
還元型酸化グラフェンの初期テストでは、有望な結果が得られました。細胞や動物を使った実験によると、この化合物は一時的にバリアーを開き、テストされた用量では身体に無害であるようです。「グラフェンは優れた電気伝導体であり、神経細胞は電気的インパルスによって相互に連絡を取り合っているため、グラフェン系のナノ材料は神経系と相互作用する可能性があると考え、この化合物を使用しました」と薬剤師・生化学者は説明する。と説明するのは、UnicampのInstitute of Biologyでポスドクとしてインターンシップを行っている研究者で、2015年と2016年にJournal of NanobiotechnologyとMolecular Pharmaceutics誌に掲載されたこれらの成果を記述した論文の筆頭著者である薬剤師・生化学者のMonique Mendonça氏です。
炭素原子が正六角形に配列された単層のグラフェンは、鋼鉄の200倍の強度を持ち、最も優れた電気伝導体の一つである。しかし、純粋なグラフェンは水に溶けにくいため、生物学的な応用には限界がある。一方、還元型グラフェンオキサイドは水に希釈され、素材と同様の電気的特性を維持する。
メンドンサは、2013年にユニカンプ大学電気工学・コンピュータサイエンス学部(FEEC)のナノエンジニアリング・ダイヤモンド研究室の研究者との講演で還元型酸化グラフェンを知り、その障壁を突破する可能性を評価することにした。「FEECの研究員であるHerder Ceragioliは、「この材料の製造プロセスを改良して、中間的な化学プロセスを必要とせずに合成し、その純度を約99%まで高めました。科学文献に記載されている製造方法では、毒性のある不純物(鉄、タングステン、ニッケルの原子)が残ることが多い。理論的な予測によると、還元されたグラフェン酸化物の純度が高ければ高いほど、生体組織へのダメージのリスクは低くなる。
実験では、酸化グラフェンをラットの血流に注入し、体内を追跡できる技術を用いて、1時間後には海馬や視床などの脳構造に浸透していることを確認しました。その結果、血管を覆う細胞を束ねるタンパク質の量が減少したことから、還元された酸化グラフェンがバリアーを構成する細胞の間にスペースを作り、バリアーを開いたと結論づけました。さらにMendonçaは、化合物を接種してから数時間後に、バリアが再び閉じてしまうことに気づいた。現在、ユニカンプ社のグループは、このバリアーを開くために細胞内で活性化される可能性のある生化学的メカニズムを調査している。

保存された神経細胞
塗布してから7日後には、ほとんどの化合物がすでに体外に排出されていたことから、化合物が蓄積して細胞に毒性を及ぼすことはないと考えられます。さらにテストを行ったところ、治療を受けたネズミには神経細胞の死が見られず、脳の形態も損なわれていませんでした。また、血液細胞や肝臓、腎臓などの臓器への影響もありませんでした。さらに、還元型酸化グラフェンは、医師が血液脳関門を開くために使用するマンニトールなどの化合物よりも優れているようです。
「還元型酸化グラフェンは、中枢神経系の体液の流れを変え、神経細胞を損傷しやすくし、腎臓の機能を変化させる可能性のあるマンニトールよりも安全である可能性があります」と、ユニカンプ大学医療科学部(FCM)の医師であるLicio Velloso氏は述べています。Velloso氏は現在、バリアーの透過性を変化させる生体の変化を研究しており、この機能を果たすための有望な候補として還元型酸化グラフェンを挙げている。「しかし、「ナノ粒子の薬理学的利用はまだ初期段階にあり、長期的な副作用を引き起こすかどうかを検証するためには、さらなる研究が必要です」と語る。
「Da Cruz-Höflingは、20年前にPhoneutria属のクモ(Brazilian wandering spiderまたはbanana spider)の毒の効果を研究していたときに、血液脳関門を通過する方法の研究を始めたという。「このクモに噛まれた人に神経毒の症状が出たので、毒がバリアーを越えているのではないかと思ったのです」と彼女は振り返る。その後、研究者は低用量でもラットでバリアが開くことを発見しました。この効果をもたらす毒の成分を分離することは困難であったため、他の化合物を試してみた。
明るい結果が得られたとはいえ、還元型グラフェンが臨床に使えるかどうかを判断するのは時期尚早だろう。その前に、人間にとって安全かどうか、また、実際に他の化合物をより効果的に脳に到達させることができるかどうかを評価する必要があります。
プロジェクト
El óxido de grafeno y el sistema nervioso central: Análisis de los efectos en la barrera hematoencefálica y perfil nanotoxicológico (nº 12/24782-5); Modalidad Beca Doctoral; Investigadora responsable Maria Alice da Cruz Höfling (Unicamp); Becaria Monique Culturato Padilha Mendonça; Inversión R$ 135.835,83 y R$ 31.276,24 (Bepe).
Artículos científicos
MENDONÇA, M. C. P. et al. PEGylation of reduced graphene oxide induces toxicity in cells of the blood-brain barrier: An in Vitro and in Vivo Study. Molecular Pharmaceutics. v. 13 (11). 18 oct. 2016.
MENDONÇA, M. C. P. et al. Reduced graphene oxide: Nanotoxicological profile in rats. Journal of Nanobiotechnology. v. 14 (53). 24 jun. 2016.
MENDONÇA, M. C. P. et al. Reduced graphene oxide induces transient blood-brain barrier opening: An in vivo study. Journal of Nanobiotechnology. v. 13 (78). 30 oct. 2015.
DE PAULA LE SUEUR, L. et al. Breakdown of the blood-brain barrier and neuropathological changes induced by Phoneutria nigriventer spider venom. Acta Neuropathologica. v. 105 (2), p. 125-34. feb. 2003.
この記事が気に入ったらサポートをしてみませんか?
