こんにちは。無理をしないで
こんにちは。少しづつフォローしてくださる人が増えてきました。ありがとうございます
興奮も熱狂も罵倒も必要ない。一般の皆様ひとりひとりに、静かに事実を理解してもらう、納得してもらう
厚労省コールセンター職員が突然、謎の自殺を遂げた。死の直前に「ワクチンは何回打てば死ぬか調査目的で打っている。実際の薬害死者は発表の10~100倍はいる」と内部告発していた。https://t.co/CajovJvQIj
— 【告発】新型ウイルスは国際規模の詐欺犯罪 (@5fake6info7leak) September 4, 2022
今もワクチンを推奨し続けている人たちは、推奨のプロ。大切なのはひとりひとりにワクチンの真実をお伝えすることです
明るい未来を目指して今日も充実した時間を過ごしましょう
ファイザー社広報より 10.13.2022
Pfizer and BioNTech Announce Positive Early Data From Clinical Trial of Omicron BA.4/BA.5-Adapted Bivalent Booster in Individuals 18 Years and Older リンク
ファイザーとバイオテック社広報より、同社のオミクロンBA.4/BA.5適応二価ワクチン(オリジナルとオミクロンBA.4/BA.5)の安全性と忍容性および免疫原性の評価を行っていたフェーズ 2/3 臨床試験(NCT05472038)からの初期のデータが発表された
18歳以上を対象とした。18歳から55歳の個人と55歳以上の個人で同様の反応が認められた(各年齢群で40人)
30μgブースター投与7日後に採取した血清では、オミクロンBA.4/BA.5中和抗体反応がブースター前よりも大幅に増加した
初期データではオリジナルワクチンと同様の安全性プロファイルを示し、忍容性が良好であった
オミクロンBA.4/BA.5適応二価ワクチンブースターの投与後1カ月における反応を測定した追加データが今後数週間のうちに得られる見込みである
言い換えると、これらの初期データは、同社の二価ワクチンが、現在流行している変異型OmicronサブラインBA.4およびBA.5に対して、オリジナルのワクチンよりも中和抗体反応が大幅に増加、つまり優れた防御力を発揮し、この冬の患者数の急増を抑制するのに役立つ可能性があることを示唆していると ブーラCEOと、BioNTechのCEO兼共同創業者であるUgur Sahin教授(医学博士)が述べた
免疫原性は、SARS-CoV-2生ウイルス蛍光焦点減少中和試験(FFRNT)アッセイを用いて評価された
55歳以上の参加者(各年齢層40名)から2回目のブースター投与7日後に血清を採取し、SARS-CoV-2の野生型スパイクタンパク質をコードするBNT162b2を過去3回投与され、BNT162b2 Wild-Typeで2度目のブースターを受けた55歳以上の参加者の7日後血清と比較した
また、若年者と高齢者の二価ワクチン反応を比較するため、オミクロンBA.4/BA.5適応の二価ブースターを接種した18歳から55歳の参加者(n=40)の二回目接種後7日目に血清を採取した
2価ワクチン接種者の3回目と4回目の接種間隔は約11カ月であったのに対し、オリジナルワクチン接種者は約6カ月であった。この差にもかかわらず、ベースラインの中和抗体反応は、各群で概ね同様でした。参加者のうち、SARS-CoV-2の既往または現病歴がある人とない人では、ベースラインで各グループに等しく層別化されていた
オミクロンBA.4/BA.5二価ワクチンブースターの投与後1カ月における反応を測定した追加データは、今後数週間のうちに発表される予定である。これらのデータは、両社のオミクロンBA.4/BA.5適応の二価ワクチンCOVID-19の完全認可および国際登録の可能性をサポートするために使用される。さらに、両社は、6カ月から11歳までの小児を対象にオミクロンBA.4/BA.5適応2価ワクチンを検討する同様のフェーズ1/2/3試験(NCT05543616)を開始した
オミクロンBA.4/BA.5適応二価ワクチン30μgブースター用量は、米国食品医薬品局(FDA)により12歳以上への緊急使用が承認された
また、EUでは、欧州医薬品庁(EMA)より同年齢層への販売が承認されている
バイオテック社のCOVID-19ワクチン(COMIRNATY®)は、バイオテック社独自のmRNA技術に基づき、バイオテック社とファイザー社が共同で開発したワクチンである
BioNTech社は、BNT162b2野生型およびBNT162b2二価(WT/OMI BA.4/BA.5) の米国、欧州連合、英国、カナダなどにおける販売認可、および米国(Pfizer社と共同)などにおける緊急使用認可または同等物の保持者である
なお、緊急時使用許可等を取得した国々においては、今後、承認申請等を行う予定である
フェーズ2/3試験について
この多施設共同無作為化比較第2/3相試験(NCT05472038)には、米国で12歳以上の健康なボランティアで、公認COVID-19ワクチンを少なくとも3回接種した人が約900人登録されている。試験中、18歳以上の参加者はファイザーとバイオンテックのオミクロンBA.4/BA.5適応のCOVID-19ワクチンの30μgまたは60μgブースター投与を受け、12歳から17歳の参加者は同じワクチンの30μgブースターを受けた。なお、全世界での承認・登録の可能性を検討するため、以前に4回目の接種を受けたオリジナルワクチンによる対照群との比較も行われる予定である
ファイザー社広報より 10.12.2022
Pfizer and BioNTech Receive U.S. FDA Emergency Use Authorization for Omicron BA.4/BA.5-Adapted Bivalent COVID-19 Vaccine Booster in Children 5 Through 11 Years of Age
ファイザーとバイオテック、「オミクロンBA.4/BA.5適応二価ワクチンCOVID-19ブースター」の5~11歳児への緊急使用承認を米国FDAより取得
ファイザー(NYSE:PFE)とバイオテックSE(Nasdaq:BNTX)は10月12日、米国食品医薬品局(FDA)が5~11歳の子どもを対象にオミクロン BA.4/BA.5 対応二価 COVID-19 ワクチンのブースター用量 10 µg を緊急使用承認(EUA)に認定したことを発表した
米国疾病管理予防センター(CDC)の勧告を待って、10μgの用量は直ちに出荷される予定である
5歳から11歳の小児用二価ワクチンCOVID-19の承認は、ファイザーとバイオンテックの30μgオミクロンBA.1適応二価ワクチンの安全性および免疫原性データ、両社の10μgオミクロンBA.4/BA.5適応二価ワクチンの非臨床および製造データ、30μgオミクロンBA.4/BA.5適応二価ワクチンの前臨床データに基づいて行われる
第2/3相試験の臨床データでは、ファイザーとバイオインテックの30μgオミクロンBA.1適応二価ワクチンのブースター投与により、両社のオリジナルのCOVID-19ワクチンと比較してオミクロンBA.1亜種に対する優れた免疫反応が得られ、安全性プロファイルは良好であることが示された
また、前臨床試験において、30μgのBA.4/BA.5適応型二価ワクチンのブースター投与により、オリジナルのウイルスと同様にオミクロンBA.1、BA.2、BA.4、BA.5亜種に対して強い中和抗体反応が得られることが示された
両社は、米国政府との既存の供給契約に基づき、オリジナルワクチンと二価ワクチンを供給する予定である
5歳から11歳までの個人に対するブースター接種は、CDCが推奨する可能性があることを確認した後に開始される予定である
米国政府はCOVID-19ワクチンの無償提供を約束しており、米国居住者は引き続き無償で本ワクチンを接種することができる
BA.4/BA.5適応の二価COVID-19ワクチンの10μgブースター用量をこの年齢層に含めるよう、欧州医薬品庁(EMA)に申請している
今後数週間のうちに、世界各国の規制当局に同様の申請を行う予定である
現在、オミクロンBA.4/BA.5適応二価ワクチンCOVID-19の異なる投与レジメンと投与量を年齢層を超えて評価するための第1/2/3相小児試験が進行中である
「ファイザー会長兼最高経営責任者(CEO)のアルバート・ブルラは、次のように述べている。「全米の家族が秋の行事に参加し、来るホリデーシーズンの計画を立てる中、学齢期の子供たちに、米国での感染者の80%以上を占め続けているオミクロンBA.4/BA.5亜型に対するさらなる防御を提供することが目的です。このニーズを見越して、当社は数百万回分のブースター用量を製造し、CDCの勧告を待って、家族がCOVID-19の予防接種を最新の状態に保つことができるようにする予定です。
「BioNTechのCEO兼共同創設者であるUgur Sahin教授(医学博士)は、「このマイルストーンは、より多くの人々に変種適応型ワクチンへのアクセスを提供できるようになるために重要です。「さらに、BA.4およびBA.5亜種をベースにした適応ワクチンを6カ月から11歳までの小児で評価する臨床試験を開始し、すべての年齢層にオミクロンの亜種および亜種に対する予防接種の機会を提供することを目指します。"
ファイザー社広報より 9.28.2022
Pfizer and BioNTech Complete Submission to European Medicines Agency for Omicron BA.4/BA.5-Adapted Bivalent Vaccine Booster in Children 5 Through 11 Years of Age
ファイザーとバイオテック、「オミクロンBA.4/BA.5適応二価ワクチンブースター」の5~11歳児への投与について欧州医薬品審査庁への申請を完了
ファイザー(NYSE: PFE)とバイオテック(Nasdaq: BNTX)は9月28日、両社のオミクロンBA.4/BA.5適応二価ワクチンCOVID-19の10μgブースター用量を5~11歳の子ども向けに欧州医薬品庁(EMA)への申請を完了したと発表しました
本申請は、オミクロンBA.1適応二価ワクチンの安全性・免疫原性データ、オミクロンBA.4/BA.5適応二価ワクチン10μgの非臨床・製造データ、オミクロンBA.4/BA.5適応二価ワクチンの前臨床データに基づいて、この年齢群にオミクロンを追加するための製造販売承認の変更を申請するものであり、オミクロン BA.4/BA.5 適応の二価ワクチンについては、本臨床試験で得られたデータに基づいている
また、9月26日には、米国食品医薬品局(FDA)に、5歳から11歳の小児を対象としたオミクロンBA.4/BA.5適応二価ワクチンCOVID-19のブースター投与に関する緊急使用承認(EUA)を申請している
また、両社は、6カ月から11歳までの小児を対象に、両社のオミクロンBA.4/BA.5適応二価ワクチンについて、異なる用量および投与レジメンの安全性、忍容性および免疫原性を評価するフェーズ1/2/3試験(NCT05543616、C4591048)も開始した。本試験は、規制当局のガイダンスに沿ったものであり、この年齢層における予防のさらなる選択肢を評価するための前回のPhase1/2/3試験のデザインに沿ったものである
Bivalent SARS-CoV-2 mRNA vaccines increase breadth of neutralization and protect against the BA.5 Omicron variant
二価のSARS-CoV-2 mRNAワクチンは、中和の幅を広げ、BA.5 Omicron変異体に対しても防御する
Posted September 13, 2022.
doi: https://doi.org/10.1101/2022.09.12.507614
ABSTRACT
SARS-CoV-2は、抗体中和を回避できるスパイク蛋白に多数の置換を持つオミクロン系統の変種が出現したため、ワクチン効果が低下し、感染が持続するようになった
ワクチン誘導免疫を拡大する戦略の一つとして、野生型と新たに出現した変異株のスパイクタンパク質をコード化した二価ワクチンを投与することが挙げられる
今回,Wuhan-1とBA.1(mRNA-1273.214)またはBA.4/5(mRNA-1273.222)スパイクタンパク質をコードする2つのmRNAを含む2価ワクチンの免疫原性と保護効果を評価した
BALB/c マウスに一次接種したところ、いずれの二価ワクチンも構成する一価ワクチン(mRNA-1273 [Wuhan-1], mRNA-1273.529 [BA.1], mRNA-1273-045 [BA.4/5] )より幅広い中和抗体反応を誘導しました
また,K18-hACE2遺伝子改変マウスにmRNA-1273を接種後7カ月でブースターとして投与したところ,mRNA-1273ブースターと比較して,2価ワクチンでは中和抗体の幅と大きさが大きくなった.
さらに、二価ワクチンブースターマウスにおける反応は、BA.5感染および肺の炎症に対する防御力の増加と関連していた
したがって、二価のオミクロンベースのmRNA-1273.214またはmRNA-1273.222ワクチンによるブーストは、現在流通しているSARS-CoV-2株に対する免疫原性と防御を強化するものである
RESULTS
Preclinical bivalent Omicron-targeted mRNA vaccines induce robust antibody responses in BALB/c mice
Immunization with bivalent vaccines that include components targeting an Omicron spike and the original Wuhan-1 spikes could confer broader immunity. To begin to address this question, we generated two lipid-encapsulated (LNP) mRNA vaccines (mRNA-1273.529 and mRNA-1273.045) encoding a proline-stabilized SARS-CoV-2 spike from BA.1 and BA.4/5 viruses, respectively. The mRNA-LNPs then were combined with mRNA-1273 in a 1:1 ratio to generate bench-side mixed versions of mRNA-1273.214 and mRNA-1273.222. As a first test of their activity, we immunized BALB/c mice twice at a 3-week interval with 1 μg (total dose) of preclinical versions of mRNA-1273, mRNA-1273.529, mRNA-1273.045, mRNA-1273.214 or mRNA-1273.222 vaccines (Fig 1A). Three weeks after the first dose (day 21) and two weeks after the second dose (day 35), serum was analyzed for binding to Wuhan-1 (S2P), BA.1 (S2P.529), and BA.4/5 (S2P.045) spike proteins by ELISA (Fig 1B).
前臨床段階の二価オミクロン標的mRNAワクチンは、BALB/cマウスで強固な抗体反応を誘導する
オミクロンスパイクとオリジナルのWuhan-1スパイクを標的とした成分を含む二価ワクチンを接種することで、より広範な免疫力が得られる可能性があります
この疑問に答えるため、BA.1およびBA.4/5ウイルスのプロリン安定化SARS-CoV-2スパイクをそれぞれコードする2種類の脂質カプセル化(LNP)mRNAワクチン(mRNA-1273.529およびmRNA-1273.045)を作製した
The mRNA-LNPs then were combined with mRNA-1273 in a 1:1 ratio to generate bench-side mixed versions of mRNA-1273.214 and mRNA-1273.222.
その活性の最初のテストとして、BALB/c マウスに前臨床版の mRNA-1273、mRNA-1273.529、mRNA-1273.045、mRNA-1273.214 または mRNA-1273.222 ワクチン 1 μg(合計量)を 3 週間の間隔で 2 回免疫した(図 1A)。最初の投与の3週間後(21日目)および2回目の投与の2週間後(35日目)に、血清を、ELISAによってWuhan-1(S2P)、BA.1(S2P.529)およびBA.4/5(S2P.045)スパイクタンパク質への結合について分析した(図1B)
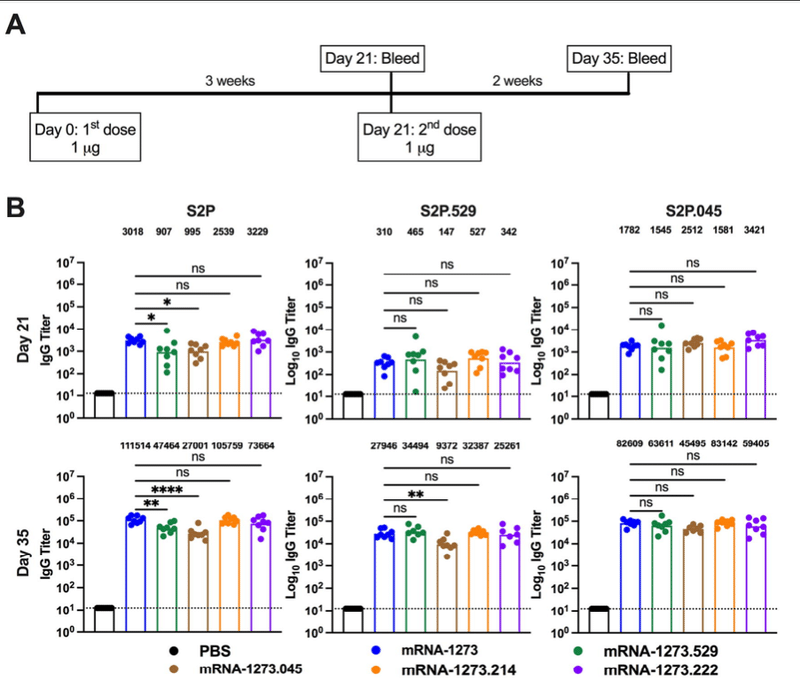
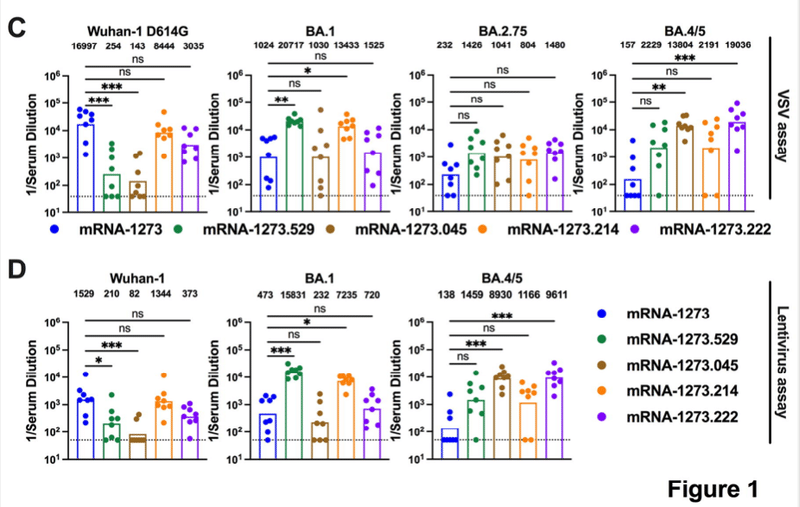
Figure 1. Robust antibody responses in BALB/c mice after a primary immunization series with preclinical versions of monovalent and bivalent mRNA vaccines.Six-to-eight-week-old female BALB/c mice were immunized twice over a three-week interval with PBS or 1 μg total dose of preclinical versions of mRNA-1273 [Wuhan-1 spike], mRNA-1273.529 [BA.1 spike], mRNA-1273.045 [BA.4/5 spike], mRNA-1273.214 [benchside 1:1 mixture of mRNA-1273 + mRNA-1273.529], or mRNA-1273.222 [benchside 1:1 mixture of mRNA-1273 + mRNA-1273.045]. Immediately before (day 21) or two weeks after (day 35) the second vaccine dose, serum was collected. A. Scheme of immunization and blood draws. B. Serum antibody binding to Wuhan-1 (S2P), BA.1 (S2P.529), or BA.4/5 (S2P.045) spike proteins by ELISA at Day 21 and Day 35 (n = 8, boxes illustrate mean values, dotted lines show the limit of detection [LOD]). C. Neutralizing activity of serum at day 35 against VSV pseudoviruses displaying the spike proteins of Wuhan-1 D614G, BA.1, BA.2.75, or BA.4/5 (n = 8, boxes illustrate geometric mean values, dotted lines show the LOD). GMT values are indicated above the columns. D. Neutralizing activity of serum at day 35 against pseudotyped lentiviruses displaying the spike proteins of Wuhan-1, BA.1, or BA.4/5 (n = 8, boxes illustrate geometric mean values, dotted lines show the LOD). GMT values are indicated above the columns. Statistical analysis. B. One-way ANOVA with Dunnett’s post-test. C-D. Kruskal-Wallis with Dunn’s post-test (ns, not significant; * P < 0.05; ** P < 0.01; *** P < 0.001; **** P < 0.0001).
図1. 6~8週齢の雌性BALB/cマウスに、PBSまたは総量1μgの前臨床バージョンのmRNA-1273[Wuhan-1 spike],mRNA-1273.529[BA.1 スパイク]、mRNA-1273.045 [BA.4/5 スパイク]、mRNA-1273.214 [mRNA-1273 + mRNA-1273.529 のベンチサイド 1:1 混合]、または mRNA-1273.222 [mRNA-1273 + mRNA-1273.045 のベンチサイド 1:1 混合] の前臨床版を用いた。2回目のワクチン投与の直前(21日目)または2週間後(35日目)に、血清を採取した。A. 免疫化および採血のスキーム。B. 21日目および35日目のELISAによるWuhan-1 (S2P), BA.1 (S2P.529), または BA.4/5 (S2P.045) スパイクタンパク質への血清抗体結合 (n = 8, 箱は平均値、点線は検出限界 [LOD] を示す). C. Wuhan-1 D614G、BA.1、BA.2.75、またはBA.4/5のスパイクタンパク質を表示するVSV偽ウイルスに対する35日目の血清の中和活性(n = 8、ボックスは幾何平均値を示し、点線はLODを示す)。GMT値は列の上に表示されている。D. Wuhan-1、BA.1、またはBA.4/5のスパイクタンパク質を表示する偽タイプ化レンチウイルスに対する35日目の血清の中和活性(n = 8、ボックスは幾何平均値を示し、点線はLODを示す)。GMT値は列の上に示した。統計解析。B. 一元配置分散分析(Dunnettの事後検定あり)。C-D. Kruskal-Wallis with Dunn's post-test (ns, not significant; * P < 0.05; ** P < 0.01; *** P < 0.001; **** P < 0.0001).
Robust serum IgG binding was observed against S2P, S2P.529, and S2P.045 proteins after a two-dose primary series with monovalent mRNA-1273, mRNA-1273.529, and mRNA-1273.045 vaccines as well as bivalent mRNA-1273.214 and mRNA-1273.222 vaccines, compared to immunizing with PBS only. (a) S2P. On day 21, geometric mean titers (GMT) against S2P ranged from 907 to 3,229 and increased by approximately 23- to 52-fold on day 35, with values ranging from 27,001 to 111,514 across the vaccine groups (Fig 1B). On day 35, mice vaccinated with mRNA-1273, mRNA-1273.214, or mRNA-1273.222 achieved higher GMTs than mice vaccinated with mRNA-1273.529 or mRNA-1273.045 vaccines (b) S2P.529. Serum binding GMTs against S2P.529 at day 21 ranged from 147 to 527 and increased by approximately 61- to 90-fold on day 35, with values ranging from 9,372 to 34,494 across the vaccine groups (Fig 1B). There were no significant differences in binding titers against S2P.529 across most groups on day 35, although serum from mice vaccinated with mRNA-1273.045 showed reduced binding compared to mRNA-1273. (c) S2P.045. At day 21, serum IgG binding GMTs against S2P.045 ranged from 1,545 to 3,421 and increased by approximately 17- to 52-fold on day 35, with values ranging from 45,495 to 83,142 (Fig 1B). On day 35, robust IgG GMTs against S2P.045 were observed for all mRNA vaccinated groups with no substantive differences noted.
一価のmRNA-1273, mRNA-1273.529, mRNA-1273.045 ワクチンと二価のmRNA-1273.214, mRNA-1273.222 ワクチンを2回接種した後、PBS のみで免疫した場合と比較して、S2P, S2P.529, S2P.045 タンパクに対する堅牢な血清 IgG 結合が観察された。(a) S2P。21日目のS2Pに対する幾何平均力価(GMT)は907~3,229であり、35日目には約23~52倍に上昇し、ワクチン群全体で27,001~111,514の値となった(Fig.1B)。35日目には、mRNA-1273、mRNA-1273.214、またはmRNA-1273.222を接種したマウスは、mRNA-1273.529またはmRNA-1273.045ワクチンを接種したマウスより高いGMTを達成した(b) S2P.529. 21日目のS2P.529に対する血清結合GMTは147から527の範囲であり、35日目には約61から90倍に増加し、ワクチン群全体で9,372から34,494の値であった(図1B)。35日目のS2P.529に対する結合価にはほとんどの群で有意差はなかったが、mRNA-1273.045を接種したマウスの血清はmRNA-1273と比較して結合の減少を示した。(c) S2P.045. 21日目のS2P.045に対する血清IgG結合GMTは1,545から3,421の範囲であり、35日目に約17倍から52倍に増加し、値は45,495から83,142に及んだ(図1B)。35日目には、すべてのmRNAワクチン接種群でS2P.045に対する強固なIgG GMTが観察され、実質的な差は認められなかった
We next tested the inhibitory activity of serum antibodies from BALB/c mice that received two doses of the different preclinical mRNA vaccines using a vesicular stomatitis virus (VSV)-based neutralization assay with pseudovirusesdisplaying spike proteins of Wuhan-1 D614G, BA.1, BA.2.75, or BA.4/5 (Fig 1C and Extended Data Fig 1). Serum obtained at day 35 from mice vaccinated with mRNA-1273.222 or mRNA-1273.045 vaccines showed robust neutralizing antibody responses (GMT: 19,036 and 13,804, respectively) against BA.4/5. When compared to the neutralizing antibody response against Wuhan-1 D614G elicited by the mRNA-1273 vaccine (GMT: 16,997), the response against BA.4/5 elicited by mRNA-1273.222 vaccine was equivalent, if not slightly higher. Moreover, the neutralizing antibody response against Wuhan-1 D614G elicited by the mRNA-1273.222 vaccine was greater than that elicited by the mRNA-1273.045 vaccine (GMT: 3,035 and 143, respectively). As expected, serum from the mRNA-1273.214 and mRNA-1273.529 vaccine recipients robustly inhibited infection of BA.1 pseudoviruses, with slightly greater titers elicited by the mRNA-1273.529 vaccine (GMT: 13,433 and 20,717, respectively). However, the mRNA-1273.214 vaccine induced much greater serum neutralizing activity against Wuhan-1 D614G (GMT: 8,443) than the mRNA-1273.529 vaccine (GMT:196). The mRNA-1273 vaccine showed a robust response against Wuhan-1 D614G (GMT: 16,997), but less effective responses against BA.1 (GMT: 1,024), BA.2.75 (GMT: 232), or BA.4/5 (GMT:157). All of the Omicron-matched vaccines induced slightly greater (3.5 to 6.4-fold) neutralizing antibody responses than mRNA-1273 against BA.2.75, although these differences did not attain statistical significance.
次に、Wuhan-1 D614G, BA.1, BA.2.75, または BA.4/5 のスパイクタンパク質を表示した疑似ウイルスを用いた水疱性口内炎ウイルス (VSV) ベースの中和アッセイで、異なる前臨床 mRNA ワクチンを 2 度投与した BALB/c マウスの血清抗体の阻害活性を検証した (Fig 1C および拡張データ Figure 1).mRNA-1273.222またはmRNA-1273.045ワクチンを接種したマウスから35日目に得られた血清は、BA.4/5に対する強固な中和抗体反応(GMT:それぞれ19,036および13,804)を示した。mRNA-1273ワクチンで得られたWuhan-1 D614Gに対する中和抗体反応(GMT:16,997)と比較すると、mRNA-1273.222ワクチンで得られたBA.4/5に対する反応は若干高いものの、同等であることが分かりました。また,Wuhan-1 D614G に対する中和抗体反応は,mRNA-1273.222 ワクチンの方が mRNA-1273.045 ワクチンより大きかった(GMT:それぞれ 3,035 と 143).予想通り、mRNA-1273.214およびmRNA-1273.529ワクチン接種者の血清はBA.1疑似ウイルスの感染を強固に阻害し、mRNA-1273.529ワクチンの方がわずかに高い力価が得られた(GMT:それぞれ13,433および20,717)。しかし,Wuhan-1 D614Gに対する血清中和活性は,mRNA-1273.214ワクチン(GMT:8,443)がmRNA-1273.529ワクチン(GMT:196)よりはるかに大きかった.mRNA-1273ワクチンはWuhan-1 D614G(GMT:16,997)に対して強い反応を示したが、BA.1(GMT:1,024)、BA.2.75(GMT:232)、BA.4/5(GMT:157)に対してはあまり有効であった。BA.2.75に対しては,オミクロンに適合したすべてのワクチンがmRNA-1273よりもわずかに大きな(3.5~6.4倍)中和抗体反応を誘導したが,これらの差は統計的有意差には達しなかった.
We also evaluated serum neutralizing antibody capacity using a lentivirus-based pseudovirus assay with virions displaying Wuhan-1, BA.1, or BA.4/5 spike proteins. The neutralizing antibody responses measured with lentiviruses were similar to those obtained using VSV pseudoviruses (Fig 1D and Extended Data Fig 2). On day 35, mice immunized with the mRNA-1273.045 or mRNA-1273.222 vaccines had robust responses against BA.4/5 (GMT: 1,166 and 9,611, respectively), although the responses against Wuhan-1 and BA.1 were lower. Serum from animals immunized with mRNA-1273 vaccine efficiently neutralized Wuhan-1 (GMT: 1,529) but the responses against BA.1 and BA.4/5 were lower (GMT: 473 and 138, respectively). The mRNA-1273.529 and mRNA-1273.214 vaccines induced strong neutralizing antibody responses against BA.1 (GMT: 15,831 and 7,235, respectively) with less inhibitory activity against Wuhan-1 (GMT: 210 and 1,344, respectively) and BA.4/5 (GMT: 1,459 and 1,166, respectively). Overall, based on data from the VSV and lentivirus pseudovirus assays, both bivalent mRNA-1273.222 and mRNA-1273.214 vaccines offered the most neutralization breadth.
また、Wuhan-1、BA.1、またはBA.4/5スパイクタンパク質を表示したビリオンを用いて、レンチウイルスベースの偽ウイルスアッセイで血清中和抗体能力を評価した。レンチウイルスを用いて測定した中和抗体反応は、VSV疑似ウイルスを用いて得られたものと同様であった(図1DおよびExtended Data Fig 2)。35日目に、mRNA-1273.045またはmRNA-1273.222ワクチンで免疫したマウスは、Wuhan-1とBA.1に対する反応は低かったものの、BA.4/5(GMT:それぞれ1,166と9,611)に対して強い反応を示しました。mRNA-1273ワクチンを接種した動物の血清は、Wuhan-1を効率的に中和したが(GMT:1,529)、BA.1およびBA.4/5に対する反応は低かった(GMT:それぞれ、473および138)。mRNA-1273.529およびmRNA-1273.214ワクチンは、BA.1に対して強い中和抗体反応を誘導し(GMT:それぞれ15,831および7,235)、Wuhan-1(GMT:それぞれ210および1,344)およびBA.4/5(GMT:それぞれ1,459および1,166)に対しては阻害活性が低下していました。全体として、VSVおよびレンチウイルス偽ウイルスアッセイのデータに基づいて、二価のmRNA-1273.222およびmRNA-1273.214ワクチンの両方が最も中和幅を提供しました
Clinically representative versions of bivalent mRNA vaccines induce robust neutralizing antibody responses in BALB/c mice
We next evaluated the immunogenicity of clinically representative versions of mRNA-1273.214 and mRNA-1273.222, where two monovalent mRNAs were separately formulated into LNPs and then mixed in a 1:1 ratio in the vial, a process that is representative of the commercial drug product. These versions were compared to responses obtained with mRNA-1273. BALB/c mice were immunized twice at a 3-week interval with 1 μg (total dose) of mRNA-1273, mRNA-1273.214, or mRNA-1273.222 vaccines (Fig 2A). Two weeks after the second dose (day 35), serum was collected and analyzed for neutralizing activity using VSV-based pseudoviruses displaying Wuhan-1 D614G, BA.1, BA.2.75, or BA.4/5 spike proteins (Fig 2B and Extended Data Fig 3). Whereas mRNA-1273 induced a robust neutralizing antibody response against Wuhan-1 D614G (GMT: 28,920), 30 to 194-fold less activity was measured against pseudoviruses displaying BA.1, BA.2.75, and BA.4/5. The breadth of neutralizing activity seen with the bivalent mRNA-1273.214 vaccine was better, with the greatest responses against the matched BA.1 (GMT: 13,183) and 1.7 to 52-fold reductions against Wuhan-1 D614G, BA.2.75, and BA.4/5, with the lowest potency against BA.4/5 (GMT: 293). The mRNA-1273.222 vaccine achieved the broadest inhibitory activity with the highest neutralizing titers against the matched BA.4/5 (GMT: 15,561) and only 1.7 to 6.7-fold reductions in activity against Wuhan-1 D614G, BA.1, and BA.2.75.
二価のmRNAワクチンの臨床応用例でBALB/cマウスに強固な中和抗体反応を誘導
mRNA-1273.214とmRNA-1273.222は、2つの一価mRNAを別々にLNPに製剤化し、バイアル内で1:1の割合で混合するという、市販品に近い製法で免疫原性を評価したものである。これらのバージョンは、mRNA-1273で得られた反応と比較された。BALB/c マウスに、mRNA-1273、mRNA-1273.214、または mRNA-1273.222 のワクチン 1μg(総量)を 3 週間の間隔で 2 回免疫した(図 2A)。2回目の投与から2週間後(35日目)に血清を採取し、Wuhan-1 D614G, BA.1, BA.2.75, または BA.4/5 スパイクタンパク質を表示する VSV ベース疑似ウイルスで中和活性を分析した(図 2B および拡張データ図 3)。mRNA-1273はWuhan-1 D614G(GMT:28,920)に対して強固な中和抗体反応を誘導したが、BA.1, BA.2.75, BA.4/5を持つ偽ウイルスに対しては30~194倍の中和活性が測定された。二価のmRNA-1273.214ワクチンで見られた中和活性の幅はより良好で、一致するBA.1に対して最大の反応(GMT:13,183)、Wuhan-1 D614G, BA.2.75, BA.4/5 に対して 1.7 ~ 52倍の減少、 BA.4/5 に対して最も低い効力(GMT:293)であった。mRNA-1273.222ワクチンは,一致するBA.4/5に対して最も高い中和価(GMT:15,561)で最も広い阻害活性を示し,Wuhan-1 D614G,BA.1,BA.2.75に対しては1.7~6.7倍の活性低下のみであった
Figure 2. Robust neutralizing antibody responses in BALB/c mice after primary series immunization with clinically representative versions of mRNA-1273, mRNA-1273.214, and mRNA-1273.222.Six-to-eight-week-old female BALB/c mice were immunized twice over a three-week interval with PBS or 1 μg total dose of clinically representative versions of mRNA-1273, mRNA-1273.214 [1::1 mixture in the vial of separately formulated mRNA-1273 and mRNA-1273.529], or mRNA-1273.222 [1:1 mixture in the vial of separately formulated mRNA-1273 and mRNA-1273.045]. Immediately before (day 21) or two weeks after (day 35) the second vaccine dose, serum was collected. A. Scheme of immunization and blood draws. B. Neutralizing activity of serum at day 35 against VSV pseudoviruses displaying the spike proteins of Wuhan-1 D614G, BA.1, BA.2.75, or BA.4/5 (n = 16, boxes illustrate geometric mean values, dotted lines show the LOD). GMT values are indicated above the columns. Statistical analysis. Kruskal-Wallis with Dunn’s post-test (ns, not significant; ** P < 0.01; **** P < 0.0001).
この記事が気に入ったらサポートをしてみませんか?
