新しいオミクロン変異株 XBB、CH.1.1 の治療
オミクロン変異株 BQ.1.1 と XBBが優勢になった頃の説明です
現在、新型コロナウイルスによる死亡が急増しているアメリカ、フランスなどはオミクロン変異株BQ.1.1 の影響です。アジアで死者が多い香港、インドネシアは組み替え変異株のXBB の影響です

BQ.1.1は既に日本でもある程度の流行が見られています
BQ.1.1 やXBB に感染した場合の治療法はあるのか?
BQ.1.1 とXBBへの 抗体医薬と抗ウイルス薬の効果 を実験で調べた結果
In vitro 試験管内実験の結果が東大医科研 河岡先生のラボから12月7日にNew Engl J Med に報告されました
論文 タイトル Efficacy of Antiviral Agents against Omicron Subvariants BQ.1.1 and XBB
原著リンク ブログ対訳リンク

*米国の動向
米国FDAは11月30日に、ベブテロビマブが米国全域で緊急使用の承認がされていないと発表しました (リンク)。全米各地域でBQ.1 および BQ.1.1 が 50% 以上の流行のシェアを超え、この系統にベブテロビマブが無効であるためです
ベブテロビマブはイーライリリーの抗体医薬で、日本未承認です
以下
詳細な説明になります
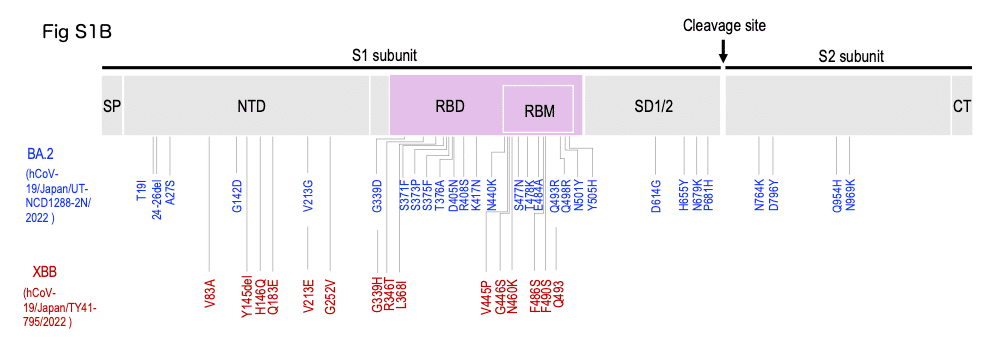
BQ.1.1 とXBB に見られた変異の図
抗体医薬が無効になったBQ.1.1 とXBB のスパイク蛋白に入った変異は、BQ.1.1 は R346T、K444T、N460K です (下図)

XBBはBA.2 系統で BJ.1 と BM.1.1.1 のリコンビナントです (下図)

XBB の 結合部位 RBD に入った新しい変異は G339H, R346T, L368I, V445P, G446S, N460K, F486S, F490S です。Q493 は野生型に戻る変異です (下図)
抗ウイルス薬による増殖抑制効果

実際に ウイルスの増殖阻害に必要な抗ウイルス薬の濃度は下表になります。有効性に変化はありませんでした

*レムデシビル (ベルクリー) の作用機構 [点滴投与]
レムデシビルは、COVID-19 の患者を治療するための最初のFDA承認薬です
レムデシビルはヌクレオシド類似体で、その取り込みが伸長を終わらせず、さらに3つのヌクレオチドを追加した後にのみRdRpを失速させます
このため、コロナウイルスの持つエキソヌクレアーゼ校正を回避することができます
レムデシビルの有効性などは別の記事でお知らせします
CH.1.1とBA.2.75への 抗体医薬と抗ウイルス薬の効果 を実験で調べた結果
2023年2月の時点で米国ではXBB.1.5が優勢であり、英国ではCH.1.1(BA.2.75の子孫)が急速に流行しています
CH.1.1に対する抗体医薬と抗ウイルス薬および各種コホート血清の効果をIn vitro 試験管内実験で調べた結果が東大医科研 河岡先生のラボから2023年5月23日にLancet Infect. Dis. に報告されました
論文2. タイトル Efficacy of antivirals and bivalent mRNA vaccines against SARS-CoV-2 isolate CH.1.1.
原著リンク ブログ対訳リンク
CH.1.1 に見られた変異の図
CH.1.1はBA.2.75と比較して、SARS-CoV-2に対するワクチンや治療用モノクローナル抗体の主要抗原であるスパイクタンパク質の受容体結合ドメインに、さらに4つの置換(R346T、K444T、L452R、F486S)がある


抗体によるCH.1.1分離株の中和
試験したモノクローナル抗体((REGN10987[imdevimab]、REGN10933[casirivimab]、COV2-2196[tixagevimab]、COV2-2130[cilgavimab]、S309[sotrovimabの前駆体]、およびLY-CoV1404[bebtelovimab])は、Vero E6-TMPRSS2-T2A-ACE2細胞で試験した最も高いFRNT50値(50,000 ng/mL以上)でも、CH.1.1分離株を中和しませんでした。REGN10987を除くこれらの抗体はすべてBA.2.75を中和しました。BA.2.75はCH.1.1とSタンパク質のアミノ酸が4つ異なるので、これらのアミノ酸置換がCH.1.1に対するモノクローナル抗体の中和活性の低下に寄与していると推測されます。ただし、in vitroでの中和活性は抗体の有効性に関する洞察を与えますが、抗体依存性細胞細胞傷害性などの抗体の他の機能的活性のため、ヒトにおける抗体の防御能を必ずしも反映しない可能性があります。したがって、臨床現場でこのオミクロン変異体に対する抗体の治療効果を評価するには追加の研究が必要です


抗ウイルス薬によるCH.1.1分離株の増殖抑制効果
CH.1.1 分離株には、RdRp に 1 つの置換 (P3395H) と、メインプロテアーゼに 2 つの置換 (P314L および G662S) があります (図S1B)。これらは、抗ウイルス薬に対する感受性が高い BA.2.75 および XBB 変異体にも存在します。 これら 4 つの抗ウイルス薬に対する CH.1.1 の感受性は、祖先株の感受性と類似していました (つまり、レムデシビル、モルヌピラビル、ニルマトレルビル、およびエンシトレルビルの IC50 値は要因によって異なりました)。 それぞれ 0.7、1.3、0.7、および 0.4、付録 p 7)。 これらの結果は、レムデシビル、モルヌピラビル、ニルマトレルビル、およびエンシトレルビルが試験管内で CH.1.1 に対して有効であることを示唆しています。

CH.1.1分離株に対する3つの異なるコホートの血漿の中和能
最後にCH.1.1分離株に対する3つの異なるコホートの血漿の中和能を評価されました
(1) 一価のmRNAワクチンBNT162b2(ファイザー・バイオンテック)またはmRNA-1273(Moderna)のいずれか、あるいは両方を4回接種された人
(2) 5回目として二価(祖型、BA.4、BA.5)のmRNAワクチンを接種された人
(3) mRNAワクチンを3回接種された後にBA.2のブレークスルー感染を起こした人
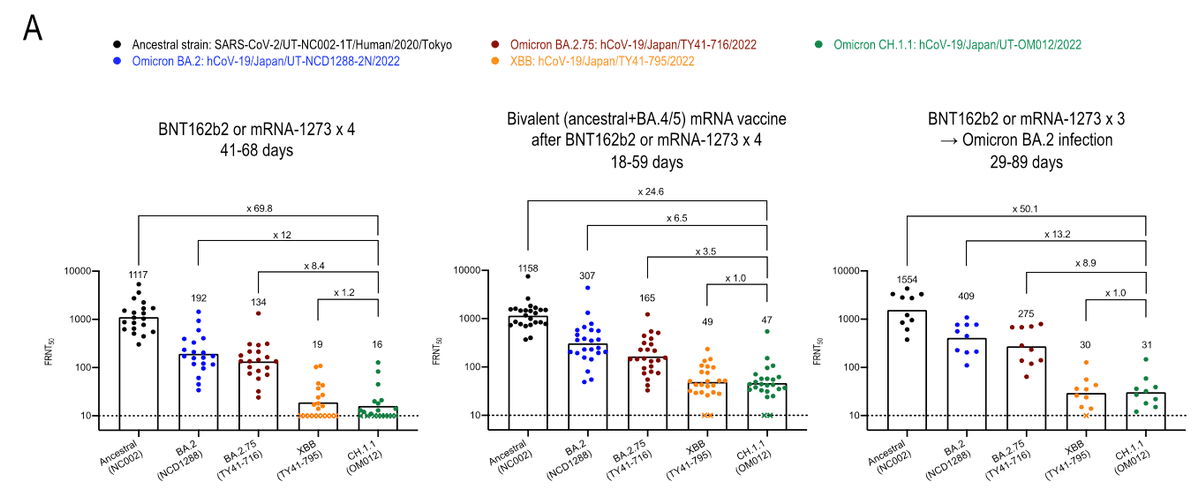
4回目のmRNAワクチン接種後の血漿のCH.1.1に対するFRNT50幾何平均力価は、先祖株、BA.2またはBA.2.75臨床分離株に対する力価よりも、それぞれ69.8倍、12倍、8.4倍低かった。5回目のワクチンとして2価のmRNAワクチンを接種した人の血漿についても、CH.1.1に対する中和活性は、先祖株、BA.2、BA.2.75に対する中和活性に比べて、それぞれ24.6倍、6.5倍、3.5倍低かった。
CH.1.1に対するFRNT50幾何平均力価は,BA.2ブレークスルー感染者の血漿検体では,先祖株,BA.2,BA.2.75に対してそれぞれ50.1倍,13.2倍,8.9倍低かった。これは、5回目のワクチンとして2価のmRNAワクチンを接種した人の検体を用いた結果と同様でした。
注目すべきことに、5回目の投与として投与された二価ワクチンは、CH.1.1に対する中和力価を3.6倍増加させました。これは、祖先株に対する中和価の変化(1.5倍)、BA.2(2.1倍)、BA.2.75(1.8倍)よりも大きい。(図S4)

*モルヌピラビル (ラブゲリオ) の作用機構 [経口投与]
モルヌピラビル は、ヌクレオシド類似体β-d-N4-ヒドロキシシチジン の イソプロピルエステルプロドラッグです。コロナウイルスは、RNAゲノムの複製と転写にRNA依存性RNAポリメラーゼ(RdRp)を使用します。RdRpがシチジン三リン酸またはウリジン三リン酸の代わりにモルヌピラビルの活性型であるβ-d-N4-ヒドロキシシチジン(NHC)三リン酸を基質として使用し、NHCはGまたはAのいずれかの取り込みを指示し、変異したRNA産物をもたらします。A、Gを取り込む現象は臨床において確認されています (私信)
原著 Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis
ブログ記事 リンク
モルヌピラビルの有効性は証明されませんでした。EMAの該当ページはこちらです↓ リンク。その下に日本語を出しました


日本におけるモルヌピラビル (ラブゲリオ) 投与の観察研究の結果が 3月16日2023年に Infect Dis Ther. doi: 10.1007/s40121-023-00782-5 に報告されました。詳細をこの記事の末尾に載せました。ここには副反応の表3を表示します

*ニルマトレビル・リトナビル (パキロビッド)の作用機構 [経口投与]
新型コロナウイルスのメインプロテアーゼと呼ばれる3CLプロテアーゼ (Mpro)を阻害します。Mproは、ウイルス複製サイクルに不可欠ですが、ヒトの類似体が認められていないため、目的以外の作用が起こる可能性が低いという利点があります
また、ニルマトルビルは主にCYP3A4で代謝されるので、パキロビッドはニルマトレビルと、CYP3A4阻害剤である低用量(100mg)のリトナビルとを併用することにより、ニルマトルビルの代謝を抑えています。CYP3A4は遺伝的多型が報告されていますので、日本人にとって海外のデータは参考レベルとします
ニルマトレビル・リトナビル (パキロビッド)の第 2-3 相二重盲検ランダム化比較試験の結果 (NCT04960202、 ファイザー社協賛)
論文:Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19
N Engl J Med 2022; 386:1397-1408
[注意:承認されるためのデータなので、通常最も良かった結果が提出されているようです]
対象患者は、重症Covid-19に進行するリスクが高い有症状でワクチン未接種の非入院で18才以上。
方法は、ニルマトルビル 300 mg とリトナビル(薬物動態改善剤)100 mg を 12 時間ごとに 5 日間投与。
結果は、投薬群697人のうち入院5人、死亡0人に対し、プラセボ群682人のうち入院44人、死亡9人と投薬により相対的なリスクが88.9%減少しました

副反応は、
投薬群1109人のうち476人に副反応が認められ、重篤な副反応で中断または停止が4人、副反応で停止が23人でした
プラセボ群1115人のうち525人に副反応が認められ、重篤な副反応で中断または停止が4人、副反応で停止が47人でした
副反応に関しては、症例報告等がでています。別の記事に続く

EUにおけるニルマトルビル/リトナビルの扱い
ニルマトルビル/リトナビルは酸素補給を必要とせず、重症のCOVID-19に進行するリスクが高い成人におけるCOVID-19の治療に適応されます;入院または死亡のリスクを減らすため、診断がついた後できるだけ早く、症状発現後5日以内に投与する必要があります[ref.pdfリンク英語]ブログ記事リンク
市販されている抗体医薬でBQ.1.1またはXBBに有効なものは無い

読んでくださいましてありがとうございます。それではまた
鼻洗浄、鼻うがいは有効です
モルヌピラビル (ラブゲリオ)
有害転帰のリスクが高い新型コロナウイルス感染症成人に対する早期治療として、モルヌピラビルと通常の治療を併用した場合と通常の治療のみを併用する場合(PANORAMIC):非盲検、プラットフォーム適応型ランダム化対照試験
Lancet 1月23日2023 link PANORAMIC試験
結論は、モルヌピラビルは、地域社会のワクチン接種を受けた高リスク成人におけるCOVID-19 に関連した入院や死亡の頻度を減少させることはなかった。この論文のブログ
PANORAMIC試験とは?
英国を拠点とする全国的、多施設共同、非盲検、多グループ、前向き、プラットフォーム適応型ランダム化比較試験でした。 対象となる参加者は、年齢が50歳以上、または関連する併存疾患を有する18歳以上で、地域社会で新型コロナウイルス感染症が確認されてから5日以内の体調不良が続いている人でした。 参加者は、モルヌピラビル 800 mg を 1 日 2 回、5 日間投与する群と通常のケアを受ける群、または通常のケアのみを受ける群にランダムに (1:1) 割り当てられました。 安全なウェブベースのシステム(Spinnaker)を無作為化に使用し、年齢(50 歳未満 vs 50 歳以上)とワクチン接種状況(はい vs いいえ)で層別化しました。 COVID-19 の結果は、無作為化後 28 日間、自己記入型のオンライン毎日日記を介して追跡されました。 主要アウトカムは、無作為化から28日以内の全原因による入院または死亡で、無作為に割り付けられた適格な参加者全員を対象にベイジアンモデルを用いて分析された。 この試験は ISRCTN に登録されています (番号 30448031)。
調査結果
2021年12月8日から2022年4月27日までに、26 411人の参加者がランダムに割り当てられ、12,821人がモルヌピラビルと通常のケアに、12 962人が通常のケアのみに、628人が他の治療群に割り当てられた(これについては別途報告する)。 モルヌピラビルと通常の治療グループの参加者 12,529 名、および通常の治療グループの参加者 12 525 名が一次解析母集団に含まれました。 人口の平均年齢は56・6歳(SD 12・6)で、25,708人の参加者のうち24,290人(94%)が少なくとも3回のSARS-CoV-2ワクチン接種を受けていた。
入院または死亡は、モルヌピラビル+通常治療群では12,529人中105人(1%)で記録されたのに対し、通常治療群では12,525人中98人(1%)でした(調整オッズ比1.06[95%ベイズ信頼区間0 ·81–1·41]; 優位性の確率 0·33)。 サブグループ間の治療相互作用の証拠はありませんでした。 重篤な有害事象は、モルヌピラビル+通常治療群の参加者 12 774 名中 50 名(0.4%)、通常治療群の参加者 12 934 名中 45 名(0.3%)で記録されました。 これらの事象はいずれもモルヌピラビルに関連すると判断されませんでした。
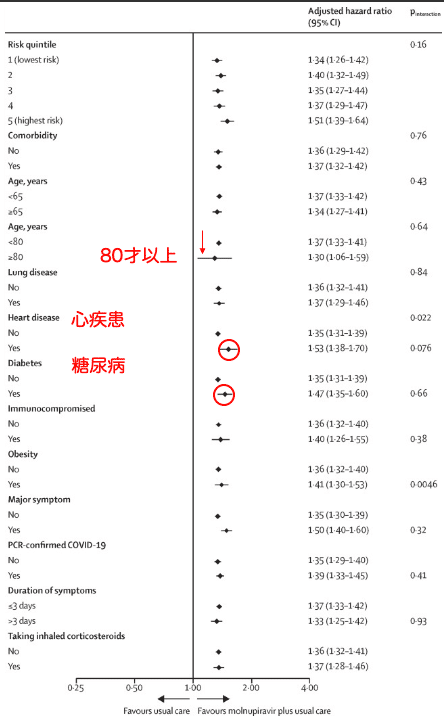
図4は各サブグループにおけるモルヌピラビルの投与の有無によるCOVID-19から回復するまでの時間の比較です。心疾患と糖尿病のサブグループで少し改善までの時間が短くなっています (図4赤○) が、中には増悪してしまった人が出ています (図4赤↓)。

モルヌピラビル (ラブゲリオ) 観察研究の中間報告 3月16日2023年 Infect Dis Ther. doi: 10.1007/s40121-023-00782-5
データ収集期間:2021 年 12 月 27 日から 2022 年 6 月 15 日
モルヌピラビルは、COVID-19 の症状の発症から中央値で 1~2 日で開始されました
治療の開始時に (表 1.掲載略)、863 人の患者 (83.71%) に併存疾患 (重度の COVID-19 疾患の危険因子を伴う疾患を含む) があり、153 人の患者 (14.84%) に基礎となる併存疾患はありませんでした。最も一般的な合併症は、高血圧 (45.00%)、2 型糖尿病/真性糖尿病 (22.31%)、脂質異常症 (20.17%) でした
96.61%の患者が治療を完了しました
安全性:安全性分析セットの 1031 人の患者のうち、68 人 (6.60%) の患者が ADR を報告し、4 人 (0.39%) の患者が重篤な ADR を報告しました。ほとんどの ADR はモルヌピラビル投与直後に発生し、投与開始から 1~2 日後に 32 人の患者で 34 件の ADR が観察され、安全性解析対象の合計 35 例 (3.39%) がモルヌピラビルの投与を中止しました。観察された主な副作用は、下痢 [26 人の患者 (2.52%)]、発疹 [6 人の患者 (0.58%)]、めまい [5 人の患者 (0.48%)]、軟便 [4 人の患者 (0.39%)] でした
医師による副作用評価では、重篤な副作用は 4 例(4 件)に認められ、内訳は発疹、肝機能異常、COVID-19(増悪)、間質性肺炎(増悪)が各 1 例ずつでした

安全性の続き:対象の中で死亡者は 7 名でした(表 4)[外来患者なし、入院患者 3 名(モルヌピラビル投与開始時の酸素または人工呼吸なし 1 名、2 名)、その他 4 名の介護施設患者など]。すべての死亡例の因果関係は、医師によってモルヌピラビルとの関連はないと判断されました。記録された死亡者のうち 6 人は 80 歳以上の患者で、死亡した 1 人の患者の年齢は不明でした。すべての死亡例には、COVID-19 疾患の重症化危険因子がありました。死因は次のとおりです。COVID-19(COVID-19に関連する合併症および関連症状による死亡を含む)3人の患者。尿路感染症/敗血症、糖尿病性ケトアシドーシス、老化、および不明(慢性腎臓病と高血圧の併存症、および記録された呼吸障害のAE用語を伴う)がそれぞれ1人でした

有効性:モルヌピラビル投与の開始後、9/199 (4.52%) の入院患者で新たに酸素投与が開始され、 2/199 (1.01%) の入院患者が死亡しました。
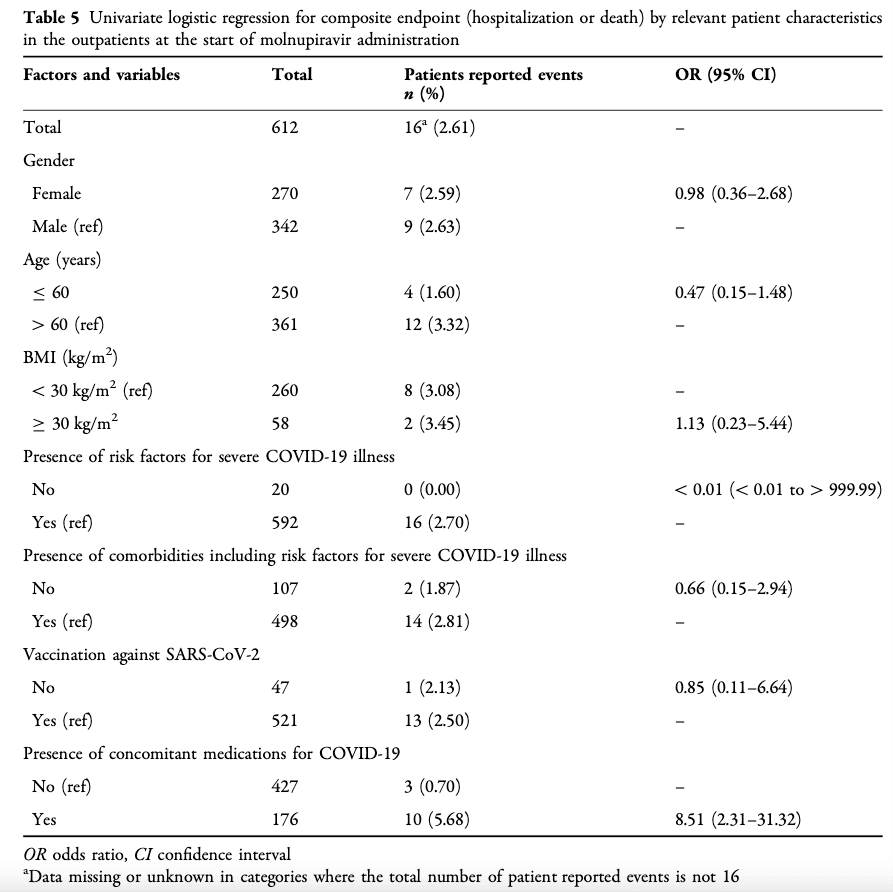
安全性分析に含まれた 1031 人の患者のうち、884 人の患者が有効性分析セットに含まれました。これらのうち、612 人 (69.23%) は外来患者、227 人 (25.68%) は入院患者、45 人 (5.09%) はその他に分類されました。有効性分析セットでは、外来患者 (患者 612 人、69.23%) と、モルヌピラビル投与開始時に酸素または人工呼吸器を使用していない入院患者 (患者 199 人、22.51%) が、複合有効性エンドポイントを解析されました (入院または死亡、および酸素/機械換気の開始または死亡、それぞれ)。 外来患者のうち、16/612 患者 (2.61%) がすべての原因で、投与開始から 29 日までに入院しました (図 3a)。表 5 に示すように、外来患者のうち 12/16 が 60 歳以上でした。 16 人中 14 人の患者に、重度の COVID-19 疾患の危険因子を含む併存疾患がありました。 10/13 (3 人の患者のデータが欠落) の患者は、COVID-19 の併用薬を受けていました。そして 16/16 には重度の COVID-19 疾患の危険因子がありました。 16 人の患者のうち 12 人 (1.96%) が COVID-19 関連で入院しました。外来患者での死亡は報告されていません
入院患者(モルヌピラビル投与開始時に酸素なし)のうち、9/199 患者(4.52%)が投与開始から 29 日間酸素投与を開始しました(図 3b)。人工呼吸器 (ECMO を含む) を使用した患者はいませんでした。 2 人の入院患者が、投与開始から 29 日以内に死亡しました [2/199 (1.01%)]。入院患者の場合、複合エンドポイント [死亡、酸素の開始、または人工呼吸器 (ECMO を含む)] の頻度は 5.03% でした

論文の結論には"日本で日常的に使用されているモルヌピラビルの中間分析は、オミクロンが主要な SARS-CoV-2 バリアントであったパンデミック条件下でのモルヌピラビルの安全性と有効性のプロファイルをサポートしています"と記載されています ブログ
この記事が気に入ったらサポートをしてみませんか?
