
「ゲノム編集の光と闇」読後のまとめ:その1
いい歳になって初めてnoteなるものに初挑戦している私。
noteのやり方もほとんど分かっていませんが、まずはやってみることが大事と勇気を振り絞って、また自分がこれまで読んだ本の中で面白かった本のまとめを自分なりにしてみたいという気持ちもあり、初noteを書いてみたいと思います。
青野由利さん(科学ジャーナリスト)の書かれた「ゲノム編集の光と闇〜人類の未来に何をもたらすか」、初学者の私にも比較的読みやすく興味をそそる本でした。その本の中身の概要を私なりにまとめていきたいと思います。
年寄りにとっては内容が物凄く多く難しいので、まずは前半部分だけ。
全く専門分野でもない素人の自分のためのまとめになりますが、お許しください。
2018年11月26日にAP通信の記事が流れてきた時の衝撃‥
「中国の研究者がゲノム編集した受精卵から双子の女の赤ちゃんを誕生させたと主張している」「改変したのはエイズウイルスの感染に関わる遺伝子だという」
ゲノム編集は2012年頃から注目を集めるようになった「遺伝子を狙い通りに切り貼りできる技術」です。
特に「クリスパー・キャス9」と呼ばれるゲノム編集の分子ツールは、正確で効率がよく、扱いが簡単で安いという素晴らしい技術で、野火のように世界の研究室に広がっていきました。既に野菜や家畜などでは「ゲノム編集生物」が次々と生み出されています。それはゲノム編集治療の分野にも押し寄せてきています。
ゲノム編集に関わるキーワードだけあげていっても、遺伝子組み換え、遺伝子治療、体外受精、着床前診断、クローン技術、ES細胞、iPS細胞、遺伝子ターゲティング、ヒトゲノム計画、異種移植、絶滅動物再生、デザイナーベビー、などなど。
クリスパー誕生物語:
開発に関わった主人公の二人、フランス人のエマニュエル・シャルパンティエと米国人のジェニファー・ダウドナ。この二人を中心に開発されたクリスパー・キャス9(略してクリスパー)は、生物の設計図とも言えるゲノムを自在に編集できるゲノム編集ツールです。クリスパーは、もとはと言えば、細菌がウイルスの攻撃から身を守るために備えている自然界の仕組みなのですが、これをうまく利用して細胞の中で働く使い勝手のいい分子ツールに仕立てたのです。
ゲノム編集ツールとしてのクリスパーの可能性を二人が論文に発表したのが2012年。今から10年前になります。それ以前にも「ZFN」(ジンク・フィンガー・ヌクレアーゼ)と「TALEN」(ターレン)と呼ばれる、それぞれ第一世代と第二世代のゲノム編集技術はありました。これらの分子ツールに共通する役割は、標的とするDNAの配列を見つけて、二重鎖をバッサリと切断すること。専門家はこのことを
「DSB:Double Strand Break」と呼んでいます。
ダウドナのチームがクリスパーの仕組み解明を一歩進めた時のネイチャー誌の表紙には「探して、破壊する」というそのもののタイトルがついていました。
これをもう少しイメージしやすいように書くと、ハサミを備えた小さな分子マシン(クリスパー)が、細胞の中のDNAの上を移動しながら、次々と塩基配列を点検していきます。このマシンは、ゲノムの中で編集したい遺伝子の中の塩基配列(20文字ほど)が書かれたチケットを持っていて、ちょうどこれと同じ塩基配列を見つけると、照合し、ハサミで二重鎖を切断します。もちろん、チケットは紙ではなく、人工的に設計したRNAで出来ています。ハサミはタンパク質で出来ています。
では、DNAの二重鎖を切断した後に何が起きるかというと、DNAの修復です。
細胞のDNAは自然の状態でも放射線や化学物質などによって傷ついていますので、身を守るために全ての生物はDNA修復の仕組みを持っています。
ゲノム編集の主な狙いは、こうした自然の修復を利用して、遺伝子の働きを失わせる「遺伝子ノックアウト」を実行したり、望みの遺伝子を入れ込む「遺伝子ノックイン」を実行したりすることです。そのために、次のような2通りの修復機能を利用・応用します。
(1)ともかく、切断された末端同士を繋ぎ合わせる。(非相同末端結合修復)
(2)切断されたDNAと同じ配列を鋳型として、元通りに修復する。
(相同組み換え修復)
(1)の場合では、しばしば、切断されたDNAは元通りにはならず、遺伝子の働きが失われますので、「遺伝子ノックアウト」が起きます。
(2)の場合では、切断された部分にピッタリとはまるように設計した望みの遺伝子をクリスパーと一緒に入れておきます。すると、もとのDNAが再生される代わりにこの遺伝子が挿入され、「遺伝子ノックイン」が起きます。
言い換えると、「探して」「切って」「遺伝子をノックアウト」または「望みの遺伝子をノックイン」するというのがゲノム編集の基本的な仕組みになります。


ゲノム編集ツールには標的とするDNAを「探し当てる」検索機能と、DNAを「切断する」ハサミ機能の二つが必要となります。
ハサミの機能はどの世代のゲノム編集でも「ヌクレアーゼ」と呼ばれる酵素が担うことになります。
クリスパー・キャス9の場合、「切断する」ハサミの役割を担うのは、古細菌から発見された「Cas9」と呼ばれるヌクレアーゼ、すなわちタンパク質です。
一方、標的DNAの検索機能を担うのは、人工的に作る1本鎖のRNAです。ハサミ役のキャス9を標的まで案内(ガイド)する役目を持つので、「ガイドRNA」と呼ばれます。切断したい標的DNAに応じてガイド役の分子を設計し合成する必要がある点は、他のゲノム編集ツールと変わりませんが、はるかに簡便です。
また「複数の遺伝子を一度に編集できる」ことも優位なところです。
例えば、病気のモデルマウスを作ろうとした場合、複数の遺伝子をノックアウトしないと病気の再現が出来ない場合もあります。また複数の変異遺伝子を一度に修復して、病気の治療に役立てたい場合もあるでしょう。
ただ、標的とするDNA配列だけを切断する「特異性」の点では、第一世代、第二世代が優っています。裏を返せば、クリスパーは狙った標的以外のDNAを誤って切断してしまう場合があります。
このような目的以外の切断を「オフターゲット」と呼びます。
これが起きると、思わぬDNAの切断から、正常な遺伝子の機能を損ない、時にはガンを引き起こすことにも繋がってしまいます。
自然界のCRISPRと免疫機能:
そもそもクリスパーは自然界に存在する仕組みです。シャルパンティエとダウドナが開発したクリスパー・キャス9は、この自然界の仕組みを利用した人工的な分子ツールです。
以後、人工的なクリスパーと区別するために、この本では原則として自然界のクリスパーはCRISPRと表記するものとします。
では自然界におけるCRISPRとはどんなものなのか。
一言で言うなら、細菌が外敵(ウイルス)から身を守るための「免疫機構」です。
細菌の場合、ウイルスの攻撃を受けて、感染・死滅してしまうことがあります。
こうした細菌に感染するウイルスは総称して「バクテリオファージ」と呼ばれます。単に「ファージ」と呼ばれる場合も多いです。
CRISPRというのは、
Clustered Regularly Interspaced Short Palindromic Repeat の頭文字。
直訳すれば、「間隔をおいて繰り返される短い回文配列の塊」となります。
ウイルスの侵入を受けた細菌は、そのウイルスの遺伝子を切り刻み、一部を細菌自身のDNAに組み込んで記憶します。次に同じウイルスが侵入してきた時には、これを利用して敵を認識し、すばやく攻撃を仕掛けて排除する。このような敵の「記憶ファイル」がCRISPRの実態。人間で言うなら「獲得免疫」に当たります。
外敵であるファージの種類はたくさんあるので、CRISPRにはさまざまなファージの塩基配列をファイルしておく必要があります。「敵A」「敵B」「敵C」「敵D」の配列があるとすると、その間は「リピート」と呼ばれる同じ配列で区切られています。「敵A」「リピート」「敵B」「リピート」「敵C」「リピート」‥‥といった具合。
「リピート」は25〜50塩基程度の配列で、これが回文配列を含んでいます。
回文とは、「タケヤブヤケタ」「シンブンシ」のように、前から読んでも後ろから読んでも同じような、という意味ですが、DNAの配列の場合はちょっと違います。二重鎖を成すDNAの上に並ぶ塩基配列の文字が、片方の鎖をある方向に読んだ場合と、それと対を成す鎖を逆方向から読んだ場合が一致する配列のことを言います。
例えば「GAATTC」がこれに相当します。塩基はAとT、GとCがペアを成すので、
「GAATTC」と対を成す配列は「CTTAAG」で、ちょうど反対から読むと一致することがわかるでしょう。
この回文配列の間に埋め込まれているのが「敵」の配列で、「スペーサー」と呼ばれます。こちらも30〜40塩基程度の短い配列です。
つまり、CRISPRとは、「敵の配列」(スペーサー)と短い回文配列(リピート)が交互に出てくるひとまとまりの配列ということになります。

その後、研究が進むうちに、CRISPR配列の近くに寄り添うように配置されている塩基配列の存在が明らかになってきました。この配列は、CRISPRを持つ細菌には存在しますが、CRISPRを持たない細菌にはありません。
このため、CRISPRと連動して働く遺伝子だと考えられ、「CRISPRに関連する」(CRISPR-Associated)という意味の頭文字をとってCas(キャス)の名付けられました。これが結果的に、ハサミの役割を果たすタンパク質の遺伝子だと分かりました。
CRISPRとCasはセットで、異なるCRISPRには異なるCasが対応します。その種類は90を超え、注目のCas9もその一つということになります。
デンマーク発祥の国際食品会社「ダニスコ社」では、乳酸菌に攻撃を仕掛けるファージについて研究。乳酸菌のさまざまな株でCRISPR配列を分析。ファージ抵抗性のある変異株にはファージ由来と思われる追加のスペーサー配列を発見。研究を更に続け、CRISPR配列にファージの配列を付け加えるとファージへの抵抗性が生まれ、逆に削除すると抵抗性がなくなること、Casを不活化すると抵抗性が失われることも確認しました。
CRISPR/Casのシステムが、どのように細菌の獲得免疫として働いているのか、パズルを完成させるための研究は続きます。
2008年には、オランダのチームが、ファージから取り込んだ配列を持つ小さなcrRNA(クリスパーRNA)が、Casタンパク質を標的DNAに導くことを、大腸菌を使って示しました。DNAのCRISPR配列全体が、まず、長い1本鎖のRNAに転写され、次に酵素の働きによってRNAのリピート部分で切断されます。こうして、スペーサー配列(つまり、過去に細菌に感染したファージの配列の断片)を一つずつ含む短いRNAが出来ます。これがクリスパーRNAです。
次に、ノースウェスタン大学のチームが、CRISPRの標的がRNAではなく、DNAであることを示しました。
2010年には、CRISPR/Cas9が標的とするDNAの二重らせんを切断するのは、「PAM」と呼ばれる配列のすぐそばであることをカナダのチームが示しました。
「PAM」とは、「Protospacer Adjacent Motif」の頭文字で、「スペーサーの元になる配列に隣接するモチーフ」といった意味です。「◯GG」という塩基配列で(◯はどの塩基でもいい)、2005年にフランスのチームが発見しています。
PAMはCRISPRが働く時の一つの目印で、CRISPRが大量の塩基配列の中から標的配列をすばやく検出するのに役立っています。また、ウイルスと自分を見間違えて切断してしまわないための目印にもなっています。
人工クリスパーを設計する時には、どの配列をターゲットにするかを決める目印ともなります。ターゲットに出来る配列がPAMの近くに限られてしまうため制限が生まれてしまいますが、これを解決する技術開発も進んでいます。
その後、シャルパンティエとボーゲルのチームが、化膿性レンサ球菌で遺伝子の制御に関わるスモールRNAの塩基配列を解読しているうちに、未知のスモールRNAが大量に存在し、このRNAはCRISPR配列のすぐ近くの配列から読み出されていること、しかもこのスモールRNAの中の25塩基がCRISPR配列の一部とペアをなしていることも分かりました。このスモールRNAはCRISPRと関係しているとしか思えず、シャルパンティエはこのRNAを「tracrRNA」(トレイサーRNA)と名付けました。
模式図:
①過去に侵入したファージCが再度侵入する
②CRISPR領域のうち、過去に感染したファージCの配列を持つ領域が転写されて、クリスパーRNA(crRNA)が合成される

※クリスパーRNA(crRNA)は敵(ファージC)とペアになる配列を持っている
③クリスパーRNA(crRNA)とトレイサーRNA(tracrRNA)が複合体をつくり、クリスパーRNAと同じ配列をもつ場所までCas9をまでガイド

※トレイサーRNA(tracrRNA)は別の配列から転写されてできる
④クリスパーRNA(crRNA)とペアになる塩基配列をCas9が切断
*人工クリスパーではcrRNAとtrRNAを繋ぎ合わせ、ガイドRNA(sgRNA)とする。
ここでもう一度おさらいすると、クリスパーRNAは細菌のCRISPR配列から読み出される「敵の配列」を持つ小さなRNA、Cas9はCRISPRと共に働くハサミ役のタンパク質。トレイサーRNAはその後の研究で、上記の二つと連動して動くことが判明しました。この研究に大きな役割を果たしたのは、当時ウィーン大学でシャルパンティエのラボにいた修士課程の女子学生のデルチバでした。その後、二人を中心に確認実験が重ねられ、レビューを経て、2011年3月にネイチャー誌に掲載されました。
これで、細菌の免疫を担うCRISPRシステムが、たった三つの分子、すなわち
「クリスパーRNA」「トレイサーRNA」「Cas9タンパク質」で構成されていることが明らかになりました。それは思った以上にシンプルなシステムでした。
その後、二つのRNAと一つのタンパク質からなるCRISPR/Cas9が、どのように標的DNAを切断するのかが実験で示され、その論文が2012年8月のサイエンス誌に掲載されました。このエポックメイキングな成果をもたらしたのが、シャルパンティエとダウドナの出会いでした。2011年のプエルトリコでの米国微生物学会の学術集会。ここで二人は出会い、二人を中心とした共同研究チームは実験と研究と分析を続けました。
前述した2012年8月のサイエンス誌の論文の要旨は以下の通り。
(1)クリスパーRNAとトレイサーRNAが複合体(人工的に繋いだ)を作ってCas9を標的DNAに導き、クリスパーRNAとペアをなすDNAの配列を切断する。
(2)標的DNAの2本鎖は、それぞれCas9の別の部位によって切断される。
(Cas9タンパク質が二つのハサミを持っているイメージ)
(3)場所を特定した切断は、クリスパーRNAの標的配列と、標的配列のすぐそばにあるPAM配列の両方によって決定される。
そしてなんといっても重要だったのは、「クリスパーRNAとトレイサーRNAを人工的に繋いだRNAも、自然界と同様に標的DNAを切断すること」を確かめ、切断した標的に応じて、「RNAを設計することによって、標的DNAを編集出来るシンプルで汎用性の高いシステムを開発出来る」と示したことでした。
また、クリスパーRNAの配列を変えると、その配列とマッチするDNAの配列を見事に切断出来ることも分かりました。
また、前述したように、「クリスパーRNA+トレイサーRNA」は、クリスパーを標的まで導く案内役(ガイド)となるので、「ガイドRNA」(sgRNA)と呼ばれます。
この発表の後、世界中から怒涛のようにクリスパーを使った研究論文が発表されるようになりました。
次の段階へ:
二つのRNAを繋いだ1本のガイドRNAが、本当に狙ったDNAを切断してくれるのか。彼女たちのチームが選んだのは、クラゲの緑色蛍光タンパク質(GFP)遺伝子。下村脩がオワンクラゲから発見した発光遺伝子。彼女たちはこのクラゲ遺伝子のDNAの中から5種類のDNA配列を選び、これと一致する配列を持つクリスパーRNAを設計しました。そして5種類のクリスパーRNAとトレイサーRNAを繋いだ5種類のガイドRNAを作り、これをCas9と合わせ、本当に狙った配列を切断出来るかどうか試してみました。そしてこの実験も成功しました。
つまり、彼女たちはどんな生物でも狙ったDNA配列を切断出来る人工的なツールを手に入れたわけです。
2013年1月、米国のブロード研究所のチームは、人工クリスパーを哺乳動物の細胞に応用した結果をサイエンス誌に発表。研究チームのリーダーは中国系アメリカ人のファン・ジャン。彼らは2種類のクリスパー・キャスのシステムを設計し、ヒトとマウスの細胞で狙った標的遺伝子を切断出来ることを示しました。
また相同組み換え修復がうまく出来るクリスパーや、一度に複数の標的を切断出来るクリスパーの作製にも成功しています。
ダウドナ自身のチームもヒトの細胞で人工クリスパーが働くことを示し、ソウル大学のチームやロックフェラー大学のチームもこれに続きました。
これらの論文では、ヒトの細胞やマウスの細胞だけでなく、ゼブラフィッシュの受精卵もゲノム編集出来ることが示されました。
5月にはMITのチームがクリスパーを使ってマウスの受精卵を編集したという論文をセル誌に発表しました。体細胞ではなく、哺乳類の受精卵というところがミソです。このチームには再生医療研究の世界的権威であるイェーニッシュが参加していました。マウスの受精卵の遺伝子改変は、生命科学実験の要の一つです。
マウスに外来の遺伝子を導入する初めての試みが1974年に行われていますが、この実験を実施したのがイェーニッシュでした。
外来の遺伝子を導入した受精卵をメスマウスの子宮で育てて出産させると、体中の細胞にこの外来遺伝子を持ったマウスが出来ます。こうしたマウスは「トランスジェニック・マウス」と呼ばれます。
その後、ガラスピペットを使った遺伝子導入法などが生まれ、各国の研究室でたくさんのトランスジェニック・マウスが生み出されることになりました。
1982年12月には米国のチームが通常の2倍もの大きさに育った「スーパーマウス」の発表をネイチャー誌で行なっています。マウスより一回り大きいラットの成長ホルモンの遺伝子を導入して作っています。しかも、その遺伝子はマウスの子孫まで伝わっていきました。
ただ、付け加える遺伝子がマウスのゲノムのどこに入るか、この頃はコントロール出来ませんでした。
そこで次に登場したのが、標的とする遺伝子を操作する技術、「遺伝子ターゲティング」または「標的遺伝子組み換え」です。
中でも、特定の遺伝子だけを壊した「ノックアウト・マウス」が生命科学研究で重要な役割を担うようになりました。
この仕組みを理解するために、「ES細胞」「キメラマウス」「相同組み換え」というキーワードの理解が必要です。

もう一度、復習の時間。私たちのDNAは二重らせん構造で、染色体のかたちで細胞核の中に畳み込まれています。染色体は2本で1対のペアを形作っています。
ペアの片方は母親から、もう片方は父親から受け継ぎます。
このペアを「相同染色体」と呼びます。
相同染色体同士の間では、ペアをなす対立遺伝子の間で配列の交換が起きることがあります。これが「相同組み換え」で、卵子や精子が出来る過程で起きることが知られています。卵子や精子が出来る時には、減数分裂と呼ばれる特別な分裂が起きて、通常の体細胞の半分のDNAがそれぞれに分配されます。この時に、ペアをなす相同染色体同士の間で相同組み換えによる遺伝子のシャッフルが起きます。
この遺伝子のシャッフルは、人間であれ、他の動物であれ、「遺伝子の配列が同じ個体を、事実上、二度と再び生み出さない」ということに繋がり、生物の遺伝的な多様性を生み出す原動力になっています。
マリオ・カペッキとオリバー・スミシーズは、こうした相同な配列同士の組み換えが体細胞でも起きれば、哺乳類の細胞で狙った遺伝子を改変出来るだろうかと考えました。外から導入したい遺伝子やDNAが相同組み換えを起こして、標的遺伝子と組み換わるように細工して、細胞の核に入れるというアイデアです。
カペッキはまず、傷ついた遺伝子がDNAの相同組み換えによって修復出来ることを哺乳類の細胞で示しました。更に、この技術が標的遺伝子をノックアウト出来ることにも気づきました。スミシーズは、相同組み換えを使うことで、ヒトの遺伝子疾患を治せないかと考えて実験し、変化させたDNAをヒトの培養細胞のDNAに導入することに成功しました。
ES細胞=万能細胞:
「ES細胞」は、日本語では「胚性幹細胞」。受精卵を壊して作る細胞で、様々な細胞に変化出来る性質があることから、「万能細胞」と呼ばれることもあります。
受精卵が卵割を繰り返し、胚盤胞と呼ばれる段階まで育ったところで、中の細胞の塊を取り出して培養して作ります。
エバンスは、望みの遺伝子をマウスの生殖系列細胞に導入する方法を考えていて、マウスのES細胞作りに成功しました。更に、ある系統のマウスの受精卵に、別の系統のマウスのES細胞を注入して育てることによって、ES細胞由来の遺伝子が生まれてくる子供にまで伝わることを示しました。ここで登場するのが「キメラマウス」です。
キメラとは、ギリシア神話に出てくる怪物で、頭はライオン、体は羊、そして尾は蛇という異形のものです。生物学の世界でいうキメラは、異なる種類の親に由来する細胞が入り交じった生物のこと。ニワトリとウズラのように、種の異なる生物という場合もありますし、系統の違うマウス同士ということもあります。
例えば、マウスの受精卵AからES細胞を作り、別の受精卵Bが少し育った胚盤胞に入れて、代理母マウスの子宮で育てると、AとBの細胞が交じったキメラマウスが生まれます。
ES細胞は、どんな細胞にも変化出来る万能細胞なので、キメラマウスの卵子や精子にもES細胞由来のAの細胞が入ります。もし、事前にES細胞の特定の遺伝子を操作しておくことが出来れば、その遺伝子は卵子や精子にも伝わる場合があります。
そうしたキメラマウスを普通のマウスと掛け合わせると、体中の細胞で相同染色体の片側の標的遺伝子が操作されたマウスを誕生させることが出来ます。
更にこうした遺伝子改変マウス同士を掛け合わせることで、相同染色体の両方の標的遺伝子が操作された「標的遺伝子組み換えマウス」が出来ます。
この事前の操作に使われるのが、カペッキやスミシーズが取り組んでいた「相同組み換え」です。
1989年には、これらを組み合わせた標的遺伝子組み換えマウス作製の成功が複数のチームから報告されています。その一つがイェーニッシュのラボでした。
この手法を使えば、標的遺伝子を破壊した「ノックアウトマウス」も、標的部分に遺伝子を挿入した「ノックインマウス」も作製出来ます。
ただこのような過程はやはりかなりの困難を伴っていました。
一般に言われていたのは「一つの遺伝子を壊したノックアウトマウスを作るのに1年半以上かかる」ということ。
だからこそ、クリスパーの登場は科学の世界を変える「ゲーム・チェインジャー」であったのです。
それまでの苦労を熟知しているイェーニッシュはクリスパーの登場を一気に味方にしました。そして、2013年5月、イェーニッシュのチームがいち早くセル誌に発表した論文のタイトルは「複数の遺伝子変異を持つマウスをクリスパーを使ってワンステップで作製する方法」。そして、マウスの受精卵に複数の異なるガイドRNAを組み込んだ複数のクリスパーを導入。これを母マウスの子宮で育てることによって、狙った複数の遺伝子を編集することに成功しました。
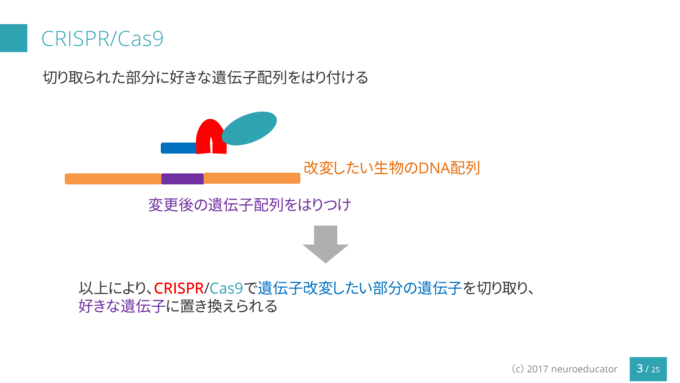
まとめ1(人工クリスパーで遺伝子を編集する方法):
①まず、標的とする遺伝子にハサミ役のキャス9を導く「ガイドRNA」を設計する。様々な標的遺伝子に対するガイドRNAの基本構造は一定で、約20塩基の部分だけを標的遺伝子に応じて作り変えればいい。
②次に、このテーラーメイドのガイドRNAとキャス9タンパク質を作るDNA(もしくは、ガイドRNAそのものと、キャス9タンパク質そのもの)を細胞内に送り込む。
③ガイドRNAはキャス9と複合体を形成し、細胞のゲノムの中から標的遺伝子の場所を探し出してくっつく。
④すると、キャス9が、標的DNAの二重鎖を切断する。
⑤切断されたDNAは、細胞が持つ修復機能によって再び繋げられる。この時に、高い確率で修復エラーが起きる。余分な配列が入ってしまったり、必要な配列が欠損してしまったりする。(非相同末端結合修復)
⑥その結果、標的遺伝子の機能が失われる。これをマウスの受精卵に使えば「ノックアウトマウス」が出来る。
⑦標的遺伝子を別の遺伝子と入れ換えたい場合は、目的の遺伝子の鋳型をガイドRNAやキャス9とともに細胞の中に入れてやればいい。そうすると、⑤のような修復が起きる代わりに、切断部分に望みの遺伝子を入れることが出来る。(相同組み換え修復)これが遺伝子の「ノックイン」である。ただ、ノックアウトに比べると、ノックインの効率は高いとは言えないので、今後の研究発展が期待される。
この記事が気に入ったらサポートをしてみませんか?
