新型コロナウイルス感染症に対するモノクローナル抗体治療ロナプリーブ®(カシリビマブ/イムデビマブ)
2021年8月20日追記:
適正使用ガイドや患者さん向け説明資材など中外製薬のホームページに準備されていますので,こちらを参照してください。
https://chugai-pharm.jp/product/ron/div/
ーーーーーーーーーーーーーーーーーーーーーーーーーーー
新型コロナウイルス感染症(Covid-19)に対するモノクローナル抗体治療(カシリビマブ/イムデビマブ)が特例承認されるというニュースがありました。
2021年7月19日追記:
ーーーーーーーーーーーーーーーーーーーーーーーーーーー
2021年7月19日特例承認されました。
商品名はロナプリーブ®というのですね。
以下厚労省のプレスリリースと添付文書です。
重症化高リスクで,低酸素血症がない段階の人が適応です。
https://mhlw.go.jp/content/11123000/000807746.pdf
ーーーーーーーーーーーーーーーーーーーーーーーーーーー
この薬は,新型コロナウイルス(SARS-CoV-2)のスパイク蛋白がヒトのACE2レセプターと結合するのをブロックします。
米国FDAは2020年11月に緊急使用承認
していました。発症早期(10日以内)で重症化のリスクが高い人のうち,軽症から中等症のCovid-19患者に適応です。
(2021年8月21日追記:日本では発症7日以内で低酸素血症なし[SpO2 93%以上]で適応になっています。)
Covid-19による入院患者,酸素吸入が必要な患者には米国FDAでも未承認です。モノクローナル抗体治療はCovid-19による入院患者での利益は報告されておらず,Covid-19によってハイフロー酸素治療,人工呼吸管理が必要な患者では予後不良と関連する可能性があります。
投与の適応になる重症化高リスク患者は以下の通りです。
以下の1つ以上がある患者
・BMI35以上
・慢性腎臓病
・糖尿病
・免疫不全疾患
・現在免疫抑制剤で治療中
・65歳以上
55歳以上で以下の1つ以上がある患者
・心血管疾患
・高血圧
・COPD,その他慢性呼吸器疾患
12-17歳で以下の1つ以上がある患者(体重40kg以上)
・BMIが年齢,性別の85パーセンタイル以上
・鎌状赤血球症
・先天性または後天性心疾患
・神経発達障害(脳性麻痺など)
・医療機器使用中(気管切開,胃瘻,陽圧換気[Covid-19関連のものは除く])
・喘息,反応性気道疾患,その他慢性呼吸器疾患で毎日の薬物治療が必要
緊急使用承認の根拠になったフェーズ1/2試験(二重盲検)は
・799人の軽症から中等症Covid-19外来患者を対象
・SARS-CoV-2検査陽性から3日以内に以下の3群にランダム割付
- カシリビマブ,イムデビマブ2400mg(それぞれ1200mgずつ)単回点滴
- カシリビマブ,イムデビマブ8000mg(それぞれ4000mgずつ)単回点滴
- プラセボ
プライマリーエンドポイントの「ベースラインから7日目のウイルス量の
時間加重平均値の減少」は,プラセボと比べて有意に減少しました。
事前設定されたセカンダリーエンドポイントの「28日間以内のCovid-19関連の医療機関受診 (入院 ,救急外来受診 ,救急診療所受診 ,一般外来/遠隔医療受診)」は,カシリビマブ/イムデビマブ群で2.8%,プラセボ群で6.5%で統計学的有意差がありました。カシリビマブ/イムデビマブの投与量による違いはなかったということで,2400mgの方が承認されたようです。
主な変異ウイルスに対する感受性の低下は今のところなさそうです。

副反応としてインフュージョン反応と1例のアナフィラキシーが報告されましたが全例回復したそうです。
この後,2021年6月3日米国FDAが緊急使用承認の用量変更,投与経路追加を発表しました(https://www.fda.gov/media/145610/download)。
・フェーズ3試験のCOV-20677 (NCT04425629)の結果により,カシリビマブ/イムデビマブ2400mgから1200mg(カシリビマブ600mg,イムデビマブ600mg)に変更
・静脈内点滴が困難あるいは時間がかかる場合,投与経路として皮下注射を追加
だそうです。
フェーズ3試験の結果は以下の通り(https://www.fda.gov/media/145611/download)でした。
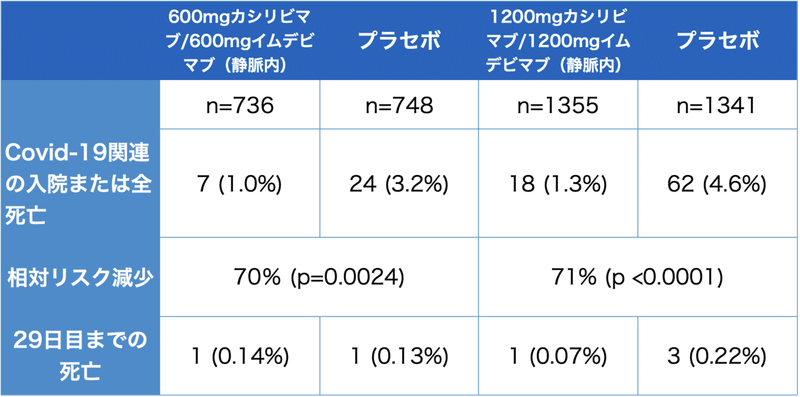
プラセボ群のイベント発生割合がやや低めなのは,投与の適応が広すぎるのかもしれません。(例えば,65歳以上または50歳以上で基礎疾患がある患者を対象にした吸入ステロイドのブデソニドの
PRINCIPLE試験では通常ケア群での28日間の入院または死亡は約10%でした。)
外来で軽症から中等症の高リスクの人に使用できる承認薬がこれまでなかったので,外来で重症化リスクが高い人に投与できる薬ができるのはありがたいです。とはいえ,今あるデータを見る限り,もう少し重症化リスクの高い人を中心に投与した場合,人工呼吸器管理や死亡をどこまで減らせるかはまだよくわからないと思いました。
もう一つの問題点は,今の日本の体制で外来で投与するのが難しいかもしれないことです。病状的には入院が必要ないけれど,高リスクの人に隔離のために早めに入院してもらい投与,ということになるのでしょうか(でも,入院減少がアウトカムなのに,入院患者対象になってしまうと変ですね)。幸い,ワクチンのおかげか新規陽性者が増えても高齢の入院患者は減っているので,病床的にはまだ余裕があるところが多いでしょう。療養ホテルや在宅で投与できるようになれば,助かるケースもあると思います。病床逼迫時には,重症化高リスク患者のためのモノクローナル抗体外来治療センターを作ることも一つでしょうか。
おそらく値段は高いでしょうから,投与の適応をどうするかによって費用対効果も変わります。特例承認により,どういう人に適応になるかが気になるところです。
ちなみに,コロナワクチン未接種の人で,モノクローナル抗体治療を受けた場合,投与後90日間はコロナワクチン接種を遅らせた方がよいようです。
参考文献:
An EUA for casirivimab and imdevimab for COVID-19. Med Lett Drugs Ther. 2020;62:201–2.
https://secure.medicalletter.org/w1614a
FACT SHEET FOR HEALTH CARE PROVIDERS
EMERGENCY USE AUTHORIZATION (EUA) OF REGEN-COVTM (casirivimab and imdevimab) https://www.fda.gov/media/145611/download
この記事が気に入ったらサポートをしてみませんか?
