
SARS-CoV2:スパイクタンパク質の毒性…それはCOVIDワクチン:スパイクタンパク質の毒性
この記事を「SARS-CoV2→COVIDワクチン」として、所々置き換えて読むと、如何にワクチンが危険なのか?理解しやすい。
何故かと言うと今回のワクチンはウイルスそのものを再現したのではなく、スパイクタンパク質の設計図を身体に打ち込むからです。
そのスパイクプロテインが引き起こす副作用は多岐にわたる…それは血管を利用して全身に回るから、何が起きても不思議ではない。
できるだけ多くの人がこの毒殺の罠に気がつき、接種しないことを願う今日この頃ですが、ワクチン接種後の犠牲者が後を絶たない…
止めたい!止めなければならない!😎🎗🎗🎗
記事はここからです。(完全機会翻訳w😅)
SARS-CoV2:スパイクタンパク質の毒性の可能性に関する警告
2021年4月15日
22:21に投稿-22:56に更新
著者:FranceSoir
- A+ A
ケビン・マケアン博士、博士号
スパイクタンパク質は、SARS-CoV2ウイルスの必須の病原性因子です。SARS-CoV2に感染した細胞によって、またはmRNAまたはアデノウイルスベクター(DNA)ワクチンによる形質導入後に生物学的に活性な形で発現される場合、その役割は免疫原性エピトープの不活性な提示に限定されません。その発現は、SARS-CoV2ウイルスの存在とは無関係に、COVID-19疾患の特定の臨床症状を再現できる、多数の毒性の可能性を示唆しています。この記事は、スパイクタンパク質の発現によって誘発される自律的な毒性の可能性を短期、中期、長期的に統合することを目的としています。
スパイクタンパク質はSARS-CoV2ウイルスの向性を決定します
SARS-Cov2は、いとこのSARS-CoV、ACE2受容体、TMPRSS2プロテアーゼのように細胞への侵入に使用します[1]。(図[1])

[2]からの図[1]
しかし、その向性は、嗅覚および呼吸上皮、血管内皮、および脳の感染力を高める別のニューロピリン-1受容体の存在によって拡張されます[3] [4](図[2])。

図[2] [5]によると
スパイクは、インテグリンに結合する他のウイルスと共通のRGDドメイン(アルギニン-グリシン-アスパラギン酸)を示します(図[3])。インテグリンは、特に肺細胞、血小板、内皮細胞において、細胞接着、細胞遊走、細胞シグナル伝達に関与するヘテロ二量体受容体です。

図[3] [6]によると
ウイルスとインテグリンとの相互作用は、ウイルスの細胞への侵入を促進するか、ウイルスが細胞の表面に付着し、アンタゴニスト(受容体をブロックする)またはアゴニストとして振る舞い、カスケードを引き起こす可能性があります細胞内シグナル伝達の。
最後に、RBDレベルでのヘパリン結合ドメインの存在は、膜ヘパラン硫酸プロテオグリカンとの相互作用およびエンドサイトーシスを介したウイルスの内在化を可能にします[7]。
SARS-CoV2スパイクタンパク質は、スーパー抗原性コロナウイルスSARSの中で独特の挿入を示し、多系統炎症性症候群(MIS)を説明する可能性があります [8]。
「PRRA」フューリン切断部位(FCS)の特異な挿入[図3。コロナウイルスSARSの中でユニークな4A]の前には、クレードでもユニークなモチーフ「YQTQTNS」があります。得られた配列(Y 674 QTQTNSPRRAR 685)は、コブラ毒、狂犬病ウイルス、HIV1のgp120タンパク質、および黄色ブドウ球菌のエンテロトキシンBに存在するスーパー抗原と相同です。 、毒素性ブドウ球菌性ショック症候群(TSS)に関与している[図4D]。S1 / S2切断部位のこのスーパー抗原は、TCR(CMH2)を介して免疫系を活性化することができ、一部の個人ではサイトカインストームを引き起こし、ショック症候群と同様の多系統炎症性症候群(MIS)を説明します。ブドウ球菌性疾患(TSS)およびカワサキ症候群。

図[4] [9]によると
SARS-COV2スパイクタンパク質を呈するのヘビ毒神経毒の相同配列Elapilidaeのファミリーをニコチン性アセチルコリン受容体に対するアンタゴニスト活性を有する、特に配列375から390 [10] [11]、相同NL神経毒(図[5])、コブラトキシンおよびα-ブンガロトキシンに相同な前述の674-685配列[図4D] [12] [13] [14]。 このアセチルコリン受容体拮抗薬の活性は、マクロファージの活性を調節する迷走神経の抗炎症性コリン作動性経路を含む、自律神経系の麻痺および機能障害に関与していると考えられています[図6]。ニコチン作動薬、およびイベルメクチンなどのニコチン性アセチルコリン受容体α-7の正のアロステリックモジュレーター[15]は、スパイクタンパク質によって誘発されたこれらの機能障害を回復させる可能性があります。

図[5]。[10]によると、NL神経毒との二重相同性
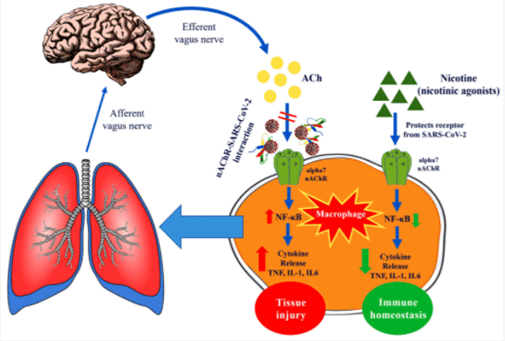
[10]からの図[6]
スパイクタンパク質は、細胞インテグリンとの相互作用の、ACE2への結合のドメインに近いそのRGDドメインにリンクされた凝固促進性および血管新生の状態を誘発する可能性があります[16] 肺レベルでの剖検は、微小血栓および血管新生の異常な存在(インフルエンザウイルスと比較してx9およびx2.7)[17]、インテグリンとの相互作用によって部分的に調節されるイベント。
血栓性イベントを引き起こしたであろうが、SARS-CoV2よりも目立たないSARS-CoV1は、インテグリンに対して親和性を有するであろうKGD相同ドメインを有する。MERS-CoVにはこの相同配列がなく、並行して血栓症の症状は報告されていません[図3]。
特定の変異体に存在する変異N501Y、N439K、Y453Fは、表面でのアクセス可能性を調節することにより、RGDドメインとインテグリンとの相互作用を改善する可能性があります。
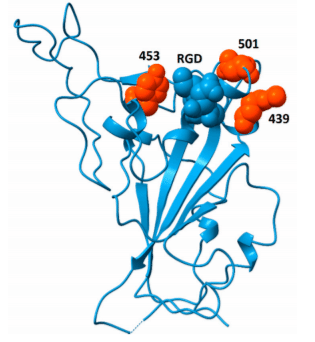
[16]からの図[7]
ハンタウイルス誘発性凝固障害との類推により、内皮浸潤は、αIIbβ3インテグリンの活性化を含む血小板の接着および活性化につながる可能性があることが示唆されている。フィブリノーゲンはαIIbβ3インテグリンに結合し、血小板表面でのトロンビンの活性によってフィブリンに変換され、血小板凝集を引き起こします。
SARS-CoV2スパイクタンパク質は、特に抗PF4抗体に依存して、免疫複合体に対する免疫アレルギーメカニズムの誘導によって血栓形成性です。
ヘパリン治療中に、血小板減少症および/または血栓症に関連する免疫アレルギー症状が、抗PF4抗体の出現に関連して発生する可能性があります。これは、血小板FcγRII受容体を活性化する免疫複合体[ヘパリン-PF-4-Ac抗PF4]の形成を伴うヘパリン起因性血小板減少症(HITタイプII)です(図[8])。抗PF4抗体に依存する免疫複合体を伴うHITタイプIIは、治療開始後少なくとも5〜15日、または以前の治療による以前の感作の場合はそれ以前に発生する可能性があります。
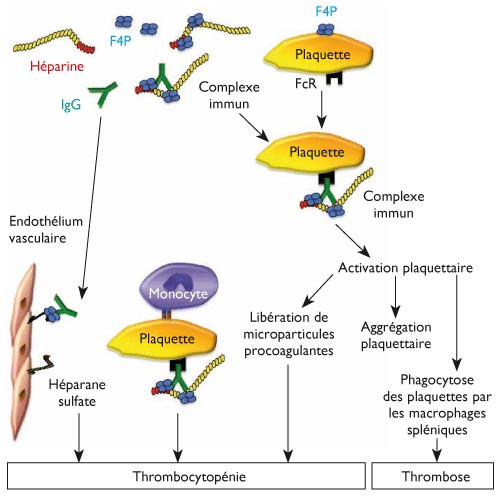
図[8] [18]によると
血小板減少症を伴う血栓症のこれらの表は、Covid 19のコンテキストでSARS-Cov2で観察されています。一部の著者は、抗抗体の存在に関連して、血栓症を伴うヘパリン起因性血小板減少症の発生率の増加を示しています。PF4、COVID-19集中治療を受けている患者[19]、他の著者は、メカニズムが抗PF4抗体の非存在下で、血小板FcγRIIa受容体を活性化する免疫複合体の形成に起因することを示しました[20]。
抗PF4抗体は、少なくとも部分的には、VIPITワクチン誘発性血栓形成促進性免疫血栓症と呼ばれるワクチン接種後の脳血栓症の最初の観察に関連しているようです[21]。スパイクタンパク質は、特に、PF-4とも呼ばれるケモカインCXCL4の放出を引き起こします[22]。PF-4の放出は、抗PF4抗体に対する免疫アレルギー反応の発症に必要な最初の条件の1つであり[23]、ヘパリンの非存在下でPF-4との免疫複合体の形成に関与する補因子は現在不明です。
SARS-CoV2スパイクS1サブユニットは血管毒性があり、肺血管細胞(内皮細胞および平滑筋細胞)の細胞シグナル伝達経路をトリガーし、肺動脈性肺高血圧症(PAH)の素因となります[24]。
肺動脈性肺高血圧症は、メディエーター(ベンフルオレクス)のスキャンダルを明らかにした病理です。肺動脈性肺高血圧症は、肺動脈圧の上昇によって引き起こされるまれな疾患であり、多くの場合、それらの内層の肥厚に関連して、右心不全を引き起こします。主な症状は進行性の息切れです。症状は非特異的であり、肺血管疾患の長期経過後にのみ強く感じられます。技術的に複雑な診断は遅れることが多く、適切な治療がない場合、診断時の生存期間の中央値は3年です。
H1N1インフルエンザ感染後の10回の死後剖検の対照群と比較して、SARS-Cov2感染後の10回の死後剖検は、SARS-Cov2感染後の肺動脈の肥厚を明らかにしました(図[9])。

[24]からの図[9]
SARS-CoV1は、肺動脈血管壁のそのような肥厚を誘発しませんでした。これは、SARS-CoV2のユニークな特性です。
肺、内皮および平滑筋血管細胞の培養物でのインビトロアッセイは、スパイクのS1サブユニットがMEK / ERKマイトジェン経路の細胞内リン酸化のカスケードを誘導し、血管壁細胞の過形成および/または肥大を促進することを示した。血管壁への有害な影響は、SARS-CoV2による侵入と複製を必要とせず、スパイクは自律的な血管毒性を持っています。
スパイクタンパク質は神経浸潤性であり、血液脳関門(BBB)を通過します...ウイルスキャプシドの有無にかかわらず
スパイクタンパク質は神経向性であり、血液脳関門を通過した後、コロナウイルスが標的細胞、特に脳細胞に侵入することを可能にします。マウスモデルでは、ウイルスキャプシドが存在しない場合でも、組換えS1タンパク質が血液脳関門を越えてこの神経浸潤機能を保持していることが示されています[25 ]。
BBBの2Dおよび3D細胞培養モデルは、スパイクタンパク質が血液脳関門のレベルでウイルスの血管毒性とは独立した血管毒性を有し、BBBの炎症と透過性を引き起こし、神経浸潤を促進することを示しています[26]。
スパイクタンパク質は、神経変性プロセスの起点で、プリオンの形成、アミロイドタンパク質の凝集および細動を誘発することができます [19]。
動物では、SARS-COV2誘導pauci-症候性呼吸器疾患、体系的に変性神経疾患に続いて、 嗅粘膜の侵攻から始まります。
-ヒトACE2受容体K18-hACE2を発現するトランスジェニックマウス[27]
K18プロモーターの依存下にあるヒトACE2受容体のSARS-COV2に感染したK18-hACE2トランスジェニックマウスは、14日以内に93%の致命的な神経変性疾患を発症しますが、肺症は中等度のままです。
神経浸潤プロセスは嗅球のレベルで始まり、D2-D3周辺の初期の無嗅覚症によって臨床的に特徴づけられました。剖検は、ウイルスマーカーの存在に関連する多発性脳海綿状態を示した。
ウイルスの向性は、さまざまな組織におけるACE2の存在と部分的にしか相関しておらず、ニューロピリン-1などの他のメカニズムがウイルスの向性に関与していることを示唆しています[4]。
-マカクで[27]
マカクでは、耳鼻咽喉科および呼吸器レベルでのSARS-Cov2感染により、中程度の症状を伴う10日間のウイルス複製が生じました。これらの10日後、脳の代謝活動のコントロールは、8匹のマカクのうち2匹で1か月間、下垂体(下垂体)の活動の増加を示しました。感染後5〜6週間後、マカクの1つであるマカクを犠牲にして、壊死させました。 (1/8)は脳のさまざまな領域にウイルスRNAを持ち、すべてのマカクはT細胞の浸潤とミクログリアの活性化を伴う多発性脳炎症を起こし、6/8は下垂体、アルファシヌクレインの沈着に富むアミロイド構造を持っていました。パーキンソン病に特徴的なプリオン様タンパク質です。シミアンモデルに関するこの研究は、10日間に限定された、無症候性または無症候性の呼吸器感染症の後、神経疾患の後に、沈着による神経変性プロセスの開始を伴うウイルスの神経浸潤能に関連する神経疾患が体系的に続くことを示しています。病気に特徴的なアミロイド構造の分析。[28]
ヒトでは、無嗅覚症はSARS-CoV2感染の主要な症状であり、SARS-CoV2の嗅粘膜を貫通した後の中枢神経系への侵入も報告されています [29]。
剖検時に中枢神経系でウイルスを探すと[30]、中枢神経系でのウイルスの存在は、ウイルスの検出による13/40を含む53%(21/40)の症例で見られます。 'RT-PCRによるRNAおよび免疫組織化学による16/40、スパイクタンパク質の症例の88%(14/16)およびヌクレオカプシドの症例の44%(7/16)で陽性。症例の20%は、RNAとウイルスタンパク質の陽性に関連しています。
持続的なコビッド後の症状(「コビッドロング」)の中で、自律神経系の機能障害が報告されており[31]、これは脳幹に対するウイルスの向性によって説明される可能性があります[32] [33]。ロングコビッド脳PETスキャンは脳代謝低下を示しています[34] [35]。
インシリコ研究は、アミロイドタンパク質の凝集と細動を誘発するスパイクタンパク質の特異性を示しています
「PRotinaceousInfectiousOnly」の頭字語であるプリオンは、核酸を含まない、もっぱらタンパク質の性質を持つ型破りな感染性病原体(NCTA)です。
感染型のプリオンは異常なタンパク質の折り畳みを示し、生理学的タンパク質にこのコンフォメーション異常を誘発することができます。これらの異常なタンパク質の凝集は、進化が遅い多くの神経変性疾患に関与しており、数年間無症候性のままである可能性があります[37] [38]。
PLAACアルゴリズムなどのインシリコ研究では、SARS-COV2のスパイクタンパク質にプリオン様ドメインが存在することが確認されています。これは、スパイクタンパク質のS1領域のRBD(受容体結合ドメイン)にプリオン様ドメインを持つ唯一のコロナウイルスです[36] [39]。このプリオン様ドメインは、SARS-CoVと比較してACE2との相互作用を10〜20倍増加させることが示唆されています[36]。
スパイクタンパク質は、RBDにヘパリン結合ドメインとヘパリン結合タンパク質を持っているため、未分画ヘパリン、および程度は低いがエノキサパリンなどの低分子量ヘパリンは、SARS-CoV2の侵入を阻害する通常の治療濃度になります[40 ]。
ヘパリン結合ドメインは病理学的アミロイドタンパク質に共通の特徴であり、ヘパリンはこれらのタンパク質の凝集を促進し、次にそれらの細動を促進します[7]。これらのヘパリン結合ドメインを有するSARS-Cov2などの特定のウイルスは、膜ヘパラン硫酸プロテオグリカンを乗っ取って、エンドサイトーシスを介して細胞に感染する可能性があります。ヘパリン結合ドメインがAβ42ペプチドと相互作用してその凝集を引き起こし、アルツハイマー病を促進する単純ヘルペスウイルスHSV1との類推により、SARS-Cov2のヘパリン結合ドメインがプリオンタンパク質Aβ42と相互作用する可能性があることが示唆されています。 α-シヌクレイン、タウ、およびプリオンは、それらの凝集を開始し、神経変性疾患の発症を促進します[7] [41] [42]

図[10] [2]によると
細胞侵入中のスパイクの活性化には、2つのプロテアーゼ、S1 / S2切断部位のフューリン(残基669-688)、次に膜貫通プロテアーゼセリン2(TMPRSS2)(残基808-820)による2つの連続した切断が必要であり、約150アミノ酸。ペプチドの自己凝集を予測することを可能にするAGGRESCANサーバーは、S-CoV-ペプチドと呼ばれるこのペプチドが機能的なアミロイド(βストランドが軸に垂直なβシートで構成される繊維状タンパク質集合体)のように振る舞う可能性があることを示しています変性剤およびプロテアーゼに耐性があり、プリオンタンパク質Aβ40およびα-シヌクレインよりも自己凝集する傾向が高い[41]。
その結果、スパイクによって誘発される神経変性効果に関する研究がない場合、スパイクのプリオン様ドメインが病的プリオンの形成を誘発し、アミロイド斑に凝集し、原因不明の神経変性効果を説明することを排除することはできません。SARS-Cov2の観察動物、マウスおよびサルモデルで。自律神経系の機能障害もプリオン病の範囲の一部であることを覚えておく必要があります[43]。
参考文献
[1] SARS-CoV-2細胞侵入は、ACE2およびTMPRSS2に依存し、臨床的に証明されたプロテアーゼ阻害剤によってブロックされます。
Hoffmann M、Kleine-Weber H、Schroeder S、KrügerN、Herrler T、Erichsen S、Schiergens TS、Herrler G、Wu NH、Nitsche A、MüllerMA、Drosten C、PöhlmannS.Cell。2020年4月16日; 181(2):271-280.e8。土井:10.1016 /j.cell.2020.02.052。
[2] SARS-CoV-2による宿主細胞感染の増強。
KielianM.Science。2020年11月13日; 370(6518):765-766 土井:10.1126 /science.abf0732。
[3] ニューロピリン-1はSARS-CoV-2感染の宿主因子です。
Daly JL、Simonetti B、Klein K、Chen KE、Williamson MK、Antón-PlágaroC、Shoemark DK、Simón-GraciaL、Bauer M、Hollandi R、Greber UF、Horvath P、Sessions RB、Helenius A、Hiscox JA、Teesalu T、Matthews DA、Davidson AD、Collins BM、Cullen PJ、YamauchiY。理科。2020年11月13日; 370(6518):861-865 土井:10.1126 /science.abd3072。
[4]ニューロピリン-1はSARS-CoV-2細胞の侵入と感染性を促進します。
Cantuti-Castelvetri L、Ojha R、Pedro LD、Djannatian M、Franz J、Kuivanen S、van der Meer F、Kallio K、Kaya T、Anastasina M、Smura T、Levanov L、Szirovicza L、Tobi A、Kallio-Kokko H 、ÖsterlundP、Joensuu M、Meunier FA、Butcher SJ、Winkler MS、Mollenhauer B、Helenius A、Gokce O、Teesalu T、Hepojoki J、Vapalahti O、Stadelmann C、Balistreri G、SimonsM.Science。2020年11月13日; 370(6518):856-860 土井:10.1126 /science.abd2985。
[5] ACE2-SARS-CoV-2感染の追加の宿主細胞メディエーターの探求:COVID-19に関与する新規SARS-CoV-2宿主細胞侵入メディエーターとしてのニューロピリン-1(NRP1)。
Kyrou I、Randeva HS、Spandidos DA、KarterisE.SignalTransduct TargetTher。2021年1月18日; 6(1):21。土井:10.1038 / s41392-020-00460-9。
[6] SARS-CoV-2による宿主細胞侵入におけるインテグリンの潜在的な役割。
Sigrist CJ、Bridge A、Le Mercier P. AntiviralRes。2020年5月; 177:104759。土井:10.1016 /j.antiviral.2020.104759。
[7] SARS-CoV-2細胞の侵入および感染を阻止するための新規治療法としてのヘパリン結合ペプチド。
Tavassoly O、Safavi F、TavassolyI.MolPharmacol。2020年11月; 98(5):612-619 土井:10.1124 /molpharm.120.000098。
[8]過炎症患者の歪んだTCRレパートリーによってサポートされるSARS-CoV-2スパイクに特有のインサートのスーパー抗原特性。
Cheng MH、Zhang S、Porritt RA、Noval Rivas M、Paschold L、Willscher E、Binder M、Arditi M、BaharI.Proc Natl AcadSci US A.2020 Oct 13; 117(41):25254-25262。土井:10.1073 /pnas.2010722117。
[9]過炎症患者の歪んだTCRレパートリーによってサポートされるSARS-CoV-2スパイクに特有のインサートのスーパー抗原特性。
Cheng MH、Zhang S、Porritt RA、Noval Rivas M、Paschold L、Willscher E、Binder M、Arditi M、BaharI.Proc Natl AcadSci US A.2020 Oct 13; 117(41):25254-25262。土井:10.1073 /pnas.2010722117。
[10] ニコチン性コリン作動性システムとCOVID-19:SARS-CoV-2とニコチン性受容体の間の相互作用のインシリコ同定と潜在的な治療標的化の意味。
Farsalinos K、Eliopoulos E、Leonidas DD、Papadopoulos GE、Tzartos S、PoulasK.Int J MolSci。2020年8月13日; 21(16):5807 土井:10.3390 / ijms21165807。
[11] ニコチン性コリン作動系およびCOVID-19:α7ニコチン性アセチルコリン受容体とSARS-Co-VおよびSARS-CoV-2スパイク糖タンパク質の潜在的エピトープとの間の相互作用のインシリコ同定。
Lagoumintzis G、Chasapis CT、Alexandris N、Kouretas D、Tzartos S、Eliopoulos E、Farsalinos K、PoulasK.FoodChemToxicol。2021年3月; 149:112009。土井:10.1016 /j.fct.2021.112009。
[12]予防的および治療的意味を持つCovid-19のニコチン性仮説。
Changeux JP、Amoura Z、Rey FA、Miyara MC RBiol。2020年6月5日; 343(1):33-39。土井:10.5802 /crbiol.8。
[13]シミュレーションは、SARS-CoV-2スパイクタンパク質とニコチン性アセチルコリン受容体との相互作用をサポートし、サブタイプの特異性を示唆しています。
Oliveira ASF、Ibarra AA、Bermudez I、Casalino L、Gaieb Z、Shoemark DK、Gallagher T、Sessions RB、Amaro RE、MulhollandAJ.bioRxiv。2020年7月21日:2020.07.16.206680。土井:10.1101 /2020.07.16.206680。プレプリント。
[14] SARS-CoV-2スパイクタンパク質とニコチン性アセチルコリン受容体の間の潜在的な相互作用。
Oliveira ASF、Ibarra AA、Bermudez I、Casalino L、Gaieb Z、Shoemark DK、Gallagher T、Sessions RB、Amaro RE、MulhollandAJ。BiophysJ。2021 Feb 18:S0006-3495(21)00146-6。doi:10.1016 / j.bpj.2021.01.037
[15] イベルメクチン:alpha7ニューロンのニコチン性アセチルコリン受容体の正のアロステリックエフェクター。
Krause RM、Buisson B、Bertrand S、Corringer PJ、Galzi JL、Changeux JP、Bertrand D. Mol Pharmacol 1998年2月; 53(2):283-94。土井:10.1124 /mol.53.2.283。
[16] SARSCoV-2スパイクタンパク質における不正なRGDモチーフを介したインテグリン結合の生物学的および臨床的結果。
Makowski L、Olson-Sidford W、W-WeiselJ。ウイルス。2021年1月20日; 13(2):146。土井:10.3390 / v13020146。
[17] Covid-19における肺血管内皮炎、血栓症、および血管新生。
Ackermann M、Verleden SE、Kuehnel M、Haverich A、Welte T、Laenger F、Vanstapel A、Werlein C、Stark H、Tzankov A、Li WW、Li VW、Mentzer SJ、Jonigk DN Engl JMed。2020年7月9日; 383(2):120-128。土井:10.1056 / NEJMoa2015432。
[18]ヘパリンと皮膚反応:診断から
治療までNeda Barouti、IsabelleMasouyé、Wolf-Henning Boehncke、Christa Prins
Rev Med Suisse 2013; 9.705-711巻
[19]重度のCOVID-19におけるヘパリン起因性血小板減少症
DavietF、Guervilly C、Baldesi O、Bernard-Guervilly F、Pilarczyk E、Genin A、Lefebvre L、Forel JM、Papazian L、Camoin-JauL。サーキュレーション。2020年11月10日; 142(19):1875-1877 土井:10.1161 / CIRCULATIONAHA.120.049015
[20]ヘパリン起因性血小板減少症が疑われる重症のCOVID-19患者で同定された血小板活性化免疫複合体。
Nazy I、Jevtic SD、Moore JC、Huynh A、Smith JW、Kelton JG、Arnold DM.JThrombHaemost。2021年2月27日:10.1111 /jth.15283。土井:10.1111 /jth.15283。
[21]コロナウイルス19ワクチン接種後のヘパリン誘発血小板減少症に似た血栓性血小板減少症
アンドレアス・グレイナッハー、トーマス・ティーレ、セオドア・E・ワーケンティン、カリン・ワイサー、ポール・カイル、サビーネ・アイヒンガー
DOI:10.21203 / rs.3.rs-362354 / v1
[ 22] SARS-CoV-2は血小板ACE2に結合し、COVID-19の血栓症を増強します。
Zhang S、Liu Y、Wang X、Yang L、Li H、Wang Y、Liu M、Zhao X、Xie Y、Yang Y、Zhang S、Fan Z、Dong J、Yuan Z、Ding Z、Zhang Y、Hu LJ HematolOncol。2020年9月4日; 13(1):120。土井:10.1186 / s13045-020-00954-7。
[23]ヘパリン誘発性血小板減少症の発生率、病態生理学および治療におけるPF4の役割の強調。
Prechel MM、WalengaJM.Thromb J. 2013年4月5日; 11(1):7。土井:10.1186 / 1477-9560-11-7。
[24]肺血管細胞におけるSARS-CoV-2スパイクタンパク質を介した細胞シグナル伝達。
Suzuki YJ、Nikolaienko SI、Dibrova VA、Dibrova YV、Vasylyk VM、Novikov MY、Shults NV、Gychka SG.VasculPharmacol。2021年4月; 137:106823 土井:10.1016 /j.vph.2020.106823。Epub 202011月21日。
[25] SARS-CoV-2のS1タンパク質は、マウスの血液脳関門を通過します。
Rhea EM、Logsdon AF、Hansen KM、Williams LM、Reed MJ、Baumann KK、Holden SJ、Raber J、Banks WA、EricksonMA。ナット神経科学。2021年3月; 24(3):368-378。土井:10.1038 / s41593-020-00771-8。
[26]ヒト血液脳バリアの2D静的および3Dマイクロ流体invitroモデルにおけるSARS-CoV-2スパイクタンパク質はバリア機能を変化させる。
Buzhdygan TP、DeOre BJ、Baldwin-Leclair A、Bullock TA、McGary HM、Khan JA、Razmpour R、Hale JF、Galie PA、Potula R、Andrews AM、Ramirez SH NeurobiolDis。2020年12月; 146:105131。土井:10.1016 /j.nbd.2020.105131。
[27] K18-hACE2マウスにおけるSARS-CoV-2の致命的な神経浸潤は、hACE2の発現に部分的に依存している
Mariano Carossino、Paige Montanaro、Aoife O'Connell、Devin Kenney、Hans Gertje、Kyle A. Grosz、Susanna A. Kurnick、Markus Bosmann、Mohsan Saeed、Udeni BR Balasuriya、Florian Douam、Nicholas A. Crossland
doi:https: //doi.org/10.1101/2021.01.13.425144
[28] SARS-CoV-2は、マカクに脳の炎症を引き起こし、レビー小体の形成を誘発します
。 Roos、Bernadette Schurink、Marianna Bugiani、Ronald E. Bontrop、Jinte Middeldorp、Willy M. Bogers、Lioe-Fee de Geus-Oei、Jan AM Langermans、Marieke A. Stammes、Babs E. Verstrepen、Ernst J.
VerschoorbioRxiv。 プレプリント。2021年2月23日doi:https: //doi.org/10.1101/2021.02.23.432474
(29] COVID-19患者の中枢神経系侵入のポートとしての嗅覚経粘膜SARS-CoV-2浸潤。MeinhardtJ
、Radke J、Dittmayer C、Franz J、Thomas C、Mothes R、Laue M、Schneider J、 BrüninkS、Greuel S、Lehmann M、Hassan O、Aschman T、Schumann E、Chua RL、Conrad C、Eils R、Stenzel W、Windgassen M、RößlerL、Goebel HH、Gelderblom HR、Martin H、Nitsche A、Schulz- Schaeffer WJ、Hakroush S、Winkler MS、Tampe B、Scheibe F、KörtvélyessyP、Reinhold D、Siegmund B、KühlAA、Elezkurtaj S、Horst D、Oesterhelweg L、Tsokos M、Ingold-Heppner B、Stadelmann C、Drosten C、 Corman VM、Radbruch H、HeppnerFL.NatNeurosci。20212月; 24(2):168-175。Doi:10.1038 / s41593-020-00758-5
[30] ドイツにおけるCOVID-19患者の神経病理学:事後モーテムケースシリーズ。
Matschke J、LütgehetmannM、Hagel C、Sperhake JP、SchröderAS、Edler C、Mushumba H、Fitzek A、Allweiss L、Dandri M、Dottermusch M、Heinemann A、Pfefferle S、Schwabenland M、Sumner Magruder D、Bonn S、Prinz M、Gerloff C、PüschelK、Krasemann S、Aepfelbacher M、Glatzel M. Lancet Neurol 2020年11月; 19(11):919-929 土井:10.1016 / S1474-4422(20)30308-2。
[31] 「長いCOVID」における自律神経機能障害:理論的根拠、生理学および管理戦略。
Dani M、Dirksen A、Taraborrelli P、Torocastro M、Panagopoulos D、Sutton R、Lim PB.Clin Med(ロンドン)。2021年1月; 21(1):e63-e67。土井:10.7861 /clinmed.2020-0896。
[32]自律神経センターとCOVID-19の病態生理学。
Chigr F、Merzouki M、Najimi M.ACSChemNeurosci。2020年6月3日; 11(11):1520-1522 土井:10.1021 /acschemneuro.0c00265。
[33] ロングCOVIDにおける持続性脳幹機能障害:仮説。
Yong SJ.ACSChemNeurosci。20212月17日; 12(4):573-580 土井:10.1021 /acschemneuro.0c00793。
[34] (18)SARS-CoV-2感染後のF-FDG脳PET代謝低下:持続性/遅延性障害の基質?
Guedj E、Million M、Dudouet P、Tissot-Dupont H、Bregeon F、Cammilleri S、Raoult D. Eur J Nucl Med Mol Imaging 2021年2月; 48(2):592-595 土井:10.1007 / s00259-020-04973-x。
[35] (18)長いCOVID患者におけるF-FDG脳PET代謝低下。
Guedj E、Campion JY、Dudouet P、Kaphan E、Bregeon F、Tissot-Dupont H、Guis S、Barthelemy F、Habert P、Ceccaldi M、Million M、Raoult D、Cammilleri S、EldinC。EurJ Nucl Med MolImaging。2021年1月26日:1-11.doi:10.1007 / s00259-021-05215-4。
[36]スパイクタンパク質のSARS-CoV-2プリオン様ドメインはACE2へのより高い親和性を可能にします。
テッツ、G。; Tetz、V.
予稿集 2020、2020030422(DOI:10.20944 / preprints202003.0422.v1)。
[37] 神経変性疾患におけるプリオン様タンパク質封入体の伝播。
Goedert M、Clavaguera F、TolnayM.TrendsNeurosci。2010年7月; 33(7):317-25。土井:10.1016 /j.tins.2010.04.003。
[38]神経変性疾患におけるタンパク質凝集体のプリオン様感染。
Brundin P、Melki R、KopitoR.Nat Rev Mol CellBiol。2010年4月; 11(4):301-7。土井:10.1038 / nrm2873。
[39]真核生物ウイルスのプリオン様ドメイン。
Tetz G、TetzV.SciRep。2018年6月12日; 8(1):8931 土井:10.1038 / s41598-018-27256-w。
[40]ヘパリンはSARS-CoV-2による細胞浸潤を阻害する:スパイクS1受容体結合ドメインとヘパリンとの相互作用の構造依存性。
Mycroft-West CJ、Su D、Pagani I、Rudd TR、Elli S、Gandhi NS、Guimond SE、Miller GJ、Meneghetti MCZ、Nader HB、Li Y、Nunes QM、Procter P、Mancini N、Clementi M、Bisio A、 Forsyth NR、Ferro V、Turnbull JE、Guerrini M、Fernig DG、Vicenzi E、Yates EA、Lima MA、SkidmoreMA.ThrombHaemost。2020年12月; 120(12):1700-1715 土井:10.1055 / s-0040-1721319。
[41] COVID-19感染の長期合併症の可能性としてのSARS-CoV-2による脳タンパク質凝集の播種。
Tavassoly O、Safavi F、Tavassoly I.ACSChemNeurosci。2020年11月18日; 11(22):3704-3706 土井:10.1021 /acschemneuro.0c00676。
[42] SARS-CoV-2スパイクタンパク質とアミロイド形成タンパク質との相互作用:神経変性の潜在的な手がかり。
Idrees D、Kumar V. Biochem Biophys ResCommun。2021年3月24日; 554:94-98。土井:10.1016 /j.bbrc.2021.03.100。
[43] 神経障害における自律神経不全への臨床的アプローチ。
BenarrochEE.Nat RevNeurol。2014年7月; 10(7):396-407。土井:10.1038 /nrneurol.2014.88。
著者:FranceSoir
この記事が気に入ったらサポートをしてみませんか?
