mRNA COVID-19ワクチン接種後の水痘帯状疱疹ウイルス感染の持続は、病変部におけるコード化スパイクタンパク質の存在と関連することが明らかになった
気になったのでメモしておきます。
https://onlinelibrary.wiley.com/doi/10.1002/cia2.12278
Mayuko Yamamoto MD, PhD,Misaki Kase MD,Hozumi Sano MD,Reiko Kamijima … See all authors
First published: 25 August 2022
https://doi.org/10.1002/cia2.12278
ケーススタディ mRNA COVID-19ワクチン接種後の水痘帯状疱疹ウイルス感染の持続は、病変部におけるコード化スパイクタンパク質の存在と関連していたhttps://t.co/QFIfa9uCs5
— ohagi🇯🇵 (@fgidf98fj9jh0h) August 29, 2022
概要
背景
COVID-19ワクチン接種キャンペーンが開始されて以来,世界中でワクチン接種後のさまざまな皮膚副作用が報告されている.水痘帯状疱疹ウイルス(VZV)の再活性化は,COVID-19 mRNAワクチン,特にBNT162b2ワクチン接種後の男性で最も頻度の高い皮膚反応であると報告されている。
目的
BNT162b2ワクチン接種後,3カ月以上の長期にわたって皮膚症状が持続した患者を対象に,VZVウイルスおよびワクチン由来のスパイク蛋白の関与について検討した。
材料と方法
VZVウイルスおよびCOVID-19ワクチンmRNAにコードされるスパイク蛋白の検出のための免疫組織化学。VZVウイルスのPCR解析。
結果
これらの病変は、PCR解析および免疫組織化学的手法によりVZV感染と診断された。真皮の小胞性角化細胞や内皮細胞にCOVID-19ワクチンでコードされたスパイク蛋白が発現していたことが印象的であった。
考察
COVID-19のmRNAワクチン接種により,免疫系が撹乱され,VZVの持続的な再活性化が誘導される可能性があるが,発現したspikeタンパクが病原性を有するかどうかは不明であった.
結語
今回,COVID-19 mRNAワクチン接種後にVZVが持続感染し,患部皮膚にspike proteinを発現した1例を報告した.今後,ワクチンの副作用に注意し,SPの役割について検討する必要がある.
1 はじめに
2019年に中国から流行した重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2またはCOVID-19)の世界的な大流行により、COVID-19ワクチンの開発が急がれるようになりました。これまで、COVID-19ワクチン接種後の皮膚反応として、注射部位反応、いわゆるCOVIDアーム、蕁麻疹反応、臼状皮疹、小水疱性病変、バラ色粃糠疹様病変、紫斑、血管炎、血栓、潰瘍、ヘルペスウイルスの再活性化などが世界中で報告されています1, 2。
これまでの研究で、最も頻度の高い皮膚反応は、女性ではコビド腕(38.1%)、男性では水痘帯状疱疹ウイルス(VZV)の再活性化(20%)であることが明らかになっています。2 mRNAコビド19ワクチン接種に伴う皮膚反応(以下、CVSR)の基礎的な病理メカニズムはほとんど分かっていません。1-3 VZVの再活性化は、加齢による免疫力の低下や、免疫抑制剤、HIV感染、悪性腫瘍などによる免疫不全の状態で生じることが多い。COVID-19感染やCOVID-19ワクチン接種に伴うVZV再活性化の報告では,VZVに対する細胞性免疫の異常が潜伏状態からの再活性化を可能にしたと考えられる2, 4, 5.今回,我々はCOVID-19ワクチン接種後にVZV持続感染を認めた1例を報告する.
2 症例提示
64歳男性,プレドニゾロン(5 mg/日),タクロリムス(1.5 mg/日),メトトレキサート(10 mg/週)による治療下で関節リウマチを発症していたが,両脚と手に痛みを伴う皮膚発疹を発症した.発疹は,mRNA COVID-19ワクチンBNT162b2の初回接種後13日目に発症した.2回目のBNT162b2接種後に病変が増悪し,2日後に当院を紹介された。初診時,下肢に小水疱,右手背と左膝窩に壊死性結節を認めた(図1A).発熱や全身症状はなかった。臨床検査では,凝固異常を示唆する軽度のdダイマー上昇を除き,血球数,肝機能,腎機能に著明な変化はなかった.本症例は有痛性の小水疱性病変を有していたため,単純ヘルペスの診断のもとにバラシクロビル1日1000 mgを5日間投与したが,ほとんど効果がなかった.その後,左膝窩の壊死性結節から生検を行った。病理組織学的に,表皮は壊死し,真皮中層から深層にかけて閉塞性血管障害,好中球,白血球減少,フィブリン滲出,滲出性赤血球,微小血栓を伴う炎症性浸潤が認められた(図1B,C)。また、皮下脂肪組織にはリンパ球の浸潤が見られた(図1D)。組織学的に壊死性血管炎と診断された。発症88日目には、小水疱の一部が壊死性結節となり(図2A)、両脚に新たに赤斑上の小水疱群が発生した(図2B)。また,右膝窩に圧痛,触知可能な紐状の皮下結節があり,表在性血栓性静脈炎が疑われた(図2C).小水疱性発疹を生検し,病理組織学的に真皮内の血管周囲に巨細胞や単核球が浸潤した表皮内小水疱を認めた(図2D).抗VZVによる免疫染色では、小胞内の変性したケラチノサイトが陽性となり、VZV感染と最終診断された(図2E)。そこで、2ヶ月間隔の初期と後期に採取した2つの生検標本、すなわち壊死性結節と小胞からそれぞれ抽出したDNAを用いて、PCRでVZVを確認した(図2F)。バラシクロビルを1日3000mgの用量で7日間投与したところ、すべての皮膚病変が改善された。併せて、3ヶ月にも及ぶ持続性多発性皮膚炎VZVと診断した。したがって,散発的な壊死性結節と有痛性皮下結節も,最近報告されたようにmRNA COVID-19ワクチン接種後のVZVによる小血管炎と診断された6.

図1
図ビューアーで開く
パワーポイント
臨床症状および病理組織学。(A)初診時(発症10日目、BNT162b2 2回目投与2日後)の臨床的特徴。四肢に有痛性の壊死性結節と小水疱を認める。R、右。L、左。(B)右膝窩の壊死性結節の病理組織像(発病24日目).(B)表皮と真皮の壊死性変化(H&E染色。 原倍率40倍)。(C)好中球の炎症性浸潤、白血球破砕、フィブリン滲出を伴う真皮中層から深層の閉塞性血管障害(×200)。(D)脂肪組織に限局した単核球浸潤(100倍)。

図2
図ビューアーで開く
パワーポイント
発症から88日目の臨床症状とVZVの検出。(A)壊死性結節。(B)小水疱の群れ。(C)疼痛を伴う皮下結節(点線丸)。(D) 小水疱の病理組織像(H&E, ×100)。E)抗VZV抗体による免疫染色(400倍)で矩形部分を拡大した。(F) PCRによるVZV DNAの検出。1, 2;本症例(S.T.)の発症24日目および88日目に採取した皮膚の生検体。3-5;表示通りのコントロール。βグロビン遺伝子はローディングコントロール
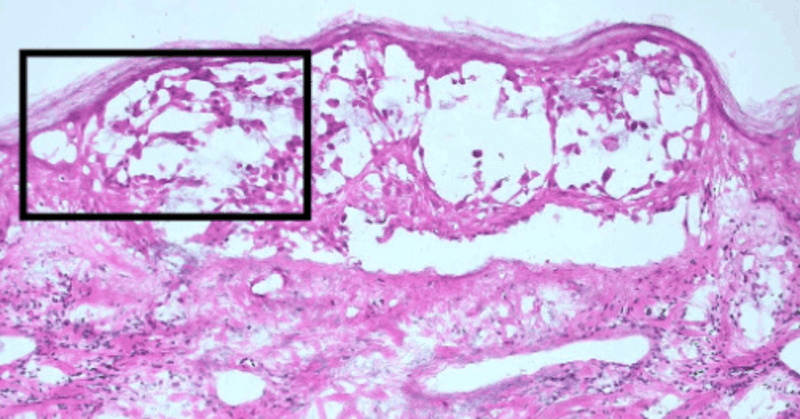
彼の病変と、発症の 13 日前と 8 日後に投与された mRNA COVID-19 ワクチン接種との関連が疑われたため、病変におけるエンコードされたスパイクタンパク質の発現を調査しました。驚くべきことに、抗コロナウイルススパイクタンパク質(SP)抗体を用いた免疫染色により、表皮の小胞内細胞(図 3A、B)および真皮の炎症血管の内皮細胞(図 3A、C、D)におけるSP発現が明らかになりました。この研究では二重染色戦略が実行されなかったため、VZV感染ケラチノサイトがSPタンパク質を共発現したかどうかは特定されませんでした。さらに、SPは、ヘルペス血管炎病変の下にある皮下脂肪組織の細静脈の内皮細胞にも見られました(図 S1 )。SP 発現は、抗体の非特異的染色によるものではないことに注意してください。これは、VZV 発現が明確に検出された一方で、mRNA COVID-19 ワクチンとは無関係の患者の小胞病変で同じ抗体によってシグナルが観察されなかったためです (図 S2 )。

図3
図ビューアーで開く
パワーポイント
SARS-COV-2のスパイクタンパク質(SP)の検出。(A) 抗SP抗体で免疫染色した矩形領域で強調した図2Dと同じサンプルのH&E画像(100倍)(B-D)。(B) 小胞内細胞におけるSPの発現(矢印、×200)。(C,D)H&E染色(黒矢印、×400)で対応する画像に示された、炎症を起こした血管内皮細胞における局所的なSPの発現(白矢印、×400)。
3 結論
一般に、無傷の細胞性および体液性免疫は、ウイルスの再感染に対する保護において主要な役割を果たします。しかし、最近の研究では、体液性免疫ではなく細胞性免疫が VZV 再活性化の保護に不可欠であることが明らかになりました。7 VZV の再活性化は、最も頻繁に発生する CVSR の 1 つと報告されています。2 VZV の再活性化と mRNA の COVID-19 ワクチン接種との関係は不明のままですが、細胞性免疫の調節不全が病原性の役割を果たしている可能性があります。2、4、5、8さらに、最近の研究では、ワクチン接種後の播種性多皮膚 VZV 感染の症例が示されました。9本研究は、多皮膚小胞、壊死性血管炎および表在性血栓性静脈炎様病変を含む非典型的な臨床症状を示す持続性 VZV 感染の非常にまれな症例を表しており、これはおそらく BNT162b2 の 2 回投与に関連して 3 か月も持続した。COVID -19 感染に関連する VZV の再活性化も報告されており、これには多皮膚性帯状ヘルペス (HZ) および血管炎を模倣する非定型 HZ が含まれており、10、11 T 細胞性免疫の抑制状態は、両方によって誘発される共通の状態である可能性があることを示唆しています。 COVID-19感染とmRNA COVID-19ワクチン。4したがって、SPは、VZVの再活性化とその持続、および皮膚血管障害と血栓症を可能にする免疫抑制の原因である可能性があります。12、13最近の文献では、mRNA COVID -19 ワクチン接種に関連する VZV 再活性化が、免疫抑制薬で治療された関節リウマチ (RA) を含む自己免疫疾患患者で優先的に発生したことが明らかになりました。14、15私たちの RA 患者は、プレドニゾロン、タクロリムス、およびメトトレキサートを 10 年以上服用しており、mRNA ワクチン接種後の VZV 感染の長期化に寄与した可能性があります。VZV の活性化が数ヶ月以上持続する症例が 3 つの文献に記載されており、そのうち 2 例は HIV 感染を併発していました16 。、17 、およびリンパ腫の化学療法の結果として重度の免疫不全状態にある別の患者は、CD4細胞数が100 / mm 3未満に減少したことを示しています。18しかし、私たちの患者は、COVID-19 ワクチン接種前に RA の治療を受けていたにもかかわらず、臨床的に免疫不全ではなかったため、T 細胞免疫に深刻な影響を与えたと考えられます。
本患者の患部皮膚に検出されたSPは,これまで報告されたことがないものであった.実際、小胞病変の小胞ケラチノサイトとその下にある皮膚内皮細胞はSPを発現していた。さらに、血管炎病変の内皮細胞にもSPが見いだされた。病変部におけるSPの病原性は不明であったが、BNT162b2のウリジン全塩基をメチルシュードウリジンに置換したRNAの安定化により、あらゆる細胞からコードされたSPが長時間生産され、皮膚を含む防御免疫系の微小環境に持続的な影響を及ぼすのではないかというもっともな仮説が立てられた。我々の研究の弱点は、SPの存在が免疫組織化学によってのみ示唆されたことである。したがって、今後、他の方法、例えばウェスタンブロッティングなどを用いてSPの同定を行うことが必要であろう。
以上,COVID-19 mRNAワクチン接種後にVZVが持続感染し,患部皮膚にSPを認めた1例を報告した.今後,ワクチンの副作用に注意し,SPの役割を調査することが必要である.
謝辞
なし
利益相反
Dr. Shigetoshi SanoはJournal of Cutaneous Immunology and Allergy Editorial Boardのメンバーである。本論文の査読プロセスの管理、および編集上のすべての意思決定は、編集長が行った。他の著者は利害関係を示さない。
宣言
研究計画書の承認 この研究には、ヒトの参加者は含まれていない。
インフォームドコンセント。該当なし。
研究/試験の登録と登録番号。該当なし。
動物実験。該当なし。
________________________________________________
この記事が気に入ったらサポートをしてみませんか?
