グラフェン系材料の安全性評価⑤生殖・発達及び中枢神経への影響評価
グラフェン系材料の生殖・発達への影響
妊娠中の女性、胎児、新生児は最も脆弱な集団であるため、GBM の危険性評価に関して特に注意が必要である。妊娠中は、粒子動態およびその後の生物学的影響に影響を及ぼすと予想される大きな生理的変化が生じる。同様に、発育中の胎児や新生児は、器官形成の進行、生理的変化、免疫系の未熟さなどにより、成人よりも異種物質の毒性作用を受けやすい。現在までのところ、GBMが胎盤関門や生殖器官に到達できるかどうかは不明である。空気-肺、皮膚、および腸のバリアにおけるナノ粒子の移動が少ないこと(198)、および血流からのGBMのクリアランスが速いこと(上述)は、現在一般的な吸入および経口曝露シナリオでは急性曝露が少ないことを主張することになる。しかしながら、GBMの新たな生物医学的用途およびこれらの物質の慢性的な曝露による組織蓄積の可能性は、GBMの潜在的な生殖および発達リスクに対して細心の注意が必要であることを明確に示唆している。
ナノ粒子が妊娠および胎児の健康を阻害する可能性があるという最初の兆候は、妊娠中の母親の大気汚染(特に、2.5μm未満の粒子状物質)への曝露が、低出生体重や早産などの有害な出生結果と関連するという疫学研究から得られた(文献(199)に総説あり)。その結果、ナノ粒子の胎盤移行と生殖・発育系への影響に関する研究が強化された。カーボンナノチューブを含む炭素系ナノ材料は、妊娠や胚・胎児の発育に悪影響を与える可能性があることが示唆されている(200)。(しかし、GBM については、既存の文献があまりにも限られており、その結果も相反するため、その潜在的な生殖・発育リスクに関する確固とした結論を導き出すことができない(200)。マウスに小型あるいは大型のGOを静脈内および腹腔内注射しても、雄の生殖能力および生殖には影響がなかった(201)し、GOへの肺曝露によっても影響はなかった(202)。(202) また、雄マウスにGO、(89) FLG、酸化FLG、PEG化FLGを静脈内投与しても、精巣組織へのダメージは見られなかった。(93) また、単層あるいは数層の小さな (20-150 nm) および大きな (200-1500 nm) rGO を受精前後に注射しても、雌マウスの性ホルモンに変化はなかった (203)。(203)しかし、後者の研究では、小さなrGOを妊娠後期に注射した場合、流産、奇形胎児、妊娠マウスの死亡につながったことが観察された。従って、これらの観察結果から、rGOに暴露されたマウスは、投与量によっては健康な子供を産む可能性はあるが、黄体ホルモン(妊娠に近い描画)のある雌ではrGOの毒性を真剣に検討する必要がある。(203) GBMの発生毒性は、ゼブラフィッシュやニワトリなど他の種でも報告されているが (204,205)、これらのモデルは哺乳類の母胎-胎盤-胚・胎児の関係を持たないため、ヒトの発生・生殖毒性評価に対する予測価値は限定的であると言える。
胎盤は、母体と胎児の境界を形成し、ガス、栄養素、老廃物の交換、ホルモン分泌、胎児-母体の免疫寛容、病原体や異種生物に対する胎児の保護などの必須機能を仲介することにより、妊娠を成功に導く。したがって、胚の胎児毒性リスクを推定するためには、GBMの胎盤移行と影響を理解することが重要である。しかし、妊娠のさまざまな段階において、GBMが胎盤関門を通過するかどうか、またどのような経路で通過するかは、現在のところ不明である。妊娠後期の妊娠マウスに125I-rGOを静脈注射した後、胎盤または胎児組織への経胎盤移行を調べた1件の研究では、微量の放射能(適用線量の約0.3%)しか測定されていないが、これも遊離125Iが移行した結果かもしれない(205)。 それでも、MWCNTなどの炭素系物質を含む妊娠中の異なるナノ粒子について胎盤移行が報告されている。(206-208) 興味深いことに、カーボンナノ材料の胚胎児毒性効果は、必ずしもナノ粒子の胎盤移行(直接効果) と相関しておらず、母体と胎盤組織に対する粒子の悪影響(間接効果)に起因する可能性があ る。(209,210) 小さな rGO では、妊娠後期に注入した後、明らかな粒子の移動なしに奇形胎児と流産が見 られた(205)。
著者らは、母体マウスで小さなrGOによって誘発された悪影響(例えば、白血球数の減少)が、観察された発生毒性を間接的に説明する可能性があることを示唆した。また、母体マウスにGOを含む飲料水(0.5mg/mL)を与えたところ、子マウスの成長が低下したことも、母体を介した影響の一例である。(211)胎盤を介したGBMの潜在的な影響、例えば胎盤の生存率および機能性への干渉については、これまで広範に検討されてこなかった。しかし、グラフェン・フラグシップにおける最近の研究では、ヒトBeWo絨毛細胞に対する4つのGOサンプルの影響について、GOシートの内在化にもかかわらず、最大40μg/mLの濃度で48時間曝露しても明らかな細胞毒性を示さなかった。(212) 一方、GOへの曝露は、フルオレセインナトリウムの転 移が一時的に増加し、ヒトコリオゴナドトロピン分泌がわずかに 減少したことから明らかなように、絨毛膜バリアの一過性の開 放を誘起した(212)。(212)これらの観察は、胎盤の機能性および母体と胎児の健康に対するGBMの長期的影響に関するさらなる研究の必要性を強調するものである。後者の研究では、rGOは全身に注入され、物質の比較的大きなサイズ(平均サイズ:342nm)は、明らかに脳への侵入の障害にはならなかった。213) 全体として、胎盤、生殖および発育機能に対する GBM の潜在的な干渉についての理解を深めることは、GBM の持続可能かつ安全な使用にとって不可欠である。特に、他の炭素系ナノ材料では生殖および発育毒性が報告されているためである(209,214)。(209,214) GBMの胎盤移行と影響に関する研究では、in vivo研究を補完し、胎盤の構造と機能における種特異的な違いによる結果の外挿における不確実性を避けるために、ヒトモデル(例えば、ex vivo胎盤灌流、胎盤摘出培養、胎盤マイクロティッシュ)を利用することが可能である。(215)
最後に、生殖・発生系に対するGBMの直接的影響に加えて、母体および胎盤組織に対するGBMの間接的影響およびメディエーターの放出は、子宮内の敵対的環境の創出が、妊娠合併症および後年の疾患発症のリスクを高めると考えられることから、注目に値すると思われる。
グラフェン系材料の中枢神経系への影響
グラフェンは、高い導電性、透明性、柔軟性などのユニークな物理化学的特性により、神経調節治療用の優れた性能を持つ機能的脳インプラントの設計や、中枢神経系(CNS)損傷の神経再生に不可欠な機能的ニューロンおよびグリア細胞ネットワークの再構成を支援する足場の設計に適した材料であり、神経科学において有望視されている(216)。(216) 特に神経学に関連するのは、多様な治療アプリケーションの要件を満たすために、正確な標的投与を可能にする薬剤のオンデマンド放出である。当然ながら、グラフェンを用いた多機能ニューロデバイスの実現には、脳細胞や神経回路が注射や移植によってこの材料に直接さらされることになるため、グラフェンおよびその誘導体の安全性評価が最も重要である。以下では、GBMとCNSとの相互作用について説明する。
グラフェン・フラグシップで実施された研究により、GBMは、その固有の特性の関数として、さまざまな方法でCNSの細胞と相互作用し、障害を与えることができることが明らかにされている(217,218)。(217,218)そのため、GOの長期曝露に対する脳細胞の反応を調査したところ、横方向のサイズに関連した細胞毒性が明確に指摘された(217)。(217) CNSの関連構造に属する細胞を培養し、異なる横方向寸法を持つGOフレークの効果を評価した。解離したラット海馬または大脳皮質の神経細胞およびグリア細胞を、大小の GO の 10 μg/mL 分散液の存在下で培養した。(217) 6-8 日間の培養後、大きなマイクロメーターサイズの GO の薄片は、明白な神経膠細胞および神経細胞の損失を誘発したようである。興味深いことに、同じ濃度のFLGで細胞を処理した場合、神経細胞とグリア細胞のいずれにおいても細胞密度や生存率の低下は観察されなかったことから、CNS細胞の試験管内での生存は、グラフェンシートの寸法とその化学組成に大きく依存するようであることが示された(217)。(しかし、細胞毒性がないとしても、GBMへの曝露がもたらす神経細胞やグリア機能への他の潜在的影響を排除することはできない(217)。(217)これらの実験では、パッチクランプ記録と蛍光イメージングを用いて、FLGおよびGOナノシート(横寸法約100 nm)を、1または10 μg/mLの濃度で含む成長培地に細胞を1週間暴露したときに、シナプスシグナル伝達を妨害する能力を確認した。両濃度のFLGを介在させたニューロンの受動的な細胞特性、ニューロンネットワーク構成、およびネットワーク全体の活性は、対照の海馬細胞と変わらなかった。その代わりに、小さなGOフレークは、細胞生存率には影響を与えないものの、神経細胞のシナプスに特異的に干渉した。(217)特に、GOの低濃度では、ネットワークシナプス活性は変化しなかったが、10μg/mLでは、シナプス後電流周波数の有意な減少が検出された。このように、高濃度のGOナノフレークは、シナプス活性を特異的にダウンレギュレートすることができるようである。また、GOナノフレークは興奮性(グルタミン酸AMPA受容体を介した)シナプスのみを障害し、抑制性GABAAを介した接続は障害しないことが示された(217)。(217)著者らは、興奮性シナプス前末端と抑制性GABA作動性末端に対するGOの選択的干渉は、興奮性と抑制性のシナプス間隙の寸法が異なることに起因する可能性があると提唱した。(219)一方、同じ寸法のFLGが異なる挙動を示すのは、細胞培養で凝集体を形成すると脳のシナプスのような微小構造とのインターフェースに適さないため、その表面が疎水性で、細胞膜と相互作用する能力が控えめであることが原因である可能性がある。
また、ナノサイズのFLGとGOが、培養した初代グリア細胞からのシナプス様マイクロベシクルのエキソサイトーシスとリサイクルを減少させる能力をテストする研究も行われた(217)。(217)マイクロベシクルは、アストロサイトの細胞膜からの直接出芽によって細胞外空間に放出され、細胞間コミュニケーションに重要な役割を持つことが示されてきた。(220)純粋なグリア細胞培養をFLGおよびGO懸濁液(10μg/mL)で6-8日間処理した。FLG と GO は、アストロサイトの密度に影響を与えず、細胞毒性作用を除外した。グリア細胞培養において、2′,3′-[ベンゾイル-4-ベンゾイル]-ATP(BzATP)によりマイクロベシクル放出を人工的に誘導し、その後、回収した上清の免疫ブロット分析により検出、定量化できることはよく知られている(221)。(221)驚くべきことに、アストロサイトをGOで処理すると、BzATP刺激と同様の効果が得られ、顕著な小胞放出が誘導された。
興味深いことに、同じ濃度と時間でFLGを用いた同様の実験では、グリア細胞培養におけるマイクロベシクルの脱落は誘発されなかった。
これまでの結果をまとめると、グラフェン薄片の横方向の大きさが材料の細胞毒性を規定する上で重要である一方、酸化状態も重要な役割を果たしており、FLGの中性効果に対して、GOがおそらくは細胞膜相互作用を介して生来の小胞制御機構を阻害する能力の違いを説明できる可能性がある、と結論づけることができる。
GBMと細胞膜の物理的相互作用は、材料の物理化学的性質に強く影響される。最近の研究では、FLGおよびGOナノシートは、主にエンドソーム/リソソーム経路を経て神経細胞に内包されることが示された。さらに、電子顕微鏡による分析では、膜を突き破ったか細胞内小器官から脱出した、細胞質内で遊離している多数の粒子が確認された(図6)。(218)注目すべきは、神経細胞でもアストロサイトでも核内に粒子が観察されなかったため、直接的な遺伝毒性障害が発生する可能性は低いということである。(一方、アストロサイトおよびミクログリアは、投与されたフレークの最大30~40%を内在化しており、これは、傷害からニューロンを防御する彼らの主要な機能と一致している。さらに、ナノシートに曝された神経細胞は、よく相互接続されたネットワークを形成したが、アストロサイトは、活性化/成熟グリアを思わせる顕著な形態変化を示し、カーボンナノチューブによって引き起こされる変化と同様であった(222)。このような形態変化は、ナノ材料が細胞のアクチン細胞骨格と相互作用し、破壊されることに起因すると思われる(222)。(223,224)
図6

図6. グラフェンとニューロンとの相互作用。初代ラット皮質ニューロンを、FLG(ここではGRと略記)およびGOフレーク(1および10μg/mL)に96時間または14日間曝露するか、あるいはそれぞれのビヒクルを等量曝露した。SEM を用いて、フレークと神経細胞との相互作用を調べた。(e-h)多数のフレーク(白矢印)が細胞膜に接触していることが確認されたが、細胞の形態およびネットワークの発達はほとんど影響を受けなかった。(i-l) FLG と GO の細胞内への取り込みと細胞内局在を TEM で調べた。24 時間後では、ほとんどのフレークが細胞外に見出された(図示していない)。しかし、96 時間後からは、フレークが細胞内小胞に内包され(i,j;黒矢印)、あるいは細胞質内に遊離した(l;黒矢印)。文献(218)より転載。Copyright 2016 American Chemical Society.
さらに、また、細胞をナノまたはミクロンサイズのフレークに曝露した前述の研究とは対照的に、表面固定化GBMの研究も報告されている。Tuらは、異なる官能基を付着させることによってGOの特性を系統的に改変し、官能基化されたGOが担う電荷を操作することによって、神経細胞の突起の伸長と分岐を制御できることを見出した(225)。(225)このように、中性、双性イオン、あるいは負に帯電したGOと比較して、正に帯電したGOが、GOコーティングしたスライドガラス上で成長したラット海馬初代ニューロンのモデルにおいて、神経突起の伸長と分岐に有益であることが判明したのである。Graphene Flagshipの最近の研究では、グラファイトの液相剥離やボールミルによる表面固定化グラフェンに着目し、こうした基材が、神経細胞の基本的な生理活性レベルを維持できる、不活性な神経細胞間物質であることが示されている(226)。(したがって、グラフェンベースの基板は、ラット海馬からの初代ニューロンの発達を支援するために使用されることに成功した(226)。関連する研究では、グラフェンを塗布した表面で成長した海馬のニューロンにおいて膜コレステロールの変化が認められ、その結果、神経伝達のシナプス前増幅が認められた(227)。(さらに最近では、グラフェン・フラッグシップの別の研究により、単層グラフェンが、ニューロン-グラフェン界面における細胞外イオンの分布を調整することによって、ラット海馬ニューロンの神経細胞発火を増加させることが明らかにされた(図7)。(この研究は、実験的・理論的アプローチに基づいて、グラフェンと陽イオン(特にカリウム)の相互作用が、グラフェンを電気絶縁性基板上に堆積させたときに最大化するためであるという仮説を立てている(228)。(このような基板は、次世代のブレイン・インターフェースとして利用できる可能性がある。その際、接着促進ペプチド(ポリリジンやポリオルニチンなど)をプレコートしなくても、固定化グラフェンで装飾した表面が神経細胞の発達(神経細胞の受動特性、自発的シナプス活性、シナプス形成、短期シナプス可塑性の観点)を支援できるという珍しい能力は、注目すべきものであろう。これまでの研究では、ペプチドをコーティングした化学気相成長法グラフェン界面が、海馬ニューロン(ポリリジンコーティンググラフェン)(229)や神経幹細胞(ラミニンコートグラフェン)と生体親和性を持つことが実証されている(230)。しかし、ペプチドコーティングは、ニューロン/界面の電気的接触や電気信号の伝達を弱め、最適な電荷移動をもたらさない可能性がある(231,232)。(グラフェンの表面固定化は、毒性効果を防ぐことができるようであり、神経細胞の発達を促進するために利用できるかもしれない(231,232)。しかし、このような基板の長期的な完全性を評価するためには、さらなる研究が必要である。さらに、摘出した神経細胞を用いた研究は有益であるが、神経細胞の微小回路に対するグラフェンの影響に関するin vivoでの詳細な研究は不足している。
図7

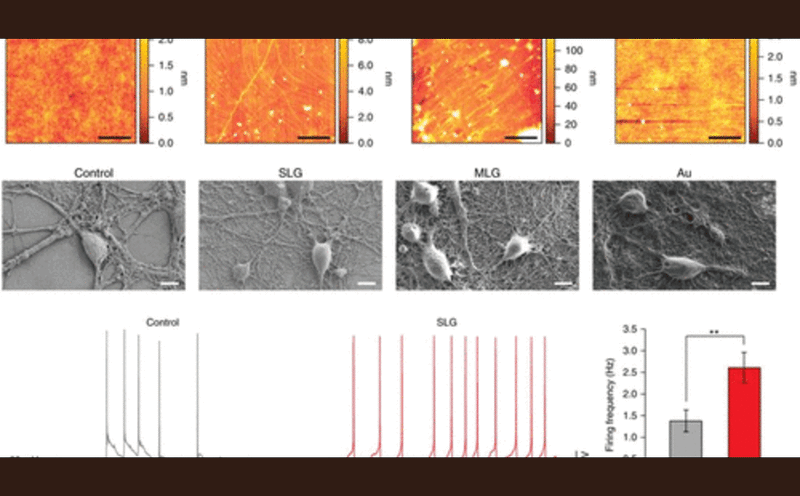
図7. グラフェンによる神経細胞間情報伝達の変調。(上段)ガラス、単層グラフェン(SLG)、多層グラフェン(MLG)、および金メッキガラス表面のAFMトポグラフィー再構成図。AFMで測定した表面粗さは、コントロールガラス(n=3)が0.23 ± 0.02 nm、SLG(n=3)が1.5 ± 0.5 nm、MLG(n=3)が20 ± 10 nm、Au(n=3)が0.47 ± 0.1 nmと変化していることが確認された。スケールバー、5μm。(中段)異なる基材に支持された、10日間in vitro後の海馬ニューロン形態を描写する代表的なSEM画像である。培養基材は、グラフェンの効果を覆い隠す可能性のある追加の接着分子で前処理されていない。スケールバー:10μm。(下段)SLGは単細胞の固有興奮性の変化を引き起こす。10日間培養した海馬ニューロンの代表的な電流クランプ記録。コントロールとSLGのニューロンは、同様の静止膜電位を示した(SLGでは-52±10 mV、コントロールでは-50±7 mV)。60 mVに維持した場合、自発活動電位の発火を測定し、ヒストグラムにまとめました(右図)。SLGでは活動電位の周波数が有意に高いことに注意(SLGで成長したニューロン、n = 21では2.60 ± 0.36 Hz;コントロール、n = 19では1.37 ± 0.26 Hz;P = 0.0054)。*p < 0.05、**p < 0.01。文献(228)から許可を得て転載。Copyright 2018 Nature Publishing Group.
GBMの脳への影響を包括的に捉えるには、神経細胞への影響だけでなく、非神経細胞、すなわちアストロサイトやミクログリアを含むグリア細胞への影響も取り上げることが重要である。GBMへの曝露によって影響を受ける分子および細胞プロセスをよりよく理解するために、GOに曝露した初代ニューロンおよびアストロサイトの培養物について、またアストロサイトの場合はGOまたはFLGに曝露して、プロテオームおよびリピドーム解析を実施した(218)。神経細胞とグリア細胞の両方で影響を受けた共通の経路の中に、神経細胞生理学のほぼすべての側面で極めて重要なCa2+シグナル伝達があり、いくつかのCa2+結合および緩衝タンパク質が、観察されたエンドサイトーシスおよび/または食作用反応を仲介していると考えられる細胞内トラフィッキングとともに、曝露した培養物で顕著にアップレギュレートまたはダウンレギュレートされていることが判明した(218)。(218)リピドミクス解析の結果、曝露された神経細胞は、ホスファチジルエタノールアミンのアップレギュレーションとホスファチジルセリンのダウンレギュレーションによって特徴づけられることが明らかになった。PE は、細胞膜やシナプス小胞膜の主要成分の一つであり、小胞の融合・分裂に重要な役割を果たす。(233) コレステロールは、ナノシートにさらされたアストロサイトで最も変化する脂質の一つであることがわかった。(218) コレステロールは、アストログリア細胞において小胞体と細胞膜の間のシグナル伝達を仲介する脂質ラフトの構造的な構成要素である。(ナノシート曝露培養物の機能性に関して、Ca2+動態の詳細な分析により、神経細胞とアストロサイトの両方で、自発的に振動する細胞の数の減少、基底細胞質Ca2+濃度の減少、外部刺激に対する応答の変化からなる著しい変化が明らかにされた。興味深いことに、これらの影響はGOへの慢性的な曝露によってのみ引き起こされ、FLGとGOへの急性曝露は両培養系においていかなる機能変化も引き起こさない。アストロサイトに関しては、最近の研究で、K+電流の著しい変化がGOによって選択的に引き起こされることが示された(235)。(235)より具体的には、膜電位の過分極、入力抵抗の減少、比コンダクタンスの増加とともに、外向き整流電流の増加が観察された。興味深いことに、GOで処理した細胞培養物では、アストロサイトから放出されるマイクロベシクルの有意な増加も観察された。(217) Ca2+ダイナミクス、グルタミン酸の取り込み、およびマイクロベシクルの放出はすべて、アストロサイトからニューロンへの通信における基本的なプロセスである。結論として、初代神経細胞およびグリア細胞を用いたin vitroの研究により、FLGまたはGOへの慢性的な曝露は細胞死を引き起こさないものの、多くの基本的な生理的プロセスに強い影響を与えるため、長期間投与した場合には毒性につながる可能性があることが示された。実際、グラフェン・フラッグシップで行われた研究により、グラフェンの神経細胞およびグリア細胞に対するサイズ依存的な毒性が明らかにされている。しかし、FLGのいくつかの特性は、CNSの病的変化を回復させるために利用できる可能性がある。したがって、今後の研究では、望ましくない作用につながる可能性のある特性を調整しながら、選択された特徴を利用するために、GBMを機能化する可能性を検討する必要がある。
この記事が気に入ったらサポートをしてみませんか?
