
グラフェンファミリーナノ粒子の毒性:起源とメカニズムに関する総説
掲載:2016年10月31日
Lingling Ou, Bin Song, ...Longquan Shao
Particle and Fibre Toxicology 13巻 記事番号:57 (2016)
元記事はこちら。
概 要
グラフェンナノ材料(GFN)は、そのユニークな物理化学的特性から、多くの分野、特にバイオメディカル用途で広く用いられている。現在、多くの研究がGFNの生体適合性と毒性をin vivoおよびin introで調査している。一般に、GFNは、投与経路の違いや生理的バリアーを通過することにより、動物や細胞モデルで異なる程度の毒性を示し、その後、組織内または細胞内に分布し、最終的に体外に排泄されると考えられている。このレビューでは、いくつかの臓器や細胞モデルにおけるGFNの毒性作用に関する研究を集めている。また、GFNの毒性を決定する要因は、横方向のサイズ、表面構造、機能化、電荷、不純物、凝集、コロナ効果など様々であることを指摘する。さらに、GFN毒性の基礎となるいくつかの典型的なメカニズム、例えば、物理的破壊、酸化ストレス、DNA損傷、炎症反応、アポトーシス、オートファジー、ネクローシスが明らかにされている。これらの機構では、(toll-like receptor-) TLR-, transforming growth factor β-, tumor necrosis factor-alpha (TNF-α) 依存性のシグナル経路が関与しており、酸化ストレスはこれらの経路で重要な役割を担っていると考えられている。本総説では、GFNsの毒性制御因子と毒性発現メカニズムに関する利用可能な情報を要約し、GFNsの毒性メカニズムを完成させ、GFNsの生物学的安全性を高め、その幅広い応用を促進するための示唆を与えることを目的として、いくつかの課題と今後の研究提案を提示する。
背 景
グラフェンは、結晶性グラファイトから単離されたもので、六角形に配列したハニカム格子の単原子厚2次元シートからなる平板な単層体である[1]。グラフェンは、そのユニークな構造、比表面積、機械的特性から、2004年の発見以来、その機能と応用に大きな注目が集まっている[2, 3]。グラフェンおよびその誘導体には、単層グラフェン、数層グラフェン(FLG)、酸化グラフェン(GO)、還元酸化グラフェン(rGO)、グラフェンナノシート(GNS)、グラフェンナノリボン、などがある[4-7]。[4-7]. GOは、グラフェン系ナノ材料(GFN)の中でも最も重要な化学的グラフェン誘導体の1つであり、その潜在的な生物医学的応用にますます注目が集まっている。グラフェン系材料は通常、サイズが数~数百ナノメートル、厚さが1~10nmであり[8, 9]、これは「ナノ粒子」または「ナノ材料」の定義にもなっている。グラフェン材料は、その卓越した物理的・化学的特性から、エネルギー貯蔵、ナノ電子デバイス、バッテリー[10-12]、抗菌[13、14]、バイオセンサー[15-18]、細胞イメージング[19、20]、ドラッグデリバリー[8、21、22]、組織工学[23-25]などの生物医学応用などのさまざまな分野で広く用いられてきた。
GFNの用途と生産量の増加に伴い、GFNへの意図しない職業的・環境的曝露のリスクも高まっている[26]。また、近年、職業環境におけるGFNsの曝露に関するいくつかの調査が行われ、GFNsの職業曝露が作業者や研究者に潜在的な毒性を有するというデータが発表されています[27-29]。GFNは、気管内投与(30)、経口投与(31)、静脈内投与(32)、腹腔内投与(33)、皮下投与(34)により体内に投与することができます。GFNは、血液-空気関門、血液-精巣関門、血液-脳関門、血液-胎盤関門などを透過し、肺、肝臓、脾臓などに蓄積することにより、組織の急性および慢性傷害を誘発することができる。たとえば、一部のグラフェンナノ材料のエアロゾルは、吸入して呼吸器に実質的に沈着し、気管気管支の気道を通って下部の肺気道に容易に浸透し、その後の肉芽腫の形成、肺線維化、曝露者への健康への悪影響をもたらす[2, 29]。いくつかのレビューでは、ユニークな特性を概説し[35, 36]、薬物送達、遺伝子送達、バイオセンサー、組織工学、および神経外科へのGFNの最新の潜在的生物学的応用をまとめ[37-39]、細胞(細菌、ほ乳類、植物)や動物(マウス、ゼブラフィッシュ)におけるGFNの生体適合性の評価[7, 40, 41] 、土壌および水環境中のGFNがもたらす影響に関する情報を収集しました [43](※1)。これらのレビューでは、関連するGFNの安全性プロファイルとナノ毒性学が議論されていますが、GFNは、その安全性プロファイルとナノ毒性学に影響を及ぼす可能性があります。
しかし,具体的な結論や毒性の詳細なメカニズムは不十分であり,毒性メカニズムを完全にまとめてはいなかった.
最近の研究で示されたGFNの毒性メカニズムは、主に炎症反応、DNA損傷、アポトーシス、オートファジー、ネクローシスなどであり、これらのメカニズムを収集することで、GFNの毒性を制御する複雑なシグナル伝達経路ネットワークをさらに探索することができる。
GFNの毒性に大きく影響するいくつかの要因、例えば、濃度、横方向寸法、表面構造、機能化などがあることを指摘する必要がある。ここで、このレビューは、GFNの生物学的安全性を向上させ、その幅広い応用を促進するために、GFNのさらなる研究のための提案を提供し、毒性メカニズムを完成させることを目的として、異なる実験方法によるin vitroおよびin vivoでのGFN毒性のメカニズムと制御因子に関する利用できる情報を包括的に要約して提示するものです。
GFNの毒性(in vivoおよびin vitro)
GFNは、様々な曝露経路や投与経路によって生理的バリアーや細胞構造を透過し、生体内や細胞内に侵入し、最終的にin vivoおよびin vitroで毒性を示すと考えられています。投与経路や侵入経路の違い、組織内分布や排泄の違い、さらには細胞の取り込みパターンや位置の違いなどが、GFNの毒性の程度を決定している可能性がある[44-46]。したがって、それらを明確にすることは、GFNs毒性の発生および進展の法則をよりよく理解するのに役立つと思われる。
投与経路
動物モデルにおける一般的な投与経路は、気道曝露(鼻腔内送気、気管内注入、吸入)、経口投与、静脈内注射、腹腔内注射、皮下注射などです。作業環境におけるGFNの主な曝露経路は気道曝露であるため、ヒトのGFN曝露を模擬するために、マウスでは主に吸入と気管内注入が使用されています。吸入法は実際の曝露に最も近いシミュレーションが可能であるが、投与はより効果的で時間を節約できる方法であり、GFNは吸入よりも投与(気管内投与、胸腔内投与、咽頭吸引)の方がより長い炎症期間を引き起こすことが明らかになった[24、30、47、48]。GFNは肺に沈着し、高濃度に蓄積し、気管内注入後ゆっくりと消失しながら3ヶ月以上肺に留まることが調査されている[49]。グラフェンナノ材料の毒性評価には静脈注射も広く用いられており、グラフェンは30分でマウスの体内を循環し、肝臓や膀胱に作業濃度で集積する[32, 50-52]。しかし、GO誘導体は腸管への吸着が少なく、成体マウスに経口投与すると速やかに排泄される[31, 53]。ナノサイズのGO(350nm)は、ミクロンサイズのGO(2μm)に比べて、頸部皮下注射後の皮下脂肪組織への単核細胞の浸潤が少なかった[34]。腹腔内注射後、注射部位付近でGOが凝集し、肝臓や脾臓の漿膜近傍に多数の小さな凝集体が沈降した[31, 33]。GFN の皮膚接触や皮膚透過に関する実験は、ここで検討した論文には見あたらず、グラフェンが無傷の皮膚や皮膚病変を透過すると結論づけるには十分な証拠がない。他のナノ材料の神経毒性または脳損傷の可能性を試験するために広く使用されている点鼻薬の経路については、今回レビューした論文では言及されていない。
GFNsの侵入経路
GFNは体内に入った後、血液循環や生体内バリアを通して様々な場所に到達し、その結果、臓器によって滞留の度合いが異なる。GFNはそのナノサイズゆえに、血液-空気関門、血液-精巣関門、血液-脳関門、血液-胎盤関門といった通常の生理的関門を通過して、より深い臓器に到達することが可能である。
血液・空気関門
肺は、グラフェンナノ粒子が気道を通じて人体に入る潜在的な入り口である。吸い込まれたGOナノシートは、宿主防御の第一線である肺サーファクタント(PS)膜の超微細構造と生物物理的特性を破壊し、その潜在的毒性を顕在化させる可能性がある[54]。凝集または分散した粒子は、肺胞内の肺胞内表面に沈着し、肺胞マクロファージ(AM)に取り込まれる[55]。肺でのクリアランスは、粘液繊毛エスカレーター、AMs、または上皮層によって促進される[56-58]。しかし、吸入された小さなナノ粒子の中には、無傷の肺上皮バリアに浸潤し、その後一時的に肺胞上皮または間質に入り込むものもある[59, 60]。気管内注入されたグラフェンは、気血関門を通過して肝臓や脾臓に再分配される可能性がある[61]。研究者や労働者は、通常、吸入によってグラフェンに職業的に暴露されるため、血液-空気関門の研究は、特に注目されるかもしれない。血液-空気関門がどのようにGFNの毒性に関与しているかを明らかにすることは、研究のホットトピックになると思われる。
血液脳関門
多数の膜受容体と選択性の高い担体からなる血液脳関門の複雑な配置は、末梢血管内皮と比較して、血液循環および脳の微小環境にわずかな影響しか及ぼしていない[62]。血液脳関門のメカニズムに関する研究は,疾患やナノ毒性に関与するものとして進展してきた.マトリックス支援レーザー脱離イオン化(MALDI)質量分析イメージング(MSI)により、平均直径342 ± 23.5 nmのrGOは、血液脳関門の傍細胞稠度を低下させることにより、時間依存的に内皮間隙に傍細胞経路を透過することが明らかにされた[63]。また、100 nm以下の小さなサイズのグラフェン量子ドット(GQD)は、血液脳関門を通過することができる[64]。グラフェン材料がどのように血液脳関門を通過して神経毒性を引き起こすかに関する研究は非常に少なく、結論を出すにはさらなるデータが必要である。
血液精巣関門
血液-精巣関門および血液-副睾丸関門は、哺乳類の体内における最も堅固な血液-組織関門であることでよく知られている[65]。直径 54.9 ± 23.1 nm の GO 粒子を腹腔内投与したところ,血液-精巣-副睾丸関門を通過することは困難であり,300 mg/kg 投与してもマウスの精子の質は明らかに影響を受けなかった [66].
血液-胎盤関門
胎盤関門は、栄養と代謝廃棄物の交換を仲介し、重要な代謝機能を発揮し、ホルモンを分泌するため、妊娠を維持する上で不可欠である[67]。最近のレビューでは、胎盤はナノ粒子の胎児への移行、特に炭素系ナノ粒子の胎児への、そして胎児内での分布に対して、タイトなバリアーを提供しないことが示唆された[42]。rGO および金粒子(直径 13 nm)は、静脈注射後、妊娠後期の胎盤および胎児にほとんど存在しないか、存在しないことが示唆された[44, 68]。しかし、他の報告では、妊娠後期にも経胎盤移行が起こることが示されている[69, 70]。ナノ材料の発生毒性は注目されており、多くのナノ粒子が胎盤関門を通過し、胚の発生に強い影響を与えることが報告されている[71-75]。しかし、胎盤関門を介したグラフェン材料の曝露に関する研究は不十分であり、今後、これらの粒子がどのように胚に移行するのかを詳細に評価する必要がある。
これら4つのバリアは文献上最も頻繁に言及されているバリアであり、その他のバリアは最近の研究では評価されていない。例えば、皮膚バリアは、検索した数百のGFNs毒性研究のいずれでも言及されていない。さらに、GFNがこれらのバリアを通過するメカニズムはよく分かっておらず、より系統的な調査が緊急に必要である。
GFNの組織内分布と排泄量
グラフェンナノ粒子の吸収、分布および排泄は、投与経路、物理化学的特性、粒子の凝集およびGFNsの表面コーティングなどのさまざまな要因によって影響を受けると考えられる。
例えば、気管内投与されたFLGは、気血関門を通過して主に肺に蓄積・保持され、4週間後に47%が残存した[61]。静脈内投与されたGOは血液循環を通じて体内に入り、肺、肝臓、脾臓、骨髄に高度に保持され、10 mg kg/体重のGOを静脈内投与したマウスの肺では炎症細胞の浸潤、肉芽腫形成、肺水腫が観察された[49]。同様に,PEG化GO誘導体を腹腔内注射したところ,肝臓や脾臓を含む網内皮系に高い集積が観察された.一方、GO-PEGおよびFLGは、経口投与による検出可能な消化管吸収や組織への取り込みを示さなかった[31]。
サイズ、用量、官能基といったGFNの異なる特性は、グラフェンの分布プロファイルに常に一貫性のない結果をもたらす。たとえば、Zhangらは、GOが主にマウスの肺に取り込まれることを見出したが[49]、Liらは、GOがマウスの肝臓に蓄積することを観察した[76]。注目すべきは、直径10-30 nmの小さなGOシートは主に肝臓と脾臓に分布していたが、10-800 nmの大きなGOシートは主に肺に集積していた[49, 52, 77]。GOのサイズが血管のサイズより大きい場合,GOは通常,注入部位の近傍の動脈および毛細血管に滞留する.肺へのGOの集積は,注入量およびサイズの増加とともに増加するが,肝臓への集積は有意に減少することが示された[78].例えば,GO-PEGおよびGO-デキストラン(GO-DEX)の静脈内注射は,短期間の毒性なしに肝臓および脾臓を含む網状内皮系(RES)に蓄積する[31, 79].さらに,血漿タンパク質の電荷と血漿タンパク質によるGOの吸着も,生体内分布に影響を与える[34].
GFNの排泄およびクリアランスは,臓器によって異なる.肺では、NGOがAMに取り込まれ、クリアランスされることが観察されており、粘膜繊毛クリアランスなどを通じて喀痰から排泄される可能性がある[57]。また、気管内注入したFLGの46.2%が曝露28日後に糞便を介して排泄された[61]。肝臓では、ナノ粒子は胆道から十二指腸に至る肝胆道系で排泄される [80]。さらに、主に肝臓および脾臓に蓄積されるPEG化GNSは、腎臓および糞便からの排泄により、徐々に除去される可能性が高い。最近のレビューにあるように、200nmより大きいGOシートは脾臓の物理濾過によって捕捉されるが、小さいサイズ(約8nm)は尿細管に浸透し、明らかな毒性なしに迅速に除去されることができる[81]。GFNの排泄経路はまだ明確に説明されていないが、腎臓および糞便ルートがグラフェンの主な排泄経路であると思われる。
近年、分布および排泄・毒性戦略は、ナノ毒性学的研究の重要な部分となっている。現在までに、グラフェンの生体内分布および排泄に関して、いくつかの論文で議論のある結果が報告されており、GFNのトキシコキネティクスに関する体系的な評価が依然として必要である。ナノ材料の代謝・排泄は長期的なプロセスであるが、近年のGFNに関する研究は短期的な毒性評価にとどまっており、異なる組織におけるGFNの長期蓄積と毒性は未知のままである。したがって、ヒトの生物医学的用途に使用する前に、材料のバイオセーフティを確保するために、異なる細胞や動物を用いてGFNの沈着や排泄に関する長期的な研究を実施する必要がある。
GFNの細胞内への取り込みと存在位置
GFNの取り込みと位置もまた、細胞株によって異なる効果を発揮することが観察されている。グラフェンは、さまざまな経路で細胞内に取り込まれる[82, 83]。基本的に、GOが細胞膜を通過するためには、サイズ、形状、コーティング、電荷、流体力学的直径、等電点、およびpH勾配などの物理化学的パラメータが重要である[84]。先に述べたように、直径<100 nmのナノ粒子は細胞に入ることができ、直径<40 nmのナノ粒子は核に入ることができる[85]。例えば、GQDはエネルギー依存的な経路ではなく、細胞膜を直接貫通する可能性がある[86, 87]。より大きなタンパク質被覆酸化グラフェンナノ粒子(PCGO)(~1 μm)は主にファゴサイトーシスを通じて、より小さなPCGOナノ粒子(~500 nm)は主にクラスリンを介したエンドサイトーシスを通じて細胞に侵入する [88]。GOシートは、細胞内に接着し、包むことができる。
GOシートは、細胞との相互作用の結果として、細胞膜に付着したり巻きついたり、脂質二重層に挿入されたり、細胞内に取り込まれたりする可能性がある[89]。同様に、PEG化還元型グラフェン酸化物(PrGO)およびrGOは、疎水性の未修飾グラファイトドメインと細胞膜との相互作用により、脂質二重層の細胞膜上に顕著に接着することが示された[90, 91]。その結果、グラフェンへの長期的な曝露や高濃度のグラフェンが、アクチンフィラメントや細胞骨格の不安定化とともに、細胞膜への物理的あるいは生物学的な損傷を誘発することが示唆された[92]。
現在のデータでは、GOシートが細胞膜と相互作用し、マクロファージによって貪食されることが実証されている。GNSの貪食には,マクロファージ上の3つの主要な受容体,すなわちFcg受容体(FcgR),マンノース受容体(MR)および補体受容体(CR)が関与している.さらに、FcgRは介在する貪食経路の重要な受容体である[90, 93, 94]。GOのタンパク質コロナが、マクロファージ受容体、特にタンパク質コロナ内に含まれるIgGによる認識を促進するのである。マクロファージは、GOとの接触により、顕著な形態変化を起こすことが観察された[34]。内在化後、グラフェンは細胞質、核周囲空間および核に蓄積し、ミトコンドリア膜電位の枯渇による細胞内活性酸素の増加、およびミトコンドリア経路の活性化によるアポトーシスの誘発により、マウスマクロファージの細胞毒性を誘発した[83]。GFNの相互作用と蓄積部位の可能性を図1にまとめた.
図1
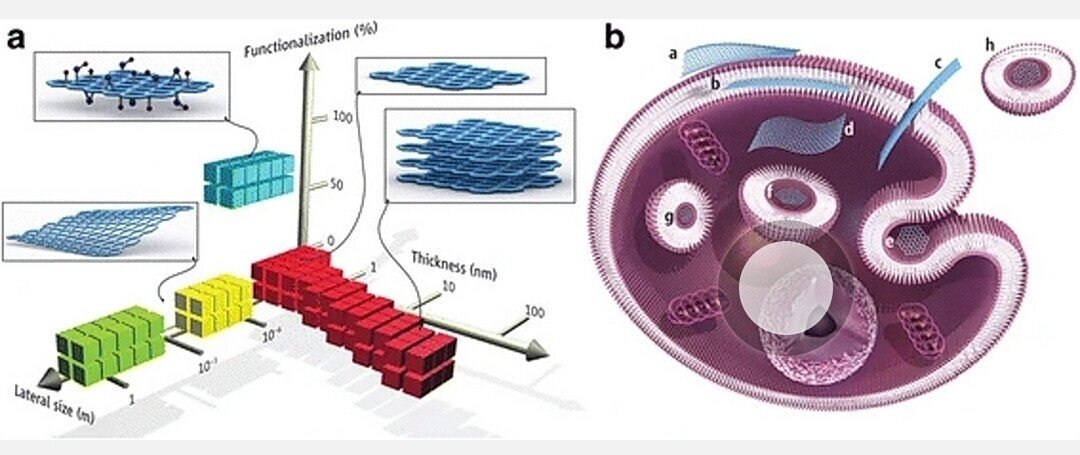
図1
グラフェン材料とその生物学的相互作用。(A)最も広く用いられているグラフェン材料のパラメータ空間は、材料の寸法と表面機能化によって記述することができる。後者は、sp3混成炭素原子の割合として定義される。緑色の四角はエピタキシャル成長グラフェン、黄色は機械的剥離グラフェン、赤色は化学的剥離グラフェン、青色は酸化グラフェンである。なお、グラフェン関連材料(グラフェン量子ドットやグラフェンナノリボンなど)も多数実験に使用されている。(B)グラフェン関連材料と細胞との相互作用の可能性(グラフェン薄片はノンスケール)。(a)細胞膜の外表面への吸着。(b)細胞膜脂質二重層の単層間への取り込み。(c)膜の移動。(d)細胞質内への取り込み。(e) クラスリンを介したエンドサイトーシス。(f)エンドソームまたはファゴソームへの取り込み。(g) ライソゾームまたは他の核周辺コンパートメント局在化。(h) エキソソームへの局在化 このような相互作用から生じる生物学的結果は、特定の生物医学的応用の文脈に応じて、有害とも有益とも考えられる。異なるグラフェン関連材料は、細胞や組織との相互作用において異なる優先的なメカニズムを持つことになるが、その発見が待たれるところである。[90] 著作権(2014)、米国科学振興協会の許可を得ています。
GFNの臓器における毒性
GFNの毒性および生体適合性は、理論および動物モデル研究を通じて観察され、評価されてきた。現在、GFNの毒性を示すデータは数多く存在し、このレビューですべてのデータを挙げることは困難である。そこで、いくつかの文献を要約し、表1に示すGFNのin vivo毒性試験のいくつかを選択した。
表1 GFNの臓器における毒性
原寸表
内臓への毒性
GOは、重要な臓器の正常な生理機能を阻害することにより、急性の炎症反応や慢性的な傷害を引き起こす可能性がある[32, 81]。経口ガベージ実験では、消化管からのGOの検出可能な吸収を示さなかった[95]。興味深いことに、母体マウスにGO懸濁液を飲ませた後、高用量のGOよりも低用量のGOが消化管に深刻なダメージを与えた。凝集のない低用量のGOは、その豊富な鋭いエッジによって消化管表面に容易に付着し、破壊を引き起こすからである[53]。GFNは、1回の気管内投与後、90日目に炎症を起こして肺に残留し、さらに鼻からの吸入により肺リンパ節に転移していた[96, 97]。凝集体を形成する高用量の GO は、肺血管を閉塞し、呼吸困難をもたらす[50, 98]。静脈注射による 1 および 2 mg/kg 体重の高濃度で血小板血栓が観察された [89]-[10] 。GOは、肺胞-毛細血管バリアを破壊し、炎症性細胞の肺への浸潤を可能にし、炎症性サイトカインの放出を刺激することが報告された[99]。線維化および炎症は、肺におけるタンパク質マーカーであるコラーゲン1、Gr1、CD68およびCD11bのレベルの増加によって検証され得た。FLGを分散させるためにTween 80を、あるいはグラフェンを分散させるためにプルロニックサーファクタントを使用すると、細胞やマウスにおける肺線維形成の可能性が低くなることが示唆されたが、グラフェンをウシ血清アルブミン(BSA)で懸濁させると肺線維が観察された[100]。さらに、放射性同位体は肺に送達することができ、肺における125I-NGOの深さ方向の分布を伴い、同位体がそこに沈着して突然変異や癌を引き起こすかもしれない[30]。しかし、最近の論文では、アミノ化GO(GO-NH2)、ポリアクリルアミド機能化GO(GO-PAM)、ポリアクリル酸機能化GO(GO-PAA)、GO-PEGなどのGOおよび機能化グラフェンの低用量を静脈内注射したマウスには明らかな病理的変化がなかったと主張し、GO-PEGとGO-PAAだけが生体内で素のGOより低い毒性を誘導したと述べている[31, 79, 89]。つまり、GFNの官能基と作用濃度や凝集状態が、GFNの毒性に大きく影響するのである。最近、GFNの毒性を減少させるために、GFNの官能基を修飾する方法、作業濃度を減少させる方法、または凝集状態を変化させる方法が通常用いられている。
中枢神経系における毒性
グラフェンは、脳腫瘍治療のための薬剤/遺伝子送達、頭蓋内および脊髄の生体適合性デバイス、バイオセンシングおよびバイオイメージング技術への応用により、脳神経外科に大きな利益をもたらしている。脳内におけるグラフェンの潜在的可能性やリスクに関する研究も出てきている。ニワトリ胚モデルでは、原始的なグラフェン薄片がリボ核酸レベルおよびデオキシリボ核酸合成速度を低下させ、脳組織の発達に悪影響を及ぼし、脳内で非定型の超微細構造が観察された [101].最近のGFNの中枢神経系における研究は,毒性よりもむしろ応用に関わるものが多い.GFN の毒性に関するデータは現在進行中である。
生殖・発生系における毒性
原始的なグラフェンは、ニワトリの受精卵に注入した後19日間インキュベートすると、心臓の血管形成と分岐血管の密度を低下させた[101]。GOおよびrGOは、濃度依存的に胚の孵化率および体長に影響を与えることにより、ゼブラフィッシュ胚に損傷を与える。暴露したゼブラフィッシュ胚では,明らかな奇形や死亡は観察されなかったが [102] ,GO はゼブラフィッシュ胚の絨毛に付着して包み込まれ,著しい低酸素状態と孵化の遅延を引き起こした.また,GO の凝集体は,胚の眼,心臓,卵黄嚢,尾など多くの小器官に保持され,これらの部位でアポトーシスや活性酸素の発生が観察された[103].
GFN は,雄または雌の生殖器系に異なる毒性作用を及ぼす.GOは,腹腔内注射で高用量投与しても,雄の生殖機能にほとんど影響を与えないことが示された[66].さらに,rGO は非妊娠の雌マウスの血清エストロゲン濃度を変化させなかった.雌マウスでは条件が異なる。マウスのダムは、交配前または妊娠初期にrGOを注射すると健康な子供を産むことができ、rGOを注射したダムの産子の中には異常胎児が数匹しか存在しなかった。しかし、妊娠したマウスはどの用量でも流産し、妊娠後期に高用量のrGOを注射するとほとんどの妊娠マウスが死亡した[44]。特に、高用量投与群では、授乳期における子動物の発育が遅れた。GOの高用量は、経口曝露により母体マウスの水分消費量を減少させ、乳汁分泌を減少させ、その結果、子孫の成長を先延ばしした[53]。これらの知見は、GFNが発達に有害である可能性を示しているが、生殖および発達毒性に関するデータはまだ不足している。そのため,GFN が雌雄の生殖・発達に与える影響について,毒性メカニズムを解明するための研究が必要である.
血液適合性の影響
GOは,血液中に放出されることが避けられない.GOの血液適合性は、機能性コーティングと暴露条件に依存することが判明した。サブミクロンサイズのGOが最も高い溶血活性を示し、凝集グラフェンは最も低い溶血反応を引き起こした。プリスティン・グラフェンおよびGOは、75μg/mLまでの溶血効果を示した[104]。GO-ポリエチレンイミン(GO-PEI)は、1.6μg/mLでもHSAに結合し、顕著な毒性を示した[105]。カルボキシル化酸化グラフェン(GO-COOH)は、50μg/mL以上の濃度でTリンパ球に対して顕著な細胞毒性を示し、25μg/mL以下では良好な生体適合性を有していたが、GO-キトサンは溶血作用をほぼ阻害していた[106]。これまで、血液適合性に対応するリスクはほとんど知られていない。
結論として、GFNによって引き起こされる肺損傷はいくつかの研究で研究されており、その結果、肺における炎症性細胞の浸潤、肺水腫および肉芽腫の形成が示されている。しかし、肝臓、脾臓、腎臓などの他の臓器における評価については、いくつかの特定の研究しか行われておらず、これらの内臓の損傷症状、損傷指数、損傷レベルについては十分に検討されていないのが実情である。さらに、GFNの神経毒性に関する研究は非常にまれで、どの神経または脳領域に障害が発生するかを明らかにしたデータはなく、関連する行動学的症状も研究されていない。GFNの発達毒性は、構造異常、成長遅延、行動および機能異常、さらには死亡を引き起こす可能性があります。GFNsの生殖・発達毒性に関する研究は、今後極めて重要であり、広く注目されると思われる。GFNsの毒性研究はほとんどすべてが短期間の実験であり、長期的な慢性毒性傷害を調査した研究はない。しかし、他のナノ材料の毒性研究に基づいて、長期的なGFNsの暴露は健康を害する重要な要因である可能性がある[107-109]。したがって、GFNsの長期的な研究が必要である。
細胞モデルにおけるGFNの毒性
GFNのin vitroにおける細胞毒性は,様々な細胞において,細胞の生存率や形態を変化させ,膜の完全性を破壊し,DNA損傷を誘導することが確認されている[110-112].GOやrGOは,細胞接着を低下させ,細胞のアポトーシスを誘導し,リソソーム,ミトコンドリア,細胞核,エンドプラズムに侵入する[113].GQD は細胞内に侵入し,NIH-3 T3 細胞において p53, Rad 51, OGG1 タンパク質の発現を増加させ,DNA 損傷を誘発した [87].また,GQD は細胞内に侵入し,p53, Rad 51, OGG1 タンパク質の発現を減少させた.しかし,GQDs はヒト乳癌細胞株(50 μg/mL の用量)およびヒト神経幹細胞(250 μg/mL の用量)に対して有意な毒性を示さなかった [114, 115].GO 誘導体は、アクチン細胞骨格の制御、フォーカルアドヒージョンおよびエンドサイトーシスなど、細胞膜の構造および機能に関与する差動遺伝子の発現を劇的に減少させた [89]。ラット褐色細胞腫細胞(PC12細胞)では、グラフェンおよびrGOは、乳酸脱水素酵素(LDH)の放出、カスパーゼ3の活性化の増加、活性酸素の生成など、細胞毒性作用およびミトコンドリア損傷を引き起こした[82, 116]。
グラフェンは、細胞株、グラフェン材料の種類、および投与量に依存して、細胞生存率を高めることもあれば [117]、細胞死を引き起こすこともある [118]。GOの細胞毒性は、ヒト繊維芽細胞および肺上皮細胞において20μg/mL以上の濃度で24時間後に観察されたが、A549細胞では50μg/mL以上の濃度で最小限の毒性しか見られなかった[119]。また,HeLa 細胞では,GO によって誘導される ROS,マロンジアルデヒド(MDA),LDH などの生体応答が増加したが,スーパーオキシドジスムターゼ(SOD)は用量依存的に減少した [120].しかし、GO-分子ビーコン(GO-MB)は、HeLa細胞において20μg/mLであっても低い細胞毒性を示した[121]。GOは、A549細胞の生存率を低下させたが、同じ濃度および時間の曝露により、CaCo2大腸癌細胞の細胞生存率を増加させた[122]。別の研究では、GOが、低濃度では神経突起長の増加および神経細胞マーカーMAP2の発現を伴うSH-SY5Yの分化を劇的に促進したが、高用量(≧80 mg/mL)ではSH-SY5Y細胞の生存率を抑制することが報告された[123]。GO-PEG [124] および GO-chitosan [125] などの GO 上の機能化コーティングは、細胞間の相互作用を阻害することによって、粒子の細胞毒性を深く減衰させることができる。
GFNのin vitroでの毒性を表2にまとめた.グラフェンナノ材料の細胞毒性に関するデータは対照的であり、さまざまな特性が結果に影響を及ぼしている。毒性のメカニズムや影響因子については、今後詳しく解明していく必要がある。
表2 細胞モデルにおけるGFNの毒性
原寸表
GFNの毒性発現の起源
報告されているように、グラフェンの濃度、横方向寸法、表面構造、官能基、純度、タンパク質コロナなどの特性は、生物系におけるその毒性に強く影響する[2, 7, 104, 126-129].
濃度
グラフェン材料は、肝・腎障害、肺肉芽腫形成、細胞生存率低下、細胞アポトーシスなど、動物および細胞において用量依存的な毒性を引き起こすことが、数多くの結果によって示されている[130-134]。生体内試験において、GOは、低用量(0.1 mg)および中用量(0.25 mg)に暴露したマウスでは明らかな毒性を示さなかったが、高用量(0.4 mg)では慢性毒性を誘発することが示された。高濃度の GO は主に肺,肝臓,脾臓および腎臓に沈着し,単回尾静脈注射では腎臓で浄化されにくかった[135].これは、高用量のGOが、潜在的に取り込み飽和を超えるか、血漿オプソニンの質量を減少させ、その結果、肝での取り込みが抑制されたためである。さらに、ある in vitro 研究では、20 μg/mL の GO ナノシートは、2 時間のインキュベーションで A549 に細胞毒性を示さなかったが、高濃度(85 μg/mL) では 24 時間以内に細胞生存率が 50 % にまで低下したと報告した [136, 137]。Lü らも、ヒト神経芽細胞腫 SH-SY5Y 細胞株では、GO は低濃度では 96 時間明らかな細胞毒性を示さなかったが、100 mg/mL の GO で 96 時間培養処理すると、細胞の生存率が 20 %まで急激に減少した[123]。HeLa細胞、NIH-3 T3細胞、および乳がん細胞(SKBR3、MCF7)をグラフェンナノリボンで処理した結果も、用量(10~400 mg/ml)および時間依存的(12~48時間)に細胞の生存率が低下した[138]。濃度の高い GO は、リソソーム、ミトコンドリア、エンドプラズム、および細胞核に侵入した[119]。いくつかのデータでは、rGO は低用量および初期時点ではアポトーシスを介した細胞死を引き起こすが、時間/用量の増加に伴いネクローシスが優勢になることが示された[110, 135]。
横方向寸法
100 nm 未満のサイズのナノ粒子は細胞に入ることができ、40 nm 未満は核に入ることができ、35 nm 未満より小さいサイズは血液脳関門を通過することができる[85]。ある研究では、GO(588、556、148 nm)はA549細胞に進入せず、明らかな細胞毒性もないことが示された[112]。グラフェンの直径が100 ~ 500 nmの間である場合、最も小さなサイズが最も深刻な毒性を引き起こす可能性があり、40 nm以下である場合、最も小さなサイズが最も安全である可能性がある。例えば、直径 11 ± 4 nm の rGO は、0.1 および 1.0 mg/mL という非常に低い濃度で 1 時間後に hMSCs の核内に侵入して染色体異常と DNA 断片化を引き起こした。しかし、直径 3.8 ± 0.4 nm の rGO シートでは、100 mg/mL という高い用量でも 24 時間後に hMSCs に目立った遺伝毒性を示さなかった [118]-[118] 。
In vivo 研究では,s-GO(100-500 nm)は肝臓に優先的に蓄積したが,l-GO(1-5μm)は主に肺に存在した.これは,l-GO がより大きな GO-タンパク質複合体を形成し,静脈内注射後に肺毛細血管によって濾過されたためである[31].同じ濃度の 3 つの GO ナノシートの相対的な横方向サイズ(205.8nm、 146.8nm および 33.78nm) を考えると、Hela 細胞では、小さい GO は大きい GO よりもはるかに大きな取り込みを経験する [139]。s-GOの高い取り込みは、細胞の微小環境において変化し、その結果、3つのサイズのGOサンプルの中で最も大きな生存率の低下と最も深刻な酸化ストレスを誘発した[119]。その結果、ある研究では、GOのサイズに依存して、in vitroおよびin vivoでマクロファージのM1分極および炎症性反応を誘導することが明らかにされた。より大きなGOは、細胞によってより取り込まれやすい小さなGOシートと比較して、貪食が少なく、細胞膜への強い吸着を示し、TLRとの強固な相互作用を誘発し、NF-κB経路を活性化した[94]。こうした効果の根底にある詳細なメカニズムを解明するためには、グラフェン材料の横方向サイズの重要なメカニズムを説明する、より多くの研究が必要である。
表面構造
GFNは、大きく異なる表面化学的性質を有している。例えば、原始的なグラフェン表面は疎水性であり、GO表面はカルボキシレート基によって部分的に疎水化されており[140-142]、rGOは中間の親水性を有している[143]。GFNは、おそらく細胞との非常に強い分子間相互作用によって、細胞膜やタンパク質の機能と構造を破壊することが観察された[2, 91]。例えば、rGOは細胞膜に結合し、受容体を刺激し、ミトコンドリア経路を活性化し、アポトーシスを誘導した[110, 111, 144]。GO は、酸素含有量が高く、エッジが滑らかで、親水性であるため、rGO よりも小さく、毒性が低いことを示す限定的な証拠があった [104, 145, 146]。GOとrGOは表面の酸化状態が異なるため、親水性が異なるGOは、HepG2細胞に容易に内包され、取り込まれる可能性がある。逆に、疎水性が明らかなrGOは、細胞表面に吸着・凝集し、取り込まれない(または取り込みが少ない)可能性がある[110]。強いπ-πスタッキング相互作用により、グラフェンはタンパク質の多くの残基、特にビリンヘッドピース(HP)、F10、W23、F35といった芳香族残基を破壊する能力が高い。タンパク質の二次構造および三次構造は、大部分がグラフェン表面に横たわっており、タンパク質の構造と機能を破壊している[41](図2)。また、GOは二本鎖 DNA の塩基対の間に挿入し、分子レベルでの遺伝情報の流れを乱すことがあり、これが GO の変異原性作用の主要な原因の一つであると考えられる[7, 112, 146, 147]。
図2
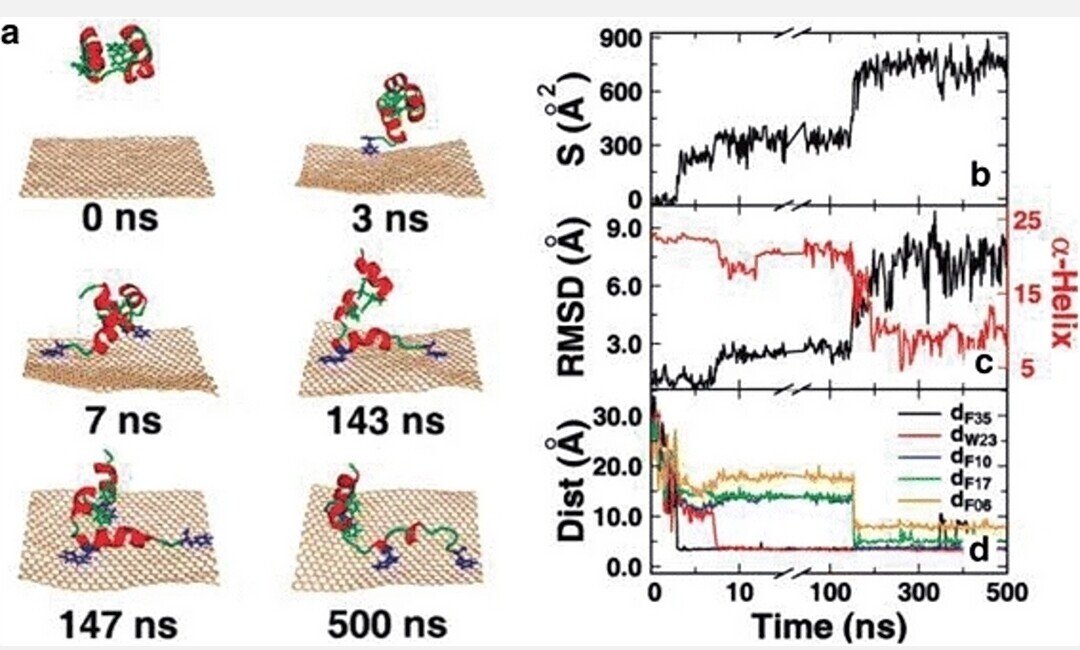
図2
HP35がグラフェンに吸着する際の代表的な軌跡。(a) 各時点での代表的なスナップショット。タンパク質は赤のヘリックスと緑のループで、グラフェンは小麦色で漫画状に示されている。π-πスタッキング相互作用を形成する芳香族残基は青色で、その他は緑色で示されている。(b) HP35のグラフェンとの接触表面積。(c) HP35のネイティブ構造からのRMSDとα-helix構造の残基数。ここで、二次構造はDSSPプログラムによって決定されている。(d) グラフェンと芳香族残基(F35、W23、F10、F17、F06)との間の距離。吸着過程をより明確に示すために、χ軸は切り捨てられ、再尺度化されている。[41] Copyright (2011), with permission from Journal of Physical of Chemistry.
電荷
多くの研究により、GOの表面電荷は、細胞の内部化および取り込みメカニズムに影響を与えることができるため、その重要性が強調されている[148-150]。貪食細胞以外の細胞では、GOの内包はごくわずかであり、これは負に帯電したGOと細胞表面との間の強い静電反発によるものと思われた[34]。しかし、他の研究者は、負に帯電したナノ粒子は、細胞表面の利用可能なカチオン部位に結合し、スカベンジャー受容体によって取り込まれることによって、非貪食細胞に内在化できることを示唆している[110, 146, 150]。GO/GS粒子は,赤血球(RBC)の形態変化と著しい溶解を引き起こし,高い溶血を引き起こすと報告されている.赤血球膜の破壊は,おそらくGO/GS表面の負電荷酸素基と赤血球外膜の正電荷ホスファチジルコリン脂質の間の強い静電相互作用に起因する[106].
官能基化
PEG [52]、PEG化ポリ-L-リジン(PLL) [151]、ポリ(ε-カプロラクトン) [152]、ポリビニルアルコール [3]、Pluronic [153]、アミン [98]、カルボキシルおよびデキストラン [79] 基による機能化が、グラフェンの毒性を大きく低減し生体親和性を向上させることが研究により確認された。In vivoの結果では、GO-Pluronicハイドロゲルの皮下注射後に軽度の慢性炎症が出現しただけで、GO-DEXの静脈内注射後に目立った短期毒性はテストされなかった [79, 154]。PEG化GSは、血液生化学および組織学的検査によって評価されるように、20 mg/kgで3ヶ月間暴露されたマウスにおいて顕著な毒性を引き起こさず、RESにおいて比較的低い保持を示した [52, 155]。GOをキトサンでコーティングすると,血液中の溶血活性がほとんどなくなった[39].さらに、PEGコーティングは、GOによる急性組織損傷を効果的に緩和し、肝臓、肺および脾臓におけるGOの凝集および保持を減少させ、GO [81]、GO-DEX [79]、およびフッ化グラフェン酸化物(FGO)[156]のクリアランスを促進させた。
In vitroでは、いくつかの細胞機能アッセイにより、原始的なグラフェンやGOの表面機能化が、強い毒性効果を低減するために重要であることが明確に示された[91]。PEG-GO、PEI-GO、およびLA-PEG-GOは、GOよりもヒト肺線維芽細胞へのダメージが少なかった[148]。PEG-GOは,グリオブラストーマ細胞(U87MG),乳癌細胞(MCF-7),ヒト卵巣癌細胞(OVCAR-3),結腸癌細胞(HCT-116),リンパ芽球様細胞(RAJI)など,いくつかの細胞培養に対して100μg/mLまでの濃度で細胞毒性を示さない [119, 157, 158].GQDs-PEGは,非常に高濃度(200μg/mL)でも肺癌および子宮頸癌細胞に対して非常に低いか全く毒性を示さなかった[159].しかし、細胞内への取り込みの可能性が高い非生分解性材料であるため、機能化グラフェンの長期的な悪影響の可能性を評価するにはさらなる調査が必要である。
凝集および沈殿
報告されているように、ナノ材料は、特に生理的条件下では、個々のユニットではなく、凝集体を形成する傾向がある。GS表面はGOと比較して赤血球の付着が少なく、水中での凝集体形成が多いためGSの溶血活性は低かった。一方,GSの速い沈降と凝集体形成は,ウェルの底で増殖させたヒト皮膚線維芽細胞の栄養利用を大きく阻害した[106].したがって、グラフェン粒子の凝集と沈降は、細胞によってさまざまな影響を及ぼすことになる。
不純物
ナノ材料の純度は重要な検討事項である。なぜなら、観察された毒性の原因は、ナノ材料そのものではなく、残留している汚染金属である可能性があり、その結果、GFNの細胞毒性に関するデータが食い違っている[35, 160]からである。従来から調製されているGOには、細胞に対して高い変異原性を有するMn2+およびFe2+が多く含まれている。従来から調製されているGOからこれらのイオンが非特異的に放出されることで、異常に高いレベルの細胞毒性とDNA破砕が生じる可能性がある[39]。特に、Peng ら [161] は、0.025 ppm Mn2+ と 0.13 ppm Fe2+ のみを含む高純度 GO を製造し、Hanene ら [161]は、0.13 ppm Fe2+ を含む高純度 GO を製造した。
自由表面電荷が高いため、ナノ材料は生体内のタンパク質と容易に「コロナ」を形成することができる[163, 164]。タンパク質コロナは,ナノ粒子の循環,分布,クリアランスおよび毒性に影響を与えることが示唆されている.いくつかの論文では,GOが血清中の吸着血漿タンパク質とGO-タンパク質コロナを形成し,これらのGO-タンパク質コロナは,生体内でのGOの生物学的挙動の運命を決定する重要な役割を担っていることが報告されている.このようなGO-タンパク質コロナは、特異的および非特異的相互作用を通じて、内皮細胞および免疫細胞へのGOの接着を制御することができる[165]。基本的に、タンパク質コロナ中の免疫グロブリンGおよび補体タンパク質は、免疫細胞においてナノ粒子を再編成するのを助け、粒子がRESによって飲み込まれるようにし、IgG被覆GOは、細胞膜受容体と特異的または非特異的相互作用によって取り込まれた [31, 165]。しかし、別の研究では、親子マウスにGO水溶液を飲ませたところ、牛乳中の豊富なタンパク質がGOの表面に吸着し、粘膜上皮細胞との直接的な相互作用を阻害したため、GOが腸管内の粘膜上皮細胞に直接付着することができないことがわかった[53]。タンパク質コロナは,HeLa,THP-1およびA549細胞において,細胞膜との物理的相互作用を制限し,細胞の形態的損傷を低減させることにより,GOの細胞毒性を緩和した[166-168].GOをFBSでプレコートし、細胞とともにインキュベートすると、細胞毒性効果は大きく減少した。100 μg/mL FBSコートGOではほぼ〜90 %の生存率、20 μg/mL FBSコートGOでは100 %の生存率が観察された。同様の傾向は、BSAで覆われたGOでも観察された[166, 169]。一貫して、追加血清は、4μg/mLの用量でJ774.A1細胞における原始的なGOの毒性を中和し、未処理細胞と比較して52.5%の細胞数の減少につながった[89]。
多くの研究を検討した結果、グラフェンの毒性は複数の要因に影響されると結論付けることができる。それらの要因が組み合わさって、多くの場合、GFNの毒性を大きく変化させた。科学的な研究では、しばしば原因と結果を明確に特定する必要がある。そのためには、一度に異なる要因を 1 つだけにしておき、その 1 つの要因の影響を判断できるようにする必要がある。しかし、いくつかの論文では、GFNsの毒性に影響を与える複数の要因が同時に研究され、その結果、混乱が生じました。
GFNの想定される毒性メカニズム
GFNの物理化学的特性および毒性は多くの学者によってよく研究されているが、GFNの毒性を支える正確なメカニズムは依然として不明である。GFNの細胞毒性の主なメカニズムの模式図を図3に示す。
図3
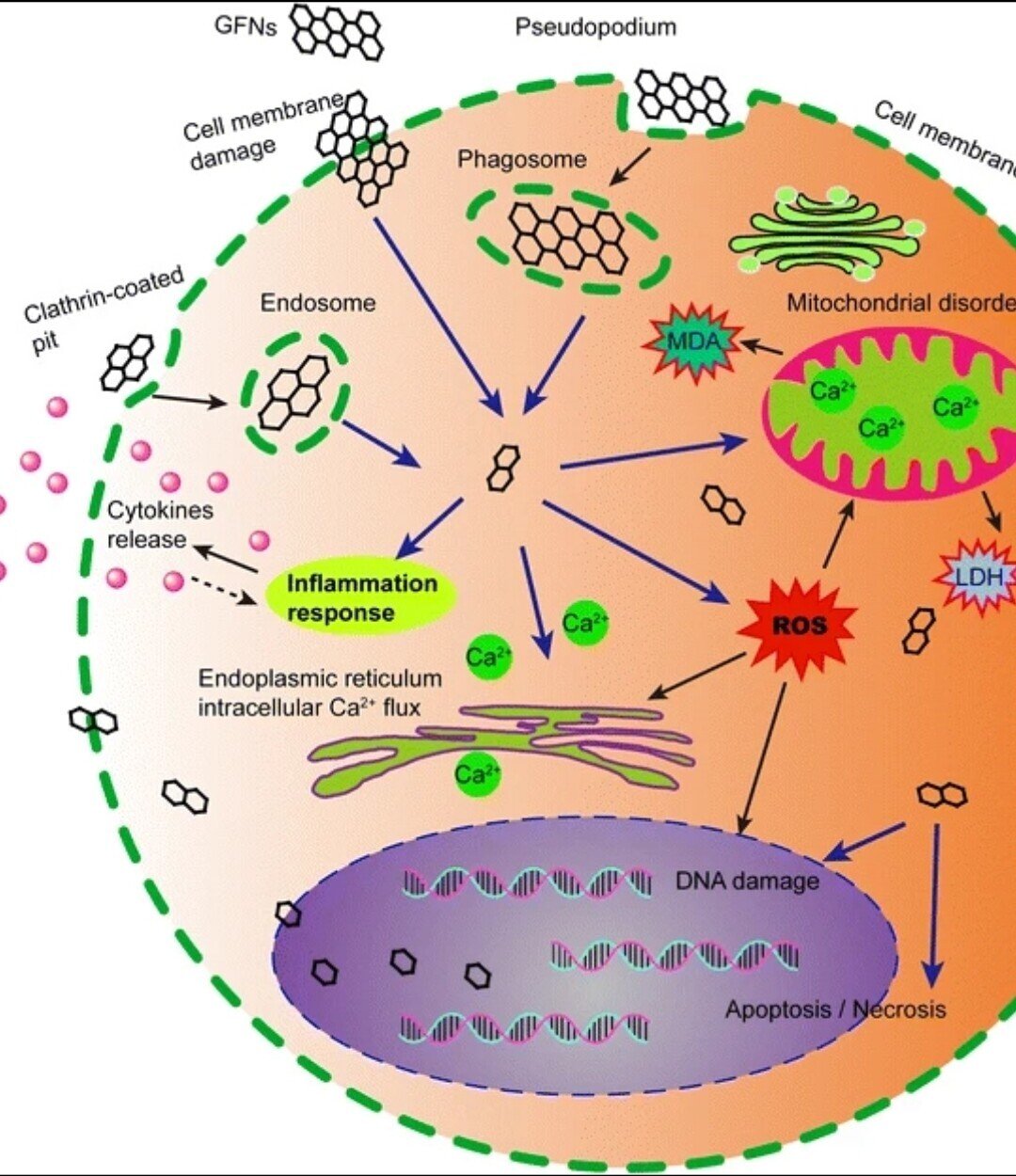
図3
GFNsの細胞毒性の可能なメカニズムを示した模式図。GFNは様々な経路で細胞内に侵入し、活性酸素の生成、LDHやMDAの増加、Ca2+の放出などを誘導する。その後、GFNは、細胞膜の損傷、炎症、DNA損傷、ミトコンドリア障害、アポトーシスやネクローシスなど、さまざまな細胞傷害を引き起こす。
物理的破壊
グラフェンは、球状や一次元のナノ粒子とは異なり、sp2炭素を含む二次元構造を持つユニークなナノ材料である。グラフェン・ナノ粒子と細胞膜との物理的相互作用は、グラフェンの細胞毒性を引き起こす主要な原因の一つである [7, 170, 171]。グラフェンは、その好ましい表面曲率により、ペプチドのα-ヘリカル構造と結合する能力が高い[172]。75μg/mL以上の濃度では、純粋なグラフェンがRAW 264.7細胞の表面に大きく付着し、細胞膜の異常な伸張を引き起こした[104]。GFNと細胞膜との強い疎水性相互作用は、F-アクチン糸状体の形態的伸展と細胞骨格の機能不全につながる。さらに、GNSの鋭利なエッジは「刃物」のように作用し、細菌の細胞膜を挿入し、切断する可能性がある[173]。さらに,GOは,大腸菌の外膜を直接損傷し,細胞内成分の放出をもたらした[173].しかし、TEMイメージングにより、GOをFBSでプレコートすると、細胞膜の破壊が無くなることが明らかになった[166]。
酸化ストレスにつながる活性酸素の生成
酸化ストレスは、活性酸素の増加により、カタラーゼ、SOD、グルタチオンペルオキシダーゼ(GSH-PX)などの抗酸化酵素の活性が圧倒されたときに生じる[174]。活性酸素は、多くの細胞内シグナル伝達カスケードにおけるセカンドメッセンジャーとして作用し、膜脂質分解、DNA断片化、タンパク質変性、ミトコンドリア機能不全などの細胞高分子損傷を引き起こし、細胞の代謝およびシグナル伝達に大きな影響を与える[175-177]。GOと細胞との相互作用は、過剰な活性酸素の発生を引き起こし、発がん、老化、変異原性のメカニズムの最初のステップとなる[83, 122]。酸化ストレスは、GOによる急性肺損傷に重要な役割を果たし[30]、酸化ストレスによる炎症反応は、GFNへの曝露時にしばしば出現した[133, 177, 178]。SODおよびGSH-PXの活性は、時間および用量依存的にGOに曝露した後に低下した[82, 106, 119]。同様に、HLF 細胞を GO に暴露した後、酸化ストレスがアポトーシスおよび DNA 損傷の主要な原因であった [148]。原始的なグラフェン処理細胞では、活性酸素の発生によってマイトジェン活性化プロテインキナーゼ(MAPK)(JNK、ERK、p38)およびTGF-β関連のシグナル伝達経路がともに引き起こされ、Bcl-2タンパク質ファミリーの二つのプロアポトーシス部材であるBimおよびBaxの活性化が伴われた。その結果、カスパーゼ-3およびその下流のPARPなどのエフェクタータンパク質が活性化され、アポトーシスが開始された [83, 179]。炎症,アポトーシス,ネクローシスを誘導するMAPK-,TGF-β-,TNF-α関連のシグナル伝達経路に関する詳細情報を図4にまとめた。
図4
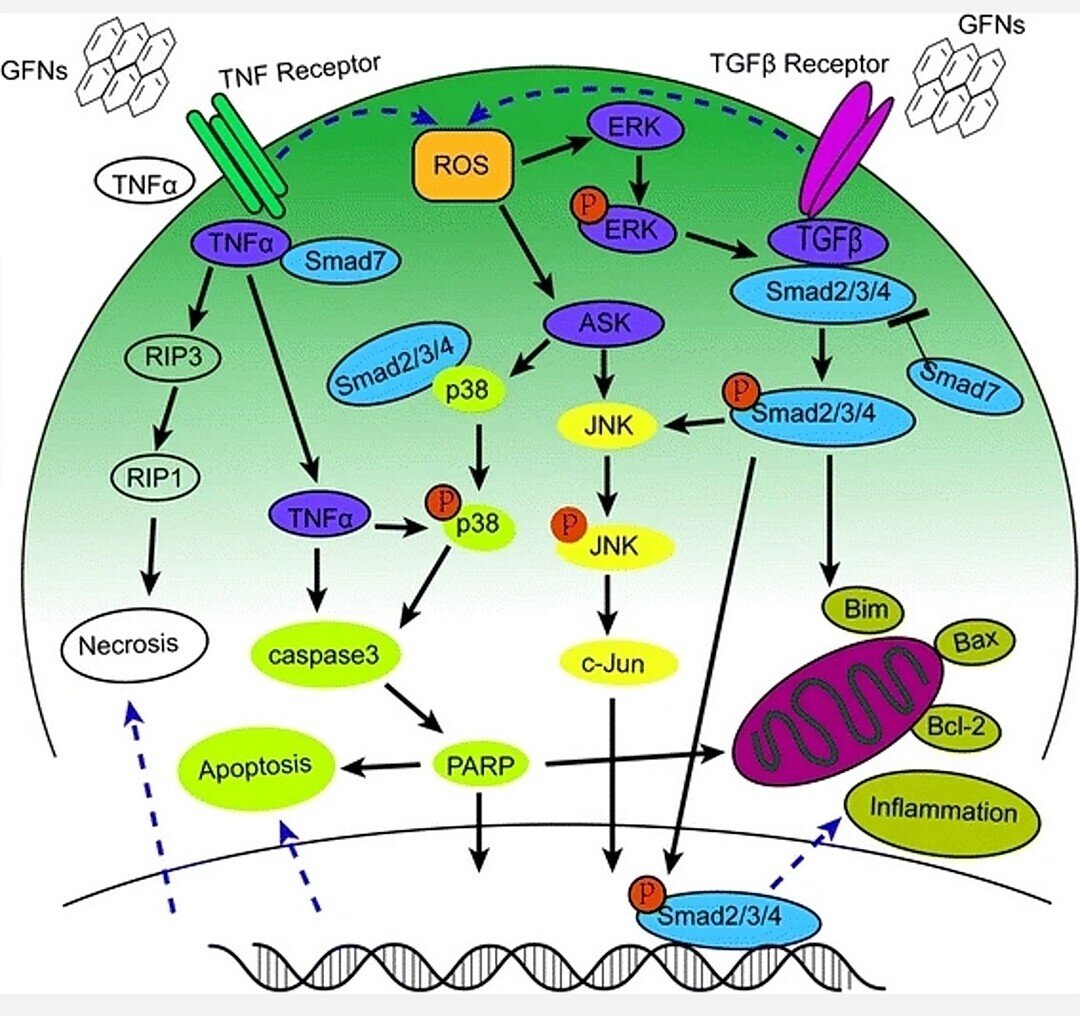
図4
GFNs毒性に関与するMAPKs、TGF-βおよびTNF-α依存性経路の模式図。活性酸素はMAPKsとTGF-βシグナル伝達経路を活性化する主要因であり、BimとBaxの活性化をもたらし、カスパーゼのカスケードとJNK経路の引き金となった。カスパーゼ3やRIP1の活性化により、最終的にアポトーシスとネクローシスを引き起こした。
ミトコンドリア障害
ミトコンドリアは,細胞内のさまざまなシグナル伝達経路に関与するエネルギー産生センターであり,アポトーシス制御のキーポイントでもある[83].GO およびカルボキシルグラフェン(GXYG)に曝露した後、HepG2 細胞ではミトコンドリア膜が脱分極し、ミトコンドリア量が減少した[180]。GFNに曝露すると、ミトコンドリア経路の活性化により、結合型および非結合型のミトコンドリア酸素消費量が著しく増加し、ミトコンドリア膜電位が消散し、最終的にはアポトーシスが誘発された[181]。例えば,GOは,ミトコンドリア電子輸送複合体 I/III の活性および電子輸送鎖のサイト I/II への電子の供給を増加させ,MHS 細胞におけるミトコンドリア呼吸中の ROS の発生を加速した [99].GO とチトクロム-c/H2O2 電子伝達系を介した -OH の形成は、酸化的および熱的ストレスを増強してミトコンドリア呼吸系を損ない、最終的に劇的な毒性をもたらす可能性がある[151]。さらに,GO 上の酸素部位は,細胞内の酸化還元タンパク質から電子を受け取り,チトクロム c や電子輸送タンパク質の酸化還元サイクルをサポートするかもしれないし,チトクロム MtrA,MtrB,MtrC/OmcA が GO への電子伝達に関与しているかもしれない[182].したがって、GFNは、細胞膜損傷および酸化ストレス誘導を除いて、細胞のミトコンドリア活性に直接影響を与えることにより、アポトーシスおよび/または細胞壊死を引き起こすことができる[183, 184]。
DNA損傷
GO は,その小さなサイズ,高い表面積および表面電荷により,重大な遺伝毒性を有し,例えば染色体の断片化,DNA 鎖の切断,点突然変異,および酸化的 DNA 付加体および変質など,重度の DNA 損傷を引き起こす可能性がある [87, 122, 185, 186] .古典的な変異原であるシクロホスファミド(50 mg/kg)と比較して,GO を 20 mg/kg の用量で静脈内注射したところ,マウスで変異原性が観察された [112].GO が細胞核内に侵入できない場合でも,核膜が破壊される有糸分裂期には DNA と相互作用する可能性があり,DNA 異常の機会が増加する [87, 147, 187, 188].また,GO が細胞核内に侵入できない場合でも,核膜が破壊される有糸分裂期には,GO が細胞核内に侵入する可能性があり,DNA 異常が増加する.グラフェン炭素環と疎水性DNA塩基対とのπスタッキング相互作用によって、DNAセグメントはグラフェン表面でらせん軸を垂直または平行に「立ち上がる」、あるいは「横たわる」ようになる。この分子間力によってDNAの末端塩基対が大きく変形し、遺伝毒性を高める可能性がある[189]。また、GOは、MAPK、TGF-β、NF-κBなどの細胞内シグナル伝達経路の活性化を通じて酸化ストレスを促進したり、炎症を誘発したりすることで、染色体の断片化、DNA付加物、点突然変異を誘発する可能性もある[110, 112, 146]。グラフェンおよびrGOはまた、染色体損傷を反映するp53、Rad51、およびMOGG1-1の発現を上昇させ、さまざまな細胞株においてG1期からS期への細胞周期移行を停止させることでCDK2およびCDK4の発現を低下させることができる[112]。DNA損傷は,癌の発生を開始させるだけでなく,GOの変異原性が生殖細胞で生じた場合,次世代の健康を脅かす可能性もあり,生殖能力や子孫の健康に影響を与える[112, 190].
炎症反応
GFNは、気管内注入または静脈内投与による高用量で、炎症細胞浸潤、肺水腫および肉芽腫形成を含む重大な炎症反応を引き起こす可能性がある[30, 49]。血小板は,炎症反応の際に病原体や粒子状物質を攻撃するための血栓形成の重要な構成要素であり,GOは静脈内注射後に肺血管を閉塞するための血小板に富む血栓形成を直接活性化することができた[98, 191].GOを21日間皮下注射すると、IL-6、IL-12、TNF-α、MCP-1、およびIFN-gなどの主要サイトカインの分泌とともに、強い炎症反応が誘導された[34, 192]。GFNは、循環単球の採用につながるサイトカインおよびケモカインを放出し、Th1/Th2サイトカインおよびケモカインの分泌を刺激することによって、炎症反応および組織損傷を引き起こすことができる[124, 193]。さらに、プリスティン・グラフェン(193)およびrGO(110)は、Toll-like受容体(TLR)に結合して細胞内のNF-κBシグナル伝達経路を活性化することにより、炎症反応を引き起こす。NF-κB シグナルカスケードは、TLR と IL-1 や TNF-α などの炎症性サイトカインによって始動する。活性化されると、NF-κBは細胞質から核に移行し、分解されたIκBの結合を促進し、転写因子として作用し、多数の炎症性サイトカインを合成します[194]。GFNによって活性化されるTLR4およびTLR9のシグナル伝達経路の模式図を図5に示す。
図5
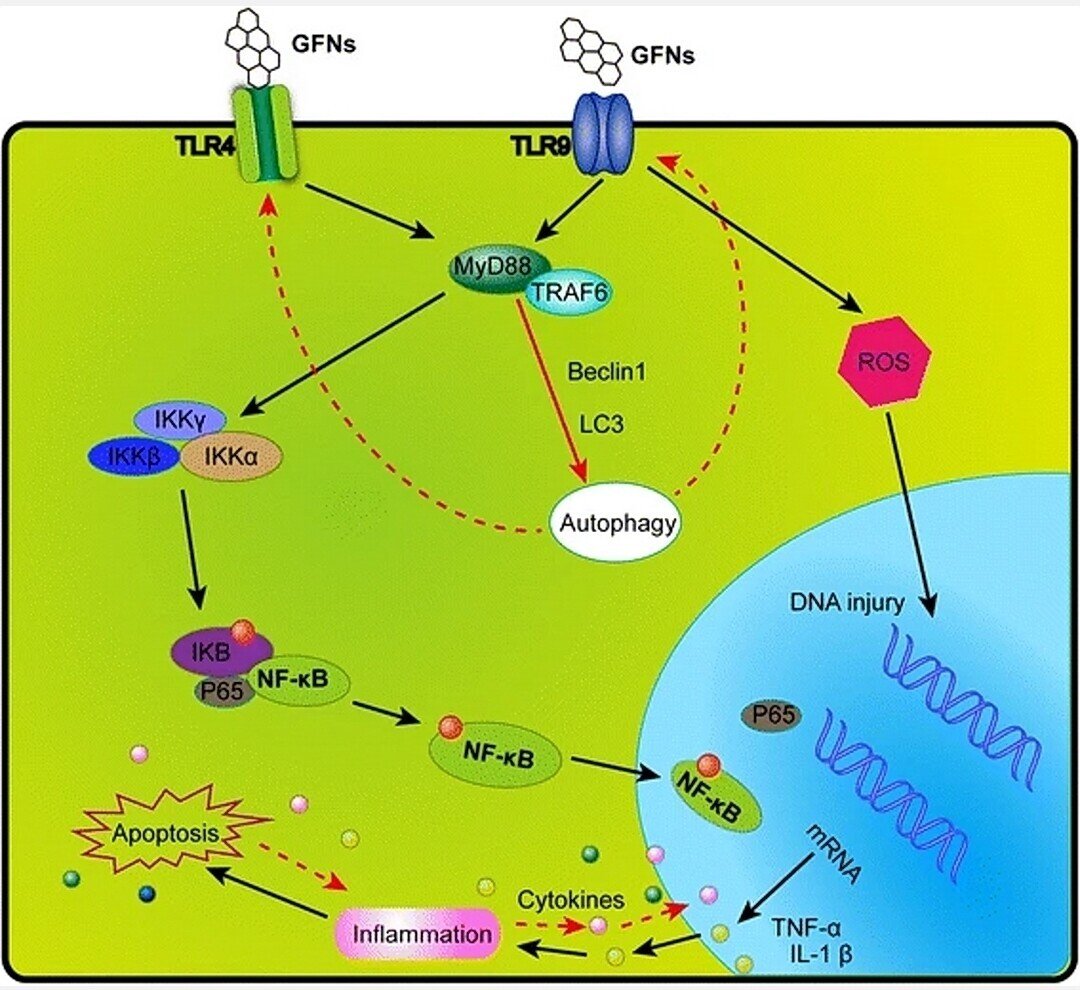
図5
GFN による細胞傷害の原因となる TLR4 と TLR9 のシグナル伝達経路を解明した模式図。GFNはTLRによって認識され、MyD88依存的なメカニズムによってIKKとIκBを活性化し、NF-κBサブユニットが放出されて核へのトランスロケーションが開始されます。このようにして、炎症性因子が核外に転写・分泌され、プログラムされたオートファジー、アポトーシス、ネクローシスを開始する免疫反応を調節している。
アポトーシス
アポトーシスは,複雑なプログラムを通じて遺伝子によって制御された細胞の自己破壊と定義される[83, 195].GOおよびrGOは、吸入後のマウスの肺にアポトーシスと炎症を引き起こし[99]、GFNも細胞においてプロアポトーシス効果を発揮した[111, 113, 124, 196]。さらに、グラフェンおよびGOは、細胞膜を物理的に損傷し [166]、ミトコンドリア外膜の透過性を高めてミトコンドリア膜電位を変化させた。増加した活性酸素は、MAPKおよびTGF-βシグナル伝達経路をトリガーして、ミトコンドリア依存性のアポトーシスカスケードを介してカスパー3を活性化し、アポトーシス実行を促す [83, 99]。同様に、rGOは低用量かつ早い時点でアポトーシスを引き起こし、デスレセプターおよび正準ミトコンドリア経路によってトリガーされた[110]。別の研究では、GFNによる3つの異なるアポトーシス経路が示された。GOは、タンパク質受容体との直接的な相互作用とそれに続くB細胞リンパ腫-2(Bcl-2)経路の活性化によって活性酸素依存性のアポトーシスを引き起こした。GO-COOHは、タンパク質受容体に結合し活性酸素に依存しない経路を起動することによって核DNAにパッシブ・アポトーシス信号を伝えた。しかしGO-PEIはTリンパ球の膜を激しく損傷してアポトーシスを誘発した [105, 197]。
オートファジー
オートファジーは,細胞成分の自己分解プロセスであり,近年,非アポトーシス的な細胞死として認識されている[198-200].オートファジーの活性化には、ベクリン1、複数のオートファジー関連タンパク質(ATG)、微小管関連タンパク質軽鎖3(LC3)およびp62を含むオートファゴソームの形成が必要である[201]。オートファゴソームの蓄積は、様々なナノ粒子への曝露と関連しており[202-205]、オートファジーは細胞外生物を除去し、細胞質内の生物を破壊することができる[206]。GOおよびGQDは、オートファゴソームの蓄積およびLC3-IからLC3-IIへの変換を誘導し、オートファジー基質であるp62タンパク質の分解を阻害することが示された [207, 208]。さらに、GOは、マクロファージ [34, 192] および結腸癌細胞 CT26 [206] において、TLR4 および TLR9 の反応を同時に誘発することができる。オートファジー経路は、マクロファージにおける TLR シグナルによる貪食と連動している [206, 209]。
壊死(ネクローシス)
ネクローシスは、炎症反応や細胞傷害によって引き起こされる細胞死の代替形態である。細胞を純粋なグラフェンに暴露すると、高用量(50mg/mL)でアポトーシスとネクローシスが引き起こされる [83]。細胞質 Ca2+ レベルの上昇によって誘発される LDH 漏出とミトコンドリア透過性遷移孔の開口は、アポトーシス/ネク ロシスにつながることが報告されている[210]。GO 処理は、TLR4 シグナルを活性化し、その後、オートクライン TNF-α 産生を一部誘発することにより、マクロファージ壊死を誘発することが明らかになった[93]。CDDP と組み合わせた GO(GO/CDDP)は、RIP1 タンパク質を減少させ RIP3 タンパク質を増加させ、核からサイトゾルへの高移動度グループ B1(HMGB1)の放出と CT26 細胞の外への放出を伴って、壊死を誘発した [205, 211, 212].
エピジェネティックな変化
エピジェネティクスには、DNAメチル化、ゲノムインプリンティング、母性効果、遺伝子サイレンシング、およびRNA編集が含まれる[213-215]。最もよく研究されているエピジェネティック修飾の一つであるDNAメチル化は、リン酸化、ユビキチン化、ATPリボシル化を含み、クロマチンリモデリングを引き起こすことがある[197, 216, 217]。最近の論文では、SL-GO/FL-GO への曝露により、DNMT3B および MBD1 遺伝子の発現が増加し、グローバルな DNA ハイパーメチル化が生じたこと、GNP 処理により DNMT3B および MBD1 遺伝子の発現が減少し、ハイポメチル化が生じたことが報告されている [216](2008 年)。GOは、CEP-1の構成要素に影響を与えることによって、DNA損傷-アポトーシスシグナルカスケードを抑制するためにmiRNA-360制御経路を活性化し得た[218]。これらのデータを総合すると、GFNはエピジェネティックな変化を調節することによって、遺伝子発現プログラミングに微妙な変化を引き起こし得ることが示唆される。しかし、GFNsが誘発するエピジェネティックな変化に関する研究は少なく、GFNs曝露によって引き起こされるエピジェネティックなメカニズムは十分に理解されていない。
結論として、多くの研究が、4つのシグナル伝達経路を含むGFNs毒性の代表的なメカニズムを論じている。TLRs、TGF-β、TNF-α、MAPKsの4つのシグナル伝達経路が関与する代表的なメカニズムについて、多くの研究が論じている。これら4つのシグナル伝達経路は相関的かつ相互調節的であり、炎症反応、オートファジー、アポトーシスなどの機構は独立しながらも、互いに関連している。さらに、これらのシグナル伝達経路の活性化には、酸化ストレスが最も重要な役割を果たすと考えられている。他のナノ材料の毒性研究では、アポトーシス、オートファジー、ネクローシスが交錯し、ある条件下で相互に阻害したり促進したりすることが報告されている。
しかし、これまでの論文で検討されたGFNs毒性のシグナル伝達経路は、複雑に絡み合った網の目のほんの一部であり、今後、シグナル伝達経路のネットワークを詳細に検討する必要がある。
データギャップと今後の研究
現在のところ、GFNの潜在的な危険性について結論を出すには、文献が不十分である。バイオメディカル用途に焦点を当てた多くの研究において、グラフェン材料は生体適合性があると示唆する研究者もいれば [119、154、162、219] 、有害な生物反応や細胞毒性を報告する研究もある [32、118、135、138、192] と、2つの相反する見解が出始めています。これらの一貫性のない結果は、研究グループの違い、様々な細胞または動物モデル、およびGFNの物理化学的特性の違いなど、いくつかの要因によって引き起こされた可能性がある。GFNを人体や他の生物医学的用途にin vivoで応用することを検討する場合、生体適合性を考慮する必要があり、GFNの毒性についてより詳細かつ正確な研究が必要である。
まず、GFNsの毒性に関する今後のすべての研究において、詳細な物理化学的特性評価が不可欠である。実験では、GFNの特徴記述には、そのサイズ、形態、表面積、電荷、表面修飾、純度、および凝集が含まれるべきである[88, 141, 148, 162]。これらの物理化学的要因は、GFNの毒性および生体適合性に大きく影響するため、単一要因の実験デザインおよび他の干渉要因の除外を考慮する必要がある。また、形成された酸化残渣が、機能化中にグラフェンおよびGOの表面構造を大きく変化させる可能性があるため、製造プロセスの詳細も提供する必要がある[151]。重要なのは、グラフェン技術において単一の普遍的な手法を確立することであり、これにより異なる研究または異なる研究室からのデータをより適切に比較することが可能になる。
第二に、観察基準やパラメータ、実験方法の選択が異なると、研究室間で大きなばらつきが生じる可能性がある[220, 221]。例えば、MTTアッセイは、自然還元により偽陽性シグナルが生じるため、グラフェンの毒性を常に正確に予測することができない。したがって、水溶性テトラゾリウム塩試薬(WST-8)、ROSアッセイ、トリパンブルー排除試験など、適切な代替評価を利用する必要がある [106, 222]。さらに、コメットアッセイは修復可能な損傷を測定し、後者は細胞分裂後に残る遺伝子損傷を測定するため、しばしば小核アッセイよりも高いレベルのDNA損傷を示す [159、223]。したがって、グラフェン材料の毒性評価に最も適したアッセイを選択する際には、偽陽性を回避するために注意が必要である。
第三に、がん細胞株はその遺伝的背景によって感受性や耐性が異なる傾向があるため、細胞株の選択が極めて重要である。同じグラフェンナノ粒子でも、さまざまな細胞の由来によって異なる反応を引き起こす可能性がある。偽陽性または偽陰性を避けるためには、安定性の高い適切な細胞株を使用しなければならない。ヒトや動物に由来する初代細胞は、ヒトの健康状態をよりよくシミュレートすることができる。他のナノ材料の毒性試験には大量の初代細胞が利用されているが[224-228]、これまでのGFNを用いた実験では、初代細胞の培養は極めて稀である[210, 229]。GFNの物理化学的性質と毒性を総合的に評価するためには、初代細胞を組み合わせた様々な細胞実験を行う必要がある。
第四に、GFNの投与経路は毒性試験において非常に重要な役割を果たし、異なる投与方法は異なる毒性学的反応をもたらすであろう[32, 53]。したがって、研究の目的に応じて、曝露経路および期間を慎重に選択する必要がある。鼻腔内薬物送達は、ナノ材料の神経毒性の研究にしばしば用いられるが[230, 231]、この投与方法は、GFNの毒性試験にほとんど適用されていない。神経系におけるGFNの毒性学的研究はまれであり、そのメカニズムは不明であり、今後さらに研究される必要がある。最近のトキシコキネティック研究は、異なる曝露経路を通じたGFNの吸収、分布、代謝、蓄積、排泄を含み、一定の結果を得ているが、内部の複雑なメカニズムを明らかにするにはまだ十分ではない。例えば、GFNが生理的障壁を通過する具体的な分子機構や、GFNの組織への蓄積量や排泄期間などを理解するためには、さらなる研究が必要である。また、ヒトのGFNへの曝露量が増加していることから、ヒトの全身毒性を評価することは、今後の研究において不可欠である。
第五に、もう一つ注目すべき重要な問題は、体内に入った後、あるいは細胞に取り込まれた後のGFNの長期的な運命である。最近の研究のほとんどは短期的な毒性評価であり[89, 232]、2008年にGFNが広く応用されて以来、長期的な毒性傷害はあまり注目されていない。
さらに、機能化されたグラフェン表面は生体適合性を向上させることができるが、表面コーティングの長期安定性を考慮する必要がある[233]。表面コーティングが最終的に分解された場合、その毒性は短期間の曝露結果とは大きく異なる可能性がある。より長い処理時間がGFNのナノ毒性ポテンシャルに影響を与えるかどうかを判断するために、拡張的な研究が必要である。
第六に、GFNの毒性メカニズムにおけるより特異的なシグナル伝達経路の発見と解明が必要である。現在、酸化ストレス、アポトーシス、オートファジーなど、いくつかの典型的なGFNの毒性メカニズムが説明され、広く受け入れられています。しかし、これらの機構は一般論として説明されているに過ぎず、これらの機構における具体的なシグナル伝達経路を詳細に調べる必要がある。また、他のナノ材料の毒性に関与するシグナル伝達経路も、GFNの研究に関連する可能性がある。したがって、今後の研究において、より多くのシグナル伝達経路を検出する必要がある。例えば、ナノエピジェネティクスは、ナノ材料の多くの研究で考慮されており、GFNの限られた毒性と副作用を評価する上でも有用である。最近の研究では、GFNがエピジェネティックおよびゲノム変化を引き起こし、物理的毒性や発がん性を刺激する可能性があることが示されている[234]。GFNは、腫瘍原性固体インプラントの特性に類似した、高い表面積、滑らかな連続表面および生物学的残留性を有する。GFNが異物肉腫を誘発する可能性があるかどうかは不明であり、したがってグラフェンの腫瘍の可能性やリスクに関する確定的な研究はできるだけ早く実施されるべきである。
結論
過去数年間、GFNは幅広い技術分野および生物医学分野で広く利用されてきた。現在、ほとんどの実験は、肺と肝臓におけるGFNの毒性に焦点を当てている。
したがって、脳障害や神経毒性に関する研究は、今後さらに注目されるに値する。多くの実験により、GFNは多くの生物学的応用において毒性副作用を有することが示されているが、毒性メカニズムの詳細な研究が緊急に必要である。さらに、GFNの毒性に関する対照的な結果は、効果的な実験方法と系統的な研究によって対処される必要がある。
本総説は、トキシコキネティクス、毒性メカニズムおよび影響因子をまとめることにより、GFNの毒性を概観し、今後、GFNのin vitroおよびin vivoの血液および生体適合性に関する徹底した研究を促進するための情報を提供することを目的としたものである。本総説は、GFNの臨床・治療応用の前に安全性に関する懸念を解消するのに役立ち、GFNの生物学的応用のさらなる開発にとって重要であると思われる。
略語
AMs:
Alveolar macrophages:肺胞マクロファージ
BBB:
Blood-brain barrier 血液脳関門
BEB:
Blood-epididymis barriers 血液・精巣上体関門
BTB:
Blood-testis barrier 血液-精巣関門
CR:
Complement receptor 補体受容体
FcgR:
Fcg receptor: Fcg受容体
FLG:
Few-layer graphene 数層グラフェン
GFNs:
Graphene family nanomaterials:グラフェンファミリーナノマテリアル
GNS:
Graphene nanosheetsグラフェンナノシート
GO:
Graphene oxide 酸化グラフェン
GO-COOH:
Carboxylated graphene oxide
カルボキシル化酸化グラフェン
GO-DEX:
GO-dextran(ゴーデックス) GO-デキストラン
GO-MB:
GO-molecular beacon GO-モレキュラービーコン
GO-NH2:
Aminated GO アミノ化GO
GO-PAA:
Poly(acrylic acid)-functionalized GO
ポリ(アクリル酸)官能基化GO
GO-PAM:
Poly(acrylamide)-functionalized GO
ポリ(アクリルアミド)官能基化GO
GO-PEG:
PEGylated GO derivatives PEG化GO誘導体
GO-PEI:
GO-polyethylenimine GO-ポリエチレンイミン
GQDs:
Graphene quantum dots グラフェン量子ドット
GSH-PX:
Glutathione peroxidase:
グルタチオンペルオキシダーゼ
GXVG:
Carboxyl graphene カルボキシルグラフェン
LDH:
Lactate and dehydrogenase
乳酸・デヒドロゲナーゼ
MALDI:
Matrix-assisted laser desorption/ionization:
マトリックス支援レーザー脱離イオン化法
MAPKs:
Mitogen-activated protein kinase
ミトジェン活性化プロテインキナーゼ
MDA:
Malondialdehyde マロンジアルデヒド
MØ:
Macrophage マクロファージ
MR:
Mannose receptor マンノース受容体
MSI:
Mass spectrometry imaging
マススペクトロメトリーイメージング
PC12 cells:
Rat pheochromocytoma cells
ラット褐色細胞腫細胞
PCGO:
Protein-coated graphene oxide nanoparticles
タンパク質被覆酸化グラフェンナノ粒子
PrGO:
PEGylated reduced graphene oxide
PEG化還元型グラフェン酸化物
RES:
Reticuloendothelial system: 網膜内皮系
rGO:
Reduced graphene oxide
還元型グラフェンオキサイド
ROS:
Reactive oxygen species 活性酸素種
SOD:
Superoxide dismutase
スーパーオキシドジスムターゼ
TLRs:
Toll-like receptor Toll様受容体
参考文献(1~100)
1. Novoselov KS, Geim AK, Morozov SV, Jiang D, Zhang Y, Dubonos SV, et al. 原子レベルの薄さの炭素膜における電場効果。Science. 2004;306(5696):666–9.
2. Sanchez VC, Jachak A, Hurt RH, Kane AB. グラフェン系ナノ材料の生物学的相互作用:学際的レビュー。Chem Res Toxicol. 2012;25(1):15-34.
3. YANG XY, WANG YS, Huang X, Ma YF, Huang Y, Yang RC, et al. デュアルターゲット機能とpH感受性を有する多機能化酸化グラフェンベース抗がん剤キャリア。J Mat Chem. 2011;21(10):3448-54.
4. Park S, An J, Jung I, Piner RD, An SJ, Li X, et al. 様々な有機溶媒中における高還元酸化グラフェンのコロイド状懸濁液。ナノレッツ(Nano Lett.) 2009;9(4):1593-7.
5. Geim AK. グラフェン:現状と展望。Science. 2009;324(5934):1530–4.
6. グラフェン系ナノ材料の毒性評価。J Food Drug Anal. 2014;22(1):105-15.
7. Seabra AB, Paula AJ, de Lima R, Alves OL, Duran N. グラフェンおよび酸化グラフェンのナノトキシシティ(Nanotoxicity of graphene and graphene oxide. Chem Res Toxicol. 2014;27(2):159-68.
8. Shen H, Zhang L, Liu M, Zhang Z. Biomedical applications of graphene. Theranostics. 2012;2(3):283-94.
9. Han U, Seo Y, Hong J. Effect of pH on the structure and drug release profiles of layer-by-layer assembled films containing polyelectrolyte, micelles, and graphene oxide.高分子電解質、ミセル、酸化グラフェンを含むレイヤーバイレイヤーアセンブルフィルムに及ぼすpHの影響。Sci Rep. 2016;6(2045-2322 (電子版)):24158.
10. Wang H, Liang Y, Mirfakhrai T, Chen Z, Casalongue HS, Dai H. グラフェンハイブリッド材料を用いた先進的な非対称型スーパーキャパシタ。Nano Res. 2011;4(8):729-36.
11. Loh KP, Bao Q, Eda G, Chhowalla M. Graphene oxide as a chemically tunable platform for optical applications(酸化グラフェンを化学的に調整可能な光応用プラットフォームとする)。Nat Chem. 2010;2(12):1015-24.
12. Wang D, Zhu L, Chen JF, Dai L. リチウムイオン電池の高容量負極材料としてのMn3O4-グラフェンハイブリッド。J Am Chem Soc. 2015;132(1520-5126 (電子版)):13978-80.
13. Gurunathan S, Han JW, Dayem AA, Eppakayala V, Kim JH. 緑膿菌における酸化グラフェンおよび還元型酸化グラフェンの酸化ストレス媒介性抗菌活性. Int J Nanomed. 2012;7(1178–2013 (Electronic)):e14.
14. Zhan S, Zhu D, Ma S, Yu W, Jia Y, Li Y, et al. 磁性体グラフェン複合体による病原性細菌の高効率除去。ACS Appl Mater Interf. 2015;7(1944–8252 (Electronic)):4290–8.
15. Yang HW, Hua MY, Chen SL, Tsai RY. 過酸化水素およびグルコース検出のための固有の過酸化水素触媒活性を有する高磁化カルボキシル修飾酸化グラフェンに基づく再利用可能なセンサー。Biosens Bioelectron. 2013;41:172-9.
16. Wang Y, Yuan R, Chai Y, Yuan Y, Bai L. トロンビンの超高感度検出を目的とした、機能化酸化グラフェンとレイヤーバイレイヤーで組み立てた金ナノ粒子によるin situ酵素的銀増幅。Biosens Bioelectron. 2012;38(1):50-4.
17. Huang J, Zhang L, Liang RP, Qiu JD. 超高感度グルコースセンシングのための酸化グラフェンに基づく「オンオフ」スイッチ可能な電気化学的アフィニティ・ナノバイオセンサー。Biosens Bioelectron. 2013;41:430-5.
18. Gao L, Lian C, Zhou Y, Yan L, Li Q, Zhang C, et al.グラフェン酸化物-DNAベースセンサー。Biosens Bioelectron. 2014;60(1873–4235 (Electronic)):22–9.
19. Chen ML, Liu JW, Hu B, Chen ML, Wang JH. 生細胞の蛍光イメージングのための量子ドットとグラフェンとのコンジュゲーション。Analyst. 2011;136(20):4277–83.
20. 酸化グラフェン共有結合グラフト型アップコンバージョンナノ粒子による近赤外線イメージングと光熱・光線力学的がん治療の複合化(Wang Y, Wang H, Liu D, Song S, Wang X, Zhang H.). Biomaterials. 2013;34(1878–5905 (Electronic)):7715–24.
21. Pan Y, Sahoo NG, Li L. The application of graphene oxide in drug delivery. Expert Opin Drug Deliv. 2012;9(11):1365-76.
22. Huiyun W, Chunyan D, Haiqing D, Aijun S, Wenjuan X, Xiaojun C, et al. PEG化ナノグラフェンオキシドにおける酸化還元反応性PEG剥離機構の設計による細胞内ドラッグデリバリーへの応用。Small. 2012;8(5):760-9.
23. Yang X, Qiu L, Cheng C, Wu Y, Ma ZF, Li D. 次世代導電性ヒドロゲルフィルムを目指した化学変換グラフェンの秩序あるゲル化。2011;50(32):7325-8.
24.
Schinwald A, Murphy FA, Jones A, Macnee W, Donaldson K. グラフェン系ナノプレートレット:その特異な空気力学的特性の結果としての呼吸器系への新たなリスク。ACS Nano. 2012;6(1):736-46.
25. Chaenyung C, Ryon SS, Xiguang G, Nasim A, Dokmeci MR, Xiaowu Shirley T, et al. グラフェン酸化物の共有結合による細胞入りハイドロゲルの機械特性の制御. Small. 2014;10(3):514-23.
26. Arvidsson R, Molander S, Sandén BA. ナノ材料グラフェンの潜在的な環境・健康リスクに関するレビュー。Hum Ecol Risk Assess. 2013;19(4):873-87.
27. Lee JH, Han JH, Kim JH, Kim B, Bello D, Kim JK, et al. グラフェンナノプレートレット製造職場の曝露モニタリング。Inhal Toxicol. 2016;28(6):281-91.
28. メイナードRL. ナノテクノロジーとナノ毒性学。エマージェンシー・ヘルス・スレット J. 2012;5.
29. Su WC, Ku BK, Kulkarni P, Cheng YS. グラフェンナノマテリアルエアロゾルのヒト上気道内への沈着。J Occup Environ Hyg. 2015;13(1):1-34.
30. Li B, Yang J, Huang Q, Zhang Y, Peng C, Zhang Y, et al. 気管内投与した酸化グラフェンのマウスでの生体内分布と肺毒性。NPG Asia Mater. 2013;5:E44.
31. 機能性ナノグラフェンオキシドのマウスへの経口および腹腔内投与による生体内分布と毒性。Biomaterials. 2013;34(11):2787-95.
32. Wen KP, Chen YC, Chuang CH, Chang HY, Lee CY, Tai NH. 機能化酸化グラフェンのマウスへの静脈内投与による蓄積と毒性。J Appl Toxicol. 2015;35(10):1211-8.
33. Kurantowicz N, Strojny B, Sawosz E, Jaworski S, Kutwin M, Grodzik M, et al. 高用量のダイヤモンド、グラファイト、酸化グラフェンのナノ粒子をラットの腹腔内に複数回注射した場合の生体内分布. Nanoscale Res Lett. 2015;10(1):398.
34. Yue H, Wei W, Yue Z, Wang B, Luo N, Gao Y, et al. 細胞応答の制御における酸化グラフェンの横方向寸法の役割。Biomaterials. 2012;33(16):4013-21.
35. Nezakati T、Cousins BG、Seifalian AM. 医療用化学修飾グラフェン系材料の毒性学。Arch Toxicol. 2014;88(11):1987–2012.
36. Chng ELK, Pumera M. グラフェン関連材料および遷移金属二カルコゲナイドの毒性。Rsc Advances. 2015;5(4):3074-80.
37. Zheng XT, Ananthanarayan A, Luo KQ, Chen P. Glowing graphene quantum dots and carbon dots: properties, syntheses, and biological applications. Small. 2015;11(1613–6829 (Electronic)):1620–36.
38. Caffo M, Merlo L, Marino D, Caruso G. Graphene in neurosurgery: the beginning of a new era.(脳神経外科におけるグラフェン:新しい時代の始まり)。Nanomed. 2015;10:615-25.
39. Wu SY, An SS, Hulme J. Current applications of graphene oxide in nanomedicine(酸化グラフェンのナノメディシンへの応用の現状)。Int J Nanomed. 2015;10(Spec Iss):9-24.
40. Tonelli FMP, Goulart VAM, Gomes KN, Ladeira MS, Santos AK, Lorencon E, et al. グラフェン系ナノ材料:生物・医療用途と毒性. Nanomedicine. 2015;10(15):2423-50.
41. Zhou R, Gao H. Cytotoxicity of graphene: Recent advances and future perspective.グラフェンの細胞毒性:最近の進歩と将来の展望. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2014;6(5):452-74.
42. 江間正樹、Hougaard KS、岸本晃、本田耕一郎:炭素系ナノ材料の生殖・発達毒性。文献レビュー. ナノトキシコロジー. 2015;10:391-412.
43. Jastrzebska AM, Olszyna AR. グラフェン系材料の生態毒性:現状、知識のギャップ、今後の必要性。J Nanopart Res. 2015;17(1):1-21.
44. Xu S, Zhang Z, Chu M. 還元型グラフェン酸化物ナノシートの長期毒性。雌マウスの生殖能力および子孫の発育に及ぼす影響。Biomaterials. 2015;54:188-200.
45. Jennifer M, Maciej W. Nanoparticle technology as a double-edged sword: cytotoxic, genotoxic and epigenetic effects on living cells.(諸刃の剣としてのナノ粒子技術:生細胞に対する細胞毒性、遺伝毒性、エピジェネティック効果)。J Biomater Nanobiotechnol. 2013;4:53-63.
46. Wu W, Yan L, Wu Q, Li Y, Li Q, Chen S, et al. 酸化グラフェン曝露の眼に対する毒性評価。Nanotoxicology. 2016;10(9):1329-40.
47. Lee K, Jeong Y, Bae J, Seok H, Yang Y, Roh S, et al. グラフェンナノプレートレットのラットにおける肺の炎症誘発性と縦隔リンパ節への転位に対する表面機能化の役割. Arch Toxicol.2016:1-10.
48. Schinwald A, Murphy F, Askounis A, Koutsos V, Sefiane K, Donaldson K, et al. 肺に滞留するプリスティングラフェンの最小限の酸化および炎症誘発性。Nanotoxicology. 2013;8(8):824-32.
49. Zhang X, Yin J, Peng C, Hu W, Zhu Z, Li W, et al. グラフェン酸化物のマウス静脈内投与による分布と生体適合性研究。Carbon. 2011;49(3):986-95.
50. 原子レベルで薄い酸化グラフェンシートの血栓誘発特性。ACS Nano. 2011;5(6):4987-96.
51. Gurunathan S, Han JW, Eppakayala V, Kim JH. マウス初代胚性線維芽細胞における微生物学的還元酸化グラフェンの生体適合性。Colloids Surf B Biointerf. 2013;105:58-66.
52. PEG化グラフェンのマウスにおけるin vivo薬物動態、長期生体内分布、および毒性。ACS Nano. 2011;5(1):516-22.
53. 授乳期マウスの発育に及ぼす酸化グラフェンの影響。Biomaterials. 2015;40:23-31.
54. Hu Q, Jiao B, Shi X, Valle RP, Zuo YY, Hu G. Effects of graphene oxide nanosheets on the ultrastructure and biophysical properties of the pulmonary surfactant film.(肺サーファクタント膜の超微細構造と生物物理学的特性に対する酸化グラフェンナノシートの効果)。Nanoscale. 2015;7(43):18025-9.
55. Gosens I, Post JA, de la Fonteyne LJ, Jansen EH, Geus JW, Cassee FR, et al. ナノ・サブミクロンサイズの金粒子の凝集状態が肺の炎症に与える影響. Part Fibre Toxicol. 2010;7(1743–8977 (Electronic)):1.
56. Geiser M, Kreyling WG. 吸入したナノ粒子の沈着とバイオキネティクス。Part Fibre Toxicol. 2010;7:2.
57. Ruge CA, Schaefer UF, Herrmann J, Kirch J, Canadas O, Echaide M, et al. 肺サーファクタントのタンパク質と脂質の相互作用は、ナノ粒子のマクロファージクリアランスに同化している。PLoS One. 2012;7(7):e40775.
58. Morfeld P, Treumann S, Ma-Hock L, Bruch J, Landsiedel R. ラットにおける吸入ナノ構造酸化チタンの沈着挙動:100 nm以下の粒子径の割合(ナノスケール)と透過電子顕微鏡のスライスバイアスの関係. Inhal Toxicol. 2012;24(1091–7691 (Electronic)):939–51.
59. Wiemann M, Vennemann A, Sauer UG, Wiench K, Ma-Hock L, Landsiedel R. ナノ材料の短期吸入毒性を予測するためのin vitro肺胞マクロファージアッセイ(Analysis for predicting the short-term inhalation toxicity of nanomaterials. J Nanobiotechnol. 2016;14(1477–3155 (Electronic)):1.
60. Kreyling WG, Semmler-Behnke M, Takenaka S, Möller W. Differences in the biokinetics of inhaled nano- versus micrometer-sized particles.吸入されたナノ粒子とマイクロメートルサイズの粒子の生物学的動態の違い。2012;46(1520-4898 (電子版)):714-22.
61. Liang M, Hu M, Pan B, Xie Y, Petersen EJ. 放射性標識した数層グラフェンのマウス気管内投与後の生体内分布と毒性。Part Fibre Toxicol. 2016;13(1):1-12.
62. Abbott NJ, Patabendige AA, Dolman DE, Yusof SR, Begley DJ. 血液脳関門の構造と機能。Neurobiol Dis. 2010;37(1):13-25.
63. Mendonca MC, Soares ES, de Jesus MB, Ceragioli HJ, Ferreira MS, Catharino RR, et al. 還元型酸化グラフェンによる一過性の血液脳関門開通:in vivo研究. J Nanobiotechnol. 2015;13:78.
64. Liu Y, Xu LP, Dai W, Dong H, Wen Y, Zhang X. Graphene quantum dots for the inhibition of beta amyloid aggregation.グラフェン量子ドットを用いたβアミロイド凝集の抑制。Nanoscale. 2015;7(45):19060-5.
65. ミタルP、ヒントンBT、デュフールJM. 血液-精巣および血液-精巣上体障壁は、そのタイトジャンクションだけではありません。Biol Reprod. 2011;84(5):851-8.
66. Liang S, Xu S, Zhang D, He J, Chu M. ナノスケール酸化グラフェンの雄マウスにおける生殖毒性。Nanotoxicology. 2015;9(1):92-105.
67. Buerkithurnherr T, Von MU, Wick P. Knocking at the door of the unborn child: engineered nanoparticles at the human placental barrier(胎児のドアをノックする:ヒト胎盤バリアでの人工ナノ粒子)。Swiss Med Wkly. 2012;142:w13559.
68. 妊娠年齢と表面修飾が、マウス妊娠におけるナノ粒子の胎盤・胎児移行に及ぼす影響。サイ・レップ 2012;2(46):847.
69. Huang X, Zhang F, Sun X, Choi KY, Niu G, Zhang G, et al. 機能化多層カーボンナノチューブが胎児発生に及ぼす遺伝子型依存的な影響。Biomaterials. 2014;35(2):856-65.
70. Qi W, Bi J, Zhang X, Wang J, Wang J, Liu P, et al. 多壁カーボンナノチューブの妊娠期間の異なる妊娠マウスへのダメージ効果。Sci Rep. 2014;4(3):doi: 10.1038/srep04352.
71. Du J, Wang S, You H, Jiang R, Zhuang C, Zhang X. ZnOナノ粒子の存在下でパーフルオロオクタンスルホン酸によって誘発されたゼブラフィッシュの発達毒性およびDNA損傷. Environ Toxicol. 2014;31(1522–7278 (Electronic)):360–71.
72. Zhou Z, Son J, Harper B, Zhou Z, Harper S. Influence of surface chemical properties on the toxicity of engineered zinc oxide nanoparticles to embryonic zebrafish.(エンジニアリング酸化亜鉛ナノ粒子の胚性ゼブラフィッシュへの毒性に及ぼす表面化学特性の影響)。ベイルシュタイン・ジェイ・ナノテクノール。2015;6(2190–4286 (Electronic)):1568–79.
73. Rollerova E, Tulinska J, Liskova A, Kuricova M, Kovriznych J, Mlynarcikova A, et al. 酸化チタンナノ粒子:毒性のいくつかの側面/開発に焦点を当てたものです。Endocr Reg. 2014;49(1210-0668 (Print)):97-112.
74. Warheit DB, Boatman R, Brown SC. 6形態の二酸化チタン試験材料(3つの顔料-異なるグレード&3つのナノスケール)を用いた発達毒性研究は、経口曝露ラットにおける影響の不在を実証している。Reg Toxicol Pharmacol. 2015;73(1096–0295 (Electronic)):887–96.
75. Ema M, Gamo M, Honda K. 人工ナノ材料のげっ歯類における発生毒性. Toxicol Appl Pharmacol. 2015;299(1096–0333 (Electronic)):47–52.
76. Li Z, Geng Y, Zhang X, Qi W, Fan Q, Li Y, et al. 多層カーボンナノチューブと酸化グラフェンナノプレートレット放射性トレーサーの同時曝露の生体内分布. J Nanopart Res. 2011;13(7):2939-47.
77. Wang Y, Li Z, Hu D, Lin CT, Li J, Lin Y. Aptamer/graphene oxide nanocomplex for in situ molecular probing in living cells(アプタマー/酸化グラフェンナノコンプレックスによる生体内分子プローブ)。J Am Chem Soc. 2010;132(27):9274-6.
78. Liu JH, Yang ST, Wang H, Chang Y, Cao A, Liu Y. マウスにおける酸化グラフェンの生体内分布に及ぼすサイズと用量の影響。Nanomedicine. 2012;7(12):1801-12.
79. デキストラン機能化グラフェンのin vitroおよびin vivoでの挙動。Carbon. 2011;49(12):4040-9.
80. 金ナノ粒子の粒子径依存性および表面電荷依存性による静脈内投与後の生体内分布。Eur J Pharm Biopharm. 2011;77(3):407-16.
81. Li B, Zhang XY, Yang JZ, Zhang YJ, Li WX, Fan CH, et al. マウスへのナノスケール酸化グラフェン静注後の生体内分布と毒性に対するポリエチレングリコールコーティングの影響. Int J Nanomedicine. 2014;9:4697-707.
82. グラフェンおよび単層カーボンナノチューブの神経褐色細胞腫由来PC12細胞に対する細胞毒性効果。ACS Nano. 2010;4(6):3181-6.
83. Li Y, Liu Y, Fu Y, Wei T, Le Guyader L, Gao G, et al. MAPKおよびTGF-βシグナル経路を介したマクロファージのアポトーシスのトリガーとなる原始グラフェン。Biomaterials. 2012;33(2):402-11.
84. 酸化状態の異なる酸化グラフェンの生体内適合性。ACS Nano. 2015;9(4):3866-74.
85. Mytych J, Wnuk M. 両刃の剣としてのナノ粒子技術:生細胞に対する細胞毒性、遺伝毒性およびエピジェネティック効果。J Biomater Nanobiotechnol. 2013;4:53-63.
86. Peng C, Hu W, Zhou Y, Fan C, Huang Q. グラフェンベース蛍光プローブによる細胞内イメージング。Small. 2010;6(15):1686-92.
87. Wang D, Zhu L, Chen JF, Dai L. グラフェン量子ドットは細胞内でDNA損傷を引き起こすことができるか?Nanoscale. 2015;7(21):9894-901.
88. Mu Q, Su G, Li L, Gilbertson BO, Yu LH, Zhang Q, et al. タンパク質でコーティングした酸化グラフェンナノシートのサイズ依存的な細胞への取り込み。ACS Appl Mater Interf. 2012;4(4):2259-66.
89. Xu M, Zhu J, Wang F, Xiong Y, Wu Y, Wang Q, et al. 表面修飾による酸化グラフェンのin vitroおよびin vivo生体適合性の改善:PEG化よりもポリアクリル酸官能基化の方が優れている。ACS Nano. 2016;10:3267-81.
90. コスタレロス K、ノボセロフ KS. 材料科学。グラフェンと生物学の接点を探る。サイエンス. 2014;344(6181):261–3.
91. Sasidharan A, Panchakarla LS, Chandran P, Menon D, Nair S, Rao CN, et al. 原始的なグラフェンと機能化したグラフェンのナノバイオ相互作用および毒性効果の違い。Nanoscale. 2011;3(6):2461-4.
92. Li Y, Yuan H, von dem Bussche A, Creighton M, Hurt RH, Kane AB, et al. Graphene microsheets enter cells through spontaneous membrane penetration at edge asperities and corner site.グラフェンマイクロシートは、エッジアスペリティとコーナーサイトにおいて自発的に膜を貫通する。Proc Natl Acad Sci U S A. 2013;110(1091-6490(電子版)):12295-300。
93. グラフェンオキシドは、マクロファージにおいてToll-like receptor 4 (TLR4) 依存性のネクロシスを誘導する。ACS Nano. 2013;7(7):5732-45.
94. マクロファージを活性化し、細胞や動物における炎症反応を促進する酸化グラフェンの横方向サイズの重要な役割。ACS Nano. 2015;9(10):10498–515.
95. Mao L, Hu M, Pan B, Xie Y, Petersen EJ. マウスに気管内投与した放射性標識数層グラフェンの生体内分布と毒性。Part Fibre Toxicol. 2016;13(1743–8977 (Electronic)):1.
96. Park EJ, Lee SJ, Lee K, Choi YC, Lee BS, Lee GH, et al. Pulmonary persistence of graphene nanoplatelets may disturb physiological and immunological homeostasis. J Appl Toxicol. 2016.
97. Kim JK, Shin JH, Lee JS, Hwang JH, Lee JH, Baek JE, et al. Sprague-Dawley ラットにおけるグラフェンナノプレートの 28 日間の吸入毒性. Nanotoxicology. 2016;10(7):891-901.
98. Singh SK, Singh MK, Kulkarni PP, Sonkar VK, Gracio JJ, Dash D. Amine-modified graphene: thrombo-protective safer alternative to graphene oxide for biomedical applications.アミン修飾グラフェン:生体用途の酸化グラフェンより安全な代替材料。ACS Nano. 2012;6(3):2731-40.
99. Duch MC, Budinger GR, Liang YT, Soberanes S, Urich D, Chiarella SE, et al. 酸化の最小化とナノスケールの安定分散により、肺におけるグラフェンの生体適合性が改善された。ナノレッツ(Nano Lett) 2011;11(12):5201-7.
100. Wang X, Duch MC, Mansukhani N, Ji Z, Liao YP, Wang M, et al. 炭素質ナノ材料の段階的試験および決定分析のためのプロフィブロニック機構に基づく予測的毒性学的アプローチの使用. ACS Nano. 2015;9(1936-086X (Electronic)):3032–43.
この記事が気に入ったらサポートをしてみませんか?
