組織チップとマイクロフィジオロジー・システムを医学、生物学、薬理学、毒物学の壮大な計画に組み入れる
デビッド・E・ワトソン、ローズマリー・フンツィカー、ジョン・P・ウィクスウォ
Exp Biol Med (Maywood). 2017 Oct; 242(16): 1559–1572.
Published online 2017 Oct 25. doi: 10.1177/1535370217732765
元記事はこちら。
要 旨
マイクロフィジオロジーシステム(MPS)は、人工オルガノイド(EOs)、単一臓器・組織チップ(TC)、複数の臓器を連結したヒト生理系のミニチュアin vitroモデルを含み、薬剤開発や組織生理学・病態生理学の機構解明に有効なツールとして急速に普及しつつある。Experimental Biology and Medicine誌の第2号MPSテーマ号は、米国国立衛生研究所、IQコンソーシアム、食品医薬品局、環境保護庁、MPS企業、学界の科学者や技術者による15の論文で構成されています。トピックは、臓器オンチップの進歩、課題、将来、医薬品へのTCの普及、子供の健康保護、肝臓ゾーネーション、肝臓チップと相互接続システムへの結合、胃腸MPS、ハートオンチップにおける未熟心筋細胞の成熟化などです。ヒト皮膚コンストラクトにおける複数種類の細胞の共培養、神経組織モデルを形成するEOを作成するための合成ハイドロゲルの使用、血液脳関門オンチップ、結合した女性生殖器官のMPSモデル、ボディオンチップの作成のためのMPS装置の結合、内分泌概日リズムを再現するためのマイクロフォーマーの使用などである。MPSのハードウェアは前回のMPSテーマ号から比較的安定しているが、ヒト人工多能性幹細胞への依存度を高めた細胞ソーシングや、MPSバイオリアクターにおける遺伝的・機能的細胞状態の特性化には大きな進歩があった。灌流液と細胞の容積比を最小にし、結合したTCの生理的スケーリングを尊重する必要性が認識されつつある。医薬品開発者の質問には、潜在的な価値、コスト、製薬会社のニーズが分析されている。最も価値が高く、スイッチングコストが低いのは、疾患メカニズムの発見に役立つMPS疾患モデルの開発、プローブ、リード、臨床候補を含む新規化合物、および薬剤候補の作用機序であろう。
インパクトステートメント
マイクロフィジオロジーシステム(MPS)は、人工オルガノイド、個体および連鎖したオルガン・オン・チップや組織チップを含み、急速に成長している研究分野です。この論文やこの特集号に掲載された他の論文で検討されているように、MPS研究は過去3年間に細胞の調達と特性評価の両面で顕著な進歩を遂げました。この分野が成熟するにつれ、現在特定されている課題が解決され、新たな課題が認識されつつある。
国防高等研究計画局DARPA、国立衛生研究所、食品医薬品局、国防脅威削減局、環境保護局による2012年以降の2億ドル以上の投資と、相当額の企業支出を基に、MPSコミュニティの学術・商業関係者は、MPS技術を医薬品開発の加速と毒性学の進展に応用するために必要なトランスレーショナル課題を満たす能力を実証している。
キーワードオーガノオンチップ、人工オルガノイド、創薬、ホムンクルス、疾患モデル、トキシコロジー
はじめに
本稿は、急速に発展しているマイクロフィジオロジー・システム(MPS)分野を特集したExperimental Biology and Medicine(EBM)誌の第2号テーマ特集の序章である。本号に掲載された14の論文を紹介しながら、まず、これらのデバイスが、単独で、あるいは結合してMPSホムンクルスを形成する際に、医学、生物学、薬学および毒性学の確立した分野とどのように関連するかを考察する。この関係を理解することは、MPSの研究開発に関連する強み、弱み、機会、脅威を適切に評価し、ひいてはMPS研究をバイオメディカル科学の大局に適切に統合するために極めて重要である。この特集号で報告された解説、レビュー、オリジナル研究の紹介では、MPS研究のいくつかの異なる分野を分析し、より大きな歴史的、科学的文脈の中にそれらを位置づける。特に、従来の細胞培養では不十分で、MPSのアプローチが解決策となりうる医学的・生物学的問題について議論する予定である。
まず、生物医学研究の主流であるプラスチック上の2次元生物学について、明らかに皮肉な見方をする。細胞生物学について私たちが知っていることの多くは、70年にわたる細胞の試験管内培養の研究に基づいています。しかし、高グルコース培地で硬いプラスチック上に単層培養した不死化細胞を用いた細胞生物学は、実際には、1日に1回砂糖を食べ、運動せず、眠らず、甲状腺、ストレス、性、その他のホルモンの変動を経験しない、癌化した、近親交配の、太った、怠惰な、糖尿病の細胞を研究しているという理にかなった議論ができるかも知れません。
同じ考えを持つ細胞とだけ話し、暗闇と自分の排泄物の中で生活し、死者を埋葬することもない。一日の終わりには、ますます酸性度が増す環境の中で、飢えとゆっくりとした窒息に見舞われるかもしれません。最も重要なことは、硬質プラスチック上で成長する細胞は、生物学者や組織工学者に、プラスチック上の2次元的な生活を定量的に詳細に説明する、再現可能で統計的に有意な結果をもたらすということです。しかし、このような「平面的」な生物学は、一般的には、特に人間の生理学や、3次元(3D)組織の試験管内での最適化には適さないかもしれません。実際、3次元が加わると劇的に変化します。1-10 この説明は状況を誇張していますが、ヒトの組織機能を生理学的に適切にモデル化する必要性を強調しています。組織モデルが2次元、2.5次元(血液脳関門や肺胞の血管と空気の界面のような平面的な関門)、3次元、さらには4次元(時間を変数として組み込む)のいずれであるべきかは、再現される生理機能の複雑さと特定の疑問に答えるために必要な精度によって決定されるでしょう。しかし、様々な刺激に対するヒトの組織やコンパートメント界面の反応について重要な質問をするために、適切な細胞-細胞、あるいは細胞-マトリックス界面を提供する、有効で信頼性が高く、使いやすいモデルが必要であることは議論の余地がない。
この特集号に掲載された論文では、2次元以上の会合が可能な半固体培地で培養した細胞から、より生理的に適切な反応が得られることを示すいくつかの追加的な例を紹介している。細胞の表現型の発達と維持における細胞外環境の役割に関する実験的証拠は、乳癌細胞と腺組織の培養に関する Mina Bissell の先駆的研究に遡る(Schmeichel and Bissell11 と McMillin et al.12 に総説あり)。
形と機能は動的かつ相互に作用する」、「我々は遺伝子の配列、遺伝子の言語、遺伝子のアルファベットについてすべてを知っているが、...形の言語とアルファベットについては何も、しかし何も知らない」という認識が広まっているにもかかわらず、である。「MPSは、さまざまなハイコンテントイメージングや分析技術をサポートしながら、長期間にわたって組織の微小環境を再現できるため、研究者は、プラスチック上の2次元生物学とin vivoまたはin vitroの動物器官の間の物理スケールと複雑さのレベルで、形態と機能の両方を研究し、定義上3次元を占める細胞不動産を作成できるようになりました。
もちろん、細胞や組織のアイデンティティにとって、細胞領域は重要ですが、近隣の多様性も重要な要素になり得ます。組織は1種類の細胞で構成されているかもしれませんが、臓器は必ず、互いに助け合う役割を持つさまざまな細胞でできています。一般的な研究分野として、MPSはいくつかの形態の細胞の集合体の研究を可能にする。すなわち、人工組織オンチップ、人工生体インターフェースオンチップ、自己組織化プリントまたはEO、さらには移植可能なマイクロオーガニズムなどである。(OoCとオルガノイドは別の研究分野であると言う人もいるかもしれないが、この2つのアプローチは互いに近づきつつあり、それゆえ我々はMPSの最も一般的な定義を支持している)。
このテーマの論文のいくつかは、肝臓、14-16 胃腸系、17 脳、18,19 皮膚、20 女性の生殖管など、MPS のアプローチで可能となる細胞の異質性を長期的にサポートすることを扱っています21。
MPSのバイオメディカル分野への進出
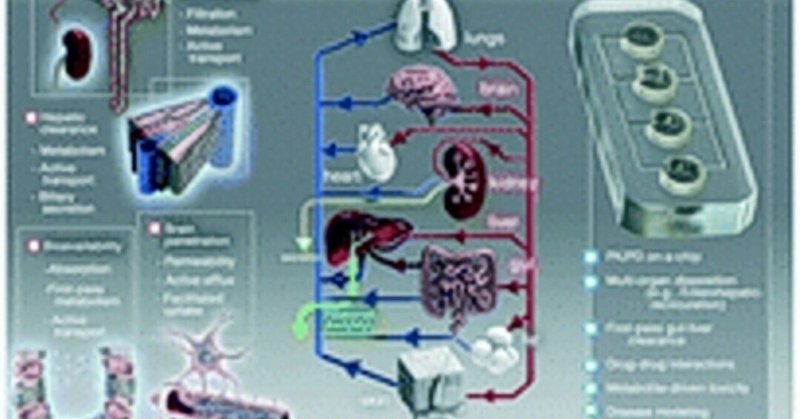
機能的な細胞を長期間維持するための合成足場、環境条件を厳密に制御するバイオリアクター、微細加工やマイクロ流体技術の改善など、数十年にわたる研究の結果、体外に分離した状態で組織機能を模倣するための利用しやすいシステムが提供されるようになりました。Ingberらは、肺胞-毛細血管界面の必須要素を組み立てることで、ヒト肺の基本的な機能単位を構築しました。マイクロ流体デバイスには、細胞増殖を促すために細胞外マトリックスタンパク質でコーティングされた薄い多孔質ポリジメチルシロキサン(PDMS)膜で区切られた2つの流路があった。肺上皮細胞は上部に、肺内皮細胞は膜の下部から単層を形成してコンフルエンスまで増殖させた。上皮層の上に空気を導入し、内皮細胞の上に血液を模倣した培地を流した。この配置により、栄養、細胞、老廃物などが2つの流路に独立して循環するようになった。また、細胞層と平行に走る柔軟な別々の横チャンネルに真空をかけることで、呼吸時の伸縮をシミュレートすることができた。研究グループは、空気界面からのナノ粒子の取り込みなどの生理的機能は、周期的な伸縮を加えることによってのみ生じることを示すという、極めて重要な観察結果を得た。また、血流路に注入された好中球が、膜の孔を通って上皮層へとくねくねと移動できることも明らかにした。さらに研究グループは、がん患者のIL-2治療で生じる肺水腫を再現した。
この2つの肺活量に関する論文は、国防高等研究計画局(DARPA)と国立衛生研究所(NIH)がMPSと組織チップの開発に多額の投資を行うきっかけとなったという点でも注目に値する。
この画期的な研究以降に誕生したMPSコミュニティは、多くの一次臓器について、生理学的に適切な反応を可能にする方法に関する同じ重要な疑問に取り組もうとした。刺激に対する器官特異的な反応を示す最小単位は何なのか?臓器内の異なる界面を異なるチップで表現し、それを連結して意味のある集合的な応答を与えることができるのか?器官特異的な反応を示すそのようなユニットを連結して、器官全体の効果を示すことができるのか?TCの長所と短所を明らかにするために適用すべき最も効果的な「ストレステスト」とは何か?その結果は一般化できるのか、それとも非常に狭い範囲での「目的適合」運動においてのみ適切なシステムなのか?プラットフォームは「ワンサイズ・フィット・オール」、あるいは「プラグ・アンド・プレイ」タイプの構成で作ることができるのか、あるいは各組織を「一から」設計しなければならないのか?複数のTCを相互接続して作成した個々の臓器チップやMPSホムンクルスは、特定の患者の病気、あるいは少なくとも特定のゲノム疾患群の病気を再現することができるのか?つまり、生体内で観察される構造と機能を細胞が適切に再現できるような微小環境を工学的に作り出すことができるのでしょうか?
DARPAとNIHは(食品医薬品局(FDA)からの重要な情報提供を受けて)、毒性スクリーニングのためのTCの設計と開発に焦点を当てた補完的なプログラムによって、この問題に取り組むことにしたのである。
多くの点で、これはこの新興分野の低空飛行の果実を収穫するチャンスだったのです。工学研究の基本原則は、明確な目標に向かって設計することです。そのため、医薬品候補として検討された何百もの化合物に関する吸収・分布・代謝・排泄毒性(ADME-Tox)データが(単一の一般公開リポジトリに集められていないとしても)豊富に存在する。投与量、代謝、持続性、生理学的効果、有効性、合併症、および動物やヒトでの試験から得られたその他の結果に関する詳細な情報が存在する。このようなデータは、与えられた組織プラットフォームのパラメータを調整するための化合物トレーニングセットを確立し、その後、テスト化合物(理想的には既知と未知の両方)のアレイを作成して性能を評価するために使用することができます。TCが単一の臓器または臓器が連結した複合体のADME-Toxを予測できることを実証すれば、この一般的な手法が医薬品開発において実現可能であることを証明する上で大きな力となるであろう。
DARPAプログラムは、5年以内に達成すべき非常に困難な目標を提示した。それは、薬剤候補に対する人間の反応全体を予測するようにリンクされた10種類のチップ(それぞれが異なる臓器機能を表す)を含むシステムを開発することであった。NIHの募集では、薬物チャレンジに対する人間の反応を予測するチップと、作業の後期には培養組織を機能的にリンクさせることも要求された。しかし、10個の臓器模倣品が完全に統合されることは、特に期待されていなかった。NIHはまた、細胞調達の問題、特に人工多能性幹細胞を出発点とした特定の表現型の細胞の開発について、規定を設けていた。プログラムが成熟するにつれ、NIHはオンチップ疾患モデル、特にヒトでの研究が困難または不可能で、現実的な動物モデルが存在しない可能性のある希少疾患への関心を表明した。
DARPAとNIHのプログラムはそれぞれ独立して運営されていましたが、相乗効果を発揮していました。EBMの前回のMPSテーマ別号では、これら2つの取り組みから初期の進展を強調する原稿が掲載された。26-42 MPSは、部分(ゲノム、プロテオーム、メタボロームなど)を理解せずに全体(競合生物)を理解することは不可能であり、部分を理解するには全体を理解する必要があると説明する生物学の解釈の輪を閉じるのに役立つと認識されていた26,43。本号で見るように、2014年に概説された課題は、複数のグループによって認識されており、特に、大量の灌流液へのシグナル伝達分子の希釈に関連する「体積問題」である26。27,28 健康および疾病における骨および関節、29 ブレイン・オン・ア・チップ、30 消化器系、31,32 肺、33 肝臓、34,35 生殖器、36 骨格筋、37 皮膚、38 血管系などの器官系について考察されました42。また、ヒト幹細胞の分化を制御するマイクロスケール技術のレビューでは、幹細胞を目的の表現型に誘導することの複雑さ41 が紹介され、MPS研究者が細胞株や初代細胞から離れる際に決定的に重要であることが明らかにされた。これらの論文から、2014年のMPS研究の現状を詳細に把握することができる。
DARPA MPS プログラムと NIH National Center for Advancing Translational Sciences (NIH/NCATS) TC の第一次助成が終了し、一般に期待以上の成果であったと考えられている。実際、医薬品開発における予測的毒性学技術を補強するツールを生み出すという当初の目標は、医薬品候補の有効性と作用機序の探求につながりました。新しい研究は、組織や臓器の正常・異常に関する洞察をもたらし、特に病気のプロセスを明らかにする上で有用になってきている。さらに、他の連邦政府の取り組みも、自らの使命に取り組むためにMPSのアプローチを取り入れている。その代表的な例が、環境保護庁(EPA)のScience to Achieve Resultsプログラムで、予測的毒物学のための器官型培養モデルの開発が進められています。また、国防脅威削減庁の「X vivo Capability for Evaluation and Licensure Program」もそのひとつです。この4年間の活動と成果を踏まえて、2回目のEBM MPSテーマ別号を発行するにふさわしい時期が来たと思います。これは、野心的な目標と短期間での目覚しい成果の両方を反映しています。私たちは現在、比較的基本的な(複雑な器官に比べて)再現可能なツールのコレクションを持っています。これは、制御された入力の機能としての器官(そしておそらく器官)生理学、代謝、疾患の発生/進行(その他の側面)に関する疑問を解決し始めることができる構成要素となっています。また、これらの組織をリンクさせる初期段階も確立されつつある。しかし、これらのシステムが研究室や医薬品開発のパイプラインの一部として常用されるようになるためには、根本的な運用上の問題が残っており、これを解決する必要がある。運用上の問題を解決する一つの方法は、MPS技術の商業化である。ZhangとRadisic44はこの分野で約20の企業が出現していると論じているが,これらの各企業のカスタマーサービス,エンジニアリング,マーケティング部門は,どんなに小さくても,顧客のニーズや希望にいち早く気づくに違いない。
同様に、製薬会社内や大規模なバイオテクノロジー企業でTCプログラムが生まれ、この分野で開発されている知的財産をもとに、多くの小規模な新興企業や委託研究機関が出現していることも心強い。これらの企業の多くはアカデミアから参入しており、博士課程の学生やポスドクが自ら開発したアッセイを実施するのと、製薬会社の技術者がそのアッセイの製品化されたバージョンを実施するのとでは、その違いがすぐに明らかになるであろう。これらの商業組織は、ベンチトップシステムを医薬品開発のための本格的なツールにすることに注力しており、試験室や臨床への進展が加速されるはずである。
DARPA と NIH の MicroPhysiological Systems 補助金による最初の取り組みの成功は、より複雑な性質の質問を促し、NIH は MPS の最初のラウンドを補足するために、特にコンソーシアムの取り組みで欠けている臓器を表すチップの構築 (PA-16-178) と希少疾患 (PA-16-173) のための資金提供機会公募を発行する結果となった。
さらに、疾患モデリングと有効性試験に焦点を当てた「次世代」MPS のオープンコンペティション(RFA-TR-16-17)が NCATS と他のいくつかの NIH 研究所の協力のもと発表されました。この分野の急速な進化は、提案募集の際に「本質的な特徴」として、「生物工学、マイクロ流体工学、材料科学、『オーミック』科学、計算生物学、疾患生物学、病理学、電気生理学、薬理学、生物統計学、臨床科学」の統合が明示されていることに反映されています。DARPAとNIHプログラムの成功は、開発・評価された臓器やTC、相互接続スキームの多様性、巻き起こった興奮に現れているが、この仕事のすべてをレビューすることは、この序論と第1および第2のEBMテーマ別課題の範囲を超えている。そこで、この特集ではその一部を紹介し、紹介しきれなかった方々にはお詫びを申し上げる。
グランドスキームへの適合
MPS/TCの分野はまだ新しく、本格的な取り組みが始まってから10年程度である。しかし、個々の研究室内、グループ間の協力、異なる米国政府機関の縦割り行政、そしてこの技術を実用化する最初の担い手である製薬会社の顧客基盤の両方において、急速な進歩を遂げている。医学、生物学、薬学、毒物学の問題にMPSが適用され始めており、EBM MPSテーマ別号がもう一つ必要である。本号では、現在NIHとDARPAのプログラムで支援されている助成先を紹介する。
NIHのプログラム担当者、製薬会社、FDA、EPAのリーダーらが、過去3年間のこの分野の進展について最新情報を寄稿している。本号では、MPS の現状を網羅的にレビューするのではなく、主に NIH/NCATS プログラムから得られた洞察に基づく視点、レビュー、およびオリジナル研究を提供するものである。まず、NIH45、製薬業界46、発達毒性学者47、小規模なMPS企業14の見解を示す3つの解説とレビューを掲載することで、それぞれが最新の課題リストを提供している。2014年の論文と比較すると、特に細胞の調達、脱分化せずに臓器構築物内の細胞を長期間維持すること、合成細胞外マトリックス、臓器のスケーリング、血管形成、組織の特徴づけ、体積問題への対処など、多くの面で進展が見られることがわかります。これらの論文では、自然免疫系と獲得免疫系の両方をMPSホムンクルスに組み込む必要性や、階層的な脈管形成など、前面に出てきている課題について論じています。MPSホムンクルスでの薬物研究から臨床のヒトへのin vivoからin vitroへの外挿に取り組むグループが増える必要がある。CRISPR cas9を用いたゲノム編集により、正常なMPSを疾患モデルに転換することも可能である。Knudsenら(47)は、in vitro MPSとin silico計算機モデリングの組み合わせが、特に発生・生殖毒性学の理解という観点から有効であることを指摘している。Hughesら(14)は、肝臓と臓器連結型MPS研究の現状と課題について実用的なレビューを行い、MPS技術と応用の継続的開発について正当な楽観論を述べている。
この分野にいる、あるいは今まさに参入しようとしている人材や機関の幅を考えると、MPSの完全な開発と展開に直面している各課題は、やがて解決されると考えるのが妥当であろう。TCを医学、生物学、毒物学の主流にするためには、明らかに、科学、工学、医学の驚くべき範囲が必要である。この特集号では、これらの3つの観点から論文を見るのではなく、数学的な意味での主成分分析として考えられるものを使って論文を検討する。MPSの取り組みの最初の3つの主成分は、(1)ハードウェアの技術的改良、(2)細胞の増殖方法、すなわちボディオンチップ(BoC)とMPSホムンクル構成要素の完成、(3)装置内の細胞が必要な生物学と薬剤反応をどれだけ再現しているかを評価する分析技術の適用であると特定した。
これらの3つの要素を合わせると、医学、生物学、薬学、毒物学の問題に機能するMPSデバイスを適用するために必要なことの多くに及びます。
本号の論文では、第一の主成分であるMPSのハードウェア開発については、比較的安定しており、現在商業化されている44が、2014年以降に報告されたいくつかの注目すべき進歩があるため、詳細な検討は行っていない。Hughesら14は、肝臓と相互接続システムのレビューでハードウェアの問題を論じている。Wangら48は、自己完結型のBoCシステムに向けた進展をレビューしている。2014年に記載されたNortisが開発したデバイス42は、現在広く使用されており、本号で記載したPittsburgh liverの一部であり、プルファイバー血管形成を使用していないものの、15,16であった。
Youngらによってレビューされた女性の生殖生物学研究に対するMPSアプローチ21は、Draper Laboratoryが最近発表した多臓器プラットフォームを利用している49,50 Cyrら51は、個別または結合臓器のMPS研究におけるホルモン概日リズムの再現にマイクロ流体マイクロホルムを適用することを論じている。低コストでマルチポートのマイクロフォーミュレーターが導入されれば、TC灌流液のカスタマイズや時間制御が容易になり、MPSホムンクルスから欠落した臓器の分泌物にも対応できるようになるはずである51,52 Phanらが議論したように、階層的な血管系で臓器チップを灌流したときにMPSバイオリアクターの設計における最大の変化が起こるだろう19
解決しなければならないハードウェア上の課題としては、MPSホムンクルス内の異なる器官間の流れのバランス、プロテオミクスおよびトランスクリプトーム解析のための細胞へのアクセスを可能にする開放型バイオリアクターの機能拡張、一方で液量を最小化し必要なせん断力を支持すること、などが挙げられる。再循環48,53-58 と気泡の混入のない定時培地交換、異なる結合臓器間の培地不適合問題を最小化する内皮バリアの使用拡大、薬物送達(薬物送達のPKsシミュレーションを含む)とサンプル取得の自動化、チューブ、ワイヤー、PDMSの最小化などである。PDMSほど便利ではありませんが、スチレン-エチレン-ブチレン製剤の導入は、エラストマーデバイスの重要な進歩であることが証明されるかもしれません59-63。オルガンオンチップデバイスにおける勾配の使用は、生理学のある側面を再現する強力な技術であることが証明されます16、 64-66。
ハードウェアが安定しつつある現在、第二主成分である細胞調達は今後も極めて重要であり、このテーマ別特集の中でも大きな比重を占めています。Knudsenら(47)は、動物とヒトの細胞の違いや、培養細胞の性差が毒性学にどのような影響を及ぼすかについての問題を取り上げている。Hughesら(14)は、細胞調達と共通培地の問題を分析している。複数の臓器を組み合わせてMPSホムンクルスを作製するようになると、「容積の問題」がよく理解されるようになり、多くのグループが、薬物の代謝物や細胞シグナル伝達分子が生理的効果の閾値以下に希釈されないように、灌流量と細胞量の比率を最小限にする努力を続けています。
ハードウェアの問題が前面に出てこない理由の一つは、既存のハードウェアを使用して、これらのプラットフォームで研究できる多様な細胞(初代、前駆、前駆体、幹細胞由来など)を探索することに注意が向けられているためである。初代細胞は生理学的に最も適切な細胞かもしれないが、バイオリアクターに播種すると末期分化して分裂しなくなる可能性があり、標準化したり再現性よく入手したりすることができない。67 ヒト人工多能性幹細胞(hiPSC)は、同じ「患者」から複数の組織を発 現することを可能にし、個別化医療や精密医療の選択肢を提供する。
本号で報告されたMurphyグループの独創的な研究は、Matrigel™の気まぐれさを、iPSCの分化をよりよく制御できるハイドロゲルに置き換えるという重要なトレンドの代表です18。ハードウェアと細胞培養技術が洗練されるにつれて、第三の主要な要素であるMPS実験に適用される分析技術も洗練されてきている。今日まで、ほとんどの臨床試験は、形態学的特徴、少数の遺伝子セットの発現、あるいは少数の臓器特異的な化合物の分泌を報告してきました。製薬業界では、ゲノミクス、トランスクリプトミクス、プロテオミクスなど、より包括的な技術がすでに常用されています。最近のMPS研究では、心筋や骨格筋の収縮力、カルシウムシグナル、電気生理学的反応などの機能測定37,69-75、電気抵抗やバリアの分子透過性76-82、炎症チャレンジに対するメタボローム反応などが見られる。本号では、Parkerグループが遺伝子発現プロファイリングを含む様々な手段を用いて、新生ラット心筋細胞の成熟した表現型に影響を与える要因を定量化している83。
TCがより多くの組織レベルの機能を再現し続けるようになれば、単層単培養では不可能だった機能測定が可能になるでしょう。
MPS の分野では、in vitro と in vivo の研究を包括的かつ定量的に比較する必要があります。最近、in vitro のラット肝臓とディッシュで培養したラット初代肝細胞の両方を比較した重み付け遺伝子共 発ネットワーク解析で実証されました84 。MPSコミュニティは、Ewartらが議論しているように、適切な生理学が再現されていることを確認し、既存の動物実験からin vitroおよびin vivoのヒト試験への外挿に情報を与えるために、例えばマウスとマウスオンチップの比較を検討するべきである46。マウスOoCを作製する大規模な取り組みでは、テネシー大学健康科学センターで開発され、特性評価が行われた、500万以上の共通変異と約1万2000のミスセンス突然変異を示す、約150の同系統で完全に配列決定された組み換え近親マウス系統からマウスチップを作って遺伝的変動の影響を調べることもできる85。
メタボロミクスは、装置の改良とデータベースの拡大により、急速に注目されるようになりましたが、データベースのアノテーションとその結果の代謝およびシグナル伝達ネットワークの解釈は、多くの潜在的エンドユーザーにとってまだ有用であることが証明されていません。
メタボローム解析技術は、OoCに適用され始めたばかりであり78 、最終的にはMPSの取り組みが、作用機序に関するアンターゲットのマルチオミクス研究によって恩恵を受ける可能性がある86。
分析手法が広がるにつれ、TCやMPSホムンクルからのデータを解釈するための数学的方法論を開発することが重要になる。これは、Shulerグループによって、TCやボディーオンチップアッセイに長年提唱されており、39,48,53,92-96、そして肝臓オンチップ研究でも価値があることが証明されています97,98。最終的には、この種の解析と生理学的薬物動態(PBPK)への拡張が、TC や MPS のホムンクルス研究をヒトでの臨床試験に関連付けるために必要となる、in vitro から in vivo への外挿に不可欠となるであろう。また、動物実験のみでは困難な、多剤併用時のヒトでの反応性を予測するためにも、MPS/PKPDモデルは有用であろう。MPSとPKPD(またはPBPK)モデルを組み合わせることで、複数の薬剤を用いた様々なシナリオに対する反応を予測することがより容易になるはずである。特に、薬物を投与する順番、投与間のタイミング、投与量などがすべて重要となるため、実験空間は大きくなります。MPSに基づくPKPDモデルは、臨床試験の設計に重要な洞察を与える可能性があり、本号でCyrら51が取り上げたマイクロホルム技術51,52を用いたin vitro MPS実験によって検証することができるであろう。
MPSの免疫学
本号でBluttら17、Abaciら20などが論じているように、MPSに免疫機能を付加することが優先されるべきであるという認識が広まっている105,106。
MPS免疫学の将来についての議論を始めるには、リンパ節が最適な場所である。この方法は、マイクロ流体バイオリアクターに応用できるかもしれないが、まだ緊急の必要性はなさそうである。リンパ節の空間的な複雑さは、マウスリンパ節の分離スライス内のB細胞ゾーンとT細胞ゾーンを別々に刺激できるマイクロ流体装置で調べられたが108、そのようなゾーンはまだ組織工学的に作られたヒトリンパ節に相当するもので再構築されてはいない。(著者らは、リンパ節スライスの灌流にマイクロ流体装置を使用することは、脳スライスの灌流にマイクロ流体装置を使用することと類似していることを指摘している109-117。)多臓器MPSホムンクルスに単一のリンパ節を追加することは魅力的ではあるが、生体内で起こるように、各臓器に特化したリンパ節を持つことがより現実的であろう。近い将来、より現実的なのは、1つのリンパ節を作り、そのリンパ節の挙動を単独で研究し、その後、肝臓や脳などの1つの臓器に1つのリンパ節を追加することを検討することでしょう。さらに、単一の固形臓器でリンパ管形成を活性化し、例えば癌の転移を研究するために一体型のリンパ節を作ることも考えられるかもしれません。
しかし、免疫にはリンパ節以上のものがある。GieseとMarx120は、リンパ系以外の組織における自然免疫とリンパ系組織における適応免疫の試験管内での模倣方法について論じた素晴らしい総説を発表しています。この総説の最後に、彼らは、試験管内免疫モデルの現状を簡潔に評価している。
残念ながら、ここで検討した既存の免疫担当の非リンパ性あるいはプロのリンパ性3D in vitro システムのいずれも、ヒトにおける有害免疫原性経路全体を再現するためのトランスレーショナルな代替手段とはなりえない。
しかし、正しい方向への動きもあります。MPS免疫学に関する一つの懸念は、分散し、相互に連結したMPSホムンクルスを循環する白血球の貯蔵、送液、更新、廃棄であろう。ヒトは約5×1011個の白血球を持ち、毎日4×1011個の白血球が血管に分布し、毎日3×1010個の白血球が組織から血液にリンパ節に還流している120。もう一つの別の本質的な問題は、白血球、特に臓器から戻ってくる白血球が、生体内の挙動を再現するように機能するかどうかということである。
典型的な異種細胞近傍問題は、非リンパ性組織に存在するマクロファージと樹状細胞(および特定の臓器にお ける同等の細胞)、およびその他の常在免疫細胞の相互作用である。この特集号で紹介するMPSの免疫学に関する研究報告では、脳のミクログリア18や肝臓のクッパー細胞が含まれていることが述べられている。15,16 腸、肺、皮膚は外部の病原体に対する免疫バリアとして機能し、腸は病原体に対する適応免疫反応を開始する上で重要な役割を担っている。120これらの臓器における白血球の移動およびその他の免疫相互作用は、in vitro MPS法を用いて研究されており、他の文献120や本号で皮膚20および腸について概説しています。67 しかし、消化管は病原体の侵入口でもある。Mills と Estes123 は、感染とそれに対抗する免疫細胞によって形成される細胞ニッチ の空間的複雑性と、免疫活性をニューロンで調節することができる非神経細胞モデルの 血管形成と神経支配の必要性について論じている。最近、hiPSCを使って機能的な腸管神経系を持つ腸管オルガノイドを作ることができるという優雅な実証がなされました124。
MPSホムンクルスに組み込むことが可能な免疫系の構成要素は他にもある。マイクロ流体脾臓が血液中の病原体を浄化する能力は実証されていますが125 、抗体を合成する脾臓の役割は実証されていませ ん。この近傍の問題は、骨髄バイオリアクターの開発でも扱われており、まずマウスに移植し、次にMPSバイオリアクターで試験管内研究のために採取されます126。
現在の免疫療法の試験方法を制限している中心的な問題は、実験動物とヒトとの系統的な距離であ り、ある種の病原体がある種に感染しても別の種には感染しないことや、自然免疫細胞や適応免疫細胞 が種間で大きく異なっていることです120 。MPS の研究において、マクロファージ、グリア細胞、クッパー細胞が含まれることは既に見たが、これらの細胞は自然免疫系の一部であり、"自己" と "非自己" を分けることはない。固形臓器や血液成分の移植や癌免疫療法は、多数の異なるヒト白血球抗原クラスやタイプによって特徴づけられるように、主要組織適合性複合体の互換性という課題に明らかに直面している121 。ヒトにおいて臓器拒絶反応や宿主対移植片疾患を誘発したくないように、MPSホムンクルスにおいて適応免疫細胞を加えることは同じリスクを冒すことになるのだ。最終的には、患者の腫瘍、線維芽細胞、白血球(あるいは腫瘍と患者の幹細胞のみ)から出発して、がん免疫療法の研究に使用できる患者特異的なホムンクルスを構築することが可能になるはずである。これは、プレシジョンメディシン127の究極の診断法である患者専用MPSデバイスを意味する。
MPSデバイスを医薬品の研究開発の中核に据えること
医薬品の開発者は、医薬品を上市する過程で多くの疑問に対処しなければならない。これらの疑問の大部分は薬理学と有効性に関するものであり、MPSシステムが医薬品開発者に最大の利益をもたらすのはこの点である。これらの疑問のいくつかを、ほぼ時系列に並べると、次のようになります。対象となるヒトの疾患に対して有用な実験モデルは存在するか?対象となる創薬標的は、この実験的疾患モデルにおいて機能的に適切であるか?これらの創薬ターゲットに結合する化合物は、生化学的、細胞的、生理学的なレベルで意味のあるPDを引き起こすか?これらのPD反応は、患者における薬理効果の臨床バイオマーカーとなり得るか?化合物によって生じる副作用はあるか、またその副作用は想定される患者集団に関連するか?薬理作用や毒性に関連する曝露-反応関係はどのようなものか?化合物の代謝と体内動態はどのようなものか?薬理学と毒性に関連する遺伝的、環境的要因で、患者に関連するものはあるか?
MPSデバイス内のヒト細胞によって実証された生化学的、細胞的、および器官的機能は、MPSデバイスが、上記のような疑問に答えようとする医薬品開発者にとって有用なツールとなる可能性があることを示唆している。MPSデバイスは既存のアプローチよりも望ましいかもしれず、そのような有用なアプリケーションを特定することで、MPSコミュニティと医薬品開発者の間の運用上の統合がより進むと考えられる。我々が検討した分野は、ヒト疾患生物学/薬理学、ADME-PK-臨床薬理学、毒性学であった。
NIHと製薬会社が優先的に取り組んでいるMPSアプリケーションは、薬物毒性評価の改善である。毎年、何千もの化合物が非臨床動物毒性試験での有害所見により開発が中止され、さらに何十もの化合物が臨床での有害事象により中止されています。このような失敗を回避することは、患者と医薬品開発者の双方に利益をもたらします。さらに、動物毒性試験は何十年も変わっていないエンドポイントを持つ標準的な試験であり、何千もの化合物に適用されており、MPSモデルの予測的価値を強固に特徴付けるために過去のデータや化合物自体の多くを利用することが可能である。さらに、ヒトの細胞を使用することで、MPS装置が安全な化合物、安全な投与量と曝露量、毒性の種類を動物よりも正確に予測できるという仮説を評価することができる。ある先見者によれば、いつの日か動物実験に代わって、人間の安全性を守るのに優れ、処理能力が高く、現在のアプローチより安価なMPSが開発されるかもしれない。毒性学は、当然のことながら、MPS技術の賢明な初期応用分野である(それゆえ、EPAはMPSを発達毒性学に応用することに関心を抱いている)。
医薬品開発において、このような野心的な役割を果たすことができるMPSはあるのだろうか?薬物毒性試験におけるヒト細胞MPSの使用は、初期の有望なデータによって裏付けられています。心臓、肝臓、腎臓、消化管など、毒性を示す主要な標的臓器の多くについて、これらの臓器に対する毒性が知られている化合物を用いたMPS装置による構造的損傷と化合物処理に応じた臓器型機能の調節が証明されている17。心臓の安全性は、毒性標的臓器としての重要性と心臓毒性の多様な様式から、特に注目されている。心臓用の MPS 装置は、カルシウムフラックスの一過性の変化、力の直接測定、電気生理学、心拍数、および合胞体に類似した筋集合体の伝導速度を検出することができる(本号83およびその他69、71、73で報告されている)。これは、製薬会社が使用する既存の非臨床ツールや、生体内で薬物を投与した器具付き動物というゴールドスタンダードを改善するものであると思われる。心臓だけでなく、他の多くの臓器系に対するこれらの代替MPSの価値は、化合物の毒性モードの理解に役立つ豊富なデータ、in vivo曝露-反応関係のより良いモデル、前臨床医薬品開発中に毒性学的負債の少ない代替化合物を特定するのに役立つスループットとコストでこれを行うことができることである。また、これらのシステムにおけるヒト細胞の供給源は、心血管疾患を経験したことが知られている患者から採取した幹細胞の心筋細胞を用いた高リスクと推定される患者の非臨床評価など、前例のないレベルのトランスレーショナルバリューをサポートできることが認識されている128。
ADME-PK-臨床薬理学は、MPSアプローチによる医薬品への大きな貢献が期待される第二の分野である。PD/PK解析は、上記および本号の他の箇所で述べたように、既にMPS研究に適用されており、医薬品開発の様々な側面で重要である。例えば、MPSはヒトの薬物クリアランスのメカニズムや速度をより正確に予測するのに役立つと思われる。クリアランスは、薬物のPK特性を評価するために必要な重要なパラメータである。このパラメータは、放射性同位元素を用いたADMEマスバランス試験がヒトで実施されるまで、確定的に知ることはできません。動物から得たin vivoのPKデータをアロメトリックにスケーリングするという非臨床における標準的な手法は、許容できないほど不正確な場合があり、培養ヒト2次元細胞系からのPKパラメータの使用は、ヒトにおける肝及び腎の薬物クリアランスを決定するプロセスの解剖学的及び生理学的複雑性を捉えられない可能性がある。例えば、肝細胞から血液に戻る洞房膜上の流出量を実験的に測定することは困難であり、受動拡散のみによって起こると仮定されることが多い。これでは、MPSで正確に表現できる薬物トランスポーターの役割が無視されてしまいます。なぜなら、クリアランスのメカニズムを早期に正確に予測することは、医薬品開発チームが、低暴露、高いPK変動、薬物間相互作用、薬理遺伝学的負債などの臨床リスクを評価し、医薬品開発の時点で、よりリスクの低い化合物を優先的に使用できるようにするために役立つからである。
MPSの医薬品開発への有用な応用の第二は、ヒトでの薬物クリアランスのメカニズムや速度の評価の向上を含む、予測されるヒトでのPK特性に適した化合物の評価と同定です。
医薬品開発におけるMPSの第三の分野は、正常および疾患生物学に関連する化合物の薬理学および有効性の評価の改善である。MPS疾患モデルは、NIH/NCATSによる次の資金提供の主要な分野である。この分野の価値を示す一例として、価値あるものがあります。長年にわたり、腫瘍学モデルはヒト癌細胞株の腫瘍異種移植片を持つ免疫不全(ヌード)マウスに依存してきた。マウスの異種移植実験では有効であった化合物の多くが、ヒトの臨床試験では大きな犠牲を払って失敗しているため、これらのモデルの陽性予測値は非常に残念なものであった。しかし、製薬会社はこのモデルに大きく依存し続けている。ここでもまた、これらのモデルの長所と短所を熟知している組織が、その限界が証明されているにもかかわらず、使い続けることを推進しているのである。このため、これらのモデルは代替が効きやすいのです。ヌードマウスのエンドポイントが主に腫瘍体積の測定と薬剤の作用機序に関連する期待されるPDエンドポイントであるのに対し、MPSは患者由来の細胞を含む人間の構成要素に基づく解剖学的および生理学的により適切なモデルの細胞挙動を実際に見る機会を提供するものである。PDエンドポイントのための曝露-反応は、毒性エンドポイントとともに、ヒトにおける抗がん剤の活性と有効性の予測因子として不十分であることがわかっている動物がんモデルに取って代わる可能性を持っている。
MPSのポンプとバルブの技術51,52を利用して作られたマイクロフォーミュレーターは、このような場面で非常に有用であることが証明された。異なるPKプロファイルの範囲をシミュレーションして、最も適したPDと毒性プロファイルを決定することで、医薬品化学者がその評価のために独自の医薬品を作る必要がなくなる。
懐疑的な人は、これらの例は、in vitro、動物、ヒトの研究間の不一致に関連する、より深い課題の表面から機会をかすめるものであり、したがって、ツールが最先端の技術に取って代わるために必要なすべてを提供していない、と正当に指摘する。心臓は、ヒトの薬物の安全性に直接関連する細胞や組織ベースのエンドポイントを幅広く持ち、濃度反応などの特性が明確に定義された化合物を用いて薬理学的かつ即座に変化させることができるという点で例外的である。それでも、これらのin vitro心疾患モデル系では血圧を測定することができず、これは一般的に測定される臨床パラメータであり、頻繁に遭遇する心血管系の責任である。もう一つの主要な毒性臓器である肝臓の現代のMPSモデルは、重要な毒性学的ターゲットである胆管を欠いています。肝毒性で市場から撤退した薬剤は、通常、胆道系への有害作用が関与している。同様に、近位尿細管は、腎臓はおろかネフロンのモデルでもないし、モデルとして表現されたこともない。これは非常に複雑な組織の一部であり、in vivoでモデル化するには、複数のMPSを連結する必要があります。これらの指摘は、製薬会社における毒性試験のためのMPSの使用という意図された文脈に関連するものである。
現在、医薬品の安全性評価で解釈されている毒性学的エンドポイントの種類と数は膨大であり、その多くは初期のMPSでは再現性がないと思われる。また、組織間の相互作用を考慮しない場合でも、化合物による毒性を経験する組織の数は膨大である。その上、化合物が毒性を引き起こすメカニズムは不明なことが多く、動物からヒトへ、MPSの場合はin vitroヒトからin vivoヒトへ、知見のトランスレーショナルリレバレッジは困難である。
この懸念事項は、臓器毒性を引き起こす化合物を有する個々の医薬品開発チームにとって局所的なレベルであり、これらの問題はMPS開発者にも影響するはずである。毒性学者は、MPSデバイスを見て、次のように尋ねるかもしれない。
そして最も重要なことは、もし新規化合物に対して毒性学的反応が得られなかった場合、その陰性的中率を信頼できるのかということです。
もし、ヒトのMPS装置で「毒性がない」と判定された最初の化合物群が、in vivoの動物では毒性を示すことが判明した場合、少なくとも2つのことが起こる。第一に、これらの矛盾するデータが、この特定の化合物の運命にどのような影響を与えるべきかという不確実性は、企業だけでなく規制当局にとっても解決するのが非常に困難になる。そして第二に、ヒトのMPSと動物のin vivoでの不一致のデータの制度的記憶が長く残ることになる。ラット、イヌ、サルでの化合物の毒性は、しばしばヒトでは観察されないからである。
しかし、このような例は必ず起こる。このため、毒物学者の医薬品開発者は、有効で完全に適格な試験だけでなく、ヒトMPSからのデータの意味を規制当局が受け入れることを支持する十分な証拠も求めているのだ。
薬物毒性評価の分野、あるいは医薬品開発の他の部分を破壊するためには、多くの種類の障壁を克服する必要があります。医薬品開発者や規制当局は、既存の手法の長所と短所について熟知している。ほぼすべての化合物に関する毒性試験の結果は、動物での前例があり、ヒトへの適用もある程度可能であるため、新しいデータの解釈は豊富な過去の経験に支えられている。最も重要なことは、これらの動物毒性試験の結果が、ヒトでの第1相試験における開始用量の安全性の非常に良い予測因子である無影響レベルを確立していることである。顕著な例外はありますが、フェーズ1試験で重篤な有害事象が発生する頻度は、実際には非常に低いのです。新薬の安全な投与は、誰もが維持したいと思う実績です。代替品への切り替えは、否定的な知見の価値に大きな確信がある場合にのみ行われる。これまでの研究のほとんどは、システムが毒性化合物に反応することができるという陽性予測値を実証することに焦点が当てられてきました。しかし、もし効果が見られなかったらどうなるのでしょう?それは、その投与量が安全であることを意味するのだろうか?
もう一つの思考実験が参考になる。動物実験に代えて、ヒトの組織を用いて主要な標的臓器の毒性モードをすべて検出する一連のMPS装置を導入することに全員が合意したとしよう。製薬会社の研究開発部門は、このようなシステムにきっと興味を持つだろう。さらに、私たちが関心を持たなければならない主要な臓器は10だけであり、各臓器はたった2つのMPS装置でモデル化できると仮定しましょう(例えば、pancreas-on-a-chipは内分泌と外分泌の両方の膵臓を持っています; kidney-on-a-chip は糸球体と尿管と管の両方を持ちます、など)。そして最後に、これらのデバイスはそれぞれ、in vivoでの毒性を極めて高い確率で予測し、偽陽性率はそれぞれわずか5%であるとしよう。無毒の化合物がこの電池で20のテストすべてで「無毒」という結果で出てくる確率は、数学的には36%である。残りの64%のケースでは、少なくとも1つの陽性結果が出ることが予想される。これはどのような試験法にも当てはまることであり、医薬品の安全性リスクを早期に発見するためのスクリーニングアッセイの支持者にとって、よくある障害である。安全性評価に必要なMPS装置の数が多ければ多いほど、安全な化合物の開発を中止するリスクが高くなる。逆に、試験の数を減らせば、毒性があってもMPS装置で「毒性なし」と判定された薬剤を患者が投与されるリスクが高まる(すなわち、偽陰性となる)。これは、診断テストの感度と特異度のトレードオフというよく知られた問題を反映している。
複数のTCの結合に伴う成功確率の掛け算の他にも、それぞれ自然故障の確率がゼロではないので、臓器を別々に育て、一番良いものを連結してMPSホムンクルスを作る方が良いのではないか、という深刻な問題もある。マウスモデルの利点は、人工マウスが死んだり病気になったりした場合、研究者にそのマウス全体が正しく機能していないことをすぐに知らせることができる点である。MPSホムンクルスには、許容できるシステム性能の基準が必要になるだろう。
これらの仮説的な例は、既存の試験が広く理解され、何十年にもわたって患者の安全を守るために成功裏に使用されてきたにもかかわらず、毒物学者が新しい試験への切り替えに消極的である理由を説明するのに役立つ。薬理試験や有効性試験におけるMPS装置の利用を考慮すると、異なる結論に至るかもしれない。多くのヒトの病気には生物学的モデルが存在しないか、ヒトの病気とのメカニズム的な関連性が弱いか、ヒトの臨床試験での有効性の予測性が低いことが知られている。これは希少疾患だけでなく、主要疾患についても同様である。マウスの異種移植は、数十年にわたる非臨床有効性試験で過度に楽観的な結果が得られているにもかかわらず、長い間、がん研究の定番となっている。
現代のMPSデバイスは、ヒト由来の腫瘍細胞の増殖や腫瘍の増殖を抑制する薬剤の送達をサポートする興味深い血管生物学を示している40。遺伝子ツールや薬理学的治療と組み合わせることで、MPSデバイスは、薬物ターゲットの優先順位付け、化合物のスクリーニング、濃度反応の探求といった価値の高い目的に取り組む機会を提供する。
これらの検討は、医薬品開発パイプラインの個別の場所にMPSを適用した場合の利点と欠点を比較することで最もよく理解されるであろう。AbaciとShuler99は、本号のEwartら46と同様に、医薬品開発パイプラインにおけるMPSアッセイの挿入ポイントについて検討した。補完的な視点を提供するため、表1では関連する問題を3つのグループに分類している。疾患生物学/薬理学、ADME-PK-臨床薬理学、毒性学である。この発表によると、創薬研究者にとっての MPS の価値は、トキシコロジーや ADME-PK-Clinical Pharmacology よりも Disease Biology/Pharmacology の方が高いことが示されている。しかし、この3つの分野での応用はすべて意味があり、実際、PD/efficacy、ADME、およびtoxicologyを単一のシステムに統合する機会は、最終的に最も説得力のある科学的およびビジネスケースとなる可能性が高いです。
表1.

長期間のin vitro 3次元組織近傍を提供するという観点から、ヒト細胞のみで作成されたMPSは非常に多くのものを提供することができる。この特集号の記事や他の場所での爆発的な記事から明らかなように、MPS/オルガン・オン・チップのコミュニティは、3Dバイオリアクター、幹細胞分化、マイクロ流体制御、分析化学、マルチオミクスなど、製薬会社が単独では開発および統合に資金を出すことを望まないような先進技術を結集しているのです。DARPAとNIHによる注目すべきタイムリーな投資は、将来的に大きな見返りが期待できることを実証しているのですベンチからベッドサイドへの転換には、細胞生物学、生物医学工学、生理学、薬理学、毒性学、生物情報学、生物統計学、コンピュータサイエンスの協力と専門知識が必要です。MPS/OoCコミュニティにおける学術的および商業的なプレーヤーは、MPS/OoC技術を応用して医薬品開発を加速するために必要なトランスレーショナルな課題に取り組む意欲を示している。しかし、このレビューで紹介したような分析は、人間の生理学の有用なモデル、たとえおもちゃのモデルであっても、それを構築する際に行う妥協の指針になるはずです。
謝 辞
また,Eli Lilly and Company の Dr. Ken Cassidy と Dr. Nathan Yumibe, Drug Disposition から貴重なご意見をいただいた。また、査読者の皆様から建設的なご指摘をいただき、感謝いたします。また、Allison Price と Don Berry には、編集と書誌の面でご助力いただきました。また、この特集号に掲載された多くの著者の方々の努力に感謝します。最後に、内容を改善してくださった多数の査読者の方々、作成に専門的な支援をいただいたDanna Zimmer氏とExperimental Biology and Medicineの編集・制作スタッフの方々に感謝する。
著者の貢献
原稿のデザイン、下書き、編集には、著者らが等しく貢献した。
利益相反の宣言
John Wikswoは、Eli Lilly and Companyと研究契約を締結中である。他の著者は、本論文に関して利益相反はない。
資金提供
本論文の作成は,米国国立衛生研究所(NIH)の National Center for Advancing Translational Sciences の 5UH3TR000491,5UH3TR000503,5UH3TR000504 および契約番号 HHSN271201600009C,ならびに環境保護庁(EPA)の支援協定番号 83573601 により一部支援を受けている。この論文で示された見解は、著者個人のものであり、必ずしも雇用者または資金提供機関の見解を反映するものではありません。EPA は、本書で言及されたいかなる製品または商業サービスも保証しない。
論文情報
Exp Biol Med (メイウッド).2017 Oct; 242(16):1559-1572.
2017年10月25日オンライン公開。doi: 10.1177/1535370217732765
PMCID: PMC5661772
PMID: 29065799
デビッド・E・ワトソン、1 ローズマリー・フンツィカー、2 ジョン・P・ウィックスウォックcorresponding author3
参考文献
1.アボットEA.Flatland: a romance of many dimensions.新訂版 オックスフォード: ベネディクション・クラシックス, 2012 [Google Scholar].
2.Horrobin DF.現代の生物医学研究:医学的現実との接点がほとんどない、内部的に自己矛盾のない宇宙?Nat Rev Drug Discov 2003; 2:151-4 [PubMed] [Google Scholar] 3.
3.Pedersen JA, Swartz MA.三次元のメカノバイオロジー。3. Pedersen JA, Swartz MA. Mechanobiology in the third dimension.
4.このような場合、「3次元のメカノバイオロジー」と呼ばれる。3 次元微小環境における多細胞組織の役割の探索。Nat Methods 2006; 3:369-75 [PubMed] [Google Scholar].
5.Baker BM, Chen CS.3次元の解体-3次元培養の微小環境が細胞の合図をどのように変えるか。J Cell Sci 2012; 125:3015-24 [PMC free article] [PubMed] [Google Scholar] 6.
6.Edmondson R, Broglie JJ, Adcock AF, Yang LJ.三次元細胞培養系とその創薬およびセルベースバイオセンサーへの応用。Assay Drug Dev Technol 2014; 12:207-18 [PMCフリー記事] [PubMed] [Google Scholar].
7.Leung BM, Moraes C, Cavnar SP, Luker KE, Luker GD, Takayama S. Microscale 3D collagen cell culture assays in conventional flat-bottom 384-well Plates.J Lab Autom 2015; 20:138-45 [PMCフリー記事] [PubMed] [Google Scholar].
8.Abbott A. Cell culture: biology's new dimension.ネイチャー 2003; 424:870-2 [PubMed] [Google Scholar]
9.Griffith LG, Swartz MA.複雑な3次元組織の生理学をin vitroで捉える。Nat Rev Mol Cell Biol 2006; 7:211-24 [PubMed] [Google Scholar].
10.Pampaloni F, Reynaud EG, Stelzer EHK.細胞培養と生きた組織の間のギャップを埋める3次元。Nat Rev Mol Cell Biol 2007; 8:839-45 [PubMed] [Google Scholar].
11.Schmeichel KL, Bissell MJ.組織特異的なシグナル伝達と臓器機能を3次元でモデル化する。J Cell Sci 2003; 116:2377-88 [PMC free article] [PubMed] [Google Scholar] 12.
12.McMillin DW, Negri JM, Mitsiades CS.薬物反応を修飾する腫瘍間質相互作用の役割:課題と機会。Nat Rev Drug Discov 2013; 12:217-28 [PubMed] [Google Scholar].
13.Bissell M. Experiments that point to a new understanding of cancer (TED Talk) 2016, https://www.ted.com/talks/mina_bissell_experiments_that_point_to_a_new_understanding_of_cancer (accessed 28 September 2017)
14.ヒューズDJ、コストルゼウスキーT、セーツEL.肝臓と相互接続されたマイクロフィジオロジーシステムのより広い採用における機会と課題。Exp Biol Med 2017; 242:1593-604 [PMCフリー記事] [PubMed] [Google Scholar].
15.Soto-Gutierrez A, Gough A, Vernetti LA, Taylor DL, Monga SP.肝疾患における代謝ゾーニングの前臨床および臨床的検討:マイクロフィジオロジーシステムの可能性.Exp Biol Med 2017; 242:1605-16 [PMCフリー記事] [PubMed] [Google Scholar].
16.Lee-Montiel FT, George SM, Gough AH, Sharma AD, Wu J, DeBiasio R, Vernetti LA, Taylor DL.(リー・モンティエルFT、ジョージSM、ゴフAH、シャーマAD、ウーJ、デビアシオR、バーネッティLA、テイラーDL)。酸素張力の制御は、ヒト肝ミクロフィジオシステムにおけるゾーン特異的な機能を再現する。Exp Biol Med 2017; 242:1617-32 [PMCフリー記事] [PubMed] [Google Scholar].
17.Blutt SE, Broughman JR, Zou W, Zeng X-L, Karandikar UC, In J, Zachos NC, Kovbasnjuk O, Donowitz M, Estes MK.消化管マイクロフィジオロジーシステム。Exp Biol Med 2017; 242:1633-42 [PMCフリー記事] [PubMed] [Google Scholar].
18.Barry C, Schmitz MT, Propson NE, Hou Z, Zhang J, Nguyen BK, Bolin JM, Jiang P, McIntosh BE, Probasco MD, Swanson S, Stewart R, Thomson JA, Schwartz MP, Murphy WL.標準的な培養技術を使用して合成ハイドロゲル上に作製された均一な神経組織モデル。Exp Biol Med 2017; 242:1679-89 [PMCフリー記事] [PubMed] [Google Scholar].
19.Phan DT, Bender RHF, Andrejecsk JW, Sobrino A, Hachey SJ, George SC, Hughes CC.Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface.血液脳関門オンチップ:血液-中枢神経系界面の複雑性を捉えるマイクロフィジオロジーシステム。Exp Biol Med 2017; 242:1669-78 [PMCフリー記事] [PubMed] [Google Scholar].
20.Abaci HE, Guo Z, Doucet Y, Jackow J, Christiano A. Next generation human skin constructs as advanced tools for drug development(医薬品開発のための先進的なツールとしての次世代ヒト皮膚構築物).Exp Biol Med 2017; 242:1657-68 [PMC無料記事] [PubMed] [Google Scholar].
21.Young AN, Moyle-Heyrman G, Kim JJ, Burdette JE.女性の生殖生物学における微小生理学的システム。Exp Biol Med 2017; 242:1690-1700 [PMCフリーアーティクル] [PubMed] [Google Scholar].
22.Powers MJ, Domansky K, Kaazempur-Mofrad MR, Kalezi A, Capitano A, Upadhyaya A, Kurzawski P, Wack KE, Stolz DB, Kamm R, Griffith LG.灌流3次元肝臓培養のための微細加工アレイ型バイオリアクター。バイオテクノロジー・バイオエンジニアリング 2002; 78:257-69
23.Sin A, Chin KC, Jamil MF, Kostov Y, Rao G, Shuler ML.溶存酸素センサーを内蔵した 3 チャンバー型マイクロスケール細胞培養アナログデバイスの設計と製造。Biotechnol Prog 2004; 20:338-45 [PubMed] [Google Scholar].
24.臓器レベルの肺機能を再構築する。チップ上で臓器レベルの肺機能を再構成する。Science 2010; 328:1662-8 (including supporting online material) [PMC free article] [PubMed] [Google Scholar].
25.Huh D, Leslie DC, Matthews BD, Fraser JP, Jurek S, Hamilton GA, Thomeloe KS, McAlexander MA, Ingber DE.Lung-on-a-chip マイクロデバイスにおける薬物毒性誘発性肺水腫のヒト疾患モデル。Sci Transl Med 2012; 4:159ra147 [PMC free article] [PubMed] [Google Scholar].
26.Wikswo JP.生物学と医学におけるマイクロフィジオロジーシステムの関連性と潜在的役割。Exp Biol Med 2014; 239:1061-72 [PMCフリーアーティクル] [PubMed] [Google Scholar].
27.ファーブル・K、リビングストン・C、タグルDA.Organs-on-chips (microphysiological systems): Tools to expedite efficacy and toxicity testing in human tissue.Exp Biol Med 2014; 239:1073-7 [PubMed] [Google Scholar].
28.スリッカー W., Jr.Of human-on-a-chip and humans: Considerations for creating and using microphysiological systems.Exp Biol Med 2014; 239:1078-9 [PubMed] [Google Scholar].
29.アレクサンダーPG、ゴッタルディR、リンH、ロジトTP、トゥアンRS。骨軟骨生理および退行性関節疾患をモデル化するための3次元骨形成および軟骨形成システム。Exp Biol Med 2014; 239:1080-95 [PMCフリー記事] [PubMed] [Google Scholar].
30.Pamies D, Hartung T, Hogberg HT.ブレインオンチップの生物学的および医学的応用。Exp Biol Med 2014; 239:1096-107 [PMCフリーアーティクル] [PubMed] [Google Scholar]
31.Hartman KG, Bortner JD, Jr, Falk GW, Ginsberg GG, Jhala N, Jian Yu, Martin MG, Rustqi AK, Lynch JP.マイクロフィジオロジー培養系を用いたヒト消化管炎症性疾患のモデル化。Exp Biol Med 2014; 239:1108-23 [PMCフリー記事] [PubMed] [Google Scholar].
32.Foulke-A J, In J, Kovbasnjuk O, Zachos NC, Ettayebi K, Blutt SE, Hyser JM, Zeng XL, Crawford SE, Broughman JR, Estes MK, Donowitz M. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract.(消化管内の宿主と病原体の相互作用の生体外モデルとしてのヒト腸管).Exp Biol Med 2014; 239:1124-34 [PMCフリー記事] [PubMed] [Google Scholar].
33.Nichols JE, Niles JA, Vega SP, Argueta LB, Eastaway A, Cortiella J. Modeling the lung.肺のモデル化。研究用組織工学マクロおよびミクロ生理学的肺モデルの設計と開発。Exp Biol Med 2014; 239:1135-69 [PubMed] [Google Scholar].
34.Clark AM, Wheeler SE, Taylor DP, Pillai VC, Young CL, Prantil-Baun R, Nguyen T, Stolz DB, Borenstein JT, Lauffenburger DA, Venkataramanan R, Griffith LG, Wells A. A. microphysiological system model of therapy for liver micrometastases(微小転移病変の治療の微小生理システムモデル).Exp Biol Med 2014; 239:1170-9 [PMCフリー記事] [PubMed] [Google Scholar].
35.Bale SS, Vernetti L, Senutovitch N, Jindal R, Hegde M, Gough A, McCarty WJ, Bakan A, Bhushan A, Shun TY, Golberg I, DeBiasio R, Usta BO, Taylor DL, Yarmush ML.肝毒性を評価するためのin vitroプラットフォーム。Exp Biol Med 2014; 239:1180-91 [PMCフリー記事] [PubMed] [Google Scholar].
36.Eddie SL, Kim JJ, Woodruff TK, Burdette JE.生殖管の微小生理学的モデリング:肥沃な努力。Exp Biol Med 2014; 239:1192-202 [PMC無料記事] [PubMed] [Google Scholar].
37.Cheng CS, Davis BNJ, Maddan L, Bursac N, Truskey GA.組織工学的骨格筋の生理と代謝。Exp Biol Med 2014; 239:1203-14 [PMCフリー記事] [PubMed] [Google Scholar].
38.Eungdamrong NJ、Higgins C、Guo Z、Lee WH、Gillette B、Sia S、Christiano AM.Challenges and promises in modeling dermatologic disorders with bioengineered skin(生体工学的皮膚を用いた皮膚疾患のモデル化における課題と展望)。Exp Biol Med 2014; 239:1215-24 [PubMed] [Google Scholar].
39.Sung JH, Srinivasan B, Esch MB, McLamb WT, Bernabini C, Shuler ML, Hickman JJ.Using physiologically-based-pharmacokinetic-guided "body-on-a-chip" systems to predict mammalian response to drug and chemical exposure(薬物および化学物質曝露に対する哺乳類の反応を予測するための生理学的ベース-薬物動態誘導型 "ボディオンチップ "システムの使用)。Exp Biol Med 2014; 239:1225-39 [PMC無料記事] [PubMed] [Google Scholar].
40.Heylman C, Sobrino A, Shirure VS, Hughes CCW, George SC.(ハイルマンC、ソブリノA、シルアVS、ヒューズCCW、ジョージSC)。A. strategy for integrating essential three-dimensional microphysiological systems of human organs for realistic anticancer drug screening.現実的な抗がん剤スクリーニングのためのヒト臓器の3次元微小生理学的システムの統合。Exp Biol Med 2014; 239:1240-54 [PMCフリー記事] [PubMed] [Google Scholar].
41.Cimetta E, Vunjak-Novakovic G. Microscale technologies for regulating human stem cell differentiation.Exp Biol Med 2014; 239:1255-63 [PMCフリーアーティクル] [PubMed] [Google Scholar].
42.Tourovskaia A, Fauver M, Kramer G, Simonson S, Neumann T. Tissue-engineered microenvironment systems modeling human vasculature.Exp Biol Med 2014; 239:1264-71 [PMCフリー記事] [PubMed] [Google Scholar].
43.Wikswo JP, Porter AP.Biology coming full circle: joining the whole and the parts.Exp Biol Med 2015; 240:3-7 [PMCフリーアーティクル] [PubMed] [Google Scholar]
44.Zhang B, Radisic M. Organ-on-a-chip devices advance to market.Lab Chip 2017; 17:2395-2420 [PubMed] [Google Scholar].
45.ロー LA, タグル DA.Organs-on-chips: progress, challenges, and future directions.Exp Biol Med 2017; 242:1573-8 [PMC無料記事] [PubMed] [Google Scholar].
46.Ewart L, Fabre K, Chakilam A, Dragan Y, Duignan D, Eswaraka J, Gan J, Guzzie-Peck P, Otieno M, Jeong CG, Keller DA, de Morais SM, Phillips JA, Proctor W, Sura R, Van Vleet T, Watson D, Will Y, Tagle D, Berridge B. Navigating tissue chips from development to dissemination: A pharmaceutical industry perspective.Exp Biol Med 2017; 242:1579-85 [PMCフリー記事] [PubMed] [Google Scholar].
47.Knudsen T, Klieforth B, Slikker W. Programming microphysiological systems for children's health protection(子供の健康を守るためのマイクロフィジオロジーシステムのプログラミング).Exp Biol Med 2017; 242:1586-92 [PMCフリーアーティクル] [PubMed] [Google Scholar].
48.Wang YI, Oleaga C, Long CJ, Esch MB, McAleer CW, Miller PG, Hickman JJ, Shuler ML.(ワン・ワイ、オレアガ・シー、ロングCJ、エッシュMB、マカリアCW、ミラーPG、ヒックマンJJ、シュラーML)。薬剤開発のための自己完結型低コストボディ・オン・ア・チップシステム。Exp Biol Med 2017; 242:1701-13 [PMCフリー記事] [PubMed] [Google Scholar].
49.Coppeta JR, Mescher MJ, Isenberg BC, Spencer AJ, Kim ES, Lever AR, Mulhern TJ, Prantil-Baun R, Comolli JC, Borenstein JT.A. onboard microfluidic flow controlを備えた薬剤開発のためのポータブルで再構成可能な多臓器プラットフォーム。Lab Chip 2017; 17:134-44 [PMCフリー記事] [PubMed] [Google Scholar].
50.Xiao S, Coppeta JR, Rogers HB, Isenberg BC, Zhu J, Olalekan SA, McKinnon KE, Dokic D, Rashedi AS, Haisenleder DJ, Malpani SS, Arnold-Murray CA, Chen K,Jiang M, Bai L, Nguyen CT, Zhang J, Laronda MM, Hope TJ, Maniar KP, Pavone ME, Avram MJ, Sefton EC, Getsios S, Burdette JE, Kim JJ, Borenstein JT, Woodruff TK.の各氏。ヒト生殖管と28日月経周期のマイクロ流体培養モデル。Nat Commun 2017; 8:14584.[PMC フリーアーティクル] [PubMed] [Google Scholar].
51.Cyr KJ, Avaldi OM, Wikswo JP.Human-on-a-chip における概日性ホルモン制御。In vitro生物学の無視されたコンポーネント?Exp Biol Med 2017; 242:1714-31 [PMC無料記事] [PubMed] [Google Scholar].
52.Wikswo JP, Block FE, III, Cliffel DE, Goodwin CR, Marasco CC, Markov DA, McLean DL, McLean JA, McKenzie JR, Reiserer RS, Samson PC, Schaffer DK, Seale KT, Sherrod SD.Integrated organ-on-chip systemsを計装・制御するための工学的課題。IEEE Trans Biomed Eng 2013; 60:682-90 [PMC無料記事] [PubMed] [Google Scholar].
53.Sung JH, Kam C, Shuler ML.A microfluidic device for a pharmacokinetic-pharmacodynamic (PK-PD) model on a chip.Lab Chip 2010; 10:446-55 [PubMed] [Google Scholar].
54.Lee H, Kim DS, Ha SG, Choi I, Lee JM, Sung JH.A. pumpless multi-organ-on-a-chip (MOC) combined with a pharmacokinetic-pharmacodynamic (PK-PD) model.(パンプレス・マルチ・オン・ア・チップと薬物動態学・薬力学モデルの組み合わせ)。Biotechnol Bioeng 2016; 114:432-43 [PubMed] [Google Scholar].
55.Wagner I, Materne EM, Brincker S, Sussbier U, Fradrich C, Busek M, Sonntag F, Sakharov DA, Trushkin EV, Tonevitsky AG, Lauster R, Marx U. A dynamic multiorgan-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture.Lab Chip 2013; 13:3538-47 [PubMed] [Google Scholar].
56.Maschmeyer I, Lorenz AK, Schimek K, Hasenberg T, Ramme AP, Hübner J, Lindner M, Drewell C, Bauer S, Thomas A, Sambo NS, Sonntag F, Lauster R, Marx U. A four-organ-chip for interconnected long-term co-culture of human intestine, liver, skin and kidney equivalents.ヒトの腸、肝臓、皮膚、腎臓の相互接続された長期共培養用チップ。Lab Chip 2015; 15:2688-99 [PubMed] [Google Scholar].
57.Zhang C, Zhao ZQ, Rahim NAA, van Noort D, Yu H.ヒトオンチップに向けて:コンパートメント化された微小環境を持つチップ上で複数の細胞種を培養する。Lab Chip 2009; 9:3185-92 [PubMed] [Google Scholar].
58.エシュ MB、スミス AST、プロット JM、オレアガ C、ヒックマン JJ、シュラー ML.マルチオーガンマイクロデバイスが医薬品開発を促進するためにどのように役立つか。Adv Drug Del Rev 2014; 69:158-69 [PMC無料記事] [PubMed] [Google Scholar].
59.Borysiak MD, Bielawski KS, Sniadecki NJ, Jenkel CF, Vogt BD, Posner JD.生体適合性スチレン系エラストマーのシンプルなレプリカマイクロモールド。Lab Chip 2013; 13:2773-84 [PMC free article] [PubMed] [Google Scholar].
60.Borysiak MD, Yuferova E, Posner JD.シンプルで低コストな動電学のためのスチレン-エチレン/ブチレン-スチレンマイクロデバイス。Anal Chem 2013; 85:11700-4 [PubMed] [Google Scholar].
61.Wasay A, Sameoto D. Gecko gaskets for self-sealing and high-strength reversible bonding of microfluidics.(ヤモリガスケットによるマイクロ流体のセルフシールと高強度可逆接合).Lab Chip 2015; 15:2749-53 [PubMed] [Google Scholar].
62.Fernandez-Alcon J, Wen N, Novak R, Ingber DE, Hamilton GA, Hinojosa C, Domanasky K, Levner D, Thompson G, Hajipouran Benam K, Villenave R, Umundum T, Paris A, Bauer G, inventors; President and fellows of Harvard College (Cambridge, MA, US), assignee.D. (米国)..オルガノミメティックデバイスおよびその使用方法ならびに製造方法。特許出願20160326477、米国、2016年。
63.このように、SEBS エラストマーを使用することで、射出成形と押出成形による薬物吸収を抑えたマイクロ流体デバイスの作製が可能となる。SEBS.エラストマーを用いた射出成形および押出成形による薬物吸収を抑制したマイクロ流体デバイスの作製。マイクロフルイド・ナノフルイド 2017; 21:107 [Google Scholar].
64.Kilic O, Pamies D, Lavell E, Schiapparelli P, Feng Y, Hartung T, Bal-Price A, Hogberg HT, Quinones-Hinojosa A, Guerrero-Cazares H, Levchenko A. Brain-on-a-chip model enables an analysis of human neuronal differentiation and chemotaxis.Lab Chip 2016; 16:4152-62 [PubMed] [Google Scholar].
65.Sip CG, Bhattacharjee N, Folch A. Microfluidic transwell inserts for generation of tissue culture-friendly gradients in well plate.Lab Chip 2014; 14:302-14 [PMCフリー記事] [PubMed] [Google Scholar].
66.Karolak A, Huffstutler B, Markov DA, McCawley LJ, Rejniak KA.3D乳房スフェロイドの計算モデルによる腫瘍微小環境不均一性の役割の解明。Biophys J 2017; 112:45a [Google Scholar].
67.Kim HJ, Huh D, Hamilton G, Ingber DE.腸の蠕動運動様の運動と流れを体験する微生物叢が生息するヒトガット・オン・ア・チップ。Lab Chip 2012; 12:2165-74 [PubMed] [Google Scholar].
68.このような場合、「痒いところに手が届く」状態であることが重要である。Fluorescent protein biosensors applied to microphysiological systems(蛍光タンパク質バイオセンサーのマイクロフィジオロジーシステムへの応用)。Exp Biol Med 2015; 240:795-808 [PMC無料記事] [PubMed] [Google Scholar].
69.Lind JU, Busbee TA, Valentine AD, Pasqualini FS, Yuan HY, Yadid M, Park SJ, Kotikian A, Nesmith AP, Campbell PH, Vlassak JJ, Lewis JA, Parker KK.マルチマテリアル3次元印刷による計装化心臓マイクロフィジオロジーデバイス。Nat Mater 2017; 16:303-8 [PMCフリーアーティクル] [PubMed] [Google Scholar].
70.Parker KK, Feinberg AW, Whitesides GM, Shevkoplyas SS, Feigel A, inventors; President and fellows of Harvard College (Cambridge, MA, US), assignee.高分子フィルム上における細胞の工学的増殖およびそのバイオテクノロジー的応用。米国特許9,383,350 B2、2016年
71.Mathur A, Loskill P, Shao KF, Huebsch N, Hong S, Marcus SG, Marks N, Mandegar M, Conklin BR, Lee LP, Healy KE.薬物スクリーニングアプリケーションのためのヒトiPSCベースの心臓微小生理学的システム。Sci Rep 2015; 5:Article 8883 [PMCフリー記事] [PubMed] [Google Scholar].
72.Huebsch N、Loskill P、Mandegar MA、Marks NC、Sheehan AS、Ma Z、Mathur A、Nguyen TN、Yoo JC、Judge LM、Spencer CI、Chukka AC、Russell CR、So P-L、Conklin BR、Healy KE.異なる空間スケールで培養したヒト人工多能性幹細胞由来心筋細胞における収縮力とカルシウムフラックスのビデオによる自動解析。Tissue Eng Part C Methods 2015; 21:467-79 [PMC無料記事] [PubMed] [Google Scholar].
73.Sidorov VY, Samson PC, Sidorova TN, Davidson JM, Lim CC, Wikswo JP.I-Wire heart-on-a-chip I: three-dimensional cardiac tissue constructs for physiology and pharmacology(I-Wireハートオンチップ:生理学と薬理学のための三次元心臓組織コンストラクト)。Acta Biomater 2017; 48:68-78 [PMCフリーアーティクル] [PubMed] [Google Scholar].
74.Schroer AK, Shotwell MS, Sidorov VY, Wikswo JP, Merryman WD.I-Wire heart-on-a-chip II: 収縮性三次元心筋細胞組織コンストラクトのバイオメカニカルアナリシス(Biomechanical analysis of contractile, three-dimensional cardiomyocyte tissue constructs).Acta Biomater 2016; 48:79-87 [PMCフリーアーティクル] [PubMed] [Google Scholar].
75.Ma SP, Vunjak-Novakovic G. Tissue-engineering for the study of cardiac biomechanics.J Biomech Eng Trans ASME 2016; 138:021010 [PMCフリーアーティクル] [PubMed] [Google Scholar].
76.Oleaga C, Bernabini C, Smith AST, Srinivasan B, Jackson M, McLamb W, Platt V, Bridges R, Cai Y, Santhanam N, Berry B, Najjar S, Akanda N, Guo X, Martin C, Ekman G, Esch MB, Langer J, Ouedraogo G, Cotovio J, Breton L, Shuler ML, Hickman JJ.4つの臓器で構成される機能的なヒトin vitroシステムにおける多臓器毒性実証。Sci Rep 2016; 6:20030.[PMC フリーアーティクル] [PubMed] [Google Scholar].
77.Srinivasan B, Kolli AR, Esch MB, Abaci HE, Shuler ML, Hickman JJ.(スリニバサンB、コリAR、エシュMB、アバチHE、シュラーML、ヒックマンJJ)。in vitroバリアモデルシステムのためのTEER測定技術。J Lab Autom 2015; 20:107-26 [PMCフリー記事] [PubMed] [Google Scholar].
78.Brown JA, Codreanu SG, Shi M, Sherrod SD, Markov DA, Neely MD, Britt CM, Hoilett OS, Reiserer RS, Samson PC, McCawley LJ, Webb DJ, Bowman AB, McLean JA, Wikswo JP.Metabolic consequences of inflammatory disruption of the blood-brain barrier in an organ-on-chip model of the human neurovascular unit(ヒト神経血管単位のオルガン・オンチップモデルにおける血液脳関門の炎症性破壊の代謝的結果)。J Neuroinflammation 2016; 13:306.[PMCフリーアーティクル] [PubMed] [Google Scholar].
79.Brown JA, Pensabene V, Markov DA, Allwardt V, Neely MD, Shi M, Britt CM, Hoilett OS, Yang Q, Brewer BM, Samson PC, McCawley LJ, May JM, Webb DJ, Li D, Bowman AB, Reiserer RS, Wikswo JP.は、血液脳関門の生理学的・構造学的研究をチップ上で再現した。血液脳関門の生理と構造をチップ上で再現:新規の神経血管マイクロ流体バイオリアクター。Biomicrofluidics 2015;9:Article 054124 [PMCフリー記事] [PubMed].
80.Odijk M, van der Meer AD, Levner D, Kim HJ, van der Helm MW, Segerink LI, Frimat JP, Hamilton GA, Ingber DE, van den Berg A. Measuring direct current trans-epithelial electrical resistance in organ-on-a-chip microsystems.Lab Chip 2015; 15:745-52 [PubMed] [Google Scholar].
81.Helms HC, Abbott NJ, Burek M, Cecchelli R, Couraud PO, Deli MA, Förster C, Galla HJ, Romero IA, Shusta EV, Stebbins MJ, Vandenhaute E, Weksler B, Brodin B. In vitro models of the blood-brain barrier: an overview of commonly used brain endothelial cell culture models and guidelines for their use.「脳内バリアの試験管モデル」(邦題:脳内皮細胞培養モデルの概要と使用ガイドライン).J Cereb Blood Flow Metab 2016; 36:862-90 [PMCフリー記事] [PubMed] [Google Scholar].
82.Stanimirovic DB, Bani-Yaghoub M, Perkins M, Haqqani AS.Blood-brain barrier models: in vitro to in vivo translation in preclinical development of CNS-targeting biotherapeutics.Expert Opin Drug Discov 2015; 10:141-55 [PubMed] [Google Scholar].
83.Sheehy SP、Grosberg A、Qin P、Behm DJ、Ferrier JP、Eagleson MA、Nesmith AP、Krull D、Falls JG、Campbell PH、McCain ML、Willette RN、Hu E、Parker KK.未熟な心筋細胞を用いたオルガン・オンチップ・プラットフォームにおける心筋成熟度の向上に向けて。Exp Biol Med 2017; 242:1643-56 [PMCフリー記事] [PubMed] [Google Scholar].
84.サザーランド JJ、ジョリー RA、ゴールドスタイン KM、スティーブンス JL。げっ歯類の肝臓と培養肝細胞における薬物誘発転写反応の一致を評価する。PLoS Comput Biol 2016; 12:e1004847.[PMC フリーアーティクル] [PubMed] [Google Scholar].
85.Wang XS, Pandey AK, Mulligan MK, Williams EG, Mozhui K, Li ZS, Jovaisaite V, Quarles LD, Xiao Z, Huang J, Capra JA, Chen Z, Taylor WL, Bastarache L, Niu X, Pollard KS, Ciobanu DC, Reznik AO, Tishkov AV, Zhulin IB, Peng J, Nelson SF, Denny JC, Auwerx J, Lu L, Williams RW.遺伝子機能と疾患リスクを検証するためのマウス-ヒト合同フェノメワイドアソシエーション。Nat Commun 2016; 7:10464.[PMC フリーアーティクル] [PubMed] [Google Scholar].
86.Norris JL, Farrow MA, Gutierrez DB, Palmer LD, Muszynski N, Sherrod SD, Pino JC, Allen JL, Spraggins JM, Lubbock AL, Jordan A, Burns W, Poland JC, Romer C, Manier ML,Nei YW, Prentice BM, Rose KL, Hill S, Van de Plas R, Tsui T, Braman NM, Keller MR, Rutherford SA, Lobdell N, Lopez CF, Lacy DB, McLean JA, Wikswo JP, Skaar EP, Caprioli RM.統合されたハイスループット、マルチオミックスプラットフォームは、細胞応答のデータ駆動型構築を可能にし、グローバルな薬物作用メカニズムを明らかにする。J Proteome Res 2017; 16:1364-75 [PubMed] [Google Scholar].
87.Poulin P, Theil FP.創薬における生理学的薬物動態モデルの使用を促進するための薬物の組織:血漿分配係数の先験的予測。J Pharm Sci 2000; 89:16-35 [PubMed] [Google Scholar].
88.このような場合、「薬物乱用防止法」を適用する必要がある。ヒトの PBPK モデルで使用される生理学的因子の個人間変動のモデル化。Crit Rev Toxicol 2003; 33:469-503 [PubMed] [Google Scholar].
89.生理学に基づく薬物動態モデリング 1: 中等度から強度の塩基の組織分布の予測.J Pharm Sci 2005; 94:1259-76 [PubMed] [Google Scholar].
90.創薬・開発における生理学的薬物動態モデリングにおける基本的な概念。CPT Pharmacometrics Syst Pharmacol 2013; 2:1-12 [PMC無料記事] [PubMed] [Google Scholar].
91.Lu J, Goldsmith M-R, Grulke CM, Chang DT, Brooks RD, Leonard JA, Phillips MB, Hypes ED, Fair MJ, Tornero-Velez R, Johnson J, Dary CC, Tan YM.Developing the physiologically-based pharmacical modeling in the drug development.暫定的なモデル構築をサポートする生理学に基づく薬物動態モデル知識ベースの開発。PLoS Comput Biol 2016; 12:e1004495.[PMC フリーアーティクル] [PubMed] [Google Scholar].
92.クイックDJ、シュラーML.ラットとマウスにおけるナフタレンの生理学に基づく薬物動態モデルの構築のためのin vitroデータの使用による種差の検討。バイオテクノルプログ 1999; 15:540-55 [PubMed] [Google Scholar].
93.Ghanem A, Shuler ML.細胞培養アナログリアクター設計と PBPK モデルの組み合わせによるナフタレン毒性メカニズムの解明。Biotechnol Prog 2000; 16:334-45 [PubMed] [Google Scholar].
94.Sung JH, Dhiman A, Shuler ML.UFT 投与によるラットの腫瘍増殖に関する薬物動態・薬力学複合(PK-PD)モデル。J Pharm Sci 2009; 98:1885-904 [PubMed] [Google Scholar].
95.Sung JH, Esch MB, Shuler ML.薬物動態-薬力学モデリングのための in silico および in vitro プラットフォームの統合。Expert Opin Drug Metab Toxicol 2010; 6:1063-81 [PubMed] [Google Scholar].
96.Sung JH, Shuler ML.In vitro microscale systems for systematic drug toxicity study.96. Sung JH, Shuler ML. Bioprocess Biosystems Eng 2010; 33:5-19 [PubMed] [Google Scholar] (バイオプロセス、バイオシステムズ工学、2010年)。
97.ロング TJ、コスグローブ PA、ダン RT、ll、ストルツ DB、ハマデ HK、アフシャリ C、マクブライド H、グリフィス LG.3D灌流型ヒト肝臓共培養プラットフォームを用いた治療用抗体-低分子薬物-薬物相互作用のモデリング。Drug Metab Disposition 2016; 44:1940-8 [PMC無料記事] [PubMed] [Google Scholar].
98.Yu J, Cilfone NA, Large EM, Sarkar U, Wishnok JS, Tannenbaum SR, Hughes DJ, Lauffenburger DA, Griffith LG, Stokes CL, Cirit M. Quantitative systems pharmacology approaches applied to microphysiological systems (MPS): data interpretation and multi-MPS integration.CPT Pharmacometrics Syst Pharmacol 2015; 4:585-94 [PMCフリー記事] [PubMed] [Google Scholar].
99.Abaci HE, Shuler ML.Human-on-a-chip design strategies and principles for physiologically based pharmacokinetics/pharmacodynamics modeling(生理学に基づく薬物動態/薬力学モデリングのためのヒューマンオンチップ設計戦略と原則).Integr Biol 2015; 7:383-91 [PMCフリー記事] [PubMed] [Google Scholar].
100.シャー・DK、ベッツ・アム。前臨床種およびヒトにおけるモノクローナル抗体の血漿および組織内体内動態を特徴付けるためのプラットフォームPBPKモデルに向けて。J Pharmacokinet Pharmacodyn 2012; 39:67-86 [PubMed] [Google Scholar].
101.Rostami-Hodjegan A. Physiologically based pharmacokinetics joined with in vitro-in vivo extrapolation of ADME: a marriage under the arch of systems pharmacology.Clin Pharmacol Ther 2012; 92:50-61 [PubMed] [Google Scholar].
102.Leung HW.生理学に基づく薬物動態モデリング(Physiologically based pharmacokinetic modelling.において。Casciano DA, Sahu SC, Ballantyne B, Marrs T, and Syversen T (eds) General, applied and systems toxicology, John Wiley & Sons, Ltd, 2009.に掲載。DOI: 10.1002/9780470744307.gat008
103.Bois FY.リスク判定のための PBPK モデルの解析。Ann NY Acad Sci 1999; 895:317-37 [PubMed] [Google Scholar].
104.Clewell HJ III.有害物質のヒト健康リスク評価における生理学に基づく薬物動態モデリングの適用。を参照。
105.ラマダン Q、Gijs MAM.In vitro micro-physiological models for translational immunology.Lab Chip 2015; 15:614-36 [PubMed] [Google Scholar].
106.Kim J, Lee H, Selimovic S, Gauvin R, Bae H. Organ-on-a-chip: Development and clinical prospects towards toxicity assessment with an emphasis on bone marrow.Drug Saf 2015; 38:409-18 [PubMed] [Google Scholar].
107.ヒグビーRG、バイヤーズAM、ディールV、ドレイクD、ファーレンカンプHG、ガンガーJ、カチュリンA、カチュリナO、レイストリッツD、マーY、メータR、ミシュキンE、モーザーJ、モスケラL、グエンM、パークヒルR、パワーS、ポワソンL、サンチェス-シュミッツG、シャニンB、シンI、ソングH、タピアT、ウォレンW、ウィットマンV.A.A.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.S.迅速なワクチン評価のための免疫学的モデル - 試験管内の臨床試験。ATLA 2009; 37:19-27 [PubMed] [Google Scholar].
108.Ross AE, Belanger MC, Woodroof JF, Pompano RR.リンパ組織の空間分解マイクロ流体刺激ex vivo。Analyst 2017; 142:649-59 [PMC無料記事] [PubMed] [Google Scholar].
109.パセラウブPA、アルメイダAC、タコールNV.脳組織スライスの灌流用マイクロ流体チャンバーの設計、微細加工、解析。Biomed Microdevices 2003; 5:147-55 [Google Scholar].
110.Shaikh Mohammed J, Caicedo H, Fall CP, Eddington DT.マイクロ流体ネットワークと標準的な灌流チャンバを使用した脳スライス刺激。J Vis Exp 2007; 8:e302 [PMC free article] [PubMed] [Google Scholar].
111.Mohammed JS, Caicedo HH, Fall CP, Eddington DT.標準的な電気生理チャンバー用のマイクロ流体アドオン。Lab Chip 2008; 8:1048-55 [PubMed] [Google Scholar].
112.このような場合、「灌流チャンバー」の設計・製作が必要である。In:Locascio LE (ed) Micro total analysis systems 2008: proceedings of the µTAS 2008: twelfth international conference on miniaturized systems for chemistry and life sciences.サンディエゴ、カリフォルニア州。化学・生物学マイクロシステム学会, 2008, pp.166300-5
113.Rambani K, Vukasinovic J, Glezer A, Potter SM.Culturing thick brain slices: an interstitial 3D microperfusion system for enhanced viability.J Neurosci Methods 2009; 180:243-54 [PMC free article] [PubMed] [Google Scholar].
114.Blake AJ, Rodgers FC, Bassuener A, Hippensteel JA, Pearce TM, Pearce TR, Zarnowska ED, Pearce RA, Williams JC.A microfluidic brain slice perfusion chamber for multisite recording using penetrating electrodes.J Neurosci Methods 2010; 189:5-13 [PMC free article] [PubMed] [Google Scholar].
115.このような場合、「臓器型脳スライスのマイクロパーフュージョンのためのチャンバーとマイクロ流体プローブ」。Lab Chip 2010; 10:326-34 [PubMed] [Google Scholar].
116.Huang Y, Williams JC, Johnson SM.Huang Y. Williams JC, Johnson SM. Brain slice on a chip: Opportunities and challenges of applying microfluidic technology to intact tissues.Lab Chip 2012; 12:2103-17 [PubMed] [Google Scholar].
117.Mauleon G, Fall CP, Eddington DT.Mauleon G, Fall CP, Eddington DT. In vitro brain slices within oxygen via microfluidic gas channels, Precise spatial and temporal control of oxygen in vitro.PLoS One 2012; 7:e43309.[PMC フリーアーティクル] [PubMed] [Google Scholar].
118. van Midwoud PM, Merema MT, Verpoorte E, Groothuis GM.A. microfluidic approach for in vitro assessment of interorgan interactions in drug metabolism using intestinal and liver slices.Lab Chip 2010; 10:2778-86 [PubMed] [Google Scholar].
119.Venero Galanternik M, Stratman AN, Jung HM, Butler MG, Weinstein BM.Building the drains: the lymphatic vasculature in health and disease.WIREs Dev Biol 2016; 5:689-710 [PubMed] [Google Scholar].
120.Giese C, Marx U. Human immunity in vitro - solving immunogenicity and more.Adv Drug Del Rev 2014; 69:103-22 [PubMed] [Google Scholar].
121.チョー・シー(Choo SY.HLAシステム。遺伝学、免疫学、臨床検査、および臨床的意義.Yonsei Med J 2007; 48:11-23 [PMC無料記事] [PubMed] [Google Scholar].
122.Ramadan Q, Jafarpoorchekab H, Huang CB, Silacci P, Carrara S, Koklü G, Ghaye J, Ramsden J, Ruffert C, Vergeres G, Gijs MA.NutriChip: nutrition analysis meets microfluidics.Lab Chip 2013; 13:196-203 [PubMed] [Google Scholar].
123.Mills M, Estes MK.感染症のための生理学的に適切なヒト組織モデル。Drug Discov Today 2016; 21:1540-52 [PMC無料記事] [PubMed] [Google Scholar].
124.Workman MJ, Mahe MM, Trisno S, Poling HM, Watson CL, Sundaram N, Chang CF, Schiesser J, Aubert P, Stanley EG, Elefanty AG, Miyaoka Y, Mandegar MA, Conklin BR, Neunlist M, Brugmann SA, Helmrath MA, Wells JM.機能的な腸管神経系を有するヒト多能性幹細胞由来の腸管組織の作製。Nat Med 2017; 23:49-59 [PMCフリー論文] [PubMed] [Google Scholar].
125.Kang JH, Super M, Yung CW, Cooper RM, Domansky K, Graveline AR, Mammoto T, Berthet JB, Tobin H, Cartwright MJ, Watters AL, Rottman M, Waterhouse A, Mammoto A, Gamini N, Rodas MJ, Kole A, Jiang A, Valentin TM, Diaz A, Takahashi K, Ingber DE.の各氏は、敗血症治療における体外式血液浄化装置を開発した。敗血症治療のための体外式血液浄化装置。Nat Med 2014; 20:1211-6 [PubMed] [Google Scholar].
126.Torisawa YS, Spina CS, Mammoto T, Mammoto A, Weaver JC, Tat T, Collins JJ, Ingber DE.Bone marrow-on-a-chip replicates hematopoietic niche physiology in vitro(骨髄オンアチップは造血ニッチの生理機能をin vitroで再現する。Nat Methods 2014; 11:663-9 [PubMed] [Google Scholar].
127.Collins FS, Varmus H. A new initiative on precision medicine.N Engl J Med 2015; 372:793-5 [PMC無料記事] [PubMed] [Google Scholar].
128.Wang G, McCain ML, Yang L, He A, Pasqualini FS, Agarwal A, Yuan H, Jiang D, Zhang D, Zangi L, Geva J, Roberts AE, Ma Q, Ding J, Chen J, Wang DZ, Li K, Wang J, Wanders RJ, Kulik W, Vaz FM, Laflamme MA, Murry CE, Chien KR, Kelley R, Church GM, Parker KK, Pu WT.人工多能性幹細胞およびハートオンチップ技術によるバルト症候群のミトコンドリア心筋症のモデル化。Nat Med 2014; 20:616-23 [PMCフリー記事] [PubMed] [Google Scholar].
129.Olson H, Betton G, Robinson D, Thomas K, Monro A, Kolaja G, Lilly P, Sanders J, Sipes G, Bracken W, Dorato M, Van Deun K, Smith P, Berger B, Heller A. Concordance of the toxicity of pharmaceuticals in human and in animal.Regul Toxicol Pharmacol 2000; 32:56-67 [PubMed] [Google Scholar].
参考記事
1 補足説明
1.マイクロ流体デバイス
半導体製造技術を用いて、微細な流路を樹脂やガラスなどの基盤に形成することで、液体もしくは液体中を流れる微粒子などの分離、濃縮、反応、解析といった操作をマイクロスケールで行うための小型集積装置。2.概日時計(体内時計)、概日リズム
約24時間の周期を有する生物リズムを概日リズムと呼び、これは生物の体内に約24時間周期を発振する内在性の概日時計(体内時計)が存在することによる。24時間周期で自転する地球環境に適応するために生物が獲得した基本的生命現象と考えられている。地球上に棲むほぼ全ての生物が概日リズムを持つとされる。3.視交叉上核(しこうさじょうかく)(SCN)
脳の視床下部に存在する神経核で、哺乳類の概日リズムの中枢。動物の視交叉上核を破壊すると概日リズムがなくなることが知られている。SCNは、Suprachiasmatic Nucleusの略。4.ルシフェラーゼ
ルシフェラーゼは、ホタルなどの生物発光において、光を放つ化学反応を触媒する作用を持つ酵素の総称。生物発光イメージングは、ルシフェラーゼなどをリポーター遺伝子として用いることで、発光強度から対象とする遺伝子の発現量を定量できる。5.オルガノイド
人工的に作られる、生体内の組織または臓器に似た細胞組織体。
2 MPSとは、健康または病気の臓器や組織の機能の特性を模倣する物理的(温度、pH、酸素など)/生化学的/電気的/機械的(流れや伸張など)な反応を提供する微小環境を構築した小型のチップ内に、機能的に特性のある細胞、器官や組織由来の採取物、自己組織化オルガノイドなどを入れたin vitroプラットフォーム。
3 はじめに
2016年の世界経済フォーラムでは“The top 10 emerging technologies of 2016”としてOrgans-on-chipsが選ばれている[1]。Tissue-chipsやHuman-on-a-chipなどとも呼ばれるこれらのチップは主に透明なシリコーンゴムなどで成形されており、単独あるいは複数の臓器コンパートメントをもち、臓器コンパートメントで細胞や組織を培養できるようになっている。血液の代わりに培養液でコンパートメントを結ぶと、人体の模倣システムが完成する。
この記事が気に入ったらサポートをしてみませんか?
