
【論文】 mRNAワクチンは、適応および自然免疫応答を再プログラムする
【解説】
mRNAワクチンを注射すると、人間の体内に複数有る免疫機能のバランスが崩れて、新しいバランスを持つ免疫システムに作り変えられる。
ワクチンに特異的なウイルス(武漢株)に対しては強い免疫を持つが、それ以外のウイルスや真菌、細菌に対する免疫力は弱まるかもしれない。
現在、武漢株はほとんど存在しません。
ふと、思い出したのがワクチン接種後に帯状疱疹を発症する人が多いこと。免疫が低下したのが関係しているのかもしれません。
https://www.medrxiv.org/content/10.1101/2021.05.03.21256520v1#disqus_thread
概要
Pfizer/BioNTech社のmRNAベースのBNT162b2ワクチンは、最初に登録されたCOVID-19ワクチンであり、SARS-CoV-2感染の予防に最大95%の効果があることが示されている。しかし、この新しいクラスのmRNAワクチンの幅広い効果、特に自然免疫反応と適応免疫反応に対する複合的な効果があるかどうかについては、ほとんど分かっていない。本研究では、健康な人にBNT162b2ワクチンを接種すると、いくつかのSARS-CoV-2亜種に対して有効な体液性免疫および細胞性免疫が誘導されることを確認した。しかし、興味深いことに、BNT162b2ワクチンは、特異的な刺激(SARS-CoV-2)および非特異的な刺激(ウイルス、真菌、細菌)を受けた自然免疫細胞による炎症性サイトカインの産生を調節した。BNT162b2ワクチン接種後、TLR4およびTLR7/8リガンドに対する自然免疫細胞の反応は低下したが、真菌によるサイトカイン反応はより強かった。結論として、mRNAのBNT162b2ワクチンは、自然免疫応答の複雑な機能的リプログラミングを誘導することがわかり、この新しいクラスのワクチンの開発と使用において考慮すべきである。
本文の内容
コロナウイルス感染症2019(COVID-19)は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)を原因とする新しい呼吸器感染症で、2019年末から世界的なパンデミックを引き起こしながら世界中に広がっています。COVID-19のパンデミックは、第二次世界大戦以来、人類が遭遇した最も重要な医療危機を意味しており、社会的、経済的に壊滅的な影響を併せ持っています。この危機的な状況に直面して、COVID-19に対するワクチンの開発に向けた大規模な取り組みが世界各国で開始されています。
現在までに、13種類のワクチンがヒトへの使用を承認されています(「COVID-19 vaccine tracker|RAPS」n.d.)。パンデミックの規模が大きくなったことで、mRNAやウイルスベクターを用いたワクチンなど、新しい技術に基づくワクチンの開発が加速しています(van Riel & de Wit, 2020)。世界で最も広く使用されている抗COVID-19ワクチンの一つは、バイオンテック社とファイザー社の共同開発によるものです(BNT162b2)。このワクチンは、中国の武漢で早期に分離されたSARS-CoV-2株に由来するスパイク(S)タンパク質のプレフュージョン安定化型をコードする脂質ナノ粒子製剤化されたヌクレオシド修飾mRNAに基づいている(Walshら、2020年)。いくつかのフェーズ3試験では、BNT162b2が広範な体液性および細胞性応答を誘発し、COVID-19に対する防御を提供することが実証されている(Sahin et al.、2020年、Walsh et al.、2020年)。
SARS-CoV-2感染症に対する世界的なワクチン接種キャンペーンが展開される一方で、大きな課題が残っており、特に新規ウイルスの変異体の拡散が問題となっている(Madhi et al.、2021年)。パンデミック中の最も顕著な変異の1つは、武漢Hu-1原株に対するスパイクD614G置換である(Korberら、2020年)。感染者数が着実に増加する中、複数のスパイク変異を持つSARS-CoV-2の変種が出現し、イギリス(B.1.1.7系統)、南アフリカ(B.1.351系統)、ブラジル(P.1系統)で初めて検出されました。これらの変異体は、病気の重症度、ウイルスの伝達性、再感染率、ワクチンの有効性に影響を与える可能性があるため、大きな懸念となっています(Abdool Karim & de Oliveira, 2021)。
BNT162b2が新しいSARS-CoV-2亜種に対して効果的な体液性免疫および細胞性免疫を誘導する能力は、現在ようやく理解され始めたところである。健康なボランティアにBNT162b2を接種したところ、B.1.1.7の中和力は標準株と同等かわずかに低下したのに対し(Muikら、2021年、Wang、Nairら、2021年)、B.1.351の中和力は顕著に低下した(Liuら、2021年、Planasら、2021年、Wang、Nairら、2021年)。対照的に、ウイルス亜種に対する細胞性免疫はあまり影響を受けないようです(Lilleriら、2021年;Skellyら、2021年)。さらに、BNT162b2のワクチン接種が自然免疫応答にも長期的な影響を与えるかどうかは未解明の領域です。このことは、炎症の制御不全が疾患の発症と重症化に重要な役割を果たしているCOVID-19に非常に関連している可能性があります(Tahaghoghi-Hajghorbani et al.、2020年)。自然免疫応答の長期的な変調は、ここ数年で関心が高まっている分野である。複数の研究により、長期的な自然免疫応答は、特定のワクチンまたは感染症の後に増加(訓練された免疫)または低下(自然免疫寛容)のいずれかになることが示されている(Neteaら、2020年)。
本研究では、BNT162b2 mRNA COVID-19ワクチンが自然免疫反応と適応免疫反応(体液性および細胞性)の両方に及ぼす影響を評価した。まず、ワクチン接種前(ベースライン;t1)、BNT162b2 30μgの初回投与から3週間後(t2)、2回目の投与から2週間後(t3)に、RBDおよびS結合抗体アイソタイプの濃度を調べた(図S1A)。t2とt3の両方の濃度をベースラインと比較して、倍数変化を計算した。BNT162b2ワクチンを接種すると、1回目のワクチン接種後にすでに高い抗Sタンパク質抗体と抗RBD抗体の濃度が得られ、2回目のワクチン接種後にはさらに強い反応が得られた。予想通り、IgG反応が最も顕著で、t2およびt3におけるRBD特異的な倍数変化の中央値は56倍と1839倍、S特異的な倍数変化はそれぞれ208倍と1100倍であった。RBDを標的とするIgGのワクチン接種前のレベルとの比較で観察された最も低い倍数変化は、t2で14倍、t3で21倍であった。S特異的IgGについては、t2で少なくとも32倍、t3で339倍の倍数変化が見られた。IgA濃度については、ワクチンの単回投与により、RBD特異的な濃度が7倍、S特異的な濃度が35倍に増加した。2回目の接種では、1回目の接種で得られた抗体濃度が、RBDで24倍、Sで52倍に増加した。IgGとIgAに比べて、IgMの濃度上昇はかなり低かった。RBD特異的濃度は初回接種後に2倍になっただけで、2回目のワクチン接種後にはそれ以上増加しなかった。対照的に、S特異的な倍数変化は、t2で11倍、t3で20倍であった(図S1A)。これらの結果は、BNT162b2ワクチン接種による体液性応答の強い誘導を報告した最近の観察結果を確認し、拡張したものである(Sahinら、2020年)。
SARS-CoV-2亜種に対する血清の中和能力を調べるため,2回目のワクチン投与から2週間後に採取した血清を用いて,50%プラークリダクション中和試験(PRNT50)を行った。その結果,すべての血清サンプルがD614G株とB.1.1.7亜種を少なくとも1:80の力価で中和した。しかし、6名(37,5%)の被験者は、B.1.351変異体に対する力価が1:80よりも低かった。D614G株、B.1.1.7、B.1.351に対する中和力価の幾何平均は、それぞれ381、397、70であった(図S1B、p<0.001)。我々の調査と同様に、いくつかの研究では、標準株と比較して、B.1.351変種に対するワクチン接種後の血清の中和活性が6~14倍減少し、B.1.1.7に対する活性はわずかに減少しただけであることが報告されている(Planasら、2021年、Shenら、2021年、Wang, Liuら、2021年)。これらのデータは、B.1.351、およびおそらく他の変異体が、ワクチンによって誘導される体液性免疫からある程度逃れることができるという証拠を裏付けています(Kustin et al. さらに、PRNT力価と2回目の投与後のIgGの抗体濃度には強い相関が見られた(図S1C)。この相関は、B.1.1.7とB.1.351では、抗RBDと抗Sの両方で、標準株よりも強かった。
BNT162b2ワクチン接種は、ウイルス特異的なCD4+およびCD8+ T細胞を活性化し、IFN-γなどの免疫調整サイトカインの産生をアップレギュレートすることが報告されている(Sahin et al.、2020)。そこで、熱で不活化したSARS-CoV-2株に対するBNT162b2ワクチン接種の前後で、末梢血単核細胞(PBMC)からのIFN-γの分泌量を評価した(図2A-2D)。BNT162b2をワクチン接種すると、一般的には2回目の接種後に特異的IFN-γの産生が中程度に増加するようだが、これが統計的に有意になったのはB.1.351変種で刺激した場合のみであった(図S2A-2C)。同様の傾向は、合成SARS-CoV-2バリアントタンパク質を用いてB.1.351に対するIFN-γ応答の上昇を誘導したTarkeらによっても観察されている(Tarkeら、2021年)。標準的なSARS-CoV-2株で刺激すると被験者の37.5%、B.1.1.7変種およびB.1.351変種で刺激すると被験者の50%でIFN-γ産生が少なくとも50%上昇したが、Bavarian変種で刺激すると被験者の18,75%でしか上昇しなかった(図S1D)。これらの結果から、BNT162b2ワクチンは、細胞性免疫応答よりも体液性免疫応答を誘導することが明らかになった。これまで、BNT162b2を単回接種しただけのワクチン接種者では、弱いT細胞応答が報告されている(Prendeckiら、2021年、Stankov、Cossmann、Bonifacius、Dopfer-jablonka、&Morillas、2021年)。興味深いことに、ワクチン接種後に最も良好な細胞応答が得られたのはB.1.351変異体に対するものでした。この変異体に対する中和抗体応答が比較的低かったことから、この変異体に対するBNT162b2ワクチンの防御効果は、体液性応答ではなく主に細胞性応答に依存している可能性があります。個々のバリアントの間に有意な差は認められなかった。刺激後のサイトカインの絶対濃度は、補足表2に記載されている。
興味深いことに、他の刺激で誘導されるIFN-γ産生に対しても、BNT162b2ワクチン接種の重要な異種作用が観察された(図S2E、2F)。BNT162b2ワクチン接種は、TLR7/8アゴニストR848で刺激した際のIFN-γ産生を減少させた(図S2F)。一方、不活化インフルエンザウイルスによるIFN-γ産生は、2回目のBNT162b2ワクチン接種から2週間後に高くなる傾向が見られたが、その差は統計学的有意差には至らなかった。また、細胞性反応とIgG抗体価の間には有意な相関関係は見られなかった。
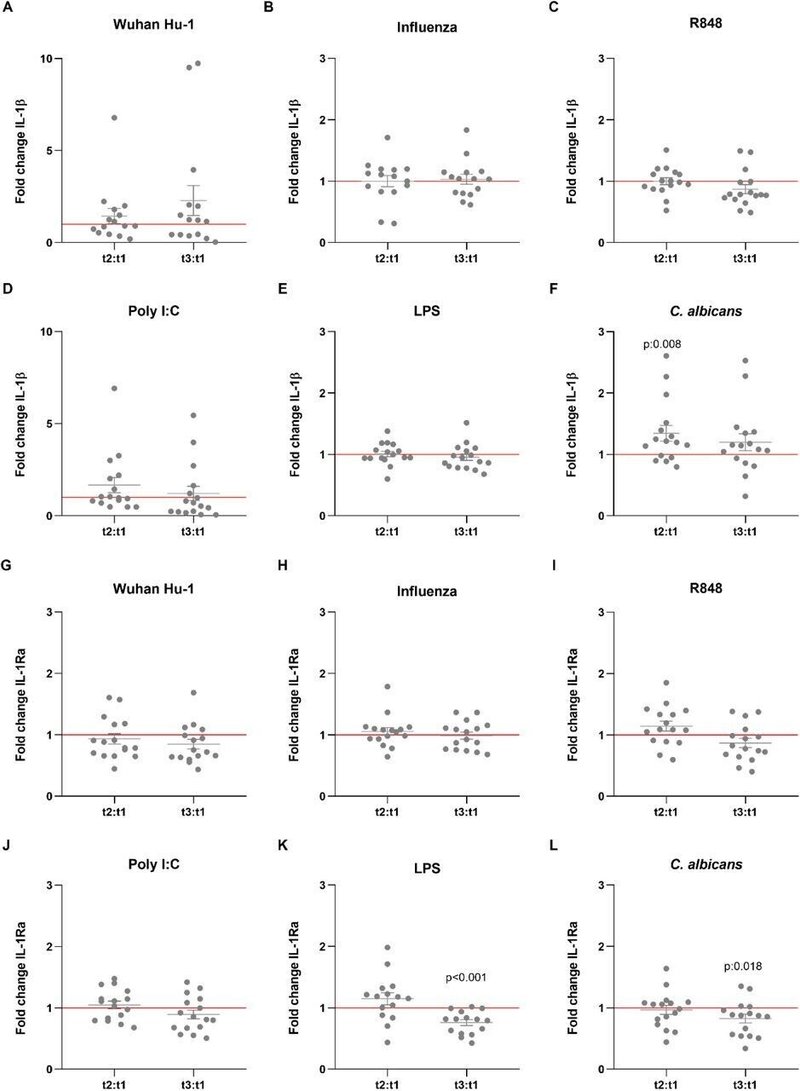
特異的(適応)免疫記憶への影響以外にも、BCG(Bacillus Calmette-Guérin)やMMR(Measles, Mumps, and Rubella)ワクチンのような特定のワクチンは、自然免疫系の細胞の長期的な機能的リプログラミングを誘発する。Netea et al., 2020)。この生物学的プロセスは、反応性の増加を伴う場合は訓練された免疫と呼ばれ、サイトカイン産生の減少を特徴とする場合は自然免疫寛容とも呼ばれる(Ifrim et al. これらの効果は主に弱毒生ワクチンで証明されていますが、我々はBNT162b2ワクチンが異なるウイルス、細菌、真菌の刺激に対する自然免疫反応にも効果を誘発するかどうかを調査しようとしました。訓練された免疫のトレードマークの一つは、二次的な傷害を受けた後の炎症性サイトカインの産生上昇である(Quintin et al., 2012)。驚くべきことに、ワクチン接種者のPBMCを標準的なSARS-CoV-2株または異種のToll様受容体リガンドで刺激すると、単球由来のサイトカインであるTNF-α、IL-1β、IL-1Raの産生量が低下する傾向が見られた(図1および2)。志願者の末梢血単核細胞をTLR7/8アゴニストR848で刺激した後のTNF-α産生量(図1B-1G)は、2回目のワクチン接種後に有意に減少した(図1C)。また、TLR3アゴニストであるpoly I:Cでの刺激後にも同様の傾向が見られたが(図1D)、その差は統計的有意差には至らなかった。一方、真菌病原体であるCandida albicansに対する反応は、ワクチンの初回投与後に高かった(図1G)。ワクチン接種によるIL-1β産生への影響はより限定的であったが(図2A-2F)、C. albicansに対する反応は有意に増加した(図2F)。抗炎症性サイトカインであるIL-1Raの産生(図2G-2L)は、2回目のワクチン接種後、細菌のリポポリサッカライド(LPS)およびC. albicansに対する反応が低下しており(図2K、2L)、これはワクチン接種後、真菌刺激に対する炎症反応が強くなる方向にシフトしたことを示すもう一つの論拠である。IL-6反応も同様に、より顕著ではないが減少した(データは示されていない)。
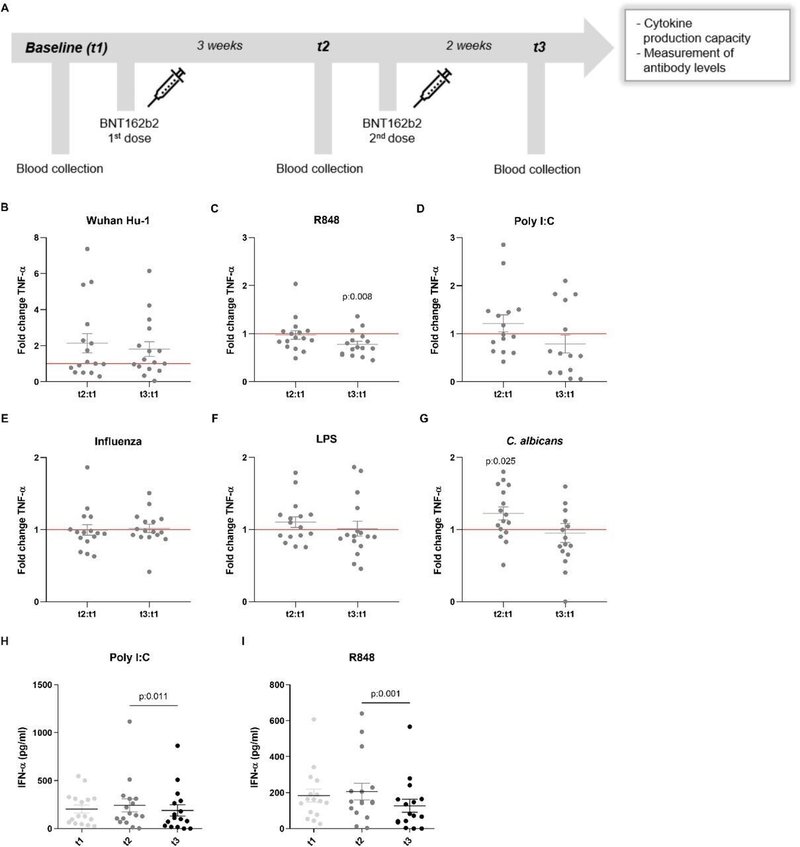
BNT162b2ワクチン接種によるTLR7/8(R848)またはTLR4(LPS)リガンドによる刺激に対する耐性の誘導は、SARS-CoV-2感染時の炎症反応がよりバランスのとれたものになっていることを示していると考えられ、このような効果が、COVID-19における潜在的な過剰炎症(主な死亡原因の1つ)を抑制するのに役立つのではないかと推測される(Tang et al.、2020年)。一方で、自然免疫反応を阻害すると、抗ウイルス反応が低下する可能性がある。また、タイプIインターフェロンは、COVID-19を含むウイルス感染症の発症と反応に中心的な役割を果たしている(Hadjadjら、2020年)。この点を考慮して、ワクチン接種後のボランティアの免疫細胞によるIFN-αの産生量も評価しました。IFN-αの濃度は、ほとんどの刺激でアッセイの検出限界以下であったが、ポリI:CとR848で刺激した後に分泌されたIFN-αの産生は、ワクチンの2回目の投与後に著しく減少したことが観察された(図1H、1I)。これは、TLR7の欠損が若い男性のCOVID-19に対する感受性を高めることが示されていることから、ウイルスに対する最初の自然免疫応答を阻害する可能性がある(Van Der Made et al.、2020)。これらの結果を総合すると、BNT162b2ワクチンの効果は適応免疫系を超えて、自然免疫応答も調節できることがわかります。
BNT162b2ワクチン接種による自然免疫応答への影響は、他のワクチンでは「ワクチン干渉」として知られているように、他のワクチン接種に対する応答を妨害する可能性も示しているかもしれない(Lumら、2010年、Nolanら、2008年、Vajo, Tamas, Sinka, & Jankovics, 2010年)。したがって、この可能性、特にインフルエンザワクチンとの相互作用の可能性を調査するために今後の研究が必要である。今後数年間(2021年秋を含む)、COVID-19ワクチンの接種プログラムは季節性インフルエンザワクチンの接種と重なる可能性があるため、COVID-19ワクチンと現在の接種スケジュールとの相互作用や影響の可能性を明らかにするために、特に免疫抑制剤を投与されている人や高齢者を対象とした追加の研究を行うことが重要である。
これらの結果の一般化には一定の制限があります。第一に,COVID-19ワクチンの効果に関する以前の免疫学的研究と同様ではあるが,本研究のボランティアの数は比較的少なかった.第二に、我々のコホートは中年で健康な医療従事者で構成されており、今後、高齢者や合併症などの重篤なCOVID-19感染症の基礎的な危険因子を持つ人々を対象とした研究を実施する必要がある(Gao et al.、2021年)。第三に、我々の研究は、西ヨーロッパの祖先を持つ個人に対してのみ行われている。自然免疫反応と適応免疫反応の誘導は、遺伝的背景、食生活、環境刺激への曝露などの異なる要因に大きく依存しており、これらは世界中のコミュニティ間で大きく異なっているため、本研究の結論は、異なる祖先や代替的なライフスタイルを持つ集団で検証されるべきである。
結論として、我々のデータは、BNT162b2ワクチンが適応免疫と自然免疫の両方に影響を及ぼすこと、そしてこれらの影響は様々なSARS-CoV-2株で異なることを示している。興味深いことに、BNT162b2ワクチンは自然免疫反応の再プログラムも誘導するので、この点を考慮する必要がある。強力な適応免疫反応との組み合わせにより、COVID-19感染時の炎症反応がよりバランスのとれたものになる可能性もあれば、ウイルスに対する自然免疫反応の低下につながる可能性もある。BNT162b2ワクチンはCOVID-19に対して明らかに防御的であるが、この防御の持続時間はまだ分かっていないので、将来の世代のワクチンにこの知識を取り入れて、防御の範囲と持続時間を改善することが考えられる。今回得られた知見は、多様な背景を持つ集団を対象としたより大規模なコホート研究を実施して確認する必要があり、また、BNT162b2と他のワクチンとの潜在的な相互作用についてもさらなる研究が必要である。
データ提供
本研究のデータはご要望に応じて入手可能です。
著者の貢献
概念設計。M.G.N, F.K.F, J.t.O, J.H., R.v.C, J.v.d.M., F.v.d.V., L.A.B.J.; 臨床研究: F.K.F.;実験的作業 J.D-A, B.G., G.K., O.B., E.S., B.L.H., G.J.O., C.G.v.K., H.D., H.L., S.A.S, M.R.; Supervision: R.P.v.R., M.I.d.J., J.D-A., M.G.N. 原稿の執筆と修正:全著者
利害関係者の申告
M.G.NとL.A.B.Jは、Trained Therapeutix社とDiscovery社の科学的創設者です。
方法
リソースの可用性
リードコンタクト
リソースや試薬に関する情報やリクエストは、リードコンタクトのMihai G. Netea (mihai.netea@radboudumc.nl)にお願いします。
入手可能な材料
本研究では、新たにユニークな試薬は発生しませんでした。
データとコードの入手
本研究で得られたデータは、ご要望に応じてご利用いただけます。
実験モデルと被験者の詳細
被験者の収集
本研究は,ヘルシンキ宣言の倫理原則を遵守して実施され,Arnhem-Nijmegen Institutional Review Board(プロトコル NL76421.091.21)により承認され,European Clinical Trials Database(2021-000182-33)に登録された。Radboudumc Nijmegenの医療従事者で,国の予防接種キャンペーンに従ってBNT162b2 mRNA Covid-19ワクチンを接種し,インフォームドコンセントを得た者が登録された。被験者(n = 16)は、26~59歳の男女で、健康な人でした(人口統計学的データは補足表1に記載)。主な除外基準には、COVID-19の病歴が含まれていた。BNT162b2の初回投与前、初回投与から3週間後(2回目の投与直前)、2回目の投与から2週間後に血清および血液を採取した。多くの参加者がBCG試験に並行して参加していたことから、過去12カ月間にBCGを接種した人の割合が高かった(56.3%)。ベースラインでSARS-CoV-2のN-抗原に対する抗体が高濃度で検出されたため、データセットから除外した人が1名いた。
ウイルスの分離と配列決定
エラスムスMCのウイルス科学部門で診断用検体からウイルスを分離し、その後、Sタンパク質の追加変異を除外するために塩基配列を決定した。D614G(BetaCoV/Munich/BavPat1/2020, European Virus Archive 026V-03883)、B.1.1.7(GISAID: hCov-465 19/Netherlands/ZH-EMC-1148)、B.1.351(GISAID: hCov-19/Netherlands/ZH-EMC-1461)。SARS-CoV-2の分離株BetaCoV/Munich/BavPat1/2020(European Virus Archive 026V-03883)は,C. Drosten教授の好意により提供された.SARS-CoV-2 Wuhan Hu-1株は、Heiner Schaal教授(ドイツ・デュッセルドルフ大学)からご提供いただきました。B.1.1.7株およびB.1.351株は、診断用検体からCalu-3肺腺癌細胞を用いて3継代で分離した。継代3回目のBavPat1、B.1.1.7およびB.1 .351の変異体を用いて、Vero E6細胞にMOI 0.01で感染させた。 01のDMEM、高グルコース(Thermo Fisher Scientific, USA, cat #11965092)に2%ウシ胎児血清(Sigma-Aldrich, Germany, cat #F7524)、20mM HEPES(Thermo Fisher Scientific, USA, cat #15630056)、50U/mLペニシリン-50μg/mLストレプトマイシン(Thermo Fisher Scientific, USA, cat #15070063)を添加したものを、加湿した5%CO2インキュベーター内で37℃で培養した。感染後72時間目に、培養上清を1500×gで5分間遠心分離し、0.45μMの低タンパク結合フィルター(Sigma-Aldrich, Germany, cat #SLHPR33RS)でろ過した。さらにウイルスストックを精製するために、培地を100kDaカットオフのAmicon Ultra-15カラム(Sigma-Aldrich, Germany, cat #UFC910008)上に移し、これをGlutaMAX(Thermo Fisher Scientific, USA, cat #51985034)を添加したOpti-MEMを用いて3回洗浄した。その後、フィルター上の濃縮ウイルスをOpti-MEMを用いて元の容量に戻し、精製したウイルスのアリコートを-80℃で保存した。感染性ウイルスの力価は、記載されているようにプラークアッセイを用いて測定し(Vargheseら、2021年)、ストックを56℃で60分間熱不活化して刺激実験に使用した。
RBDおよびSpikeタンパク質に対する抗体レベルの測定
RBDおよびSpikeタンパク質に対する抗体のレベルを測定するために、蛍光ビーズを用いたマルチプレックスイムノアッセイ(MIA)を(Fröbergら、2021年)によって以前に説明されたように開発した。三量体化モチーフGCN4と融合したSpikeタンパク質のエクトドメイン(アミノ酸1〜1,213)の安定化したプレフュージョンコンフォメーション(S-protein)と、S-proteinの受容体結合ドメイン(RBD)を、それぞれ異なる蛍光の励起スペクトルと発光スペクトルを持つビーズまたはマイクロスフィアに結合させた。血清サンプルを希釈し,抗原を結合した微小球とインキュベートした。その後、ミクロスフェアを洗浄し、フィコエリスリンを結合したヤギの抗ヒト、IgG、IgA、IgMとインキュベートしました。データはLuminex FlexMap3D Systemで取得した。平均蛍光強度(MFI)は,Bioplex Manager 6.2(Bio-Rad Laboratories)ソフトウェアを用いて,log-5PLパラメータのロジスティック標準曲線からの補間と対数軸変換により,任意単位(AU/ml)に変換した。
プラーク減少中和試験
プラークリダクション中和試験(PRNT)を行った。この試験に使用したウイルスは、エラスムスMCのウイルス科学部門で診断用検体から分離し、培養した後、Sタンパク質の追加変異を除外するために配列を決定した。D614G(GISAID: hCov-19/Netherlands/ZH-EMC-2498)、B.1.1.7(GISAID: hCov-19/Netherlands/ZH-EMC-1148)、B.1.351(GISAID: hCov-19/Netherlands/ZH-EMC-1461)。熱不活化血清は、NaHCO3、HEPES緩衝液、ペニシリン、ストレプトマイシン、1%ウシ胎児血清を添加したダルベッコ改変イーグル培地で2倍に希釈し、60μLで1:10の希釈から始めた。その後、60μLのウイルス懸濁液(400プラーク形成単位)を各ウェルに加え、37℃で1時間インキュベートした。1時間のインキュベーションの後、混合物をVero-E6細胞に移し、8時間インキュベートした。培養後、10%ホルムアルデヒドで細胞を固定し、ポリクローナルウサギ抗SARS-CoV抗体(Sino Biological社製)およびペルオキシダーゼ標識ヤギ抗ウサギIgG(Dako社製)の二次抗体で細胞を染色した。沈殿物を形成する3,3′,5,5′-テトラメチルベンジジン基質(True Blue; Kirkegaard and Perry Laboratories)を用いてシグナルを展開し、ImmunoSpot Image Analyzer(CTL Europe GmbH)を用いてウェルごとの感染細胞数をカウントした。血清中和力価は,50%以上の感染減少をもたらした最高希釈率の逆数である(PRNT50).アッセイ検証に基づき、力価が20以上の場合を陽性とした
末梢血単核細胞の分離
被験者の血液をEDTAコートチューブ(BD Bioscience, USA)に採取し、各個人から血清をサンプリングした後、末梢血単核細胞(PBMC)のソースとして使用しました。血液をCa++, Mg++を含まないPBS(1X)で1:1に希釈し(Westburg, The Netherlands, cat #LO BE17-516F)、Ficoll-PaqueTM-plus(VWR, The Netherlands, cat #17-1440-03P)を用いて密度勾配遠心分離によりPBMCを分離した。分離に使用したチューブは、より確実に分離するために専用のSepMate-50チューブ(Stem Cell Technologies, cat #85450)を使用した。細胞数はSysmex XN-450ヘマトロジーアナライザーで測定した。その後、PBMCはRecovery Cell Culture Freezing (Thermo Fisher Scientific, USA, cat #12648010)を用いて15×106/mLの濃度で凍結した。
シミュレーション実験
解凍したPBMCを、10mLのオランダ製修正RPMI1640培地(Roswell Park Memorial Institute, USA, cat # 22409031)で洗浄した。50 µg/mL Gentamicine (Centrafarm, The Netherlands), 1 mM Sodium-Pyruvate (Thermo Fisher Scientific, USA, cat #11360088), 2 mM Glutamax (Thermo Fisher Scientific, USA, cat #35050087) を含み、10% Bovine Calf Serum (Fisher Scientific, USA, cat #11551831) を補充した10mL Dutch modified RPMI 1640 medium (Invitrogen, USA, cat #22409031) で2回洗浄した後、Sysmex XN-450で細胞をカウントした。50μg/mL Gentamicine, 1mM Sodium-Pyruvate, 2mM Glutamaxを含むオランダ修正RPMI1640培地に、10%ヒトプール血清を補充した滅菌済み丸底96ウェル組織培養処理プレート(VWR, The Netherlands, cat #734-2184)でPBMC(4×105細胞/ウェル)を刺激した。刺激は、熱不活化したSARS-CoV-2 Wuhan Hu-1株(3.3×103 TCID50/mL)、SARS-CoV-2 B.1.1.7(3.3×103 TCID50/mL)、SARS-CoV-2 B.1 .351(3.3×103 TCID50/mL)、SARS-CoV-2 Bavarian(3.3×103 TCID50/mL)亜種、Influenza(3.3×105 TCID50/mL)、10μg/mL Poly I:C(Invivogen, USA, cat #tlrl-pic)、3μg/mL R848(Invivogen, USA, cat #tlrl-r848)、10 ng/mL 大腸菌LPS、1×106 /mL C. albicans。PBMCを刺激剤とともに24時間インキュベートして、IL-1β、TNF-α、IL-6、IL-1Raを検出し、7日間でIFN-γを検出した。上清を回収し、-20℃で保存した。上清からの分泌サイトカインレベルをELISAで定量した(IL-1β cat # DLB50, TNF-α cat # STA00D, IL-6 cat # D6050, IL-1Ra cat # DRA00B, IFN-γ cat #DY285B, R&D Systems, USA)。
統計解析
すべての統計解析にGraphpad Prism 8を使用した。対になったグループ間の結果は、Wilcoxonのマッチド・ペア・サイン・ランク検定で分析した。3つ以上のグループは,Kruskal-Wallis検定-Dunnetの多重比較を用いて比較した。P値が0.05未満の場合は、統計的に有意とした。グループ間の相関関係の判定にはSpearman相関を用いた。
謝辞
本研究に快く参加してくださったボランティアの方々に感謝いたします。精製されたSpikeタンパク質およびSpikeタンパク質の受容体結合ドメイン(RBD)は,ユトレヒト大学のFrank J. van KuppeveldおよびBerend-Jan Boschの好意により提供された。Y.L.はERC Starting Grant (#948207)およびRadboud University Medical Centre Hypatia Grant (2018) for Scientific Researchの支援を受けています。J.D-A.は、The Netherlands Organization for Scientific Research(VENI grant 09150161910024)の支援を受けています。M.G.N.は、ERC Advanced Grant(#833247)およびオランダ科学研究機構のSpinoza Grantの支援を受けています。
参考文献
以下割愛
DeepL翻訳ここまで。
