スパイクタンパクはDNA修復、V(D)J組換えを阻害する: Virusesに掲載された論文から
スパイクタンパクがDNA修復を阻害する事を提示した論文が発表されました。発癌物質の多くはDNAの変異原ですが、そうしたものが無くてもゲノムDNAは活性酸素などの自然な変異原に晒されています。DNA修復機構が働かなければ、変異は固定され癌の原因となります。またDNA修復機構は免疫系の遺伝子組換えにも必須です。スパイクタンパクがDNA修復を阻害するならば、コロナワクチン接種が癌や免疫不全に繋がる懸念が生じるという事です。
染色体DNAは様々な要因で損傷します。そのため細胞にはDNAを修復するシステムが備わっており、それをDNA修復機構と呼びます。DNAの損傷が正確に修復されない場合には、遺伝子配列が変化する原因となります。その代表的な病気が癌であり、癌は遺伝子変異による病気とも言えます。
正常な状態の細胞は、細胞数をほぼ一定に保つように、そして増殖し過ぎないように精密な制御を受けています。しかしDNAの変異によって細胞の増殖制御系の遺伝子に異常が生じる場合があります。癌とは増殖制御の仕組みを受けつけずに勝手に増殖を行うようになった細胞集団です。
癌を引き起こす遺伝子である癌遺伝子は元々はウイルスから見つかりました。1911年にペイトン・ラウスにより、ニワトリに癌 (肉腫) を発生させるウイルスが発見され、ラウス肉腫ウイルスと名付けられました。ラウス肉腫ウイルスはレトロウイルスです。また、このウイルスは細胞の癌化を引き起こす遺伝子を持っている事も判明しました。これが世界で初めて発見された癌遺伝子「Src」です。実は多くの動植物において癌はレトロウイルスによって感染する伝染病でもあります。例えば、猫の伝染病である猫白血病ウイルス (FeLV) は発癌性レトロウイルスで、猫の悪性リンパ腫の原因となります。ウイルス由来の癌遺伝子が発現した細胞は癌化しますが、奇妙な事にこの癌遺伝子と相同な遺伝子がヒトや動物のゲノムにも見つかりました。そういった遺伝子は癌原遺伝子 (proto-oncogene) と呼ばれます。全てのヒト細胞は癌遺伝子と相同な遺伝子を持っているにも関わらず、必ずしも癌化するわけではありません。ではそれは何故か。後に分かってきたのは、癌原遺伝子が変異する事により、制御機能を失ったものが癌遺伝子になるという事でした。
癌遺伝子と反対の機能を持つのが癌抑制遺伝子です。癌抑制遺伝子は増殖制御やDNA修復に関わる遺伝子であり、癌の発生を抑制します。代表的な癌抑制遺伝子はp53、53BP1、Rb、BRCA1、MSH2などです。このうちBRCA1、MSH2はDNA修復に関わる遺伝子であり、BRCA1は相同組換え、MSH2はミスマッチ修復に必要です。53BP1、BRCA1の変異は乳癌など、MSH2の変異は大腸癌などに見られます。このようにDNA修復は細胞癌化の抑制に必須であり、DNAの損傷が適切に修復されない事が癌の原因となります。
抗体やT細胞受容体の遺伝子はV、D、Jの3つの断片に分かれており、それぞれの断片ごとに多くの種類があります。これらの3つの断片が遺伝子組換えをする事により抗体遺伝子が完成します (V(D)J組換え)。これはいわゆる人工的な遺伝子組換えではなく、脊椎動物にもともと備わっている機能です。V(D)J組換えを触媒する主な酵素はRAG1 (Recombination activating gene 1、組換え活性化酵素1)、RAG2ですが、組換えには他にもDNA修復系の酵素が必要となります。主に必要となるのは非相同末端結合 (non-homologous end joining、NHEJ) のメンバーである多数の酵素です。こうした酵素を遺伝的に欠くヒトや動物は生まれつきの免疫不全の資質を持つ事になり、重度複合免疫不全症 (Severe combined immunodeficiency、SCID) を発症します。免疫系の遺伝子組換えにもDNA修復機構が必須です。このようにDNA修復は細胞の癌化抑制や免疫系に重要な役割を担っています。
スパイクタンパクが直接DNA修復機構を阻害し、V(D)J組換えを抑制するという研究が発表されました。
SARS-CoV-2 Spike Impairs DNA Damage Repair and Inhibits V(D)J Recombination In Vitro
Jiang and Mei, Viruses 2021
https://pubmed.ncbi.nlm.nih.gov/34696485/
SARS-CoV-2スパイクはin vitroでDNA損傷修復を阻害し、V(D)J組換えを抑制する
重症急性呼吸器症候群コロナウイルス2 (SARS-CoV-2)は,コロナウイルス病2019 (COVID-19)のパンデミックを引き起こし、公衆衛生と世界経済に深刻な影響を与えている。適応免疫はSARS-CoV-2感染症との戦いにおいて重要な役割を果たしており、患者の臨床転帰に直接影響を与える。しかし、SARS-CoV-2が適応免疫を阻害するメカニズムはまだ明らかになっていない。今回我々は、SARS-CoV-2のスパイクタンパクが適応免疫におけるV(D)J組み換えの有効性に必要なDNA損傷修復を著しく阻害する事を in vitroの細胞株を用いて報告した。そのメカニズムは、スパイクタンパクが核内に局在し、DNA修復の鍵となるタンパク質であるBRCA1と53BP1の損傷部位へのリクルートを阻害する事で、DNA損傷修復を阻害する事を明らかにした。今回の結果は、スパイクタンパクが適応免疫を阻害する潜在的な分子メカニズムを明らかにするとともに、完全長のスパイクを用いたワクチンの潜在的な副作用を強調するものである。
JiangとMeiはスパイクタンパクを発現するベクターを細胞に導入し、細胞のDNA修復及び免疫系の遺伝子組換えへの影響を解析しました。
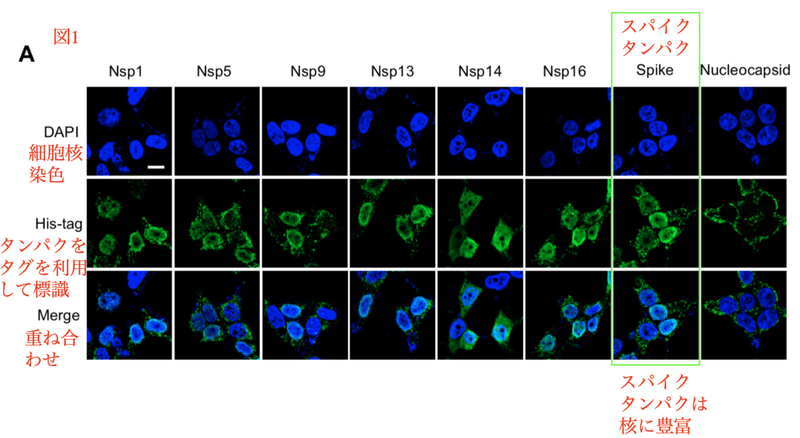
著者らはスパイクタンパクに加え、コロナウイルスの他のタンパクの遺伝子発現ベクターを細胞に導入しました。蛍光顕微鏡で観察しやすいように、これらのタンパクにはあらかじめタグがつけられています。DAPIはDNAに結合する蛍光色素であり、核を染色するためによく用いられます。
スパイクタンパクは膜タンパクであり、構造上は細胞膜上に局在する事が予測されますが、実際にはどうでしょうか。
Nsp1、Nsp5、Nsp9、Nsp13、Nsp14、Nsp16は確かに核に局在しており、ヌクレオキャプシドは細胞質に局在しています。意外な事にスパイクタンパクは核に豊富に存在する事が分かりました (図1A)。
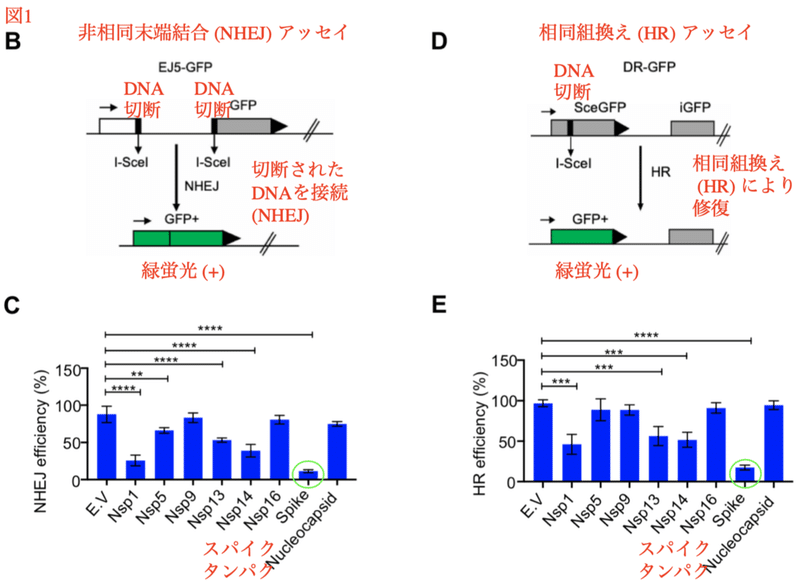
ゲノムの損傷を修復する機構が「DNA修復」です。DNA修復は「非相同末端結合 (non-homologous end joining、NHEJ)」 と「相同組換え (homologous recombination、HR) 」に大別されます。NHEJは切断された2つのDNAを再接続する仕組みで、接合部に欠失などの変異が起こりやすい事が特徴です。相同組換えは、2つの類似したDNAの間で遺伝子配列が交換される仕組みで、基本的に正確な遺伝子配列が保たれます。
図1BはNHEJのレポーターシステムです。DNA切断酵素 (I-SceIエンドヌクレアーゼ) によって生じた2つのDNA切断面が再接続されるとGFP (緑色蛍光タンパク質) が完成し、緑色の蛍光で定量化できます。
図1Dは相同組換えのレポーターシステムです。I-SceIエンドヌクレアーゼ (DNA切断酵素) によって生じた1つのDNA切断が、右のiGFPを鋳型にして正確に修復されるとGFPが完成し、緑色の蛍光で定量化できます。ちなみにここでの相同組換えは「遺伝子変換」という特殊な相同組換えで、遺伝子配列のコピー&ペーストを伴います。
興味深い事に、スパイクタンパクを過剰発現させると、NHEJが抑制され (図1C)、相同組換えも抑制されました (図1E)。このようにスパイクタンパクはDNA修復を阻害します。
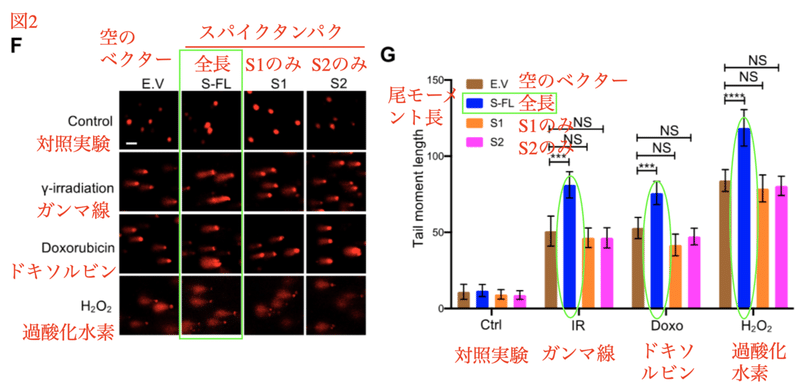
DNA修復の機能不全は遺伝子の損傷や変異に繋がります。DNAの損傷を検査する方法の1つがコメットアッセイです。染色体DNAは複雑に絡み合った高次構造を形成しますが、DNAに損傷または切断があるとDNA鎖がほぐれてある程度移動できるようになります。単細胞ゲル電気泳動法を用いて蛍光顕微鏡で観察する際に、核に当たる球形の部分から尾を曳いた彗星 (コメット) のように見える事から命名されました。長く尾を引くほどDNAの損傷が大きいと考えてください。
異なったタイプの損傷をゲノムに生じさせ、それらが修復されるのかが解析されました。γ線はDNA二重鎖切断を生じます。ドキソルビシンはDNA、RNA合成の阻害剤です。H2O2は活性酸素によりDNAを障害します。こうしたさまざまなDNA損傷処理を行ったところ、全長スパイクタンパクの存在下ではコメットアッセイの尾が長く引く事が分かりました (図2F、G) 。これらの結果はスパイクタンパクが核内のDNA修復を抑制する事を意味します。
ゲノムDNAに損傷が起きると、DNA損傷部位にDNA修復に必要なタンパクが呼び寄せられます。そういったタンパクを蛍光標識すると明るい点となって見えます。
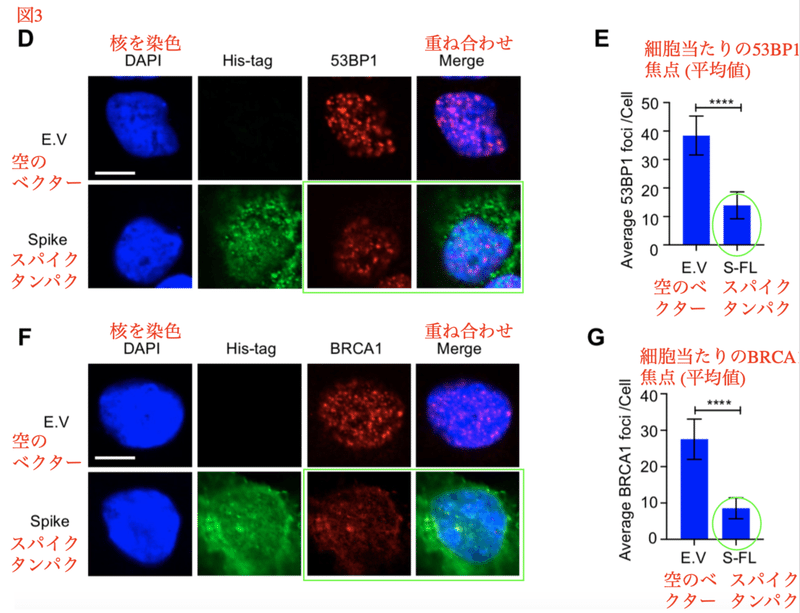
DNA二重鎖切断は細胞毒性のある損傷であり、相同組換え修復 (HR) 経路または非相同末端結合 (NHEJ) 経路のいずれかによって修復されます。NHEJはHRよりも速いが精度は低いです。この2つの経路の間で初期に分岐するステップは末端の切除であり、このステップは多くの因子によって制御されます。特にBRCA1と53BP1は2つの経路のバランスを決定する役割を果たしています。BRCA1は相同組換えによる遺伝子の修復に関わっています。53BP1は、切除を抑制し、NHEJを促進します。
スパイクタンパク質がNHEJとHRの両方の修復経路を阻害する仕組みを明らかにするために、HRとNHEJの修復にそれぞれ重要なチェックポイントタンパク質であるBRCA1と53BP1のリクルートが解析されました。その結果、スパイクタンパクは、BRCA1と53BP1の両方の焦点形成を著しく阻害しました (図3D-G)。これらのデータを総合すると、SARS-CoV-2の完全長スパイクタンパクは、DNA修復タンパク質のDNA損傷部位への集積を阻害する事で、DNA修復を抑制する事が分かります。
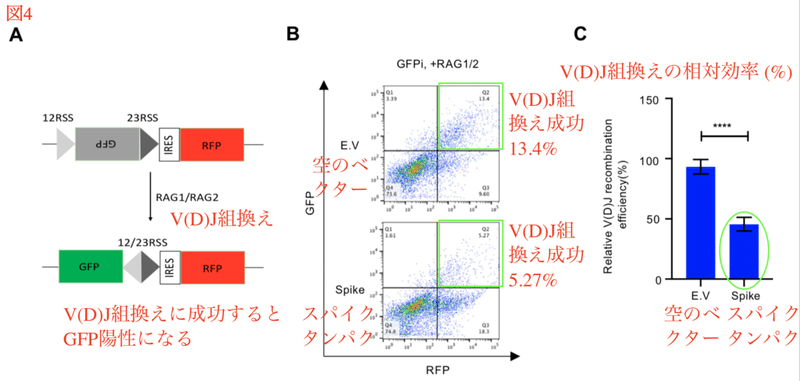
V(D)J組換えを触媒する酵素はRAG1、2であり、RAG1、2が遺伝子組換えのために認識する配列がRSS (recomibination signal sequence、組換えシグナル配列) です。V(D)J組換えの過程では2つの異なるRSS間で組換えを起こします。
スパイクタンパク質がNHEJを介したV(D)J組み換えを減少させるかどうかを検証するために、RSSを用いたV(D)J組換えレポーターシステムが利用されました。V(D)J組換えが起こるとGFP遺伝子の翻訳が活性化され、緑色の蛍光として検出されます。実際にスパイクタンパクを過剰発現させると、レポーターシステムにおいてRAGを介したV(D)J組み換えが阻害されました (図4)。
この研究により「スパイクタンパクが核内に局在しDNA修復を阻害する」という事が明らかになりました。またスパイクタンパクがV(D)J組換えを阻害するという事は、コロナワクチンが抗体やT細胞免疫形成を抑制し、免疫不全を引き起こす懸念に繋がります。さらに癌は遺伝子の病気であり、遺伝子に変異を起こす事は発癌の原因となります。
スパイクタンパクが発癌や免疫不全に与える影響は間接的なものだけでなく、スパイクタンパクそのものが発癌物質であり、免疫不全を起こす可能性が提起されています。
*記事は個人の見解であり、所属組織を代表するものではありません。
この記事が気に入ったらサポートをしてみませんか?
