脂質ナノ粒子とエンドサイトーシスについて解説しました(8月6日こびナビTwitter spacesまとめ)
※こちらの記事は、2021年8月6日時点での情報を基にされています。※
2021年8月6日(金)
こびナビの医師が解説する世界の最新医療ニュース
本日のモデレーター:岡田玲緒奈、曽宮正晴
曽宮正晴
おはようございます。
岡田玲緒奈
さて、本日金曜日はちょっとマニアックな話をしていきます。こびナビが一緒に論文やデータを書かせていただいてメンバーに入っていただいた曽宮先生に来ていただいて、脂質ナノ粒子(lipid nanoparticle:LNP)の話をしようかと思うわけですよ。どうですか? 皆さん。大丈夫ですか?(笑)
安川康介
「ダメです。トピック変えてください」って言えるんですか?
岡田玲緒奈
はい。そしたら代替案を出してください(笑)
安川康介
代替案……(笑) リンパ節の腫れ、行きます?
岡田玲緒奈
ハッハッハッハッ!
時間が余ったらリンパ節の腫れの話をしてください、安川先生。時間をあげるんで。
安川康介
ウソですウソです!(笑) 脂質ナノ粒子、すごく楽しみにしていました。よろしくお願いします。
岡田玲緒奈
それでは早速やって行きましょうかね。曽宮先生、簡単に自己紹介をしていただくことは可能ですか?
曽宮正晴
はい。大阪大学で研究者として働いている曽宮といいます。
専門はドラッグデリバリーシステム(Drug Delivery System、以下 DDS)です。薬を体の中の特定のところにデリバリーする、つまり送達する研究をやっています。まさに RNA などを小さいナノカプセルに入れて送達する実験をしているので、脂質ナノ粒子も研究で使っていますし、そのあたりを今日詳しく説明できればいいかなと思います。一歩間違えると皆さんを完全に置き去りにしてしまう可能性があるので少し不安もありますが、なるべく噛み砕いて説明できればと考えています。
岡田玲緒奈
事前に「こんなネタ」というのも聞いていたのですが、すごく面白そうですね。まさに DDS の1つと言えますので、専門ド真ん中という感じでしょうか?
曽宮正晴
そうですね。脂質ナノ粒子のすごさを今日皆さんに分かっていただければ嬉しいです。
【脂質ナノ粒子とは何か】
岡田玲緒奈
先日「一部の方は、脂質ナノ粒子 = PEG(ポリエチレングリコール)だと思っていませんか?」という話をされまして、脂質ナノ粒子とは一体何なのかという話を曽宮先生から伺いたいと思います。曽宮先生、脂質ナノ粒子とはどういうものなのですか?
曽宮正晴
脂質ナノ粒子は、モデルナ社やファイザー社のワクチンで使われているナノ粒子です。典型的には、直径50~100nmの非常に小さい脂のかたまりです。
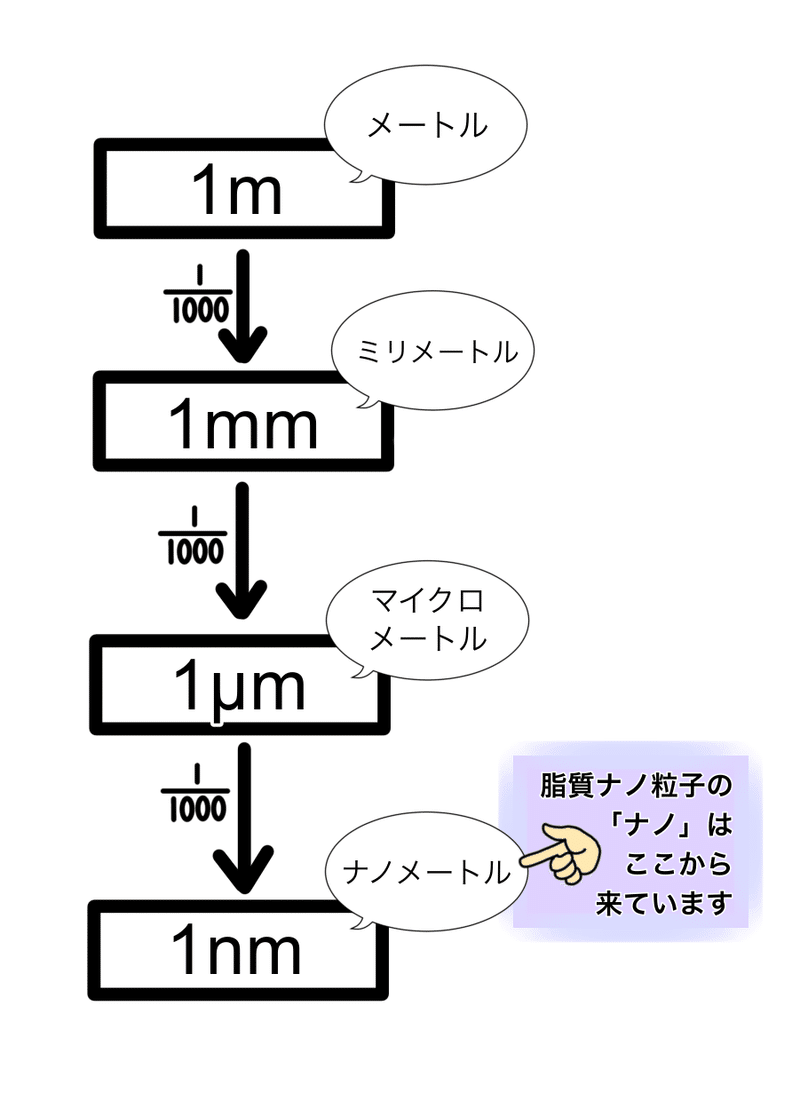
図1:単位について

図2:脂質ナノ粒子(作成:岡田)
このかたまりの中にメッセンジャーRNA(以下 mRNA)分子が数個〜10個くらい入っていると計算されています。サイズはまさにウイルスと同じくらいで、非常に小さいものです。100nmというサイズの実感がつかみにくいと思うので例えると、野球の硬式球の直径が約7cmなので、その100万分の1くらいです。
逆にちょっとわかりにくいかもしれませんが、非常に小さいということです。目にはもちろん見えないですし、光学顕微鏡では観察できません。電子顕微鏡でないと観察できないサイズです。
岡田玲緒奈
おそらく硬式球の100万分の1という話はきっと峰先生的には余計イメージが付きにくいパターンかもしれませんね(笑) 数字が苦手な峰先生😁
脂質ナノ粒子は今回の mRNAワクチンで、どういう役割をしているんですか?
【脂質ナノ粒子の mRNAワクチンにおける役割は?】
曽宮正晴
大きく分けて2つあると考えています。
① mRNA分子を守る
ワクチンの本体である mRNA分子は非常に分解されやすい性質を持っているので、脂質ナノ粒子の中に入れて分解から守る働きがあります。
② mRNA を細胞の中に届ける
より重要な役割で、mRNA を筋肉の中に投与した時に細胞の中にまで届けることで、ワクチンとしての機能を最大限に引き出すという役割があります。
脂質ナノ粒子は縁の下の力持ち的な役割を果たしますが、むしろ脂質ナノ粒子の性能自体がmRNAワクチンの性能を決めると言っても過言ではないと考えています。脂質ナノ粒子がどれくらい重要かというと、2019年5月のモデルナのブログに書いてあったことなのですが、モデルナは mRNA 自体の研究と同等か、むしろそれ以上に mRNA を送達する技術に投資をしてきました。2019年の時点で7年間に500億円以上を研究開発に投資したそうです。すさまじい額ですね。
▼Advancing the Frontiers of Our Platform Science
https://www.modernatx.com/moderna-blog/advancing-the-frontiers-of-our-platform-science-05072019
出典:Moderna blog 2019/05/07
このモデルナのブログを書いているのは社員の方だと思いますが、彼らはモデルナ自体について、mRNA の会社というよりも、mRNA の送達を開発する会社だと感じることがよくあるとブログで語っています。
mRNA そのものと同じか、それ以上に mRNA の送達技術に莫大な投資をした結果生まれてきた脂質ナノ粒子が、いま皆さんの腕の中に注射されているわけです。
岡田玲緒奈
外側の脂質ナノ粒子の部分と mRNA 自体の両方に様々な技術が入っているという認識でしたが、送達技術の方がむしろ開発上大事だったという話はイメージと違ったので、おもしろいと思いました。
さて、先ほどは mRNA の分解を防ぐ意味で脂質ナノ粒子に入れるというお話でしたが、なぜそうしないとうまくいかないかについて教えていただいてもいいですか?
曽宮正晴
先ほど説明した通り、mRNA は体内では非常に不安定な物質で、分解されやすい性質を持っています。うまくいかない理由についてですが、体内には mRNA を分解する酵素がたくさんあるからです。mRNA だけを身体の中に注射しても、簡単に分解されてしまって何も起きません。何か起きたとしても、mRNA が少ししか働かないことはよく知られています。
もう1つ、うまくいかない理由があります。mRNA が働くためには mRNA が細胞の中に到達し、それが翻訳されてスパイクタンパク質を作る必要があります。
しかし、mRNA 単独で筋肉内に注射しても、これが細胞の中にまで入る確率は非常に低いのです。つまり、mRNA が細胞の中に入ることが非常に重要なのですが、それは単独では達成できません。
ここで皆さんに生物で習ったことを少し思い出していただきます。
細胞の膜は、普通は脂質でできているのですが、非常に小さな分子を通すことができます。「分子量」という分子の大きさの単位がありますが、皆さんがよく使う普通のお薬は、この分子量が約1000以下のものがほとんどだとお考えください。1000以下の分子量のものは普通に細胞の膜を通過できて、細胞の中に入って機能できます。ファイザー/ビオンテック社の mRNAワクチンに入っている mRNA は、mRNA の長さが4284塩基といわれています。これを分子量に換算すると約137万です。
細胞膜を通る分子量は約1000以下で、1000以上になると、なかなか通過できません。ということは、約137万という大きさの mRNA は、基本的に細胞膜を通ることはできません。圧倒的に大き過ぎるからです。以上のことから、mRNA を細胞に振りかけても細胞の中を通ることができないので、普通は全然機能しないんですね。
ちなみに mRNA は基本的にひも状の分子です。mRNA の端っこと端っこを持って、ビローンとまっすぐに伸ばすと、4284塩基の mRNA の長さは約1.2μm(1200nm)になります。
脂質ナノ粒子の大きさは約0.1μm(100nm)なので、mRNA をビローンと伸ばすと脂質ナノ粒子の10倍から20倍ぐらいの大きさになるということです。逆に言うと mRNA を脂質ナノ粒子の中に包むと、1/10~1/20のコンパクトなサイズに収まって細胞の中に入りやすくなります。
この仕組みはまた後で詳しく説明しますが、ざっくり言うと、大きい mRNA をコンパクトにギュッと固めるのが、脂質ナノ粒子の役目の1つかなと思います。
【脂質ナノ粒子 その開発の歴史】
岡田玲緒奈
ありがとうございます。mRNA をコンパクトにするためにも脂質ナノ粒子が作用しているとは知らなかったので勉強になります。モデルナが mRNA の送達技術の開発に非常に力を入れてきたというお話でしたが、脂質ナノ粒子の開発の歴史を教えていただくことは可能ですか?
曽宮正晴
はい、ここからいよいよ、かなりマニアックな話になってきます。脂質ナノ粒子は最近ポッと出てきた技術ではなく、ここ20年ほどの研究の歴史があることをざっくり説明いたします。
脂質ナノ粒子の原型が論文で報告されたのは、私が知る限りは2001年、今から20年前に論文報告(Biochim Biophys Acta. 2001;1510:152-166)されました。当時は mRNA用の脂質ナノ粒子ではなく、当時話題になっていた DNA を治療に使う研究の過程で開発されました。mRNA と同様に DNA も非常に大きい分子なので、単独では細胞の中に入りません。そこで、ナノ粒子みたいなものに入れて治療に使おうと、盛んに研究が行われました。その過程で生まれたのが脂質ナノ粒子です。
当時の脂質ナノ粒子と今の脂質ナノ粒子は結構似ていて、4種類の油を混ぜてできています。
①イオン化脂質(ionizable lipid)
②PEG化脂質(ポリエチレングリコール(PEG)という高分子の末端に脂質分子を結合させた特殊な脂質)
③コレステロール
④リン脂質(Distearoylphosphatidylcholine:DSPC)
③④は補助脂質で、ごく一般的な脂質ですが、①②は化学的に合成した特殊な脂質です。
いま使われているモデルナやファイザー/ビオンテックの mRNAワクチンも、この4種類の脂質を mRNA と混ぜて脂質ナノ粒子にするのですが、2001年の時点でも基本的な構成は同じでした。さらに重要なのは、イオン化脂質の部分です。イオン化脂質とは、ある特定の条件下でイオン化する特性を持っています。この脂質は酸性の pH にさらすと正電荷を帯びます。正電荷はプラスの電荷です。
このあたりからややこしくなってきますが……。
この2001年の論文によると、DNA はマイナスの電荷を持っています。マイナスを持つ DNA と、酸性の pH でプラスになるイオン化脂質を混ぜると、マイナスとプラスが結合し、この相互作用によって小さなナノ粒子ができることが、この論文で報告されました。
つまり2001年の時点では、DNA とイオン化脂質を酸性条件で混ぜるとナノ粒子にするができる、と発表されたわけです。
2001年の論文で「脂質ナノ粒子に DNA を入れてナノ粒子ができる」と報告はされたのですが、実際にはほとんど使い物にならなかったのは重要なポイントです。
なぜ使い物にならなかったかというと、脂質ナノ粒子を細胞に振りかけると細胞の中には取り込まれるものの、DNA がうまく放出できなかったんですね。脂質ナノ粒子の技術は2001年に報告されましたが、この時点では全然使い物にならなかったのです。
岡田玲緒奈
脂質ナノ粒子から DNA が外に出られないということですか?
曽宮正晴
それに加え、後で説明するエンドソームからの脱出ができないのがもう1つの理由ですね。
岡田玲緒奈
なるほど、ありがとうございます。
曽宮正晴
どんどんマニアックになって行きますけど(笑) あと2つエピソードをご紹介します。
この2001年の報告から、脂質ナノ粒子という技術が「なんか面白そうだな」と注目され、色々な研究者が頑張ってどんどん改良していきました。脂質ナノ粒子は siRNA(small interfering RNA:短い二本鎖RNA。21~23塩基対)という長さの短い RNA の分子を治療薬として使う技術に応用され、初めて日の目を見ることになりました。
siRNA は mRNA と違い、非常に短い RNA です。siRNAは、病気の原因になる遺伝子の働きを抑えることで治療効果を得るという RNA の分子です。siRNA を治療に使うためのデリバリー技術として脂質ナノ粒子が様々に改良され、2012年に1つの完成形ができました。(Angew Chem Int Ed Engl. 2012;51:8529-8533)
この研究はアルナイラム(Alnylam Pharmaceuticals Inc.)という、siRNA治療薬を実用化するアメリカの会社が主体となったもので、特殊なイオン化脂質、DLin-MC3-DMA(dilinoleylmethyl-4-dimethylaminobutyrate)というめちゃくちゃマニアックな物質を使っています。
この特殊なイオン化脂質を使った脂質ナノ粒子が、マウスにおいて非常に効果の高い送達ができることが論文で報告されたのです。
さて、2012年の論文で脂質ナノ粒子が非常に役に立つことがようやくわかりました。
その後、アルナイラム社はこの脂質ナノ粒子を siRNA の治療薬に使いました。そしてこの薬は2018年に希少疾患である家族性アミロイドーシスという病気の治療薬として米国FDA で承認されました。翌2019年には日本でも承認されることになりました。脂質ナノ粒子を使った治療薬としては初めての承認です。
2001年 脂質ナノ粒子のプロトタイプが論文で報告される
2012年 脂質ナノ粒子の完成形ができる
2018年 脂質ナノ粒子を使用した初の治療薬が米FDA で承認される
というのが大きな流れです。
岡田玲緒奈
siRNA なので mRNA とは長さなどが全然違うのですが、siRNA を脂質ナノ粒子に入れて投与する薬は既に実用化されていたんですね。
曽宮正晴
そうです。
岡田玲緒奈
だから今回のこの mRNAワクチンは「どっから出てきたの?」という話では決してなくて、既に使われている技術としてあったのですね。お薬の名前はパチシランナトリウム(商品名:オンパットロ点滴静注)といいます。ちなみに使用経験のある先生はいらっしゃますか?
ばりすた先生
家族性アミロイドポリニューロパチーのお薬ですよね。当科(注:ばりすた先生のご専門は脳神経内科)の領域の病気なので、疑わしい患者さんに「使うかどうか」を検討するところまではあります。ただし遺伝子診断が必要な稀な病気なので、僕自身は使用経験はありませんが、(核酸治療薬として同じ脂質ナノ粒子の技術が使われているのが)パチシランナトリウムのことだと聞き「そうなんだ!」とすごく納得しまして、非常に勉強になりました。
岡田玲緒奈
コメントありがとうございます。先生方、他に何かありますか?
峰宗太郎
先へ話が進む前に、ここまでで1つ聞いておきたいことがあるんですけど、よろしいですか?
曽宮先生にお伺いしたいのですが、脂質ナノ粒子の構成成分として4つ挙げていただきました。イオン化脂質…mc3とかC12…200とか有名なものがありますが、あとは PEG化脂質とコレステロールとリン脂質ですよね。ヘルパーリピッドと言ったりもしますが。この4つに加え、今回の場合は構成成分として mRNA があり、合わせて5つの物質がありますよね。これをどう混ぜ合わせて、実際に脂質ナノ粒子(正確には mRNA含有の脂質ナノ粒子)を形成させるのでしょうか。そして、今はその大きさの規定などはどういう調製で作られているのか、簡単に教えていただくことはできますか?
曽宮正晴
めちゃめちゃマニアックな話なので興味ある人がいるか分かりませんが、峰先生のご質問なのでお答えします。
まず、これらの脂質を有機溶媒に溶かします。典型的にはエタノールなどが使われます。mRNA は、例えば水に溶かして水溶液にしておきます。この2つの脂質が溶けたエタノール溶液と mRNA が溶けた水溶液を、マイクロ流路(非常に細い管の中で液体を流す仕組み)を使って少しずつ混ぜます。流路の中で混合液が酸性に傾くと、イオン化脂質がプラスの電荷を、mRNA がマイナスの電荷を帯び、そのプラスとマイナスの粒子が混ざり合ってナノ粒子になり、脂質ナノ粒子が完成します。このマイクロ流路の液体の流れる流速などをコントロールしていくと、均一で、なおかつ50~100nmの脂質ナノ粒子ができるという仕組みです。
峰宗太郎
今ので非常にすっきりしました。我々が研究室で使うマイクロ流体デバイスの規模をスケールアップして工場で作っているという理解でよろしいでしょうか。
曽宮正晴
多分ここはめちゃめちゃ重要で、様々なノウハウがあり、大スケールで作るのは非常に難しいのですが、モデルナやファイザーはそれをなんとかやっているのではないでしょうか。
峰宗太郎
なるほど。マイクロ流体デバイスって待つのに時間がかかりますよね。だから、どうしてるのかな、なんか裏技があるのかなと疑問だったのですが、すごく腑に落ちました。
岡田玲緒奈
これ、僕もまさに聞きたかったところなのですが、4種類の脂質がこの粒子を形成する際に勝手にいい感じの割合になるんですか?
曽宮正晴
ええと…流速とかってことですか?
岡田玲緒奈
最終的に脂質ナノ粒子としての品質というか割合というか、その各脂質の割合は、どうしたらちょうど良い具合になるんでしょうか。
曽宮正晴
うーん、それはなんとも言えないのですが、多分いろいろな最適化の条件を見つけて、なるべく均一な、ちょうどいいナノ粒子ができるような混ぜ方や流速や溶液の比率等を検討した上でベストなものが使われていると思います。
ただ脂質ナノ粒子は分子ではなく粒子なので、おそらく一つひとつの脂質ナノ粒子は配合量やサイズが少しずつ異なるのですが、医薬品として許容できるポイントはきちんと品質管理されていて、比較的均一なものができているということです。
岡田玲緒奈
ありがとうございます。その部分が若干謎だったので、疑問が解消されました。
では続きまして、mRNA に繋がる部分を教えていただいてもよろしいですか?
曽宮正晴
siRNA の脂質ナノ粒子が実用化されたところまでお話をいたしました。ではこれをそのまま mRNA に使えるかというと、そうでもありませんでした。
2017年のモデルナのヒト臨床試験の論文(Molecular Therapy Vol. 25 No 6 June 2017)によると、siRNA用の脂質ナノ粒子技術は、基本的には点滴で血管内に投与する技術なんですね。mRNAワクチンのように筋肉内に投与すると、強めの副反応が出るとわかったそうです。このままでは使えないということで、mRNAワクチン用に筋肉内投与が可能な脂質ナノ粒子の開発が必要だと指摘されていました。
各社は mRNA用に様々な脂質ナノ粒子用のイオン化脂質を改良した結果、モデルナの脂質ナノ粒子に使われた SM-102 は2019年の論文(Mol Ther Nucleic Acids. 2019;15:1-11)で発表されました。またファイザー/ビオンテックの脂質ナノ粒子に使われた ALC-0315 は、論文発表自体はないものの、2017年出願の特許からその中身の情報が見られます。
おもしろいことに、この2つのイオン化脂質は、私が見た限りでは比較的構造が似ています(化学の専門家には「全然違うよ」と言われてしまうかもしれませんが)。
▼SM-102とALC-0315
SM-102
https://en.wikipedia.org/wiki/SM-102
ALC-0315
https://en.wikipedia.org/wiki/ALC-0315
Wikipedia より
別々の会社で開発されたイオン化脂質が意外に似ているのは、おそらく2社のワクチンの効果が似ていることにも繋がるでしょう。構造をよく見ると、細部に様々な研究の成果が盛り込まれているので、眺めるだけでもおもしろいというのが私の感想です。
流れを整理しますと、2001年の脂質ナノ粒子の原型から、イオン化脂質の改良、2018年の siRNA 用脂質ナノ粒子の承認・実用化、という流れにのって、mRNAワクチン用の脂質ナノ粒子が開発されたというのが経緯です。はじめは使い物にならなかった核酸のナノ粒子化技術が、基礎科学のたゆまぬ努力と改善により、ついには世界中で数億人に使われるようになっていることは、基礎研究者の私からすると非常に感慨深いです。
岡田玲緒奈
筋肉内投与で強い副反応が出るところからそれを改良するというのは、言葉では簡単に言えますが、本当にすごいことですよね。どうしたら大丈夫になるのか考えるのは難しいなと思いながら聞いていました。
曽宮正晴
これはイオン化脂質をめちゃめちゃたくさん作って、それぞれを脂質ナノ粒子化して、マウスに投与したり、いろいろな実験をして、その中から良いものを選抜し、さらに改良して…というサイクルを何回も何回も繰り返しているのだと思います。
岡田玲緒奈
いやー、すごいですね。2017年以降、4年程度で技術が確立したという理解で良いのでしょうか?
曽宮正晴
研究自体はおそらくもっと以前からやっていて、その成果が2017年に出てきたということでしょう。
岡田玲緒奈
なるほど。他の先生方何かありますか?
安川康介
曽宮先生に質問です。4つのうちの1つに PEG がついた脂質がありますよね。PEG が実際になぜ必要なのかということがまず1つ。
今回その PEG に対するアレルギー反応が起きているのではないかと言われていて、PEG に代わるもので同じような機能を持たせることが今後できるのか。以上2つをお聞きしたいです。
曽宮正晴
PEG が入っていることは非常に重要です。脂質ナノ粒子の形について少しイメージして欲しいのですが、PEG はひも状の分子で、脂の塊の周りにウニや栗みたいな感じで糸みたいなものが玉の周りにババババーッと生えているような感じです。
この「ババババーッ」の部分が PEG で、この「ババババーッ」が無いと、粒子同士がベタベタくっついちゃって、すぐに凝集しちゃうんですね。粒子の安定化という意味で、この PEG が無いと絶対安定しません。
そしてこの PEG は、通常は化学的に不活性な物質で安全なものだと思われていますが、アナフィラキシーの原因になるなど課題があります。PEG の分子を他の高分子や、より安全なものに置き換える研究は、基礎研究レベルではたくさんあるのですが、やはり PEG の性能に匹敵するものがなかなかありません。ゴールドスタンダードの PEG が最も使われているのが現状です。
安川康介
ありがとうございます。最初の野球のボールの話から始まって、めちゃくちゃわかりやすかったです。すごく面白かったです。早く文字起こしして、もう1回読みたいくらいですね。
岡田玲緒奈
峰先生、何か言いかけていらっしゃいました?
峰宗太郎
雑談ですが、僕、京都大学の薬学部出身なんですけれども、そこに半田哲郎教授という方がいらっしゃって、脂質ナノ粒子の研究ばかりやっていました。そこに所属していた私の親友からよく脂質ナノ粒子の話を聞いていたので、懐かしいなあと思いながら伺っていました。
1つだけお伺いしたいのですが、これは誰かのためにする質問ではなく、実際に興味があるんですけど、DNAワクチンを開発しようとしている方々が今いらっしゃると思います。これについて、DNAワクチン用の脂質ナノ粒子の開発というのはやはり進んでいるんですか? それとも DNA の送達はやはり他の方法でやるのが今主流になっていると考えていいんでしょうか。
曽宮正晴
はい。ちょっと難しいですね。DNA を遺伝子治療に使おうというのは、今そんなに流行っていないですよね。脂質ナノ粒子をわざわざ使わなくても、例えばウイルスベクターで結構いいもの、AAV(adeno-associated virus:アデノ随伴ウイルス) とか色々ありますし、基礎研究的にも DNA を脂質ナノ粒子に入れてやろうというのはあまり聞かないですね。
峰宗太郎
そうなんですよね。
DNAワクチンの存在意義が私もよくわからないものですから、どうやって送達しようとしてるか、エレポ(エレクトロポレーション)というデバイスを考えている人もいるようですが、今後開発されるとしても、やっぱり脂質ナノ粒子ではないということでいいですよね。
曽宮正晴
DNA の場合は、そのまま筋肉内に打ち込んでも少し発現しますし、いろんな他の物理的な、まあエレポとか、なんか圧力をかけるような方法もあって、脂質ナノ粒子をそこで使うことにあまり合理性がないのかなと思っています。
峰宗太郎
最後に、もう1つだけ質問させていただいてよろしいですか?
今この脂質ナノ粒子を使った DDS について、ワクチンや mRNA に限らずもっと大きい広い視野で、将来的に臨床応用されるような新しい薬とか治療法について、どういったものを研究者として構想されているというか、先に見えているものが何かあるのでしょうか? それがあったらお伺いしたいです。
曽宮正晴
私はいま日本DDS学会というところに所属していますが、脂質ナノ粒子はめっちゃ流行ってるんですよ。というのは、いろんなことに使えるからなんですよね。
中身の mRNA の配列を変えると様々な難しい疾患の治療にも使えるだろうし、siRNA の場合はいわゆる生活習慣病にも使えるんじゃないかとか、あとはガンの治療とか、様々な応用の仕方が考えられています。さらに mRNA を自己複製レプリコンRNA に変えると、mRNAワクチンの RNA の量を非常に少なくしても有効性が出るんじゃないかというアイディアもあります。
すごく色々な使い方が想定され、非常に注目されています。おそらく各製薬会社も、この脂質ナノ粒子の技術を使って新しい薬を作る研究を競ってやっているのではないでしょうか。
峰宗太郎
ありがとうございます。
【粒子が細胞に取り込まれる仕組み エンドサイトーシス】
岡田玲緒奈
盛り上がりますねえ。
9時5分になりました。先ほど最後でとおっしゃっていた内容がまだ残っているので、簡単にお願いいたします。曽宮先生、脂質ナノ粒子が細胞に取り込まれる仕組みについて教えていただいてもいいですか?
曽宮正晴
これ、もうマニアックもマニアックで、話をしようかどうか迷うぐらいなんですけど(笑)
簡単に言うと、脂質ナノ粒子はナノサイズの小さい粒子なのですが、そのまま細胞膜をポンと通るわけではありません。口頭で説明するのは非常に難しいのですが、細胞には「エンドサイトーシス」という細胞の外にあるものを取り込む働きがあるんですよね。
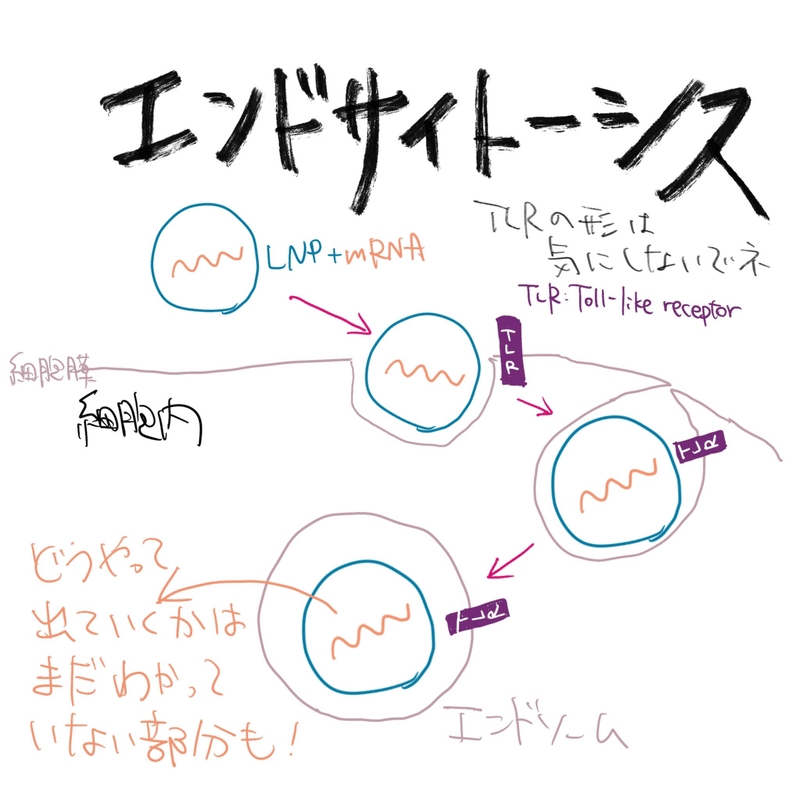
図3:エンドサイトーシス(作成:岡田)
シャボン玉をイメージしてください。例えば細胞がシャボン玉だとします。割れないシャボン玉をつついていくと、シャボン玉のつついた部分が陥没しますよね。それがそのままペコッとシャボン玉の内側に入って二重のシャボン玉になる感じです。このような仕組みで脂質ナノ粒子は取り込まれます。
エンドサイトーシスで取り込まれたものは、エンドソームという細胞の中の膜の中に包まれた状態です。めっちゃややこしいのですが、エンドソームの中は、細胞からすると外側なんですよね。だから、脂質ナノ粒子はエンドソーム内からさらに出てくる必要があります。
エンドソームというのは、いろんなものを分解する働きを持っています。中性だと pH 7 ですが、エンドソームは成熟していくと酸性になり、pH 6 とか 5 とか 4 とか、どんどん下がってきます。最初の方でお話しした通り、脂質ナノ粒子に入っているイオン化脂質は、酸性になるとプラスの電荷を持つようになります。一方、エンドソームの膜はマイナスの電荷を持っているので、イオン化脂質のプラスと細胞膜のマイナスがくっついて、エンドソームの中で脂質ナノ粒子が壊れます。そうするとエンドソームの膜も壊れて、脂質ナノ粒子の中身の mRNA が細胞の中に出てくるわけです。
まとめると、脂質ナノ粒子は細胞にエンドサイトーシスで取り込まれ、pH の低下とともに細胞内で細胞膜とくっついて、mRNA を細胞の中に放出する、という仕組みです。
簡単に説明すると言っても非常にややこしいのですが、こんな説明で大丈夫でしょうか。
岡田玲緒奈
大丈夫です。いや僕、ここが一番面白かったと言っても過言ではないです(笑)
安川康介
あと1時間ぐらい話していただけますか?
曽宮正晴
僕、今日9時半からラボの発表会があるんですよ(笑)
安川康介
あ、じゃあダメだ(笑)
岡田玲緒奈
いやー、曽宮先生、よくわかりました。僕は Twitter に後でお絵かきをしておきます。脂質ナノ粒子がどんな感じなのか、エンドソームもエンドサイトーシスも絵を描いておきますので、ご覧いただければイメージがつくかなと思います。
峰宗太郎
ちょっとマニアックな質問をしてもいいですか?
岡田玲緒奈
どうぞお願いします。
峰宗太郎
エンドソームの pH低下が起こって膜融合すると思うのですが、それでサイトゾル(細胞質基質)の中に RNA が放出されるわけですね。
僕が専門にしているものの1つが TLR、トル様受容体なんですよ。
▼用語解説
トル様受容体(Toll-like receptor:TLR)
動物の自然免疫系の細胞(マクロファージや樹状細胞など)表面にある受容体の1つ。病原体が持つ分子構造を感知し、細胞内へ情報を伝える働きを持つ。
TLR はエンドソームにのっていますが、それはやはりエンドソーム内には放出されないから、含有される mRNA はこのエンドソーム内のトル様受容体に当たるというより、サイトゾルの中の RIG-I とかに当たる方が大きいんですかね。
ちょっと生物学的になっちゃって申し訳ないんですけど。
曽宮正晴
これはめっちゃ難しい、いいポイントだと思います。脂質ナノ粒子がエンドソームの中で壊れると皆思っているのですが、実際何が起こってるかはわからないんですよね。「mRNA がサイトゾルに出ました」というのは、顕微鏡や様々なアッセイで確認できるのですが、壊れる瞬間、エンドソームの中で mRNA がニョロッと出てきてその後エンドソームも壊れるのか、エンドソームが先に壊れてサイトゾルに放出されているのか、その順番がわからないので、実際にエンドソームの中のトル様受容体に当たっているのか当たっていないのかは分からないです。
峰宗太郎
なるほど、ありがとうございます。
というのは、下流はどっちも結局のところタイプ1インターフェロンに行くんですけれども、TLR4に当たっているのか、STING-RIG 系に当たっているのかによって、どっちが優位に動いてるのか、僕が興味を持って色々なアッセイをやってみたことがあってですね。
そうか、そこがわかってないと難しいですよね。
曽宮正晴
これね、マニアックな話で、置いてけぼりになっている人めっちゃいると思います。
これ今日説明しようと思ってたんですけど、mRNA の脂質ナノ粒子に mRNA を入れて細胞に振りかけるじゃないですか。マウスに打つのでもいいですが。この mRNA の発現量と免疫原性にあまり相関がないんですよね。抗原をたくさん作るイコール免疫がたくさんできる、ではないということです。
おそらく脂質ナノ粒子の性能によって免疫の刺激の仕方が違うと思われます。ある脂質ナノ粒子では mRNA の発現量があまり高くないが免疫はめっちゃできるし、ある脂質ナノ粒子を使うと mRNA の発現量はめっちゃ高いけど免疫はあまりできない、ということがあります。
それはおそらくエンドソームでどういう動きをするか、トル様受容体にどう結合していくか、シグナルがどうなるかと繋がるんじゃないかなと思います。
これまだ全然わかってないです。
峰宗太郎
なるほど。曽宮先生の感触としてはどっちですか?
そのカーゴ(積荷)となっている脂質ナノ粒子の成分が、例えば TLR4 とか9とかでセンシングされている部分があるのか、それとも本当に放出のときのセンシングの割合ですよね。TLR3/8とかだと思うんですけど、そういう感触とか、どう考えればアッセイできそうかについてアイディアがありますかね?
曽宮正晴
多分いろんなファクターがあって、もう1つはエンドソームが壊れると、いわゆるオートファジーとか、いろんな経路が動き出すと思うんですよね。多分、そういうものの総和で免疫原性が結局どうなるかなので、「これ!」っていうのはちょっとわかんないですね。
峰宗太郎
そうですね。ただ、非常におもしろいのは、結局は脂質ナノ粒子自体がいわゆるアジュバントの働きを何らかの形でスイッチすることは、ほぼ明らかになっていると言ってもいいですよね。
曽宮正晴
それはもう間違いないと思います。
峰宗太郎
すみません、マニアックな話で。れおにい申し訳ない。
アジュバントの働きについてもう1つあるのですが、やはりアデノウイルスベクターやその他のウイルスベクターだと、細胞性免疫への刺激が強いという言い方をしますよね。
しかし mRNAワクチンも、細胞性免疫が動いている報告を見ていると、やはりアジュバントとして自然免疫をかなり刺激していると考えていいんですよね?
曽宮正晴
はい。動物実験のデータだったと思いますが、mRNA が入っていない脂質ナノ粒子をマウスに投与すると、やはり炎症のようなものが起きるらしいです。これ、アジュバントだろうと。たぶん、それは細胞性免疫を惹起するような働きに繋がるんじゃないかなと妄想しています。
峰宗太郎
僕も妄想しながらアイディアをつかみたいと思います。ありがとうございました。
岡田玲緒奈
今日は最高でしたね。この内容をここまでわかりやすく説明していただいて、なんとこの金曜の朝に「1270人の方が TLR と脂質ナノ粒子の話を聞いている」という不思議な現象が起きています。曽宮先生本当にありがとうございました。
それではもう15分延長になっておりますので、今日はこの辺りにしたいと思います。
皆さん良い連休をお迎えください。あくまで自粛が必要という状況ではありますが、ご自身や周りの方を守る行動をお願いいたします。それでは皆さんありがとうございました。
この記事が気に入ったらサポートをしてみませんか?
