IL-10-/-マウス大腸炎の表現型と微生物叢に及ぼす性差の影響
オープンアクセス論文
IL-10-/-マウス大腸炎の表現型と微生物叢に及ぼす性差の影響
https://www.mdpi.com/1422-0067/24/12/10364
著
カサド・ベドマー・マイト
,
マリリン・ロイ
そして
ヴィエノワ・エミリー
*
INSERM、U1149、炎症研究センター、パリ大学、75018パリ、フランス
*
著者宛先
Int. J. Mol. Sci. 2023, 24(12), 10364; https://doi.org/10.3390/ijms241210364
受理:2023年5月31日 受理:2023年5月31日 / 改訂:2023年6月13日 / 受理:2023年6月14日 / 掲載:2023年6月20日 受理:2023年5月31日 / 改訂:2023年6月13日 / 掲載:2023年6月20日
(本稿は、特集「消化器炎症と新たな治療標的」に属する。)
ダウンロード
図表を見る

レビュー報告書バージョンノート
要旨
性的二型性は、炎症性腸疾患(IBD)を含む様々な疾患を理解する上で重要な因子である。一般的に女性はより強い免疫応答を示すが、IBDにおける性別の役割は不明なままである。本研究では、最も広く用いられているIBDモデルマウスにおいて、大腸炎を発症する際の性差と炎症感受性を調べることを目的とした。IL10欠損マウス(IL-10-/-)を17週齢までモニターし、大腸および糞便の炎症表現型と微生物叢の変化を特徴付けた。その結果、IL-10-/-の雌マウスは、雄マウスと比較して、糞便中のmiR-21が増加し、腸内炎症がより発症しやすいこと、また、より有害な特性を持つ腸内細菌叢異常症が発症しやすいことが明らかになった。今回の研究結果は、大腸炎の病態生理における性差に関する貴重な知見を提供するとともに、実験デザインにおいて性差を考慮することの重要性を強調するものである。さらに、本研究は、適切な疾患モデルや治療戦略を開発し、理想的には個別化医療を可能にするために、性差に対処することを目的とした今後の研究に道を開くものである。
キーワード
IBD、微生物叢、大腸炎、インターロイキン-10、マウスモデル、IL-10ノックアウトマウス、雌性、性差
はじめに
様々な疾患の理解における性の重要性がますます検討されるようになってきた。性差は、正常な状態でも病的な状態でも、生理学的プロセスを調節する役割を担っている [1] 。抗原に対する自然免疫反応と適応免疫反応において、男性と女性の間に顕著な違いがあることを裏付ける科学的証拠がある。女性は感染症に対してより強い免疫反応を示し、ワクチン接種に対してはより強固な抗体反応を示す [2]。このような免疫反応の亢進により、メスはオスよりも効率的に病原体を排除することができる反面、自己免疫疾患や炎症性疾患にかかりやすくなる。一般に、自己免疫疾患に罹患する患者の約80%は女性である [3]。
免疫機能における性差は、炎症性サイトカインの産生、分泌、作用の性差によって部分的に説明できるかもしれない。インターロイキン10(IL10)は、最も重要な免疫調節性サイトカインのひとつと考えられており、炎症性反応の制御と消失に重要な役割を果たしている。特に消化管においては、IL10は大腸炎の発症と密接に関連している [4] 。生体外での免疫細胞の反応性に性差があることを示した研究もある [5] 。例えば、リポ多糖(LPS)で活性化した後の男性の末梢単核球(PBMC)によるIL10の分泌は、女性に比べて有意に低い [5]。他の状況では、性差はサイトカイン濃度の差では説明できない。興味深いことに、最近の研究では、男性の免疫細胞はIL10の抗炎症作用に対する反応性が高いことが示されている [6]。IL10のin vivoでの役割を評価するために、IL10欠損マウスを用いた多くの研究が行われてきた。IL10ノックアウトマウス(IL-10-/-)は、免疫調節経路の研究に頻繁に用いられている。さらに重要なことに、これらの動物は、広範な粘膜過形成、陰窩膿瘍、潰瘍、ムチンの枯渇、腸壁の肥厚を特徴とする自然腸炎を発症することが知られている[7]。このように、IL-10-/-マウスは、炎症性腸疾患(IBD)などのヒト消化管疾患の病態解明に用いられる最も一般的な動物モデルである。
IBDは、重篤な慢性腸炎と腸内細菌叢のバランスの乱れ、いわゆるディスバイオーシスによって特徴づけられる。これらの疾患の病因はいまだ不明であるが、現在のパラダイムでは、遺伝的・環境的要因、マイクロバイオーム異常症、腸内細菌叢に対する免疫応答の悪化が複合的に作用して発症が促進されると考えられている [8] 。憂慮すべきデータによると、IBDの有病率は上昇し、患者のQOLに影響を及ぼすと同時に、社会の経済的負担となっている [9] 。個別化医療の時代が到来し、新たな治療選択肢が与えられる中、患者の性別を考慮した治療を行うことが適切と思われる。IBDにおける性特異的な特徴は乏しく、矛盾しているが、いくつかの研究では、ATG16L1の一塩基多型が女性でより頻繁に発見されることに関連した発病の違い [10] 、発症、治療感受性が異なることが報告されており、男性では抗TNF薬に対する反応性が低下する一方、女性では副作用がより多く発現することが報告されている [11] 。女性におけるIL10プロモーター多型は、この抗炎症性サイトカインの産生低下と関連しており、若くしてIBDに罹患しやすくなっている [12] 。
免疫反応への明らかな影響に加え、腸内細菌叢と環境および宿主との相互作用を考察する際に、性別が重要な因子であることが示唆されている。中でもOrgらは、雌雄間の腸内細菌叢組成の違いを部分的に性ホルモンが媒介することを示した [13] 。
IL-10-/-マウスは実験的大腸炎モデルとして研究に広く利用されているにもかかわらず、IL-10抗炎症経路反応における性差と微生物叢への影響についてさらに調査・検討する必要がある。現在のところ、IL-10-/-マウスの表現型における性差は未解明のままであり、このことはこのIBDモデルの理解と大腸炎研究への影響における重要なギャップとなっている。我々は、IL-10-/-マウスの大腸炎表現型における基本的な性差を明らかにした。雌性マウスは雄性マウスに比べて腸炎を発症しやすく、これには微生物叢組成の明確な違いが伴っていた。特に、メスマウスの微生物叢は、バクテロイデーテス門が多く、ファーミキューテス門が少ないなど、有害な表現型と一般的に関連する特徴を示した。この結果から、動物実験では性特異性を考慮して性別を選択することが重要であることが明らかになった。結果
2.1. 雌性IL-10-/-マウスは雄性よりも重症の大腸炎を発症する。
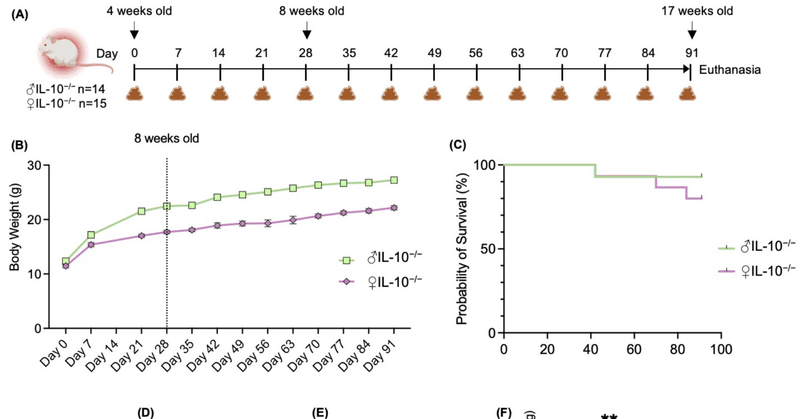
この研究で検証しようとした中心的仮説は、IL-10-/-マウスのマウスモデルで発症した大腸炎の表現型に性別が関与しているかどうかということであった。リンパ球、活性化マクロファージ、好中球の大量浸潤を伴う慢性腸炎を自然発症することが知られているIL-10-/-マウスを用いた[7]。合計29匹のIL-10/-マウス(雄14匹、雌15匹)をベースライン(4週齢)から13週間モニターした(図1A)。週に1回、糞便を採取し、体重を記録し(図1B)、生存率を記録した(図1C)。予想通り、オスはメスよりも体重が増加した(平均:♂14.9g対♀10.7g)。しかし、生後17週間の生存率は、メスの方がオス(92.8%、最終n=13)よりわずかに低かった(80%、最終n=12)。胃腸器官を採取したときの一般的な検査では、メスでより重度の炎症が巨視的に観察された。結腸の長さ(図1D)は有意に減少し、結腸重量/長さの比(図1E)はメスでわずかに増加した。脾臓重量/体重比(図1F)は、マウスの全身性炎症のマーカーとして広く用いられ、最近ではIBD患者の疾患活動性と関連することが示されている[14]が、IL-10-/-マウスの雌で有意に増加していた。
図1. 雌性IL-10-/-マウスは、巨視的に定量可能な、より重篤な大腸炎を発症した。(A) インターロイキン10ノックアウト(IL-10-/-)マウスの雌(♀)と雄(♂)を13週間モニターした実験デザインの模式図。糞便と(B)体重を1週間ごとに採取し、(C)生存率を算出した。D)結腸の長さ、(E)結腸の重量/長さの比、(F)脾臓の重量/体重の比。データは平均値±SEMで表した。統計解析はMann-Whitney U検定を用いて行った。有意差は** p < 0.01として記録した。
主に好中球から分泌される炎症の動的マーカーとして知られる糞便中リポカリン-2の測定を、非侵襲的な方法として用いて、すべてのマウスで大腸炎の発症を経時的に確認した(図2A)。遺伝子改変マウスは、8週齢で腸炎の発症を示し、12週齢になるまでに腸炎は増強し、その持続活性は最大に達した。IL-10-/-マウスは17週齢で安楽死させ、炎症マーカーの量によって特徴付けた。図2B-Eに示すように、腸の炎症は雌マウスでより重篤であった。腸炎症における性差は、主に好中球に発現する顆粒球浸潤の炎症マーカーであるMPO(図2B)の測定によって確認された。RT-qPCRによるサイトカインの解析では、IL-10-/-雄に比べてIL-10-/-雌マウスではTNF(図2C)、IL1β(図2D)、IL6(図2E)、TGFβ(図2F)の産生が増加していた。
図2. 炎症マーカーの分子生物学的研究により、IL-10-/-マウスの雌(♀)は雄(♂)よりも侵攻性の大腸炎を発症することが示された。(A)経時的に測定した糞便中リポカリン-2レベル。(B)ミエロペルオキシダーゼ(MPO)、(C-F)腫瘍壊死因子(TNF)、インターロイキン(IL)1β、IL6、およびTGFβのレベルは、比色アッセイとRT-qPCRによって大腸サンプルで測定した。データは平均値±SEMで表した。統計解析はMann-Whitney U検定を用いて行った。有意差は* p < 0.05として記録した。
H&E染色と組織学的検査の結果、大腸組織間に顕微鏡的な差は認められなかったが(補足図S1)、今回の所見を総合すると、IL-10-/-の雌では雄に比べてグレードの高い炎症が存在することが示された。
2.2. IL-10-/-マウスの大腸炎は性特異的な微生物叢の変化を起こす
メスではより攻撃的な炎症表現型が観察され、微生物叢の組成と機能に関する炎症[15,16]と性依存性[13,17]の両方が報告されていることから、大腸炎の発症過程で微生物叢がそれぞれの性でどのような影響を受けるかを評価した。まず、試験期間中の糞便中のLPSとフラジェリンの量を測定した。LPSはグラム陰性菌の外膜の主要成分であり、フラジェリンは鞭毛の構造成分である。これらの細菌成分は大腸炎関連微生物叢で一般的に増加し、運動性細菌の濃縮レベルと関連している [15,18]。興味深いことに、LPSとフラジェリンの糞便中量(図3A)は、男性では有意に増加し、女性では減少するという正反対の進化を示し、微生物叢の機能的パラメータにおける性差依存性の不一致を示した。さらに、雄のIL-10-/-マウスのBray-CurtisマトリックスのPCoAに続いて16S rRNA配列決定後の微生物叢を解析したところ、微生物叢が徐々に変化し、進化していることが明らかになった(図3B、左のグラフ)。対照的に、雌性IL-10-/-マウスでは、大腸炎前(D0)、軽症大腸炎(D42)および重症大腸炎(D91)において、非常に顕著な微生物叢のシフトがみられた。また、時間群内または時間群間のサンプル間距離の解析から、メスの微生物叢組成はオスよりも重度の大腸炎中(D91 vs. D0)に有意に影響を受けることが示された(図3C)。
図3. 大腸炎に伴うディスバイオーシスは、IL-10-/-マウスの雌では雄に比べてより悪化した。(A)TLR4HEK細胞を用いて測定した糞便中のリポ多糖(LPS)とTLR5HEK細胞を用いて測定したフラジェリンは、雌(♀)と雄(♂)の間で経時的に乖離していた。(B)主座標分析(PCoA)と(C)0日目、42日目、91日目の16S rRNA遺伝子配列決定で評価したIL-10-/-マウス微生物叢のオスとメスのBray-Curtisマトリックスの距離分析。 D)ファーミキューテス/バクテロイデーテス比はメスでより大きく変化し、その結果、(E)オシロスピラ属が顕著に減少し、(F)リケネラ科が増加した。(F)目レベルでの分類学的まとめ。(G)最も顕著な変化を示した種、Akkermansia muciniphilaを強調。棒グラフと線形グラフでは、値は平均値±SEMで示されている。バイオリンプロットでは、中央値±四分位数を示した。統計分析は、二元配置分散分析(ANOVA)検定と、それに続くボンフェローニ・ポストホック検定を用いて行った。有意差は、0日目(D0)と比較した場合、* p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001、各時点で雌と雄を比較した場合、# p < 0.05, ## p < 0.01, #### p < 0.0001として記録した。
次に、分類学的解析の結果、腸内恒常性の正常な維持に重要な影響を及ぼすと広く認められているファーミキューテス門/バクテロイデーテス門の比率は、IL-10-/-マウスのメスでは、軽症および重症の大腸炎時に有意に低下し、D42およびD91ではオスのそれよりも有意に低かった(図3D)。Oscillospira属は固形化菌の減少に大きく寄与し(図3E、左)、RikenellaceaeはBacteroidetesの増加に最も大きく寄与した科であった(図3E、右)。驚くべきことに、これらの細菌のそれぞれの減少と増加は、IL-10-/-マウスの雌で雄よりも有意に顕著であった。
さらに、微生物叢の相対存在量を目レベルで解析したところ、メスのIL-10-/-マウスではVerrucomicrobiales(図3F)が経時的に明らかに増加しており、これはAkkermansia muciniphilaという種が非常に有意に増加していることと対応していた。種レベルでの相対的存在量の分類学的パネル全体は補足図S2にある。この観察から、微生物叢がIL-10-/-マウスの大腸炎表現型に性差をもたらす可能性が示唆された。
2.3. 糞便中miR-21の発現は性差に影響される
IBDの最新の研究では、miRNAが宿主と微生物叢の両方の制御に重要な役割を果たしている可能性のある新しい因子として研究されている[19]。我々のグループは以前、IL-10-/-マウスにおいて、糞便中のmiRNAシグネチャーが微生物叢の炎症潜在性と関連していることを明らかにした [16]。同定された変化したmiRNAのうち、miR-21は大腸炎の存在下で有意に変化していることがわかった[20]。そこで、このmiRNAの糞便中レベルを大腸炎発症前と発症中に測定したところ、メスのIL-10-/-マウスでのみ糞便中miR-21の増加が観察された(図4A)。さらに興味深いことに、miR-21の糞便レベルは重症炎症の予測マーカーとなった(図4B)。大腸組織ではこのmiRNAの性差は認められなかったが(図4C)、メスのIL-10-/-マウスではmiR-21の量が巨視的な大腸の炎症と正の相関を示した(図4D)。miR-21を含む糞便中のmiRNAは、特定の微生物叢のメンバーと相関するという我々の以前の報告[16]を考えると、我々のデータは、IL-10-/-マウスの大腸炎表現型の出現において、両方の作用因子が性差を引き起こしている可能性を示唆している。
図4. miR-21の発現は、IL-10-/-雄(♂)ではなく雌(♀)の大腸炎症と関連していた。(A)IL-10-/-マウスの大腸炎発症前と発症後、それぞれ5週齢と17週齢の便から糞便中のmiR-21相対量を測定した。(B)最も有意な相関を示した2つの変数、大腸炎前の糞便中miR-21相対存在量と大腸炎中の大腸ミエロペルオキシダーゼ(MPO)量との間の線形回帰は、変数間に有意な関係を示し、雄と比較して雌では逆であった。(C)大腸炎中のmiR-21の大腸相対量は、(D)大腸重量/長さ比と相関した。ドットプロットは平均値±SEMで示した。統計解析はMann-Whitney U検定を用いて行った。有意差は*** p < 0.001として記録した。F検定は相関の有意性を決定するために用いた。雌雄間の傾きと交互作用の差を検定し、有意差として示した。考察
性的二型性は、心血管疾患[21]、骨粗鬆症[22]、自己免疫疾患[23]などの多くの一般的な疾患で観察される一般的な特徴である。女性が男性に比べて強い免疫応答を示すことはよく知られている [2]。近年、IBDの発症と進行における調節因子としての性別の役割の可能性が認識されつつあるが、利用可能なデータではまだ結論が出ていない。本研究では、IL-10-/-マウスの性差を特徴づける適切な資料が不足していることから、IBDのマウスモデルで発症した大腸炎の表現型に性別が関与しているかどうかを検証することを目的とした。
17週齢までの雌雄のIL-10-/-マウスを観察した結果、雌のIL-10-/-マウスの方が、重症の大腸炎や腸内異常症を起こしやすいことが示された。このように、本研究は、IL10欠損が腸内炎症発症時に性特異的な免疫および微生物の変化を引き起こすことを実証した(補足図S3)。これらの知見は、大腸炎の病態生理における性差に関する新規かつ重要な洞察を提供するものであり、in vivoの実験デザインにおいて考慮されるべきものである。我々の知る限り、IL-10-/-マウスの大腸炎発症における性差の特徴を初めて明らかにした。
IL10欠損マウスの最初の世代は、Werner Muller博士によってIL10tm [1]Cgnの突然変異によって作製された[7]。1993年、このグループはIL10-/-マウスを作製し、雌雄の区別なく、成長遅延、貧血、広範な粘膜過形成を伴う腸炎、炎症反応、上皮における主要組織適合性複合体クラスII分子の異常発現を報告した[7]。それ以来、これらのIL10ノックアウトマウスはIBDのマウス実験モデルとして最も使用されており、いくつかの免疫病態について広く研究されている。病態を確認するために、我々はIL-10-/-マウスの消化管臓器を採取し、研究した。巨視的マーカー(図1D-F)と分子マーカー(図2A-F)の両方を測定し、17週齢のオスと比較してメスでは一貫して炎症がより重篤であることを明らかにした。我々の結果を支持するように、TsoらはIL-10-/-マウスにおいて性差に依存した代謝プロファイルを示し、これらが腸炎症の発症と重症度に関与していると仮定した。実際、著者らは、雌マウスでは雄マウスに比べて腸の炎症がより深刻であることを報告しているが、それは組織学的傷害スコアと大腸インターフェロン-γ(IFNγ)分泌によるものであった。同様の性差は、あまり用いられていないIBDモデル129 Rag2-/-マウスでも報告されている [24]。しかし、このシナリオでは、ヘリコバクター・ピロリの同時感染により雄の大腸炎症反応が亢進し、雌に比べてより重篤な大腸炎と異形成が生じた [24]。非侵襲的な炎症マーカーとして用いられた糞便中リポカリン-2濃度(図2A)は、雌雄間で有意差を示さなかったことに注目しなければならない。Gondim Prataらが以前に示したように、リポカリン-2は好中球の存在だけでなく腸細胞の損傷も反映する可能性がある[25]。
大腸炎の罹患率や重症度に見られる表現型の変異の一部は、免疫学的性差によって説明できるかもしれない。Gunasekeraらは最近、IL-10-/-マウスにおける大腸炎の発症がIL-22に依存していることを明らかにした [26] 。IL-17Aとともに、これら2つの分子は、腸内病原体から身体を守るための自然な抗菌性防御を制御している [28]。Gunasekeraらの研究は、16週齢から20週齢のIL-10-/-雄マウスのみを用いたものであるが、雌マウスの肝臓では雄マウスに比べてIL-22の産生が有意に亢進していることが報告されている[29]。興味深いことに、テストステロンは雌の肝臓におけるIL-22産生を制御しているようであり[29]、性差に依存した免疫抑制作用を演じている[30]。一方、エストロゲンは、炎症と自己免疫疾患において複雑な役割を担っており、エストロゲン受容体β(ERβ)を介して、消化管機能に関与している可能性を示唆する実験的証拠もある。Goodmanらによって示されたように、デキストラン硫酸ナトリウム(DSS)で処理した雌性ERβノックアウトマウスは、雄性マウスと比較して腸炎症のリスクが低い [31] 。さらに、ヒトを対象とした研究でも、ERβの発現とIBDの臨床症状との関連が指摘されている。活動性の疾患患者では、寛解期の患者や健常対照群と比較して、末梢免疫細胞におけるERβの発現が低かった [32] 。この研究では、年齢や性別による差は評価されていないことは注目に値する [32] 。
腸内細菌叢は宿主の免疫系と相互作用していることから、腸内細菌叢組成の性差が免疫応答に観察される格差と関連していると考えるのは妥当である。実際、幼少期の微生物曝露が性ホルモンレベルを決定し、遺伝的リスクの高い個体における自己免疫疾患の運命を制御し、自己免疫常在微生物群集への進行を修飾することが研究で示されている [17] 。さらに、思春期における腸内細菌叢の性差の出現は、性ホルモンが腸内細菌叢の組成形成に寄与している可能性を示唆している。去勢によりアンドロゲン源を除去すると、腸内細菌叢のプロフィールは雄マウスではなく雌マウスに類似するようになる[33]。ここで我々は、より攻撃的な炎症表現型を示すメスは、オスに比べて糞便中のLPSとフラジェリン量が逆の傾向を示すことを見出した(図3A)。微生物叢の解析から、男女間で組成と機能に明確な変化があることが明らかになった(図3B-G)。雌は雄に比べ、重症大腸炎中の微生物叢組成の変化がより顕著であった。腸のホメオスタシスに重要なファーミキューテス/バクテロイデーテス比(図3D)は、軽度および重度大腸炎のいずれにおいても雌性で減少し、その主な原因はファーミキューテスOscillospiraの減少とバクテロイデーテスRikenellaceaの増加であった(図3E)。Sonら[34]は、IL-10-/-マウスのオスとメス(Orient Bio Inc.) 著者らはまた、メスマウスにおけるプロテオバクテリア門の増加についても述べているが[34]、これは検出されなかった。この違いは炎症状態の違いによって説明できるかもしれないが、著者らは炎症に関するデータを報告していない。研究間のもう1つの明らかな違いは、動物の年齢である(8週齢[34]と17週齢)。興味深いことに、42日目に測定されたオスとメスの細菌集団の間に検出された差は、91日目では有意差はなかった。リポカリン-2の測定値から推定すると、炎症は42日目では91日目ほど悪化していなかった(図2A)。このことから、メスでは炎症に先立ち、より重要な形でディスバイオーシスが起こっている可能性が示唆される。91日後、雌雄ともに重度の慢性炎症がみられ、微生物叢の安定化に影響を及ぼしている可能性が考えられた。さらに、メスマウスではVerrucomicrobiales、特にAkkermansia muciniphilaが有意に増加していた。これらの知見は、IL-10-/-の大腸炎表現型に観察される性差を引き起こすのに、微生物叢が一役買っている可能性を示唆している。注目すべきことに、Akkermansia muciniphilaは、糖尿病、肥満などの代謝経路を調節することにより、重要な抗炎症的役割を果たすことが報告されている[35,36,37]。とはいえ、その複雑な役割はまだ精査中である。例えば、便秘を主徴とする過敏性腸症候群(C-IBS)患者では、我々の雌マウスのようにアッカーマンシア・ムチニフィラの相対量が増加し、驚くほどの抗炎症作用が認められる[38]。我々の研究と同様に、Sereginら [39]は、Akkermansia muciniphilaがIL-10-/-マウスにおいて腸の炎症を誘発することを報告している。著者らは、この現象は宿主の正常な微生物群に対する免疫寛容が疾患の背景で破壊され、アッカーマンシア・ムチニフィラが常在微生物から遺伝的に脆弱な宿主の大腸炎発症を促進する病原性微生物に変化したためであるとした[39]。
プロバイオティクスを用いた研究では、メスマウスとオスマウスで炎症反応が異なることが示されている。例えば、ストレスを与えた雌ラットにラクトバチルス・ファルチミニスを投与すると、大腸粘膜の肥満細胞数と炎症性サイトカインレベルが有意に減少した [40]。同様に、マイコバクテリウム感染マウスにおいて、サイトカイン反応、腸内代謝プロファイル、腸内細菌叢の観点から、プロバイオティクスであるラクトバチルス・アニマリスNP-51の投与に対する反応の性差が観察された[41]。とはいえ、腸内細菌叢の構成に及ぼす性別の影響 [42] は、宿主の遺伝子型に左右される可能性があることが研究で示されている [13]。
現在、疾患における性差を媒介するmiRNAの関与は、控えめな研究のまま注目されておらず [43]、従来の分析では、性に特異的な調節異常miRNAの存在を認めていない。それにもかかわらず、エストロゲンは様々な細胞内において多数のmiRNAを制御することが示されている [44]。さらに、X染色体には、多様な生理学的プロセス、特に免疫機能において重要な役割を果たすmiRNAが多数含まれている [45] 。したがって、miRNAがIBDの有病率、進行、転帰における性特異的反応に寄与していることはもっともである。我々の知る限り、IBDの文脈における糞便中miR-21の性差発現を調べた報告はない。私たちの以前の研究では、IL-10-/-マウスにおいて、微生物叢の炎症潜在性に関連する明確な糞便中miRNAシグネチャーを同定した[20]。発現の変化を示したmiRNAのうち、miR-21は大腸炎の存在下で有意な影響を受けていた[16]。ここで、糞便中のmiR-21のレベルを重症大腸炎前および重症大腸炎中に測定したところ、メスのIL-10-/-マウスで特異的に有意な増加が観察された(図4A)。注目すべきことに、糞便中miR-21レベルは重症炎症の予測マーカーとして機能した(図4B)。大腸でのmiR-21発現に性差は認められなかったが(図4C)、メスのIL-10-/-マウスではmiR-21レベルと巨視的な大腸炎症との間に正の相関が認められた(図4D)。これらの所見は、miRNAの作用における潜在的な性的二型性の概念を支持するものである。私たちの性差の所見を裏付けるように、癌の分野で行われた研究では、癌のステージに依存したmiRNAと特定の性別との相関が証明されている:女性ではmiR-24、男性ではmiR-17とmiR-20である[46]。腎移植患者の長期腎機能に焦点を当てた最近の研究では、女性患者が有意に悪い転帰を示し、その転帰は異なるmiRNAプロファイルと関連していることが判明した [47] 。最近の研究では、便中miRNAの発現レベルを、他の要因の中でも特に性との関連で評価し、便中発現が性間で異なる9つのmiRNAを同定した[48]。今回の知見と合わせると、これらはマウスやヒトにおけるmiRNAに基づく研究において、交絡因子となりうる性別の重要性を示唆している。
全体として、大腸炎モデルマウスを用いた本研究は、マウスおよびIBD患者における大腸炎発症の性差の理解に大きく貢献する可能性がある。げっ歯類系の目的は、ヒトを対象とするよりも実験的に管理しやすく、性別などの変数間の因果関係を立証できることである。しかし、動物とヒトの性差を説明する根本的な生物学的メカニズムは保存されているにもかかわらず、マウスで得られた知見がそのままヒトの性差に反映されると先験的に仮定すべきではない。従って、動物実験から生じた性による病態の悪化について新たに同定された概念は、ヒトにおいて検証される必要がある。材料と方法
4.1. マウス実験と飼育
インターロイキン-10ノックアウトマウスまたはIL-10 KOマウス(IL-10-/-)をJackson laboratoryから購入し(B6.129P2-IL10tm [1]Cgn/J, Strain #:002251)、社内で飼育した。社内で繁殖させた4週齢のIL-10-/-マウス29匹(雄14匹、雌15匹)を、温度(25℃)および光周期(12:12時間の明暗サイクル)を制御したSPF条件下で17週齢まで飼育した。マウスは無作為に雌雄4-6匹の群に分けられ、餌と水を自由に摂取できるようにした。動物倫理委員会(APAFIS#23855-2020012916328162, Paris, France)の承認を得た。マウスは13週間連続モニタリング後(91日目)に安楽死させた。模式的な実験計画を図1Aに示す。
4.2. サンプルの採取と調製
7日ごとに体重と新鮮な糞便サンプルを採取し、さらなる分析を行った。炎症の巨視的証拠は、結腸長、結腸重量、脾臓重量を測定することで評価した。以下に詳述するように、さらなる分析のために大腸サンプルを採取した。
4.3. 糞便上清の調製
糞便サンプルをリン酸緩衝生理食塩水(PBS)で最終濃度 100 mg/mL に調整し、15 分間ボルテックスした後、14,000×g 4 °C で 10 分間遠心した。糞便上清を回収し、連続希釈し、さらに使用するまで-80℃で保存した。
4.4. ELISAによる糞便リポカリン-2の定量
あらかじめ処理した糞便上清中のリポカリン-2を、マウスリポカリン-2/NGAL ELISAキット(R&D Systems, Minneapolis, MN, USA)の製造者の指示に従って測定した。光学濃度は450nmで読み取った(VersaMaxマイクロプレートリーダー、Molecular Devices、San Jose、CA、USA)。
4.5. 大腸ミエロペルオキシダーゼアッセイ
好中球の酵素であり炎症のマーカーであるミエロペルオキシダーゼ(MPO)の活性は、既報の通り分析した [49]。遠位結腸組織を、50 mM PBS (pH 6.0)で希釈した0.5% hexadecyltrimethylammonium bromide (Sigma-Aldrich, Saint-Quentin-Fallavier,France)中50 mg/mLで機械的にホモジナイズし、超音波処理し、凍結融解を3回行い、14,000 rpm 4℃で15分間遠心分離した。回収した上清(50μL)を、1mg/mLのジアニシジン二塩酸塩(Sigma)と5×10-4% H2O2からなる新しく調製した反応バッファー(200μL)と混合した。光学密度の変化は、SPARK 10Mプレートリーダー(Tecan, Männedorf, Switzerland)を用いて450 nmで測定した。標準曲線の作成にはヒト好中球MPO(Sigma)を用いた。
4.6. 大腸 mRNA の単離と定量的リアルタイム qPCR アッセイ
大腸組織を安楽死中に採取し、RNA-later(Invitrogen, Waltham, MA, USA)に入れ、さらに使用するまで-80℃で保存した。NucleoSpin RNA キットを用いて、製造者の説明書に従い、結腸サンプルから全 mRNA を単離した。抽出したmRNAはNanoDrop One Spectrophotometer(Ozyme, Saint-Cyr-l'École, France)を用いて定量した。cDNA合成後、LightCycler 96システム(Roche, Basel, Switzerland)を用い、以下のプライマーを用いてTaqManによるRT-qPCRで炎症性サイトカインを測定した: ハウスキーピング遺伝子としてB2m、id: Mm00437762_m1;TNFスーパーファミリーid: Mm00443258_m1; IL6 id: Mm00446190_m1; IL1β id: Mm00434228_m1。TGF-βレベルは、以下のプライマーを用いて、SYBR Green(Qiagen, Les Ulis, France)を用いたPCRにより分析した: TGFb-fw: TGFb-fw:ATGCTAAAGAGGTCACCCGCおよびTGFb-rv: TGCTTCCCGAATCTGACG。mRNA発現の変化は、比較閾値サイクル(Ct)法を用いて倍数変化を計算することにより決定した。
4.7. 糞便および大腸miRNAの抽出と定量
小分子RNA(<200 nt)は、mirVana単離キット(Thermo Fisher社、米国マサチューセッツ州ウォルサム)を用い、製造者の指示に従って、採取した大腸および糞便サンプルから得た。簡単に言うと、サンプルをTissueLyser(Qiagen, Les Ulis, France)を用いて溶解バッファー中で破砕し、ホモジナイズした。ホモジネートをクロロホルムと混合し、遠心分離した。水相を1/3容量のエタノールと混合し、RNeasyスピンカラムにロードした。回収したろ液を2/3容量のエタノールと混合し、2回目のろ過を行った。3回の洗浄後、小分子RNAをRNaseフリーの水で溶出した。NanoDrop One Spectrophotometer (Ozyme, France)を用いてsmall RNAの質と量を分析した。あらかじめ希釈したsmall RNAサンプル(10 ng/μL)からのcDNA合成にはmiRCURY LNA RT kit(Qiagen)を用いた。得られたcDNAを2×miRCURY SYBR Green Master Mixと混合し、LightCycler 96システム(Roche)でqPCRを行った。UniSp6 RNAスパイクインは、内挿キャリブレーターとして使用した。miRNA発現の変化は、比較閾値サイクル(Ct)法を用いて、大腸菌マウスにおける安定性指標として選ばれたmiR-194-5pで正規化して、倍数変化を計算することにより決定した。
4.8. 糞便中のLPSおよびフラジェリン負荷量の定量
糞便中のLPSおよびフラジェリン負荷量は、それぞれHEK-Blue-mTLR4細胞およびHEK-Blue-mTL5細胞(Invivogen, San Diego, CA, USA)を用いて定量した。先に処理した糞便上清を哺乳動物細胞に塗布し、37℃で24時間インキュベートした。細胞培養上清をQUANTI-Blue培地(Invivogen)にアプライし、30分後にアルカリホスファターゼ活性を620nmで測定した。大腸菌由来精製LPS(シグマ社製)およびサルモネラ・チフスムー リウム由来フラジェリン(シグマ社製)を標準曲線測定に用いた。
4.9. イルミナ技術を用いた16S rRNA遺伝子配列決定による微生物叢解析
微生物叢分析は、大腸炎発症前(0 日目)、軽症大腸炎発症中(42 日目)、重症大腸炎発症中(91 日目)に行った。16S rRNA遺伝子の増幅および配列決定は、DNA抽出のためのMOBIO PowerSoil DNA Isolation Kit手順(https://press.igsb.anl.gov/earthmicrobiome(2023年4月1日アクセス))に修正を加えたEarth Microbiome Projectのプロトコールに従い、イルミナMiSeq技術を用いて行った。MoBio Laboratories (Carlsbad, CA, USA)のPowerSoil-htpキットを用いて、凍結糞便から機械的破砕(ビーズビート)によりバルクDNAを抽出した。16S rRNA遺伝子、領域V4は、複合フォワードプライマーと、Golayエラー訂正スキームを用いて設計された、ユニークな12塩基のバーコードを含むリバースプライマーを用いて、各サンプルからRT-qPCR増幅した(このプライマーは、各サンプルからのRT-qPCR産物にタグ付けするために使用した)。フォワードプライマー515F 5′-AATG ATAC GGCG ACCA CCGA GATC TACACGCT XXXX XXXX XXXX TATG GTAATT GT GTGYCAGCMGCCGCGGTAA-3′を使用した: 斜体配列は5′イルミナアダプター、12X配列はゴレイバーコード、太字配列はプライマーパッド、斜体および太字配列はプライマーリンカー、下線配列は保存された細菌プライマー515Fである。使用したリバースプライマー806Rは、5′-CAAG CAGA AGAC GGCA TACGAGAT AGTCAGCCAG CC GGACTACNVGGGTWTCTAAT-3′:イタリック体の配列はイルミナアダプターの3′逆相補配列であり、太字の配列はプライマーパッドであり、イタリック体の太字の配列はプライマーリンカーであり、下線の配列は保存された細菌プライマー806Rである。RT-qPCR反応は、Hot Master RT-qPCR mix(Quantabio, Beverly, MA, USA)、0.2 mMの各プライマー、10-100 ngの鋳型からなり、反応条件は、Bioradサーモサイクラーで95℃で3分、95℃で45秒、50℃で60秒、72℃で90秒を30サイクル行った。RT-qPCR産物をAmpure磁気精製ビーズ(Agencourt, Brea, CA, USA)で精製し、ゲル電気泳動で可視化した。産物はQuant-iT PicoGreen dsDNAアッセイを用いて定量した(BIOTEK Fluorescence Spectrophotometer, Winooski, VT, USA)。精製産物から等モル比のマスターDNAプールを作製した。このプール産物をQuant-iT PicoGreen dsDNA assayを用いて定量し、コーネル大学イサカ校でIllumina MiSeqシーケンサー(ペアエンドリード、2Å~250 bp、米国カリフォルニア州サンディエゴ)を用いて塩基配列を決定した。QIIME2 default parametersを用いたDADA2法を用いて、イルミナアンプリコン配列データの検出と補正を行うために、配列のデマルチプレックスとクオリティフィルターを行い、Qiime2アーチファクトのテーブルを作成した。次に、align-to-tree-mafft-fasttreeコマンドを用いて系統多様性解析用の木を作成し、core-metrics-phylogeneticコマンドを用いてアルファ多様性とベータ多様性を計算した。実験グループ間のばらつき(ベータ多様性)の評価にはPCoAプロットを用いた。
4.10. 統計解析
データは平均値±SEMで表し、統計解析はGraphPad Prismソフトウェア(V.8)を用いて行った。有意性は、データが正規分布または非正規分布の場合、それぞれ対応のないt検定またはマン・ホイットニーのU検定を用いて決定した。折れ線グラフ形式で異なる時点で収集したデータについては、二元配置反復測定ANOVAまたは混合効果モデル(欠損値の場合)をボンフェローニ・ポストホック検定とともに実施した。変数間の関係をスクリーニングするために、スピアマン相関係数行列を使用した。最も関連性の高い同定された条件の線形回帰を表し、線形回帰を用いて分析した。有意性は以下のように記した:0日目と比較して、* p < 0.05、** p < 0.01、*** p < 0.001、*** p < 0.0001。各時点でのオスとメスの比較、# p < 0.05、# p < 0.01、## p < 0.001、### p < 0.0001。結果はp < 0.05で有意とみなされた。結論
性差は疾患において重要な役割を果たすが、性差に特化した解析のかなりの数は、比較の側面を強調するのではなく、一方の性差に集中する傾向がある。その結果、性・ジェンダー医学の分野は未解明であることが多く、動物モデル、臨床試験、医療計画方針に両性を含める必要性を強調する文献が増加している。性に関連した微生物および免疫調節に関する詳細な知識を得ることは、適切な疾患モデルや個別化医療を可能にする治療戦略を開発するための重要な前提条件である。
補足資料
以下の補足資料は、https://www.mdpi.com/article/10.3390/ijms241210364/s1。
著者貢献
構想、V.E.、方法論、V.E.、C.-B.M.およびM.R.、正式な解析、C.-B.M.、リソース、V.E.、執筆(原案作成)、C.-B.M.、執筆(査読および編集)、V.E.、監督、V.E.、資金獲得、V.E. 著者全員が本原稿の出版版を読み、同意した。
資金提供
本研究は、ANR-11-IDEX-0005-02 Laboratory of Excellence INFLAMEXおよびAssociation François Aupetitの支援を受けた。EVはEuropean Commission Research Executive Agency(欧州委員会研究執行機関)のMarie Sklodowska-Curie個人研究助成金の受給者である。資金提供者は、本研究のデザイン、データ収集、分析、解釈、および原稿の執筆には関与していない。
施設審査委員会の声明
動物実験プロトコールは、地元の倫理委員会およびフランス研究省の承認を得た(APAFIS#23855-2020012916328162、フランス、パリ、2020年4月17日)。
データの利用可能性に関する声明
未処理のシーケンスデータは、European Nucleotide Archiveにアクセッション番号PRJEB63263で寄託されている。
謝辞
Chassaingの研究室(INSERM U1016、パリ、フランス)には、16Sシーケンスパイプラインの利用と指導を提供していただいた。また、Maryline Royにはマウス実験における技術的支援をいただいた。
利益相反
著者らは利益相反はないと宣言している。
参考文献
Westergaard、D.; Moseley、P.; Sørup、F.K.H.; Baldi、P.; Brunak、S. 男女における疾患進行パターンの違いに関する集団全体の解析。Nat. Commun. 2019, 10, 666. [Google Scholar] [CrossRef] [PubMed].
Jaillon, S.; Berthenet, K.; Garlanda, C. Sexual Dimorphism in Innate Immunity. Clin. Rev. Allergy Immunol. 2019, 56, 308-321. [Google Scholar] [CrossRef] [PubMed].
Klein, S.L.; Flanagan, K.L. Sex differences in immune responses. Nat. Rev. Immunol. 2016, 16, 626-638. [Google Scholar] [CrossRef] [PubMed].
マクロファージの代謝リプログラミングによって媒介されるIL-10の抗炎症効果。Science 2017, 356, 513-519. [Google Scholar] [CrossRef].
ヒト末梢血単核球によるサイトカイン分泌における性差: ex vivo敗血症モデルにおけるLPS誘導性サイトカイン分泌調節におけるエストロゲンの役割。Shock 2001, 16, 340-343. [Google Scholar] [CrossRef].
Islam, H.; Jackson, G.S.; Yoon, J.S.J.; Cabral-Santos, C.; Lira, F.S.; Mui, A.L.; Little, J.P. IL-10の抗炎症機能における性差: 男性の血液白血球において、より大きなSTAT3活性化とより強いTNF-α産生抑制(ex vivo)。Am. J. Physiol.-Cell Physiol.2022、322、C1095-C1104。[Google Scholar] [CrossRef].
Kühn, R.; Löhler, J.; Rennick, D.; Rajewsky, K.; Müller, W. インターロイキン10欠損マウスは慢性腸炎を発症する。Cell 1993, 75, 263-274. [Google Scholar] [CrossRef]。
炎症性腸疾患の管理におけるパラダイムの変化。United Eur. Gastroenterol. J. 2022, 10, 1044-1046. [Googleスカラー] [クロスリーフ]。
Van Linschoten, R.C.A.; Visser, E.; Niehot, C.D.; van der Woude, C.J.; Hazelzet, J.A.; van Noord, D.; West, R.L. Systematic review: 炎症性腸疾患の社会的疾病コストは生物学的製剤により増加しており、大陸によって異なる。Aliment. Pharmacol. Ther. 2021, 54, 234-248. [Google Scholar] [CrossRef].
クローン病リスク遺伝子ATG16L1における伝達の歪みが疾患関連における性差をもたらす。Inflamm. Bowel Dis. 2012, 18, 312-322. [Google Scholar] [CrossRef].
Greuter、T.; Manser、C.; Pittet、V.; Vavricka、S.R.; Biedermann、L. 炎症性腸疾患の性差。消化2020、101、98から104。[Google Scholar] [CrossRef] [PubMed].
潰瘍性大腸炎の発症にはインターロイキン10プロモーター多型が性差に影響する。Scand. J. Gastroenterol. 2008, 43, 712-718. [Google Scholar] [CrossRef] [PubMed].
マウスにおける腸内細菌叢組成の性差とホルモンの影響。Gut Microbes 2016, 7, 313-322. [Google Scholar] [CrossRef] [PubMed].
潰瘍性大腸炎およびクローン病における脾臓容積と疾患活動性の関連性.Medicine 2022, 101, e28515. [Google Scholar] [CrossRef] [PubMed].
炎症性腸疾患におけるリポ多糖と腸内細菌叢の相互作用。Int. J. Mol. Sci. 2021, 22, 6242. [Google Scholar] [CrossRef] [PubMed].
宿主由来の糞便マイクロRNAは腸内細菌叢の健全性と炎症誘発能力を示すことができる。Theranostics 2019, 9, 4542-4557. [Google Scholar] [CrossRef].
Markle、J.G.、Frank、D.N.、Mortin-Toth、S.、Robertson、C.E.、Feazel、L.M.、Rolle-Kampczyk、U.、von Bergen、M.、McCoy、K.D.、Macpherson、A.J.、Danska、J.S.腸内細菌叢の性差は、ホルモン依存的な自己免疫の制御を駆動する。Science 2013, 339, 1084-1088. [Google Scholar] [CrossRef]。
腸管上皮細胞toll様受容体5は腸内細菌叢を制御し、マウスにおける低悪性度炎症とメタボリックシンドロームを予防する。Gastroenterology 2014, 147, 1363-1377.e17. [Google Scholar] [CrossRef].
Casado-Bedmar, M.; Viennois, E. マイクロRNAと腸内細菌叢: Inflammatory Bowel Disease Pathogenesis and Therapeutics: Tiny but Mighty-Novel Insights into Their Cross-talk in Inflammatory Bowel Disease Pathogenesis and Therapeutics. J. Crohns Colitis 2022, 16, 992-1005. [Google Scholar] [CrossRef].
Serum miRNA signature diagnoses and discriminates murine colitis subtypes and predicts ulcerative colitis in humans. Sci. Rep. 2017, 7, 2520. [Google Scholar] [CrossRef].
Gao, Z.; Chen, Z.; Sun, A.; Deng, X. Gender differences in cardiovascular disease. Med. Nov. Technol. Devices 2019, 4, 100025. [Google Scholar] [CrossRef].
De Martinis, M.; Sirufo, M.M.; Polsinelli, M.; Placidi, G.; Di Silvestre, D.; Ginaldi, L. Gender Differences in Osteoporosis: 単施設観察研究。World J. Mens. Health 2021, 39, 750-759. [Google Scholar] [CrossRef] [PubMed].
自己免疫疾患における性差. Nat. Immunol. 2001, 2, 777-780. [Google Scholar] [CrossRef][PubMed]。
ヘリコバクター・ピロリとヘリコバクター・ヘパティカスに感染した129 Rag2(-/-)マウスにおける大腸炎の男性依存的促進。Int. J. Mol. Sci. 2020, 21, 8886. [Google Scholar] [CrossRef].
栄養失調児における腸内炎症の糞便バイオマーカーとしてのミエロペルオキシダーゼ、ラクトフェリン、カルプロテクチン、リポカリン-2の比較。J. Transl. Sci. 2016, 2, 134-139. [Google Scholar] [CrossRef].
Il10(-/-)マウスにおける大腸炎の発症はIL-22に依存する。Mucosal Immunol. 2020, 13, 493-506. [Google Scholar] [CrossRef].
Lindemans, C.A.; Calafiore, M.; Mertelsmann, A.M.; O'Connor, M.H.; Dudakov, J.A.; Jenq, R.R.; Velardi, E.; Young, L.F.; Smith, O.M.; Lawrence, G.; et al. インターロイキン22は腸管幹細胞を介した上皮再生を促進する。Nature 2015, 528, 560-564. [Google Scholar] [CrossRef].
Liang、S.C.、Tan、X.Y.、Luxenberg、D.P.、Karim、R.、Dunussi-Joannopoulos、K.、Collins、M.、Fouser、L.A. Interleukin(IL)-22とIL-17はTh17細胞によって共発現され、抗菌ペプチドの発現を協同的に増強する。J. Exp. Med. 2006, 203, 2271-2279. [Google Scholar] [CrossRef].
アセトアミノフェン誘発性肝障害は、性関連遺伝子産物としてマウスIL-22を露出させる。Int. J. Mol. Sci. 2021, 22, 10623. [Google Scholar] [CrossRef].
Abdelnabi、M.N.; Flores Molina、M.; Soucy、G.; Quoc-Huy Trinh、V.; Bédard、N.; Mazouz、S.; Jouvet、N.; Dion、J.; Tran、S.; Bilodeau、M.; et al. 非アルコール性脂肪性肝疾患関連線維症におけるIL-22受容体シグナリングの性依存性肝保護的役割。Cell. Mol. Gastroenterol. Hepatol. 2022, 14, 1269-1294. [Google Scholar] [CrossRef].
Goodman、W.A.、Havran、H.L.、Quereshy、H.A.、Kuang、S.、De Salvo、C.、Pizarro、T.T. エストロゲン受容体αの機能喪失は、DSS誘発実験的大腸炎から雌マウスを保護する。Cell. Mol. Gastroenterol. Hepatol. 2018, 5, 630-633.e1. [Google Scholar] [CrossRef].
Pierdominici, M.; Maselli, A.; Varano, B.; Barbati, C.; Cesaro, P.; Spada, C.; Zullo, A.; Lorenzetti, R.; Rosati, M.; Rainaldi, G.; et al. エストロゲン受容体β発現と炎症性腸疾患活動性の関連性。Oncotarget 2015, 6, 40443-40451. [Google Scholar] [CrossRef] [PubMed].
また、このような疾患は、腸内細菌叢が腸内細菌叢の活性を低下させ、腸内細菌叢が腸内細菌叢の活性を低下させ、腸内細菌叢が腸内細菌叢の活性を低下させることが示唆されている。Nat. Commun. 2021, 12, 7080. [Google Scholar] [CrossRef] [PubMed].
Son,H.J.、Kim,N.、Song,C.-H.、Nam,R.H.、Choi,S.I.、Kim,J.S.、Lee,D.H. 炎症性腸疾患のC57BL/6マウスモデルにおける腸内細菌叢の性に関連した変化。J. Cancer Prev. 2019, 24, 173-182. [Google Scholar] [CrossRef] [PubMed].
Dao, M.C.; Everard, A.; Aron-Wisnewsky, J.; Sokolovska, N.; Prifti, E.; Verger, E.O.; Kayser, B.D.; Levenez, F.; Chilloux, J.; Hoyles, L.; et al. 肥満における食事介入中のAkkermansia muciniphilaと代謝健康の改善: 腸内細菌叢の豊かさと生態との関係。Gut 2016, 65, 426-436. [Google Scholar] [CrossRef].
Shin, N.-R.; Lee, J.-C.; Lee, H.-Y.; Kim, M.-S.; Whon, T.W.; Lee, M.-S.; Bae, J.-W. メトホルミン投与により誘導されるアッケシソウ属の個体数の増加は、食事誘発性肥満マウスのグルコースホメオスタシスを改善する。Gut 2014, 63, 727-735. [Google Scholar] [CrossRef].
Liu,M.-J.;Yang,J.-Y.;Yan,Z.-H.;Hu,S.;Li,J.-Q.;Xu,Z.-X.;Jian,Y.-P. アッカーマンシア(Akkermansia)ムチニフィラによる代謝制御と腸疾患における役割に関する最近の知見。Clin. Nutr. 2022, 41, 2333-2344. [Google Scholar] [CrossRef].
便秘優位の過敏性腸症候群患者のヒト腸内細菌叢は抗炎症作用を示す。Sci. Rep. 2016, 6, 39399. [Google Scholar] [CrossRef].
NLRP6 Protects Il10-/- Mice from Colitis by Limiting Colonization of Akkermansia muciniphila. Cell Rep. 2017, 19, 733-745. [Google Scholar] [CrossRef].
Lee,J.Y.、Kim,N.、Nam,R.H.、Sohn,S.H.、Lee,S.M.、Choi,D.、Yoon,H.、Kim,Y.S.、Lee,H.S.、Lee,D.H.。プロバイオティクスは、反復水回避ストレス誘発性大腸微小炎症をウィスター系ラットにおいて性特異的に軽減する。PLoS ONE 2017, 12, e0188992. [Google Scholar] [CrossRef].
病原体Mycobacterium avium subsp. paratuberculosisおよび有益微生物に対する宿主応答は、宿主の性特異性を示す。Appl. Environ. Microbiol. 2014, 80, 4481-4490. [Google Scholar] [CrossRef].
Pigrau、M.; Rodiño-Janeiro、B.K.; Casado-Bedmar、M.; Lobo、B.; Vicario、M.; Santos、J.; Alonso-Cotoner、C. 脳腸微生物叢軸と腸管バリアホメオスタシスを調節する性とストレスの共同パワー: 過敏性腸症候群への影響。Neurogastroenterol. Motil. 2016, 28, 463-486. [Google Scholar] [CrossRef] [PubMed].
疾患におけるマイクロRNA遺伝子制御における性差の影響。Biol. Sex Differ. 2014, 5, 3. [Google Scholar] [CrossRef].
神経変性疾患におけるエストロゲンによるmiRNA-29およびmiRNA-9の潜在的制御: 神経変性疾患におけるエストロゲンによるmiRNA-29とmiRNA-9の制御の可能性。脳科学、2023、13、243。[Google Scholar] [CrossRef] [PubMed].
ヒトのX染色体についてマイクロRNAが教えてくれること。Cell. Mol. 生命科学 2020, 77, 4069-4080. [Google Scholar] [CrossRef].
Tomeva、E.; Krammer、U.D.B.; Switzeny、O.J.; Haslberger、A.G.; Hippe、B. 固形腫瘍と健常対照からの液体生検における性特異的miRNAの違い。Epigenomes 2023, 7, 2. [Google Scholar] [CrossRef] [PubMed].
腎移植患者における長期移植片機能に関連するマイクロRNA発現の性差。Int. J. Mol. Sci. 2022, 23, 12832. [Google Scholar] [CrossRef].
健康な人の年齢、性別、BMI、生活習慣に関連する便中miRNAプロファイル。Sci. Rep. 2021, 11, 20645. [Google Scholar] [CrossRef]。
腸の炎症と大腸炎関連がんを抑制する新規セスキテルペンラクトン、ミケリオリド。研究室 Investig. 2014, 94, 950-965. [Google Scholar] [CrossRef].
免責事項/出版者注:すべての出版物に含まれる声明、意見およびデータは、著者および寄稿者個人のものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されたアイデア、方法、指示、製品に起因する人または財産の損害について責任を負いません。
著者による© 2023。ライセンシー MDPI, Basel, Switzerland. 本論文は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条項および条件の下で配布されるオープンアクセス論文である。
共有と引用
MDPIおよびACSスタイル
性差がIL-10-/-マウス大腸炎の表現型と微生物叢に及ぼす影響。Int. J. Mol. Sci. 2023, 24, 10364. https://doi.org/10.3390/ijms241210364
AMAスタイル
性差がIL-10-/-マウス大腸炎の表現型と微生物叢に及ぼす影響。International Journal of Molecular Sciences. 2023; 24(12):10364. https://doi.org/10.3390/ijms241210364
シカゴ/チュラビアンスタイル
マイテ、カサド=ベドマー、マリリン・ロイ、ヴィエノワ・エミリー。2023. "The Effect of Sex-Specific Differences on IL-10-/- Mouse Colitis Phenotype and Microbiota" International Journal of Molecular Sciences 24, no. 12: 10364. https://doi.org/10.3390/ijms241210364
他のスタイルを探す
なお、2016年創刊号より、本誌はページ番号の代わりに論文番号を使用しています。詳細はこちらをご覧ください。
論文指標
引用
この記事の引用は見つかりませんでしたが、Google Scholarで確認することができます。
論文アクセス統計
記事アクセス統計記事閲覧数20. 6月21日 6月22日 6月23日 6月24日 6月25日 6月26日 6月27日 06月0100200300
ジャーナル統計の詳細については、こちらをクリックしてください。
同一IPアドレスからの複数のリクエストは1ビューとしてカウントされます。
Int. J. Mol. Sci., EISSN 1422-0067, MDPI発行
RSSコンテンツアラート
その他の情報
論文処理料金請求書の支払いオープンアクセスポリシーお問い合わせMDPIJobs at MDPI
ガイドライン
著者の方へ査読者の方へ編集者の方へライブラリアンの方へ出版社の方へ学会の方へ学会主催者の方へ
MDPIの取り組み
SciforumMDPI書籍Preprints.orgScilitSciProfilesEncyclopediaJAMSProceedingsシリーズ
MDPIをフォローする
LinkedInFacebookTwitter
MDPIジャーナルからの発行通知やニュースレターを購読する
Acoustics Actuators Administrative Sciences Adolescents Advances in Respiratory Medicine Aerospace Agriculture AgriEngineering Agrochemicals Agronomy AI Air Algorithms Allergies Alloys Analytica Analytics Anatomia Anesthesia Research Animals Antibiotics Antibodies Antioxidants Applied Biosciences Applied Mechanics Applied Microbiology Applied Nano Applied Sciences Applied System Innovation AppliedChem AppliedMath Aquaculture Journal Architecture Arthropoda Arts Astronomy Atmosphere Atoms Audiology Research Automation Axioms Bacteria Batteries Behavioral Sciences Beverages Big Data and Cognitive Computing BioChem Bioengineering Biologics Biology 生物学・生命科学フォーラム Biomass バイオマス Biomechanics BioMed Biomedicines BioMedInformatics バイオミメティクス Biomolecules Biophysica バイオセンサー BioTech Birds ブロックチェーン Brain Sciences Buildings Businesses C Cancers Cardiogenetics Catalysts Cells Ceramics Challenges ChemEngineering Chemistry Chemistry Proceedings Chemosensors 子どもたち チップ CivilEng クリーンテクノロジー 気候 臨床とトランスレーショナル神経科学 臨床と実践 時計と睡眠 海岸 コーティング コロイドと界面 着色剤 商品 複雑性 化合物 計算 計算機科学と数学 フォーラム コンピューター 物性 保存 建設材料 腐食と材料劣化 化粧品 COVID 作物 暗号化 結晶 分子生物学の最新の問題 現在の腫瘍学 酪農データ 歯科学 Journal Dermato Dermatopathology Designs Diabetology Diagnostics Dietetics Digital Disabilities Diseases Diversity DNA Drones Drugs and Drug Candidates Dynamics Earth Ecologies Econometrics Economies Education Sciences Electricity Electrochem Electronic Materials Electronics Encyclopedia Endocrines Energies Eng Engineering Proceedings Entropy Environmental Sciences Proceedings Environments Epidemiologia Epigenomes European Burn Journal European Journal of Investigation in Health、 Fermentation Fibers FinTech Fire Fishes Fluids Foods Forecasting Forensic Sciences 森林 Fossils Foundations Fractal and Fractional Fuels Future Future Internet Future Pharmacology Future Transportation Galaxies Games Gases Gastroenterology Insights Gastrointestinal Disorders Gastronomy Gels Genealogy Genes Geographies GeoHazards Geomatics Geosciences Geotechnics Geriatrics Gout, Urate、 and Crystal Deposition Disease Grasses ハードウェア ヘルスケア Hearts Hemato Hematology Reports Heritage Histories Horticulturae Hospitals Humanities Humans Hydrobiology Hydrogen Hydrology Hygiene Immuno Infectious Disease Reports Informatics Information Infrastructures Inorganics Insects Instruments International Journal of Environmental Research and Public Health International Journal of Financial Studies International Journal of Molecular Sciences International Journal of Neonatal Screening International Journal of Plant Biology International Journal of Translational Medicine International Journal of Turbomachinery、 国際医学教育発明IoT ISPRS国際地理情報ジャーナル 加齢・長寿ジャーナル 心臓血管の発達と疾患ジャーナル 臨床・トランスレーショナル眼科学ジャーナル 臨床医学ジャーナル 複合材料科学ジャーナル サイバーセキュリティとプライバシージャーナル 発生生物学ジャーナル 実験・理論解析ジャーナル 機能性バイオマテリアルジャーナル 機能形態学・運動学ジャーナル 菌類学ジャーナル イメージングジャーナル 知能ジャーナル 低電力エレクトロニクスと応用ジャーナル 製造・材料加工ジャーナル 海洋科学・工学ジャーナル 分子病理学ジャーナル ナノテラノスティクスジャーナル 原子力工学ジャーナル 耳鼻咽喉科学ジャーナル 個別化医療ジャーナル 呼吸学ジャーナル リスクと財務管理ジャーナル センサとアクチュエータネットワークジャーナル 理論と応用電子商取引研究ジャーナル 血管疾患ジャーナル 異種生物学ジャーナル 動物園・植物園ジャーナリズムとメディア 腎臓と透析 キナーゼとホスファターゼ 知識 土地 言語 法律 生命 Limnological Review 液体 文学 肝臓 論理学 物流 潤滑剤 リンパ管 機械学習と知識抽出 機械 Macromol 磁性 磁気化学 海洋薬物 材料 材料会議 数理・計算応用 数学 医学 医学フォーラム Medicina メディシン メンブレン メリット メタボライト 金属 気象学 メタン メソッドとプロトコル 計量学 マイクロ微生物学研究 マイクロマシン 微生物 マイクロプラスチック 鉱物 鉱山 モデリング Molbank 分子 マルチモーダル技術と相互作用 筋肉 ナノエネルギー 先端 ナノ製造 ナノ材料 NDTネットワーク 神経膠 神経学 国際神経科学 窒素 非 看護学レポート 栄養補助食品 栄養素 肥満症 海洋 オンコ オプティクス オーラル オルガノイド オステオロジー 酸素 パラシトロジア パーティクル 病原体 病態生理学 小児科レポート 医薬品 製薬学 薬剤疫学 薬学哲学 フォトケミックス フィコロジー フィケム 物理科学フォーラム 物理学 物理学 植物 プラズマ プラットフォーム 汚染物質 ポリマー 多糖類 家禽類 粉末 会議録 プロセス プロテオーム 精神医学 国際精神作用学 出版物 量子ビーム 科学 量子レポート 第四紀放射線 反応 受容体 リサイクル 宗教 リモートセンシング レポート 生殖医療 リソース リューマート リスク ロボット工学 反芻動物 安全科学 サイエンティア 薬剤学 硬化症 種子 センサー 分離 性別 シグナル 副鼻腔炎 スマートシティ 社会科学 社会 ソフトウェア 土壌システム 太陽固体 分光学 ジャーナル スポーツ 規格 統計 ストレス 表面 手術 手術手技 開発 持続可能性 持続可能な化学 シンメトリー シンバイオ システム 目標 分類技術 電気通信 繊維製品 サラセミア レポート サーモ・トモグラフィ ツーリズムとホスピタリティ トキシックス 毒素 移植学 トラウマケア 高等教育の動向 熱帯医学と感染症 宇宙 都市科学 ウロワクチン 自動車 性病学 獣医科学 振動 仮想世界 ウイルス 視覚 廃棄物 水 風 女性 世界 電気自動車ジャーナル 青少年 人獣共通感染症
オプションを選択
購読申し込み
© 1996-2023 MDPI (スイス、バーゼル) 特に明記されていない限り
免責事項 利用規約 プライバシーポリシー
トップ
この記事が気に入ったらサポートをしてみませんか?
