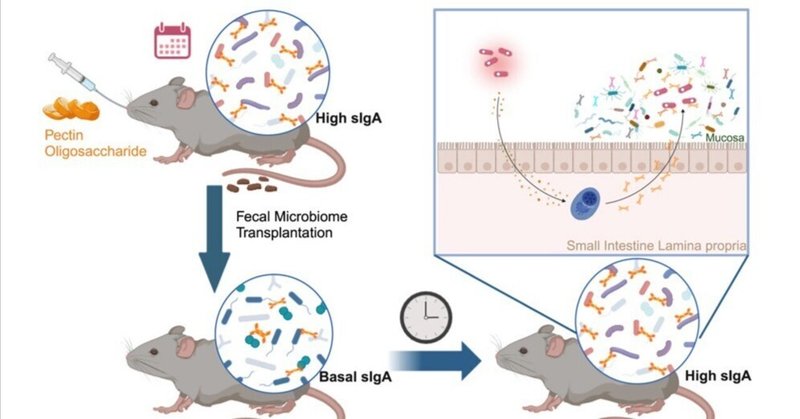
マウスの腸内でIgA濃度を高める共生生物の選択
メインコンテンツへスキップ
広告
インスピレーションを与える科学Cell Pressジャーナル
細胞宿主微生物
ログイン
論文|オンライン版
マウスの腸内でIgA濃度を高める共生生物の選択
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00368-2

シャンシャン・チャン 7
イーハン 7
ウィットマン・スコフィールド
モハメド・ドウィダー
呂秋河
サディアス・S・スタッペンベック 8
すべての著者を表示
脚注を表示する発行:2023年9月29日DOI:https://doi.org/10.1016/j.chom.2023.09.001
PlumXメトリクス
ハイライト
ペクチン由来のプレバイオティクスがマウスのIgA高値表現型を作り出す
ペクトオリゴ型微生物群集がIgA高値表現型を優勢に伝達する。
IgA高値表現型は主に小腸のCD4+ T細胞によって引き起こされる。
Lachnospiraceae属細菌A2はIgA高値マウスで濃縮され、高IgAを引き起こす可能性が高い。
概要
免疫グロブリンA(IgA)は粘膜表面の恒常性維持に重要な因子であるが、管腔内のIgAレベルは大きく変動する。IgAの総レベルは、特定の微生物に対する個々の免疫応答によって左右されると考えられている。今回我々は、プレバイオティクスであるペクチンオリゴ糖(pec-oligo)が、小腸においてT細胞依存的に高いIgAレベルを誘導することを見出した。驚くべきことに、このIgA高値の表現型はpec-oligoの投与を中止しても維持され、pec-oligoの非存在下でIgA高値を維持するには、マイクロバイオームの水平的あるいは垂直的な伝播で十分であった。興味深いことに、pec-oligo細菌群集全体で濃縮された細菌分類群は、この同じ群集のIgAコーティング微生物とは異なっていた。むしろ、Lachnospiraceae細菌A2に高度に濃縮されたエタノール耐性微生物群が、IgA高値の表現型を駆動していた。これらの知見は、限られた数の微生物が、多くの共生微生物に向けられたIgAの持続的な変化を促進するという、腸管適応免疫のモデルを支持するものである。
図解抄録
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
ペクチンオリゴ糖
プレバイオティクス
分泌性免疫グロブリンA
マイクロバイオーム
回腸微生物叢移植
CD4+T細胞
はじめに
粘膜の適応免疫系は、免疫グロブリンA(IgA)を産生し、内腔に分泌することで、この場所における監視システムを確立している1。IgAの産生、プロセッシング、輸送に関する多くの基本的なメカニズムは、当初、環境に最も直接曝される粘膜臓器である腸において確立された2。ここで、固有層にある抗体分泌細胞3は、IgAとJ鎖を産生し、IgA二量体を形成する。この二量体は、腸上皮の基底側表面にある高分子Ig受容体(Pigr)に結合する。分泌型IgA(SIgA)は、腸管上皮細胞(IEC)の先端表面でPigrがトランスサイトーシスとタンパク質分解を受けた後、腸管内腔に送り込まれる4。SIgAは、ムチンや抗菌ペプチドなどの他の分泌型分子と協調して腸内細菌叢の組成を形成し、その結果、健康状態と疾患状態の両方に影響を及ぼす5,6。
SIgAは最も豊富な粘膜抗体であり、感染症の予防や腸管傷害の影響に対抗する上で不可欠な役割であることが、多くの研究によってエレガントに証明されている7,8。SIgAは、(1)細菌2,9や細菌由来の毒素がIECに到達するのを制限する、10(2)細菌の除去、特に病原体の除去を促進する、11,12(3)細菌のコロニー形成、特に共生細菌のコロニー形成を制御する、13,14,15(4)疾患関連細菌と結合する、16,17,18(5)腸内細菌叢の構成を形成する、19,20といった機能を持つ。
ルミナルSIgAは、タンパク質抗原特異的認識21、糖鎖を介した相互作用15,22、微生物にコードされた超抗原によるSIgAの細菌結合23など、複数のメカニズムによって微生物と結合することができる。健康なヒトやマウスでは、Lactobacillus属、Akkermansia属、およびDorea属の複数の細菌種がIgAの一般的な標的であり、これらの微生物のSIgAコーティングは疾患において減少することから、これらの相互作用が腸の健康を促進する可能性が示唆される16,17,24。25。IgAの調節を例にとると、私たちの目標は、粘膜免疫プロフィールを頑健かつ一貫して操作できる戦略を特定することである。
腸管内腔のIgAレベルを決定する現在のモデルは、IgAの産生を特定の微生物に向けるT細胞依存的なプロセスに大きく基づいている。このモデルにとって重要なことは、個々の微生物は他の微生物とは無関係に、独自のIgA応答を引き起こすということである。したがって、個々の微生物に対するこれらの独立した免疫応答の総和が、腸管内腔における総IgAレベルと特異性を決定する。腸管内腔のIgAレベルは、全体的な免疫応答を上昇させるユニークな微生物ドライバーによって調整され、またそれに依存するというモデルである。このモデルを支持するものとして、われわれは、様々な微生物を標的としてIgAレベルを上昇させる、エタノール耐性で空気抵抗性の微生物の安定した集団の拡大を見出した。われわれは、オレンジの皮のペクチンをpHと熱処理によって加工したプレバイオティクスの長期投与(2ヵ月)によって濃縮された、これまで同定されていなかったLachnospiraceae属の微生物がドライバー微生物に含まれることを発見した。このプロセスは、経口投与が可能な低分子量(3-4kDa)の可溶性オリゴ糖(ペクチンオリゴ糖[pec-oligo])を生成する。フラクトオリゴ糖やガラクトオリゴ糖のような中性プレバイオティクスもまた、IgA産生を促進するが、その程度ははるかに低い27,28。ここでは、ペコオリゴが限られた数のドライバー微生物を濃縮することにより、腸内の一般的なIgAレベルを上昇させることを示す。
結果
pec-oligo経口投与はC57BL/6JマウスにおいてIgA高値表現型を刺激する。
C57BL/6J(B6)マウスの糞便中IgA濃度に及ぼすpec-oligo慢性曝露の経時的影響を調べた。B6マウスの実験群は、(1)投与なし、(2)ビヒクル投与(水のみ投与)、(3)pec-oligo投与(pec-oligoを水に溶かしたものを投与)とし、マウスを7週間投与し、毎週糞便を採取してELISA法でIgAレベルを定量した(図1A)。pec-oligoに対するIgA誘導の時間経過は、投与開始後28日目に最初の増加を示し、これはBALB/cマウスを用いた我々の以前の知見と同様であった26。この群では、糞便中IgAレベルは経時的に増加し、投与開始後35日目に最大値に近づいた(≧180μg IgA/g糞便、以下IgA高値表現型と呼ぶ)(図1B)。興味深いことに、ビヒクルコントロールマウスは、投与開始後35日目までに糞便IgAレベルが検出レベルまたはそれに近いレベルであった(≦10μg IgA/g糞便;以下、IgA-低表現型と呼ぶ)。対照的に、無投与群では、糞便IgAの基礎レベル(我々のコロニーの他の特異的病原体を持たないマウスと比較して)が7日目に出現し、実験期間中安定した(10〜180μg IgA/g糞便)。血清中の総IgAレベルは有意差を示さなかったので、pec-オリゴ経口投与の効果は腸管IgAに特異的であった(図1C)。その他の免疫グロブリン、IgGおよびIgMは、pec-オリゴ投与後49日目の血清中濃度を3群間で比較すると、同程度であった(図1Dおよび1E)。これらのデータを総合すると、pec-oligoの経口投与により、糞便中のIgA濃度は、非操作マウスに見られるベースラインよりも上昇し、最も重要なことは、ビヒクルコントロールマウスにおける検出可能なIgAの完全な消失を克服したことである。
図サムネイルgr1
図1ペクチンオリゴ糖投与による糞便中IgA濃度の上昇
キャプション
大きな画像を見るダウンロード 高解像度画像
ペクチンオリゴ処理ドナーからのIgA高値表現型の水平転移
IgAレベルは腸内で変化したが、全身的には変化しなかったことから、我々は、腸内細菌叢組成におけるpec-oligo誘発性の変化がIgA高値表現型を駆動していると仮定した。この仮説を検証するため、pec-oligoをさらに投与しない状態で、糞便中マイクロバイオーム移植(FMT)を行った。この最初の実験では、コロニー形成抵抗性の可能性を避けるため、FMTの2週間前にレシピエントB6マウスを広域抗生物質(バンコマイシン、ネオマイシン、アンピシリン、メトロニダゾール[VNAM])で前処理した(図2A)29。VNAM前処置により、レシピエントの糞便中IgAが減少することを確認した(図2B、0日目の値)20。VNAM前処置を行ったレシピエントへのFMTドナーとして、マウスの3つのドナー群(無投与対照、ビヒクル投与、pec-oligo投与)を用いた(図2A)。3回のFMT(1日1回)の後、pec-oligoレシピエントマウスにおいて糞便中IgAレベルの急速な誘導が観察され(最後のFMT投与後7日目)、これらの糞便中IgAレベルは35日間の実験期間中維持され、無投与ドナーによって誘導されたレベルよりも高かった(図2B)。ビヒクル投与群では、これらの実験の35日間の経過中、糞便中IgAを誘導できなかった(図2B)。pec-オリゴFMT群における糞便中IgAの上昇は、ドナーサンプルからのIgA移行による可能性がある。しかしながら、我々は、pec-oligoドナーサンプルは、移植あたり6〜8μgのIgAを含むと推定し(表S1)、この量のIgAは、このグループから移植されたマウスにおける200μg/g糞便を超える持続的なIgAレベル(これは、1.5g/日の糞便の計算に基づく約300μg/日のIgA産生に相当する)を説明することはできなかった。
図サムネイルgr2
図2pec-オリゴ処理ドナーから非pec-オリゴ処理レシピエントへのIgA高発現型の水平転移
キャプション
大きな画像を見るダウンロード 高解像度画像
ペコオリゴドナーからVNAM前処置マウスへのFMTによる糞便中IgAの急速な誘導(図2B)は、ペコオリゴ処理が移植可能なIgA高表現型を誘導するマイクロバイオームを作り出したという我々の仮説を支持した。FMT終了後35日目の3つのドナー群とレシピエント群について、16S rDNAアンプリコンシークエンシングにより糞便細菌群集の組成を解析した。主成分分析によると、ドナー群とレシピエント群はビヒクル投与マウスで最も乖離しており、IgA低値表現型は容易に伝達されたものの、マイクロバイオームの移行は完全ではなかったことが示された(図2C)。対照的に、pec-oligo投与群と無投与群のドナー群とレシピエント群は類似しており、これらのドナーからレシピエントへのマイクロバイオームの移行がより完全であったことを示している(図2C)。予想通り、pec-oligo投与群のレシピエントは他の2群とは異なっていた(図2C)。pec-oligoドナーおよびレシピエントに濃縮された分類群を分析したところ、グラム陽性およびグラム陰性の微生物が多様であることが示された(図2D)。これらの結果から、pec-oligo処理の効果は持続し、微生物群集の水平移動と関連していることが示された。
宿主細胞や組織に対する抗生物質の潜在的影響をコントロールするため、無菌B6マウスをレシピエントとしてFMT実験も行った(図2E)。ここでも、pec-oligo処理はどのレシピエントマウスにも行われなかった。pec-oligoドナーの糞便サンプルを移植したマウスでは、VNAMで前処理したレシピエントと比較して、無菌レシピエントマウスでのIgA誘導の遅延が観察された(14日目対7日目)(図2Bおよび2F)。興味深いことに、pec-oligo投与群におけるIgA誘導の大きさは、VNAM投与群と比較して、無菌マウスで約2倍大きかった。ビヒクル処理対照群では、糞便中IgAは検出されなかった(図2F)。これらのデータを総合すると、レシピエントマウスに水平伝播するIgA高値表現型を駆動するのに十分なpec-オリゴ型マイクロバイオームの役割が支持される。
pec-オリゴ処理ドナーからの糞便中IgA誘導菌の垂直伝播
pec-oligoドナーからのIgA誘導性マイクロバイオームの移入におけるコロニー形成抵抗性の役割を調べるため、上記と同じ3群のドナーを用いて、抗生物質非投与の通常飼育B6マウスでFMTを行った。驚くべきことに、pec-oligoドナーは、糞便中IgAの安定レベルを維持した無投与ドナー群と比較して、雌雄両方のマウスレシピエントにおいて糞便中IgAを誘導した(図3Aおよび3B)。ビヒクル処置した対照レシピエントは、FMT後7日目までに糞便中IgAが検出されなかったが、pec-oligo処置した雄および雌のレシピエントは、FMT後7日目に有意に上昇した糞便中IgAレベルを示した。pec-オリゴドナーによるこの誘導は、VNAMで前処理したマウスレシピエントと同等の速度で起こった(図2B)。pec-オリゴ群のマウスのIgAレベルの上昇は、移植後7日目に始まり、FMT後28日目まで持続した(図3Aおよび3B)。これらの結果は、レシピエントには通常、病原体と共生細菌の両方に対して強固なコロニー形成抵抗性を提供する無傷のマイクロバイオームが存在するにもかかわらず、マウスをコロニー形成することができるIgA誘導マイクロバイオームの役割を支持するものである。
図のサムネイルgr3
図3IgA高発現型の垂直伝播は細菌に依存する
キャプション
大きな画像を見るダウンロード 高解像度画像
次に、微生物叢の垂直伝播(ダムから子孫へ)が子孫の糞便中IgA高値を維持できるかどうかを検証した。従来の方法で飼育した年齢を一致させたB6雌マウスと、pec-oligo処理マウスからFMTを受けたIgA高値の雄マウス(図3C)を同居させた。以前の結果(図3Aおよび3B)と一致して、pec-oligo処理を継続しない場合、表現型は雄マウスから雌マウスに水平伝播した(図3C)。対照として、年齢を一致させ、微生物群に寄生させなかった雄マウスと同居させた雌マウスは、糞便中IgAレベルに変化を示さなかった(図3C)。さらに、pec-oligo飼育群の子孫はIgA高値表現型を維持しており(図3D)、IgA高値表現型は垂直移動可能であることが示唆された。
共生細菌に加えて、ウイルス、真菌、および原生動物もまた、粘膜IgAレベルを調節しうる腸内マイクロバイオームの構成要素である。31,32 細菌と真菌および原生動物の相対的な役割を明らかにするために、従来のB6マウスにFMTを行い、pec-oligo群のIgAレベルがプラトーに達したFMT後28日目に、細菌群に選択的な抗生物質でレシピエントを処理した。その結果、アンピシリン投与は糞便中IgA高値表現型を逆転させるのに十分であることがわかった。アンピシリン投与10日後に糞便中IgAは基礎レベルまで低下したことから、アンピシリン感受性細菌がIgAレベルの誘導に関与していることが示唆された(図3E)。ウイルスの役割をより具体的に調べるため、pec-oligoドナーマウスのIgA高値糞便を0.45μmのフィルターに通した後、通常飼育のB6マウスにフィルターで濾過した糞便またはフィルターで濾過していない糞便を接種した。その結果、濾過された糞便サンプルはIgA表現型を移さないことがわかり、糞便中IgAレベルの増加における細菌の役割をさらに支持した(図3F)。これらの結果を総合すると、ペックオリゴ型細菌群集の構成要素が、水平方向にも垂直方向にも、IgA高値表現型を優勢に推進し、伝達することができるというモデルが支持される。
我々の仮説は、pec-olio群集(図2D)に最も多く存在する微生物が、IgAによって優先的に標的にされるというものであった。この仮説を検証するため、pec-oligo、ビヒクル、または無投与群落を投与した、抗生物質非投与の移植レシピエントマウスの糞便サンプルを用いてIgA-seq解析を行った(図3A)。IgAコーティング・インデックス(ICI)スコアとIgA濃縮分析により、pec-oligo群で主に標的とされた微生物は多様な分類群であり、両コントロール群と同様の差異を示した(図3Gと3H)。これらの結果は、ビヒクルコントロールの糞便中IgAレベルが非常に低い/検出されないにもかかわらず得られた。しかしながら、優先的にIgAを標的とした微生物と、pec-オリゴのドナー/レシピエントで最も濃縮された微生物との重複は見られなかった(図2D)。この結果は、ペックオリゴグループの特定の微生物が、共生微生物の配列に対するIgA産生のドライバーであるという代替モデルを示唆している。
ペックオリゴ誘導細菌は小腸でIgA高値表現型を促進する
一般的なIgAドライバーであるペックオリゴ群微生物の探索を開始するために、まず腸内でIgAが優先的に産生される場所を確定し、この産生がT細胞に依存するかどうかを決定した。常在細菌に対するIgA応答は、コロニー形成に基づき、腸の頭尾軸に沿って区分されることが多い。例えば、Clostridium butyricumはウサギの小腸に定着し、IgAを誘導する33。一方、特定のBacteroides ovatus株はマウスの結腸に定着し、IgAを誘導する34。興味深いことに、VNAM処理マウス(図4A)、無菌マウス(図S1A)、および非抗生物質処理マウス(図S2A)のFMT後35日目のpec-oligoレシピエントにおいて、小腸の管腔IgAレベルが上昇していた(対照2群に対して)。3つのモデルマウスすべてにおいて、pec-oligoドナーのマイクロバイオームを持つレシピエントの管腔IgAレベルは空腸と回腸で増加した(図4A、S1A、S2A)。ビヒクル対照マウスは、小腸において、無食餌対照マウスと同レベルのIgAを産生した(図4A、S1A、およびS2A);しかしながら、上述のように、ビヒクル対照群の糞便中ではIgAレベルは検出不可能となった(図2B、2F、および3A)。
図サムネイルgr4
図4pec-oligo処置マウスからのFMTは、VNAM前処置レシピエントの小腸においてIgA高値表現型を促進する
キャプション
大きな画像を見るダウンロード 高解像度画像
腸管IgAは、薄層前膜に存在する様々なIgA+細胞によって産生される35。この部位におけるIgA+細胞の数を定量化したところ、pec-オリゴ投与群では、2つの対照群と比較して、空腸および回腸絨毛関連薄層前膜の両方でIgA+細胞の数が多かった(図4B-4D)。pec-oligo群と対照群のIgA+細胞の倍数差は、回腸で一貫して大きかった(表S1)。Pigrは腸管上皮に発現し、二量体IgAを上皮を越えて腸管内腔に輸送する重要な因子である。興味深いことに、pec-oligoを投与された患者の回腸では、Pigrタンパク質とmRNAのレベルがコントロールと比較して上昇していた(図4E-4G)。組織切片では、Pigrタンパク質はpec-oligoレシピエントの絨毛上皮でより豊富であるように見えた。陰窩-絨毛軸の3つの領域でPigrシグナルを定量し(図S3A)、Pigrの分布が絨毛の長さに沿って確かに増加していることを示した(図S3B-S3D)。他の2つのモデルにおいて、pec-oligoドナーを無菌レシピエント(図S1B-S1G)または非抗生物質処理レシピエント(図S2B-S2G)にFMTした場合も、lamina propria IgA+細胞と絨毛Pigr発現の増加を示した。興味深いことに、3つのモデルすべてにおいて、結腸ではPigrもIgA+ lamina propria細胞も増加しなかった(図S3E-S3H)。これらの観察結果を総合すると、pec-オリゴドナーグループの小腸内腔細菌が、IgA産生細胞数の増加およびIgAを小腸内腔に輸送する送達機構を介して、小腸内腔におけるIgAの増加と関連しているというモデルが支持される。IgA誘導の局在は、ペコオリゴ群集におけるIgAの潜在的なドライバー集団に関連している。
ペックオリゴ微生物叢はT細胞依存的にIgAの上昇を引き起こす。
組織切片上のCD4+ T細胞の局在は、pec-oligo FMT VNAM処置レシピエントの空腸と回腸の両方で、これらの細胞の拡大を示した(図5A)。GK1.5とYTS191の2つの異なるクローンを同時に用いて抗CD4抗体を全身投与することにより、マウスのCD4+ T細胞を枯渇させ、脾臓細胞のフローサイトメトリー分析により枯渇を確認した(図5BおよびS4A-S4C)。抗CD4抗体を投与したペックオリゴFMTマウスは、アイソタイプコントロール抗体を注射したペックオリゴFMTマウスと比較して、糞便/腔内IgAの減少を示した(図5Cおよび5D)。同様に、空腸および回腸の絨毛固有層におけるIgA+細胞の数(図5E-5G)、ならびに小腸におけるPigrタンパク質(図5Hおよび5I)およびmRNAレベル(図5J)は、アイソタイプコントロールと比較して、CD4欠失マウスでは減少した。興味深いことに、CD4枯渇後の糞便中IgAレベル(図5C vs. 図2B、2F、3A)および絨毛固有層IgA+細胞レベル(図5E-5G vs. 図4B-4D、S1B-S1D、S2B-S2D)は、3つのFMTモデルで示された無食餌対照マウスのベースラインレベルと同程度であり、このレベルのIgA産生が主にTに依存していることを示唆していた。pec-オリゴ微生物に関連した表現型は、TCRβ×δ/-マウスでも同様に消失した(図S5A-S5F)。TCRβ×δ/-マウスは、 ɑβおよびγδT細胞の両方を欠損しており、 T依存性の抗体応答を獲得することができない。これらのデータを総合すると、pec-oligo微生物処理マウスにおけるIgA高値表現型の生成におけるCD4+ T細胞の重要な役割が支持される。
図5IgA高値表現型
図5IgA高値表現型はCD4+ T細胞に依存する
キャプション
大きな画像を見るダウンロード 高解像度画像
Lachnospiraceae属細菌A2はIgA高値表現型の潜在的なドライバーである
次に我々は、IgA高値表現型に寛容なpec-oligoドナーのマイクロバイオーム中の微生物を同定しようとした。上述したように、IgAを誘導する細菌は、グラム陽性菌とグラム陰性菌に対して幅広いスペクトラム活性を持つアンピシリン(図3E)に感受性があった42。抗生物質感受性を調べるため、pec-oligoドナーから抗生物質非投与のWTマウスにFMTを行い、その後、グラム陽性菌を標的とするバンコマイシン(図6A)またはグラム陰性菌を標的とするナリジクス酸/コリスチン(図S6A)でレシピエントマウスを処理した。 43,44,45我々は、バンコマイシンはIgA高値の表現型を逆転させるのに十分であったが、ナリジクス酸/コリスチン(図6BおよびS6B)は逆転させなかったこと、およびバンコマイシンを投与したpec-オリゴ群からの糞便IgAは投与2日後にベースラインレベルまで低下したことを見出した(図6B)。さらに、バンコマイシン投与後5日目の回腸SIgAレベルは、3群のマウス間で差を示さなかった(図6C)。これらのデータは、pec-オリゴドナーのマイクロバイオームにおけるバンコマイシン感受性細菌(グラム陽性分類群に富む)がIgA高値表現型を促進することを裏付けている。
図のサムネイルgr6
図6IgA高値表現型の誘導因子として有胞子性Lachnospiraceaeを支持する証拠
キャプション
大きな画像を見るダウンロード 高解像度画像
IgA-seqデータから、pec-oligo群に濃縮を示すグラム陽性生物を探索した(図3Gおよび3H)。C. arthromitusはこの基準に適合したが、糞便IgA 16S rDNAアンプリコンデータのリード数は、両コントロール群と比較して、pec-oligo群ではこの微生物が濃縮されていないことを示した(図S6C)。
次に、IgAの主要な誘導部位である小腸の微生物を評価した(図4)。3つのFMTレシピエント群を比較した小腸管腔バイオマスに差は検出されなかった(図S6D)。そこで、3群すべての従来型マウスレシピエントの小腸内容物から16S rDNAアンプリコンシークエンシング解析を行い、マイクロバイオームが異なることを示した(図6D)。さらに、FaecalibaculumとLigilactobacillusはpec-oligoレシピエント群のマイクロバイオームで非常に濃縮されていた(図S6E)。Faecalibaculum(図2D)のような糞便サンプルのシークエンシングデータと部分的には一致するが、pec-オリゴ受容者の小腸内容物において差次的に濃縮された分類学的単位は、IgA標的微生物とは重複を示さなかった(図3Gおよび3H)。さらに、pec-oligoの回腸内容物からFaecalibaculum rodentium(F.rodentium)株とLigilactobacillus murinus(L.murinus)株を分離し、その後、無菌マウスに単コロニー化した。しかし、これらの菌株はいずれも単独ではIgA高値表現型を誘導しなかった(図S6FおよびS6G)。
別のアプローチとして、機能試験用のバンコマイシン感受性微生物プールをさらに精製した(図6E-6J、S7C、およびS7D)。pec-oligoドナーの糞便スラリーを50%エタノール処理すると、未処理の完全糞便スラリーと同程度の糞便中IgAレベル(図6E)が誘導されることを見出した。エタノール処理は芽胞形成生物を濃縮する可能性があることから46、IgA誘導のこの過程におけるエタノール耐性微生物(芽胞の可能性)の役割を推測した。IgA高値表現型を誘導するエタノール耐性グラム陽性微生物をさらに絞り込むために、IgA高値表現型の潜在的なドライバーを絞り込むための一連の機能試験を行った。まず、無食餌、ビヒクル、およびpec-オリゴ処理ドナーの非エタノールまたはエタノール処理回腸内容物を無菌マウスに移植した(図6F)。pec-oligo腸内細菌のIgA誘導動態は、細菌群集全体(糞便細菌;図2F)のIgA誘導動態と同様であった: IgA高値はFMT後14日目までに始まった(図6G)。興味深いことに、エタノール処理したpec-オリゴ回腸マイクロバイオームは、無投与群およびビヒクル群の対応する細菌と比較して、無菌レシピエントにおいてIgAを誘導するのに十分であった(図6H)。
IgA高発現ドライバー候補を絞り込むために、次に無菌マウスレシピエントの糞便サンプルのショットガンメタゲノムシークエンシングを行った(図6H)(エタノール処理pec-oligo回腸マイクロバイオームを接種した無菌レシピエントと、無投与またはビヒクルの回腸マイクロバイオームを比較)。興味深いことに、Lachnospiraceae細菌A2だけが、pec-oligoグループのエタノール処理物に非常に濃縮されていた(pec-oligoグループのリードの42%に対し、コントロールのリードは最小レベル;図6I)。他の2つのLachnospiraceae(A4とM18_1)は、pec-oligoグループにはあまり存在せず、コントロールグループには存在した(図6I)。系統樹は、Lachnospiraceae bacterium A2がLachnospiraceae bacterium 3-1 acPFpおよびRoseburia intestinalis L1に遺伝的に最も近いことを示した(図S7A)。我々はLachnospiraceae bacterium A2に特異的なプライマーを設計し(図S7B)、PCR産物のサンガー配列決定により確認した(図6J)。予想通り、この微生物はpec-oligo群の無菌レシピエントの糞便サンプルにおいて、対照群と比較して濃縮されていた(約30倍)。
pec-オリゴ、エタノール処理した微生物が嫌気性血液寒天培地上で嫌気培養で維持できるかどうかを試験した(図S7B)。図6Hの無菌レシピエントの糞便細菌をプレーティングし、各群から培養物を採取し(プレートスクレイピングによる)、次いで抗生物質非投与の慣行飼育レシピエントに移植した。pec-oligo群の培養物は、糞便微生物群集全体(図3A)と同様のレベルまでIgA高値表現型(図S7C)を誘導した。我々は、pec-オリゴ受容体マウスの小腸内腔において、対照群受容体と比較してLachnospiraceae細菌A2の相対存在量が高い(約80倍)ことを検証した(図S7D)。この結果にもかかわらず、我々はLachnospiraceae bacterium A2の純粋培養を得るために同様の培養条件を作り出すことがまだできていないため、in vitroおよびin vivoではヘルパー株を必要とする可能性を示唆している。
重要な疑問は、図2および図3に示したわれわれのオリジナルFMT実験の小腸におけるLachnospiraceae bacterium A2の存在量と機能である。一つの課題は、Lachnospiraceae bacterium A2がもともと16S rDNAデータベースに登録されていなかったことである。図3AおよびS6Dのシークエンシングデータを再調査したところ、Lachnospiraceae bacterium A2のリード数は3グループとも同程度であり(図7A)、この微生物用に設計されたプライマーは3グループ間で存在量に差を示さなかった(図7B)。Lachnospiraceae bacterium A2および関連微生物は新たな研究分野であるため、16S rDNAの違いでは区別できない複数の関連微生物が存在する可能性がある。
図サムネイルgr7
図7Pec-オリゴエタノール耐性菌は、ラクノスピラ科細菌A2およびラクノスピラ科細菌A2以外の微生物に指向したIgAを産生する。
キャプション
大きな画像を見るダウンロード 高解像度画像
そこで、図2のように、従来のマウス移植の小腸におけるIgA結合Lachnospiraceae bacterium A2の検出に基づいて機能を検討した。しかし、小腸内腔内容物を用いてIgA-seqを行うことは、この場所でIgA結合微生物から得られるDNAが限られているため、技術的に不可能であることがわかった。代替案として、3つのレシピエントグループの小腸内容物を用いてIgAソーティングを行い、その後、Lachnospiraceae細菌A2を検出するために開発したプライマーを用いてPCR増幅を行った。興味深いことに、IgA+のLachnospiraceae細菌A2はpec-oligo群でのみ検出され、対照の2群では検出されなかった(図7C)。これはメタゲノム解析やエタノール耐性微生物を用いた機能試験(図6H-6J)と一致している。F. rodentiumとL. murinusも対照群のIgA+プールで検出されたことから、Lachnospiraceae細菌A2の存在下では、他の微生物がIgAの標的であることが示唆された(図7C)。
pec-オリゴレシピエントマウスにおける腸内IgAの反応性をさらに評価するために、細菌フローサイトメトリー計数およびIgA ELISA定量を用いた(図7D〜7F)。ビヒクル群およびpec-オリゴ受容体群の糞便スラリーを脳心筋梗塞(BHI)ブロス中で好気的に培養した。Lachnospiraceae細菌A2は、この方法による3回のサブカルチャー後に、もはや検出されなかった(図S7E)。次に、亜培養した細菌を、pec-オリゴレシピエントマウス由来のSIgAを含む糞便上清とインキュベートした。フローサイトメトリーによる定量は、pec-オリゴ糞便上清から単離されたIgAが、培養したビヒクルレシピエントと比較して、培養したpec-オリゴレシピエント由来の微生物により高頻度に結合することを示した(図7E)。さらなる検証として、Lachnospiraceae細菌A2(図S7E)を除く、ビヒクルレシピエントからのサブ培養微生物のタンパク質溶解物をELISAプレートにコートした。つのレシピエント群からのIgAを含む糞便上清と一晩インキュベートした後、光学密度測定により、pec-オリゴIgAはコントロール群からのIgAと比較して高い反応性を示した(図7F)。これらのデータは、IgA誘導の代替モデルを支持するものであり、pec-オリゴ群由来の回腸のエタノール耐性微生物の限られた群集が、共生微生物の配列に対するIgA産生のドライバーである。
pec-oligoとLachnospiraceae細菌A2の関係をさらに調べるため、この微生物がブロス培養で維持されるためにpec-oligoを利用できるかどうかを試験した。コントロールとして、セロビオース、デキストロース、マルトース、デンプンを含む炭水化物源のカクテルを加えた。予想通り、Lachnospiraceae細菌A2はpec-oligoを含むブロス培養でのみ維持された(図7G)。さらに、3群の無菌レシピエント(pec-oligoと2群のコントロール)から最初に得た微生物のpec-oligo添加ブロス培養物を、抗生物質非投与の慣行飼育レシピエントに接種した。pec-oligo群からのブロス培養物は、無投与群およびビヒクル対照群からのものと比較して、pec-oligoレシピエントにおいてより高い糞便中IgAレベルを誘導した(図7H)。予想通り、微生物接種後28日目のpec-oligoレシピエントでは、回腸IgAレベルも上昇した(対照2群に対して)(図7I)。重要なことは、pec-oligo投与マウスの回腸内容物中のLachnospiraceae細菌A2の相対量が、対照群2匹と比較して濃縮されていることを検出できたことである(図7J)。
これらのデータを総合すると、Lachnospiraceae bacterium A2に代表されるpec-oligo群由来の回腸のエタノール耐性微生物の限られた群集が、IgA高値表現型のドライバーとなりうるというモデルが確立された。さらに、pec-oligo投与マウスのIgAの高い多反応性は、pec-oligo群から選択された回腸のエタノール耐性微生物が、共生細菌を標的とした高レベルのIgAを広く駆動しているという我々の仮説を支持している。
考察
我々は、天然源(オレンジピールペクチン)から加工されたプレバイオティクスであるpec-oligoが、マウス腸内でIgA高値表現型を安定的に誘導することを見出した。IgAレベルは、実験に用いたWTマウスと同じコホートに属する2群のコントロールマウスに対して、pec-oligo処理マウスで高かった。pec-oligoは最初のIgA誘導には必要であったが、IgA高値の表現型を維持するためには、この処置は必要ではなかった。小腸はIgA高値表現型を誘導する主要な部位であり、この表現型はCD4+ T細胞に依存していた。次に、回腸マイクロバイオーム移植レシピエントにおける小腸マイクロバイオームの機能的特性に注目した。エタノール耐性グラム陽性微生物の小さな集団がIgA表現型を移し、ディープメタゲノムシークエンシングにより、pec-オリゴドナーではLachnospiraceae細菌A2が濃縮されていることが示された。pec-オリゴ受容体の高IgAは、Lachnospiraceae細菌A2を含む腸内微生物に対する広範な反応性の上昇を示した。In vitroでは、Lachnospiraceae bacterium A2自体がpec-oligoに反応し、高IgA表現型のドライバーとしての役割を支持した。これらの結果を総合すると、ラクノスピラ科細菌A2はpec-oligoを利用し、IgA高発現型のドライバーとなり、共生細菌に向けられたIgA産生を広く刺激することが示唆された。これらの知見は、他の系で観察されているIgA高値表現型の生成に関する代替モデルを支持するものである。34,47 我々のモデルは、限られた数の微生物(すなわち、ラクリス菌A2)が、多くの共生生物へのIgA産生を促進し、その結果、IgAの全体的なレベルを上昇させることを示唆している。
IgA高値の表現型が、pec-oligoドナーからのFMTで、抗生物質処理されていない、従来通りに飼育されたレシピエントに伝達されたことは、当初驚くべきことであった。このような容易なコロニー形成は、マウスではCitrobacter rodentium、ヒトでは腸管病原性大腸菌や腸管出血性大腸菌のような選択的な腸内病原体で典型的に起こる。
2つの対照群(無食餌とビヒクル食餌)では、糞便中のIgA濃度に驚くべき違いが見られた。小腸では、IgAの産生と送達は同程度であったが、ビヒクル投与群の糞便中IgA濃度は、常にELISAで検出できるレベルか、それに近いレベルであった。ビヒクル群の糞便中IgAのベースラインレベルが低いことのメカニズムはまだ確立されていないが、1つの可能性として、IgA分解菌50が毎日の経口摂取という慢性的なストレスによって上昇および/または活性化することが考えられる51。この対照群では、プレバイオティクスがマイクロバイオームに与える影響が、この対照群で観察された糞便中IgAの低レベルを克服したことから、ペックオリゴ投与の効果の新たな側面が明らかになった。
驚くべき発見のひとつは、pec-oligo投与マウスの糞便および回腸のマイクロバイオーム(バルク16S rDNA分析により決定)が、IgA標的微生物(IgA-seqにより決定)とほとんど、あるいは全く重複しなかったことである。この不一致は、ユニバーサルプライマーの偏った親和性と16S rDNA解析の短いリードサイズに起因する可能性がある。この欠陥は、糞便ペレットのような高複雑度サンプルで増幅される可能性があり、そのようなサンプルでは、ユニバーサルプライマーによって増幅される分類群が多いか少ないかもしれない。しかしながら、これらの微生物はいずれもIgAレベルを上昇させなかった。このことは、存在量ベースのシーケンス技術の限界を裏付けるものである:異なる存在量の微生物は、与えられた宿主の表現型のドライバーではなく、同乗者にすぎないかもしれない54。
Lachnospiraceae bacterium A2はこのデータベースには含まれておらず、他の類似微生物との関係も調査されていない。そのため、IgA-seqでも、16S rDNAによる微生物移行の調査でも、この微生物は検出されなかった。エタノール処理による)微生物プールの機能的制限に焦点を当てた我々のアプローチは、ショットガンメタゲノム配列決定と検証実験と相まって、高IgA表現型の潜在的なドライバーとしてLachnospiraceae細菌A2を同定するのに不可欠であった。このアプローチにより、高IgAの他のドライバー微生物もこの実験モデルに存在する可能性があり、採用した方法では発見できなかった。
T細胞依存性のIgA高値反応は多細菌性であり、Lachnospiraceae細菌A2を含んでいた。対照的に、ベースラインのIgAレベルは、他の研究と同様に、ほとんどT細胞に依存しないようである55。Lachnospiraceae bacterium A2に対する多反応性IgA反応のメカニズムとして考えられるのは、(1)T細胞が線状エピトープを共有することにより、連鎖認識を介してこれらの微生物上の3Dエピトープに特異的なB細胞が活性化される、 56 (2)同族T/B細胞相互作用がない場合のB細胞のバイスタンダー活性化(同族T細胞の助けがない場合の粘膜抗ウイルスIgA産生)57、および(3)T細胞ヘルパー応答またはB細胞活性化を直接支援するラクノスピラ科細菌A2のアジュバント特性。 58 このメカニズムを解明するには、さらなる研究が必要である。
大腸でIgAを誘導する微生物、例えばOdoribacter splanchnicusは、大腸炎からの代謝および免疫細胞の防御を促進する。ここでは、小腸でIgA高発現型を誘導し、エタノール前処理と無菌レシピエントへの回腸マイクロバイオーム移植を組み合わせた機能試験を行うことで、潜在的なIgA誘導細菌を発見するモデルを提供した。
我々は、Lachnospiraceae細菌A2がIgA高値表現型の潜在的なドライバーであることを提唱する。まず、pec-oligoドナーのエタノール処理物を用いた無菌レシピエントの糞便サンプルのメタゲノム配列決定データから、リードの約42%がこの細菌由来であることが示された。これに対し、対照の2群では、この菌のリードはごくわずか(約1%)であった。エタノール処理したpec-oligo群では、11の生物について検出可能な配列が含まれており、pec-oligo群で配列が濃縮された他の生物はいなかった。第二に、エタノール処理したpec-oligo微生物は、無菌マウスと抗生物質非投与の通常飼育マウスの両方に移植すると、IgA高値の表現型を作り出した。qPCRによる定量では、従来のマウスレシピエントの回腸内容物においてLachnospiraceae細菌A2が濃縮されていた(約80倍)。従来型マウスにおけるIgA表現型の刺激は、IgA高値表現型のドライバーとしてのLachnospiraceae細菌A2の役割を支持する。
pec-oligoによって増強されたLachnospiraceae bacterium A2はこのオリゴ糖に選択的であるようである。他のオリゴ糖、例えばガラクトオリゴ糖やキシロオリゴ糖を用いた動物での研究では、Lachnospiraceae属細菌A2とは異なるLachnospiraceae属細菌の増強が報告されている66,67。他の広く用いられている非デンプン多糖類(例えばLycium barbarum多糖類、イヌリン、オリゴフルクトース)は、芽胞形成Clostridiumの増強と関連している68,69,70。注目すべきは、芽胞形成菌であるクロストリジウム・パーフリンゲンス(Clostridium perfringens)とクロストリジウム・ボツリヌス(Clostridium botulinum)は、デンプンのアミロ分解反応から生じる利用可能な炭水化物によって強化される可能性があることである71,72。クロストリジウム・パーフリンゲンス(Clostridium perfringens)、クロストリジウム・ディフィシル(Clostridium difficile)、クロストリジウム・ボツリヌス(Clostridium botulinum)が嫌気性感染症の主要な原因であることを考えると、73,74,75 動物やヒトが消費する多糖類の種類の選択には慎重であるべきである。
今回の知見は、腸内に基幹種が存在するという概念を支持するものである。本研究のデータは、全体的なIgA値を上昇させる基幹種の存在を支持しており、Lachnospiraceae bacterium A2がこの定義に当てはまる可能性を示唆している。この概念をさらに検証するためには、この微生物を含む、あるいは含まない意図的な群集を作る今後の研究が必要である。この研究の潜在的な意義は、ペックオリゴのような長期的な食事介入によって、粘膜免疫系と広く接することができるマイクロバイオームのキーストーン種が濃縮される可能性があるということである。
STAR★方法
主要資源表
試薬またはリソース識別子 ソース識別子
抗体
抗マウスpIgR/SC R&D System Cat#AF2800; RRID:AB_2283871
抗ヤギ IgG (H+L), Alexa Fluor 568 Invitrogen Cat#A11057; RRID:AB_2534104
抗ヤギ IgG (H+L)-HRP Invitrogen Cat#31460;
抗β-アクチンSigma Cat#A5441; RRID:AB_476744
抗マウス IgG-HRP Biolegend Cat#405306; RRID:AB_315009
AlexaFluor488 標識ヤギ抗マウス IgA Serotec Cat#STAR137F; RRID:AB_2075636
抗マウス CD4 Abcam Cat#ab183685; RRID:AB_2686917
抗ウサギ IgG (H+L), Alexa Fluor 488 Invitrogen Cat#R37116; RRID:AB_2556544
抗マウス IgA α鎖-HRP Abcam Cat#ab97235; RRID:AB_10681186
抗マウスIgM mu鎖-HRP Abcam Cat#ab97230; RRID:AB_10688258
抗マウス CD16/32 BD Biosciences Cat#560539; RRID:AB_1645268
抗 CD4-FITC BD ファーミンゲン Cat#561828; RRID:AB_10896658
抗 CD8α-APC BD ファーミンゲン Cat#561093; RRID:AB_10563416
InVivoMAb 抗マウス CD4 Bio X Cell Cat#BE0119; RRID:AB_10950382
InVivoPlus 抗マウス CD4 Bio X Cell Cat#BP0003-1
InVivoPlus ラット IgG2b アイソタイプコントロール Bio X Cell Cat#BP0090
抗 IgA-PE eBioscience Cat#12-4204-83; RRID:AB_465918
HRP結合抗IgA抗体 Invitrogen Cat#62-6720; RRID:AB_138466
細菌およびウイルス株
Faecalibaculum rodentium この試験 該当なし
Ligilactobacillus murinus この試験 該当なし
生物学的サンプル
糞便サンプル(マウス) 本試験 N/A
Jejunum and ileal content samples (mouse) 本試験 N/A
糞便および大腸内容物サンプル(マウス) 本試験 N/A
この試験 N/A Jejunum and ileal tissue (mouse) この試験 N/A
大腸組織(マウス) 本試験 N/A
血清(マウス) 本試験 N/A
糞便細菌懸濁液(マウス) 本試験 N/A
化学物質、ペプチド、組換えタンパク質
柑橘類の皮のペクチン Sigma Cat#9000-69-5
アンモニア Thermo Scientific Cat#1336-21-6
過酸化水素 Thermo Scientific Cat#7722-84-1
塩酸 Thermo Scientific Cat#7647-01-0
抗 PE マイクロビーズ Miltenyi Biotechnology Cat#130-048-801
ウシ血清アルブミン(BSA)Sigma Cat#A3294
プロテアーゼ/ホスファターゼ阻害剤カクテル Cell Signaling Technologies Cat#5872S
寒天 Sigma Cat#A7921
マルチ96カラム Miltenyi Biotechnology Cat#130-092-445
パラホルムアルデヒド(PFA)、32% Electron Microscopy Sciences Cat#15714
Hoechst 33342 溶液(20 mM) Thermo Scientific Cat# 62249
重要な市販アッセイ
マウス IgA ELISA キット Immunology Consultants Labs Cat # E-90A
マウス IgG ELISA キット Immunology Consultants Labs Cat # E-90G
マウスIgM ELISAキット Immunology Consultants Labs Cat # E-90M
QIAamp Powerfecal Pro DNA キット Qiagen Cat#51804
MagAttract 微生物 DNA キット Qiagen Cat#27200-4
NucleoSpin® RNA 分離キット Clontech Cat# 740984.5
Pierce™ BCA タンパク質アッセイキット Thermo Scientific Cat # 23225
SuperSignal West Pico PLUS 化学発光キット Thermo Scientific Cat # 34577
寄託データ
16S rDNA 遺伝子シーケンスデータセット この研究 BioProject PRJEB59479
メタゲノムシークエンシングデータセット 本試験 BioProject PRJEB59479
実験モデル 生物
C57BL6/J The Jackson Laboratory stock # 000664; RRID:IMSR_JAX:000664
TCRβδ KO The Jackson Laboratory stock # 002122; RRID:IMSR_JAX:002122
無菌マウス Cleveland Clinic Lerner Research Institute Gnotobiotic Facility N/A
オリゴヌクレオチド
GAPDHプライマー、fwd: 5'-AGGTCGGTGTGAACGGATTTG-3'; Moonら、201563 PMID: 24220295 N/A
GAPDHプライマー、rev:5'-TGTAGACCATGTAGTTGAGGTCA-3'
pIgRプライマー、fwd: 5'-ATGAGGCTCTACTTGTTCACG C-3' Moonら、201563 PMID:24220295 N/A
pIgRプライマー、rev:5'-CGCCTTCTATACTACTCACCTCC-3'
Feacalibaculum rodentiumプライマー、fwd: 5'-GGATGCGAAGATGCAGAGAT-3';本研究 N/A
Feacalibaculum rodentiumプライマー、rev:5'-TGGCATGAGTCCTCAGCTT-3'
Ligilactobacillus murinusプライマー、fwd: 5'-CCAAGGCAATGATGCGTAGC-3';本研究 N/A
リギラクトバチルス・ムリヌスプライマー、レブ:5'-AATCCGGATAACGCTTGCCA-3'
ラクリス菌A2プライマー、fwd: 5'-GGACAACAGCCGGAAACG-3'′;本研究 N/A
Lachnospiraceae bacterium A2プライマー、rev:5'-TTCACATCAGGCTTGCCAG-3'
ソフトウェアとアルゴリズム
Prism 9.0 ソフトウェア GraphPa N/A
ImageJ 米国国立衛生研究所 N/A
Illustrator CC Adobe N/A
新しいタブで表を開く
リソースの有無
連絡先
更なる情報要請は、主任連絡先であるThaddeus Stappenbeck (STAPPET@ccf.org)までお願いします。
材料の入手可能性
本試験で使用された全てのユニーク/安定試薬は、Materials Transfer Agreement(材料譲渡同意書)に記入の上、研究責任者から入手可能である。
実験モデルと被験者の詳細
倫理的配慮
動物の世話および実験はNIHガイドラインに準拠し、すべての動物モデル研究はCleveland ClinicのInstitutional Animal Care and Use Committeeの承認を得た(IACUCプロトコル番号2281)。
動物と飼育条件
C57BL/6J(ストック番号000664)マウス(4~6週齢)およびTcrbtm1Mom Tcrdtm1Mom/J(ストック番号002122)繁殖ペアはJackson Laboratoryから購入し、すべての動物はCleveland Clinicの病原体フリー施設で維持飼育した。6~8週齢のTcrbtm1MomTcrdtm1Mom/Jの子供は、実験の同じバッチについて異なる治療群に割り当てられた。マウスは個体換気ケージ(IVC)に入れられ、1ケージあたり5匹以下で、14時間の明暗サイクルで飼育された。すべてのマウスは、抗生物質投与期間中を除き、施設から日常的に供給される酸性化飲料水を摂取した。実験に先立ち、マウスの糞便サンプルはCharles River Laboratory Testing Management® (LTM™)プラットフォームにより、原虫/ウイルス/真菌が陰性であることを確認した。
Cleveland Clinic Lerner Research Institute Gnotobiotics Facilityで、HEPAフィルター付きプラスチック製フレキシブルフィルム製グノトバイオティクス・アイソレーターで無菌C57BL/6マウスを飼育した。6~8週齢のグノトバイオティクスマウスは、実験研究のために無菌のアレンタウン密閉陽圧ケージに移され、維持された。すべてのマウスは、14時間明期/10時間暗期の厳格なサイクルのもと、滅菌水と餌を自由に摂取できるよう制御された環境で飼育された。マウスの無菌状態はGnotobiotics Facilityにより毎週確認された。
ガベージ実験(pec-oligo経口投与)
C57BL/6J(B6)マウスを、経口投与なし、ビヒクル、pec-oligo(4匹/ケージ)の3群に無作為に割り付けた。ケージ効果を考慮し、ビヒクル群とpec-oligo群には2ケージずつマウスを入れた。投与なし」群にはpec-oligoを投与せず、「ビヒクル」群にはpec-oligo投与マウスと同量の滅菌水を投与した。我々の先行研究26に基づき、pec-oligo群マウスは0.8pec-oligo g/Kg体重の1日投与量を受けた。ビヒクル群、pec-oligo群ともに、d49にマウスを犠牲にするまで毎日経口投与した。
マウスへの抗生物質投与
マウスレシピエントから内因性微生物を除去するため、あるいは機能性細菌の抗生物質耐性を試験するため、本研究では以下の3つの抗生物質投与戦略を用いた: 複合抗生物質のVNAMカクテル(0.5mg/mLバンコマイシン、1mg/mLネオマイシン、1mg/mLアンピシリン、1mg/mLメトロニダゾール);グラム陰性菌またはグラム陽性菌を標的とするレジーム:コリスチン(600μg/gavage/マウス)とナリジクス酸(10mg/mL)の組み合わせ、または単一のバンコマイシン(0.5mg/mL)と単一の広域スペクトル抗生物質アンピシリン(1mg/mL)。
固有の微生物負担を最小化するため、VNAMを2~3週間、飲水で自由摂取させ、介入期間中はケージを週3回交換した。
IgA誘導菌の抗生物質感受性を調べるため、まず、pec-オリゴ処理ドナーからの微生物叢を、非抗生物質処理した従来飼育のB6マウスレシピエントに移植し、IgAレベルがプラトーに達した時点で、レシピエントをコリスチン/ナリジクス酸、バンコマイシンまたはアンピシリンで処理した78,79。
糞便微生物叢移植(FMT)
経口投与実験の48日目に、各マウスから糞便サンプルを採取し、同じ治療を受けたサンプルを経口投与なし、ビヒクル、pec-oligoとしてプールした。プールしたサンプルを滅菌PBSに再懸濁し、最終濃度200mg/mLとし、0.45μmストレーナーで濾過し、OD600(2.0-3.0)の滅菌グリセロール(50%v/v)と1:1で混合し、使用まで-80℃で凍結した。各マウスは、解凍した懸濁液200μL(OD600で測定した約5×108 CFUに等しい)を、対応するレシピエントに3日間連続で経口投与した。
CD4+ T細胞枯渇実験では、pec-oligo処理マウスの糞便微生物叢が唯一のドナーであり、比較のためにWTまたはCD4+ T細胞欠損の非抗生物質前処理B6レシピエントに導入された。
TCRβ×δ-/-レシピエントに対しては、経口摂取なしまたはpec-oligoドナーからの糞便微生物叢を移植した。WTマウスの糞便中IgAのベースラインレベルのため、経口摂取なしのドナーの微生物叢を対照群とした。
すべてのFMT実験において、各マウスの糞便サンプルを移植開始後毎週採取し、IgA測定またはマイクロバイオーム解析のために-80℃で保存した。
回腸微生物叢移植(IMT)
まず、3つのドナー群(経口投与なし、ビヒクルおよびpec-oligo)からのFMTを、抗生物質非投与の通常飼育WTマウスに導入し、その後、糞便中IgAがプラトーに達した時点でマウスレシピエントを安楽死させた。コンタミネーションを避けるため、安楽死させた各マウスを70%エタノールに15分間浸した。小腸全体を3等分し、最も近位端と最も遠位端の約2cmの組織を廃棄した。回腸内容物を滅菌冷PBSで洗浄し、同じ処理からFMTレシピエントマウスの回腸細菌懸濁液をプールした。これらをそれぞれ、経口投与なしの回腸マイクロバイオーム(IM)、ビヒクルIM、pec-oligo IMと命名した。
pec-oligoのIMは2つに分注した。一方は直ちに微生物叢移植に使用した。もう1つの部分の細菌細胞をペレット化し、1mLの50%エタノールに再懸濁し、好気的条件下でシェーカー上で1時間揺動させた。この懸濁液を滅菌PBSで3回洗浄した。これをエタノール処理pec-oligo IMと命名した。
全ドナー(群)のエタノール処理および未処理の回腸材料を滅菌PBSで5×109 CFU/mLに調整した。無菌マウスを3回経口投与することでコロニー形成させた(回腸内容物200μL/回/マウス)。IgA測定またはマイクロバイオーム解析のため、FMT後に糞便ペレットを毎週採取した。
従来のC57BL/6JマウスにおけるCD4+ T細胞の枯渇
CD4+ T 細胞のインビボでの枯渇は、若干の調整を加えて記述されたとおりに実施した。82,83 手短に言えば、まず従来の B6 マウス(8 週齢)に、抗マウス CD4 モノクローナル抗体(Bio X Cell、クローン GK 1.5、クローン YTS 191)を各 0.2 mg/日/マウス、またはマッチさせたアイソタイプ対照抗体(Bio X Cell、クローン LTF-2)を 0.4 mg/日/マウスで 3 日間連続して腹腔内(i.p.)注射した。その後、実験期間中5日ごとにi.p.注射を行った。最初の抗体注射の3日後、CD4+ T細胞欠損マウスとCD4+ T細胞充足マウスの両方に、pec-oligo細菌懸濁液を経口経口投与で接種した。糞便サンプルは、将来の分析のために、FMT開始後毎週、各レシピエントから採取した。
共同飼育試験
まず、抗生物質を投与していないB6レシピエントに、経口摂取なしまたはpec-oligoドナーのマイクロバイオームを移植した。次に、得られたIgA-basal(10-180μg IgA/糞便グラム;Jackson Laboratory由来)またはIgA-highの雄を、Jackson Laboratory由来の年齢をマッチさせた雌と3週間まで同居させた(1:1)。IgA測定のため、同居の前後に雌の飼育者から糞便サンプルを採取した。さらに、この表現型が垂直伝播するかどうかを決定するために、IgA高値のブリーダーと経口摂取なしのブリーダーの成体の子孫のIgAレベルを比較した。
試験管内での微生物培養
エタノール処理したpec-oligo回腸微生物を無菌レシピエントに接種し、糞便IgAがプラトーに達した後に糞便を採取した。糞便サンプルを滅菌PBSに再懸濁し、ストックとして最終濃度200mg/mLとした。試験管内培養では、1:100のストック希釈液50μLを1単位のニート接種液とした。CDC寒天培地プレート(Anaerobe systems, # AS-646)に1:10のニート接種液をプレーティングし、コントロール群も含めて4日間嫌気培養した。掻爬した培養物を抗生物質非投与の通常飼育マウスに移植した。糞便中IgAは、移植開始後毎週検査した。
in vitroのブロス培地培養では、炭水化物添加および炭水化物無添加の刻み肉培地(Anaerobe systems, #AS -811 および #AS -823)を1:100で接種した。炭水化物を含まないチョップドミート培地には0.1g/mLのpec-oligoを添加した。微生物DNAを抽出し、接種7日後にLachnospiraceae菌A2についてPCR/qPCRを行った。
方法の詳細
柑橘類果皮ペクチンからのペクチンオリゴ糖(pec-oligo)の調製
ペックオリゴは、以前に記載された化学分解法によって調製した26。簡単に説明すると、柑橘類の果皮ペクチンを脱イオン水(1%、V/M、pH=10)に溶解し、pHを記録してアンモニアで10に調整した。この溶液を90℃で10分間安定化させた後、0.78Mの過酸化水素(H2O2)を添加し、90℃で3.0時間振とう機にかけた。その後、エタノール沈殿の前にHClを用いてpHを元のpHに調整した。ガラクツロン酸(62.74%)、ガラクトース(26.44%)、グルコース(7.64%)、ラムノース(2.18%)からなる分子量3.543×103 Daのpec-オリゴを本研究に用いた。
血清、管腔内容物および組織サンプルの採取
血液サンプルは、イソフルラン麻酔をかけたマウスから心臓穿刺により採取した。分離した血清試料は、免疫グロブリン分析のために-80℃で凍結保存した。各マウスの空腸および回腸組織は、上記の「回腸マイクロバイオーム移植」の項に記載したように採取した。空腸、回腸、盲腸、結腸の内腔内容物を氷冷PBSで洗浄し、IgA分析用に-80℃で凍結した。RNAおよびタンパク質抽出のために、各腸管セグメント(空腸、回腸、結腸)から組織の小切片2枚(約1cm/セグメント)をスナップ凍結する。空腸、回腸、結腸からそれぞれ組織(約3cm/セグメント)を採取し、4%パラホルムアルデヒドで固定した後、パラフィン包埋し、免疫染色のために厚さ5μmの横断切片を切り出した84,85。
ELISAによる免疫グロブリンの定量
総糞便/腔内および血清IgA、ならびに血清IgGおよびIgMを、製造業者の説明書に従ってサンドイッチELISAキット(Immunology Consultants Labs)を用いて検出した。吸光度は、SpectraMax iD3 Multi-Mode Microplate Reader(Molecular Devices, San Jose, CA)を用いて450 nmで測定した。
糞便中IgAの検出には、毎週マウスから糞便ペレットを採取し、滅菌PBSに100mg/mLの重量/容量になるように懸濁した。糞便を3,000rpm、25℃で10分間ボルテックスした後、14,000rpm、25℃で10分間遠心した。上清は測定まで-80℃で保存した。製造者の指示に従ってサンドイッチELISAキット(Immunology Consultants Labs)を使用し、調製した上清から糞便中IgA濃度を測定した。吸光度は、SpectraMax iD3 Multi-Mode Microplate Reader(Molecular Devices, San Jose, CA)を用いて450nmで測定した。個々の図のデータを作成するため、すべてのサンプルを同じキットを用いて同時にELISAで評価した。ELISA用に調製した上清の標準希釈は1:300であった。いくつかの実験では、この標準希釈を変更し、図の凡例に示した。内腔洗浄液と血清の希釈倍率は、それぞれ1:100と1:200であった。
免疫ブロッティング
プロテアーゼ阻害剤カクテル(Thermo Scientific)およびEDTA(Thermo Scientific)を含む500μLのRIPA緩衝液中で、Fastprepビーズビーターシステム(MP Bio、BioSpec)を用いて腸組織セグメントからタンパク質を単離した。総タンパク質はPierce BCA Protein Assay Kit(Thermo Scientific)で定量した。等量のタンパク質をSDS-PAGE(AnykDまたは7.5%Mini-Protean TGXゲル、Bio Rad)で分離し、ニトロセルロース膜(Bio Tris-Rad)に転写した。膜をReagent Blocking One(nacalai tesque)で30分間、または0.1% Tween-20トリス緩衝生理食塩水中の5%無脂肪牛乳で室温で1時間ブロックし、ヤギIgG抗Pigr/SC(R&D、カタログ番号AF2800)またはマウス抗β-アクチン(Sigma、カタログ番号A5441)で4℃で一晩プローブした。ブロットをワサビペルオキシダーゼ結合多価ロバ抗ヤギまたはヤギ抗マウス免疫グロブリン二次抗体(Invitrogenカタログ#A16005、Biolegendカタログ#405306)で1時間インキュベートした後、SuperSignal West Pico PLUS化学発光キット(Thermo Scientific)で現像した。
糞便上清は前述のように調製し、SDS-PAGEゲルにロードする前に10倍に希釈した。次に、ブロックしたメンブレンを、製造元の指示に従って、西洋ワサビペルオキシダーゼ結合ヤギ抗マウスIgAα鎖(Abcam、カタログ番号ab97235)と1時間インキュベートした。血清サンプルの検出には、西洋ワサビペルオキシダーゼ結合ヤギ抗マウスIgAα鎖、ヤギ抗マウスIgGまたはヤギ抗マウスIgM mu鎖(Abcam、カタログ番号ab97230)抗体を用いた。
組織の調製と免疫蛍光分析
組織切片を脱パラフィンし、水和し、Trilogy solution(Cell Marque社)で20分間煮沸し、PBSでリンスし、10 mg/mL ウシ血清アルブミン/0.1% Triton-X100で30分間ブロックし、一次抗体と4℃で一晩インキュベートした。以下のタンパク質に対する抗体を指示希釈で使用した: Pigr 1:500(R&Dシステムズ、カタログ#AF2800)、IgA-AlexaFluor488 1:200(Serotec、カタログ#STAR137F)、CD4 1:500(Abcam、カタログ#ab183685)。PBSで3回洗浄後、AlexaFluor568標識ロバ抗ヤギ1:500(Invitrogen、カタログ#A11057)およびAlexaFluor488標識ヤギ抗ウサギ1:500(Invitrogen、カタログ#R37116)を、それぞれPigrおよびCD4タンパク質用の二次抗体として使用した。室温で1時間インキュベートした後、スライドをPBSで3回洗浄し、核を可視化するためにビスベンズイミド/ヘキスト(Invitrogen)で染色し、Fluoromount™ Aqueous Mounting Medium(Sigama、カタログ番号F4680)でマウントした。染色はLeica TCS SP5顕微鏡で可視化した。
簡単に言えば、AlexaFluor568チャンネルとbis-benzimide/Hoechst染色の両方について、一定の光照射で15~20枚のランダム画像を盲検下で撮影した。pec-オリゴと他の2つの対照群との間のタンパク質分布パターンの変化を調べるため、各画像を陰窩と絨毛の切片に分離した。次に、図S3Aに示すように、絨毛を断面に沿って2つの部分に分注した。すべての部分をImageJソフトウェアバージョン10.2(NIH、メリーランド州ベセスダ)を用いて処理し、各切片(全域、陰窩、下部の絨毛、上部の絨毛)のPigr発現レベルをシグナルの積分密度によって計算し、次に関心領域に対して正規化して平均グレー強度を得た。
IgA+分泌細胞を定量化するために、全群を全く同じ画像取得パラメータで撮像し、各マウスから約20のよく配向した絨毛の陽性細胞数を数えた。絨毛は盲検下で無作為に選択し、読み取り値は絨毛あたりのIgA+細胞数で表した。統計解析のため、各染色は、マウス1匹につき15~20画像/20絨毛に対応する各染色の平均値をとって算出し、一元配置分散分析(ANOVA)検定を適用して、群間のシグナル差の有意性を決定した。
脾臓細胞のフローサイトメトリー
CD4+ T細胞シグナル伝達に対する抗体の遮断効率を評価するため、解剖中に脾臓を採取した。脾臓から単離した細胞を、既述のようにFITC標識抗マウスCD4抗体またはAPC標識抗マウスCD8α抗体(BD Pharmingen)で染色した87。簡単に述べると、免疫グロブリンのFcレセプターへの非特異的結合を抗マウスCD16/32抗体(BD Biosciences)でブロックした後、細胞を標識抗体(100μLのPBS/0.1%BSA中、106細胞あたり1μgのAb)と氷上で30分間インキュベートし、最後にPBS/0.1%BSAで3回洗浄した。標識細胞を1%パラホルムアルデヒドに再懸濁し、CellQuestソフトウェア(BD Biosciences)を用いてBD Biosciences FACScanで解析した。各サンプルについて合計1,000,000イベントを取得し、解析した。
免疫グロブリン(Ig)Aでコートされた微生物叢の選別と配列決定
IgA-SEQは、基本的に以前に記載された方法で実施した88。無菌レシピエントからの凍結糞便サンプルを50 mg/mlの冷PBSに再懸濁し、氷上で15分間インキュベートした後、ボルテックスでホモジナイズし、100 g、4℃で10分間遠心分離した。上清中に回収された糞便細菌は、14,000 gで2分間遠心分離してペレット化し、冷PBS/1% BSAで2回洗浄した。得られた細胞を正常ラット血清で20分間ブロックし、抗IgA-PE(クローンmA-6E1)で30分間染色した。細胞をPBS,1%BSAで3回洗浄し、抗-PE MicroBeads (Miltenyi Biotec, cat#130-048-801)で15分間インキュベートした。MultiMACS™ M Separator(Miltenyi Biotec Inc.)上のマルチ96カラム(Miltenyi Biotec, cat#130-092-445)を用いて、ポジティブセレクション(IgA+)に続いてネガティブセレクション(IgA-)を行うために、特注の96ウェル磁気セパレーターを使用した。得られた陽性および陰性選択菌プールから、MagAttract Microbial DNA kit(Qiagen社製)を用いてDNAを抽出した。次に、16SリボソームRNA遺伝子のV4領域をMiSeq(2×250;Illumina)を用いて、以前に記載されたとおりに配列決定した89。微生物多様性解析は、Quantitative Insights into Microbial Ecology(QIIME version 2)解析スイートを用いて行った90。QIIIME 2 では、Greengenes 13_8 99% OTUs で学習させた分類法を用い、V4 領域にトリミングして分類した。フィーチャーテーブルは40,000配列/サンプルのシーケンス深度で希釈した。5サンプル未満で検出された分類群をフィルターで除去し、IgAコーティング指数(ICI)を、IgA陽性サンプルの分類群の相対存在量とIgA陰性サンプルの存在量の間の割合として各分類群について計算した。Pec-oligo群とビヒクル群のIgA+プールにおける分類群存在量の差を評価するため、Mann-Whitney検定のq値を算出し、Benjamini-Krieger-Yekutieliを用いてP値をFDR補正した。
試験管内での機能性微生物培養
エタノール処理したペックオリゴ回腸微生物を無菌レシピエントに接種し、糞便IgAがプラトーに達した後に糞便を採取した。糞便サンプルを滅菌PBSに再懸濁し、最終濃度200mg/mLをストックとした。試験管内培養では、50μLの1:100ストック希釈液を1単位のニート接種液と定義した。CDC寒天培地プレート(Anaerobe systems, # AS-646)に1:10のニート接種液をプレーティングし、コントロール群も含めて4日間嫌気培養した。掻爬した培養物を抗生物質非投与の通常飼育マウスに移植した。糞便中IgAは、移植開始後毎週検査した。
in vitroのブロス培地培養では、炭水化物を含む刻み肉培地と含まない刻み肉培地(Anaerobe systems、#AS-811および#AS-823)を1:100で接種した。炭水化物を含まないチョップドミート培地には0.1g/mLのペックオリゴを添加した。微生物 DNA を抽出し、接種 7 日後に Lachnospiraceae 細菌 A2 の PCR/qPCR を行った。
腸内組織におけるPigr mRNAの定量的解析
NucleoSpin® RNA isolation kit(Clontech; Mountain View, CA)を用いて、空腸、回腸、結腸組織からRNAを単離した。相補的DNA(cDNA)合成は、0.2μgのRNAとSuperScript III逆転写酵素(Life Technologies)を用いて行った。定量的PCR反応(qPCR)は、SYBR Advantage qPCR Premix(Clontech; Mountain View, CA)を用い、40 ngの合成cDNAを用いてLightCycler 480システム(Roche, Branchburg NJ)で行った。発現レベルはサンプルごとに3連で測定し、グリセルアルデヒド3リン酸デヒドロゲナーゼ(Gapdh)の発現で正規化した。プライマー配列は以下の通り: Gapdhフォワードプライマー、5'-AGGTCGGTGTGAACGGATTTG-3';Gapdhリバースプライマー、5'-TGTAGACCATGTAGTTGAGGTCA-3';Pigrフォワードプライマー、5'-ATGAGGCTCTACTTGTTCACG C-3';Pigrリバースプライマー、5'-CGCCTTCTATACTACTCACCTCC-3'93。
PCR増幅と微生物の定性分析
ゲノムDNAは、Quick-DNA™ Fecal/Soil Microbe Miniprep Kit(Zymo Research, Irvine, CA, USA)を用いて、IMT実験における無菌マウスレシピエントおよび通常飼育マウスレシピエントの糞便サンプルから抽出した。qPCRアッセイは、Lachnospiraceae細菌A2の相対存在量を測定するために行った。25ulのqPCRシステムには、12.5ulの2X TB Green® Advantage® qPCR Premix、1ulのフォワードプライマーとリバースプライマー(10uM)、10ngのDNA鋳型、およびPCRグレードの水が含まれていた。特異的プライマーの配列は以下の通りである: Lachnospiraceae bacterium A2 - F, 5'-GGACAACAGCCGGAAACG-3'; Lachnospiraceae bacterium A2 - R, 5'- TTCACATCAGGCTTGCCAG -3'; Feacalibaculum rodentium forward primer, 5'-GATGCGAAGATGCAGAGAT-3'; Feacalibaculum rodentiumリバースプライマー、5'-TGGCATGAGTCCTCAGCTT-3';Ligilactobacillus murinusフォワードプライマー、5'-CCAAGGCAATGATGCGTAGC-3';Ligilactobacillus murinusリバースプライマー、5'-AATCCGGATAACGCTTGCCA-3'。すべてのプライマーは、サンガー配列決定によって検証された。
IgA多反応性ELISAおよび細菌フローサイトメトリー
pec-オリゴマウスから生成したIgA多反応性は、以前に記載されたものを改変して試験した。94 ビヒクル群およびpec-オリゴ群から採取した糞便スラリーを、37℃の振盪培養器中で、Brain Heart Infusion(BHI)ブロス中で、1:100の割合で24時間好気的に培養した。培養菌は、Lachnospiraceae菌A2(PCR法で確認)を確実に枯渇させるため、接種比1:100で連続3日間、さらに3回継代培養した。次いで、5×108 CFUの下培養細菌を、pec-オリゴレシピエントマウスから生じたIgAを含むニート糞便上清と4℃で1時間インキュベートした。上清処理した微生物を抗IgA-PE(Invitrogen、#12-4204-82、1:100希釈)で4℃で30分間染色し、フローサイトメトリーでIgA+イベントの頻度を解析した。示したデータは、抗IgA-PEのみで染色したIgA+微生物のバックグラウンド頻度から差し引いたものである。
ビヒクル群由来のサブ培養細菌を遠心分離し、洗浄し、ペレット化した。得られた微生物ペレットを滅菌PBSに再懸濁し、液体窒素中で5回の凍結融解サイクルと10分間の超音波処理(3秒オン、8秒オフ、振幅80%)を行った。分解を防ぐためにプロテアーゼ/ホスファターゼ阻害剤カクテルをサンプルに加え(Cell Signaling Technologies, #5872S )、溶解液のタンパク質含量をBCAアッセイ(Thermo Fisher, #23227 )を用いて定量した。96ウェル高結合ELISAプレート(Corning #2592 )に、分画した微生物(100μL中1μgの総タンパク質)を4℃で一晩コートした。プレートをPBS中0.05% Tween-20で洗浄し、PBS中1% BSAで6時間室温でブロックした。サンプルまたは1% BSA PBSコントロールを、糞便微生物溶解液でコートしたELISAプレートに4℃で一晩添加した。プレートを洗浄後、1% BSA PBSで1:3000に希釈したHRP結合抗IgA抗体(Invitrogen, #62 -6720)と室温で1時間インキュベートした。プレートはTMB基質(Biolegend, #421101 )を用いて現像した。光学密度は、Cytation 5装置(Biotek)を用いて、OD450からOD570をバックグラウンド減算することにより決定した。
16S rDNAイルミナ配列決定と解析
16S rDNA遺伝子配列決定のために、FMTドナー、抗生物質処理した従来のFMTレシピエントマウスから糞便ペレットを採取した。細菌鋳型DNAは、市販のPowerFecal DNA抽出キット(Qiagen)を用いて、製造元の指示に従って糞便サンプルから単離・精製した。次に、精製された微生物ゲノムDNA(gDNA)は、最初のPCRステップのための正確なサンプルインプットを確実にするために、分解の兆候がないかチェックされ、定量された。16S rRNA遺伝子のV4領域の増幅とIllumina Nextera Unique Dualインデックスの添加には、ネステッドPCR法を用いた。その後、各ライブラリーはサンプル濃度とサンプル品質をチェックする標準的な品質管理手順を受けた。各ライブラリーは、シーケンスリード間のサンプル分布が均等になるようにプールされた。その後、illuminaのiSeq 100で2 x 150リード長のアンプリコンシーケンスを行った。
バイオインフォマティクス解析は、先に説明した方法を用いて行った95。簡単に説明すると、生の16Sアンプリコン配列とメタデータを、QIIME2に実装されているsplit_libraries_fastq.pyスクリプトを用いて多重化解除した90。多重化解除したfastqファイルを、QIIME2のsplit_sequence_file_on_sample_ids.pyスクリプトを用いてサンプル固有のfastqファイルに分割した。非生物学的ヌクレオチドを含まない個々のfastqファイルは、Divisive Amplicon Denoising Algorithm(DADA)パイプラインを用いて処理した91。dada2パイプラインの出力(アンプリコン配列バリアントのフィーチャーテーブル(ASVテーブル))は、Rのphyloseq,96およびmicrobiomeSeq(http://www.github.com/umerijaz/microbiomeSeq)パッケージを用いてアルファおよびベータ多様性解析のために処理した。存在量の差分解析は、「lefse」アルゴリズムを用いて行った。全体を通して統計的有意性(P < 0.05)を評価した。必要に応じて、Benjamini and Hochberg法に従って多重比較のP値を調整し、偽発見率(False Discovery Rate)97をコントロールしながら、サンプルカテゴリーに従って分類群存在量の多重検定を行った。microbiomeSeqパッケージ(http://www.github.com/umerijaz/microbiomeSeq)のplot_anova_diversity関数を用いてα多様性指標を測定しながら、サンプルカテゴリー間の分散(ANOVA)を分析した。microbiomeSeqパッケージのordination関数を用いて、CCAで得られたすべての主座標に対して、999回の並べ替えを伴う並べ替え多変量分散分析(PERMANOVA)を行った。
メタゲノムショットガンシーケンス解析
Nextera DNA Library Preparation Kit for Illumina(New England Biolabs、マサチューセッツ州)を用いて、メーカーのプロトコールに従ってシーケンスライブラリーを構築した。シーケンスライブラリーはMiSeqプラットフォーム(MiSeq Reagent Kit v3(2 x 75 bp))を用いてシーケンスした。nesoni pipeline (https://github.com/Victorian-Bioinformatics-Consortium/nesoni)を用いて生リードを品質フィルターおよびトリミングした。クオリティトリミングしたリードは、MetaPhlAn4.99を用いた分類解析に使用した。
比較系統解析
Lachnospiraceae bacterium A2)を含むすべての細菌ゲノムの全ゲノムアセンブリ(GenBank assembly accession: GCA_000403315.2)をncbi-genome download (https://github.com/kblin/ncbi-genome-download)ツールを用いてダウンロードした。次に、FastANIツール100を用いて、L. bacterium A2の全ゲノムアセンブリを、NCBI、Daskovaら101、およびMGnifyデータベース102からダウンロードした細菌ゲノムと比較した。全ゲノムに基づく比較系統樹解析は、ここhttps://github.com/edgraham/PhylogenomicsWorkflow、16個のシングルコピーリボソーム遺伝子103を用いて行った。系統樹はiTol version 5 web serverを用いて可視化した104。
統計解析
2群間の統計学的有意性は、特に断りのない限り、t検定または多重t検定に続く対にならないノンパラメトリックのマン・ホイットニー検定によって決定した。P値の計算は両側で行った。2群以上の比較は、一元配置分散分析または二元配置反復測定分散分析にTukeyの多重比較検定を加えて行った。データのプロット、補間、統計解析はGraphPad Prism 9.0(GraphPad Software, La Jolla, CA)を用いて行った。実験の統計的詳細は、図の凡例に記載した。p値が0.05未満を統計的に有意とみなした。16S rDNA解析の詳細は、上記の「16S rDNAイルミナシーケンスと解析」のセクションに記載されている。
データとコードの利用可能性
マイクロバイオームデータセットはBioProject PRJEB59479としてNCBIにアップロードされた。
本論文ではオリジナルのコードは報告していない。
本論文で報告されたデータを再解析するために必要な追加情報は、要望があればリードコンタクトから入手可能である。
謝辞
本研究はクローン病・大腸炎財団の支援を受けた。Cleveland Clinic Lerner Research Institute Gnotobiotic Facility and Imaging Coreに感謝する。
著者貢献
T.S.S.とQ.L.は本研究のコンセプト立案と監督を行った。S.Z.とY.H.は、ほとんどの実験の計画、実施、データ解析を行った。W.S.はIgA-seqアッセイを実施し、データを解析した。S.P.はpec-oligoの調製に協力した。M.N.とA.V.はT細胞枯渇アッセイを行った。P.E.K.、K.P.N.、J.Y.Z.はSIgAの多反応性アッセイを行った。R.J.M.とN.S.はバイオインフォマティクス解析を行った。M.D.はエタノール処理実験を手伝った。S.Z.、Y.H.、T.S.S.が原稿を執筆した。著者全員が原稿の批評に貢献した。
利益申告
T.S.S.はヤンセンファーマとアムジェンの科学諮問委員会のメンバーである。T.S.S.はメビウスケアの創設者である。
インクルージョンと多様性
私たちは、非ヒト被験者の選定において男女のバランスを確保するよう努めました。私たちは、包括的で多様かつ公平な研究実施を支持します。
補足情報
pdfダウンロード (2.4 MB)
pdfファイルのヘルプ
資料S1. 図S1〜S7、表S1、S2
参考文献
マンティス N.J.
ロル N.
Corthésy B.
分泌性IgAの腸管における免疫と粘膜恒常性における複雑な役割。
Mucosal Immunol. 2011; 4: 603-611
https://doi.org/10.1038/mi.2011.41
論文で見る
スコパス (774)
パブコメ
概要
全文
全文PDF
グーグル・スカラー
ハンドT.W.
レボルディA.
免疫グロブリンAの産生と機能。
Annu. Immunol. 2021; 39: 695-718
https://doi.org/10.1146/annurev-immunol-102119-074236
論文で見る
スコープス (24)
PubMed
クロス
グーグル奨学生
モラ J.R.
フォン・アンドリアンU.H.
IgA分泌細胞の分化とホーミング。
Mucosal Immunol. 2008; 1: 96-109
https://doi.org/10.1038/mi.2007.14
論文で見る
スコパス(176)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ヨハンセン F.E.
ケッツェル C.S.
高分子免疫グロブリン受容体とIgA輸送の制御:pIgR発現を刺激する環境因子と粘膜免疫におけるその役割に関する新たな進展。
Mucosal Immunol. 2011; 4: 598-602
https://doi.org/10.1038/mi.2011.37
論文で見る
スコープス (231)
パブコメ
概要
全文
全文PDF
グーグル奨学生
倉島康雄
清野博之
腸管ホメオスタシスと組織治癒に関わる上皮細胞と免疫細胞の粘膜生態系ネットワーク。
Annu. Rev. Immunol. 2017; 35: 119-147
https://doi.org/10.1146/annurev-immunol-051116-052424
論文で見る
スコープス (176)
PubMed
クロス
グーグル奨学生
サンチェス・デ・メディナ F.
ロメロ-カルボI.
Mascaraque C.
マルティネス-アウグスティンO.
腸の炎症と粘膜バリア機能。
炎症。Bowel Dis. 2014; 20: 2394-2404
https://doi.org/10.1097/MIB.0000000000000204
論文で見る
スコープス (274)
PubMed
クロス
グーグル奨学生
マクファーソン A.J.
ゲーキング M.B.
マッコイ K.D.
国土安全保障: 身体のフロンティアにおけるIgA免疫。
Trends Immunol. 2012; 33: 160-167
https://doi.org/10.1016/j.it.2012.02.002
論文で見る
スコープス (138)
パブコメ
概要
全文
全文PDF
グーグル奨学生
サザーランドD.B.
鈴木啓一郎
ファガラサン S.
免疫グロブリンAによる腸内細菌叢との高度な相互作用の促進。
Immunol. Rev. 2016; 270: 20-31
https://doi.org/10.1111/imr.12384
論文で見る
スコープス (65)
PubMed
クロス
グーグル奨学生
ムーアK.
ディアードM.
セリン M.E.
フェルミー B.
ウォツカ S.Y.
トスカ A.
バッケレン E.
アーノルディーニ M.
バンセプト F.
コ A.D.
他
高活性IgAは増殖中の細菌を鎖でつないで腸を保護する。
Nature. 2017; 544: 498-502
https://doi.org/10.1038/nature22058
記事で見る
スコープス (234)
PubMed
クロス
グーグル奨学生
徳原大介
結城由紀
野地 哲也
児玉 崇
目島正明
黒川 聡
高橋由伸
南野雅彦
中西 宇.
高岩文雄
ほか
米由来ワクチンによるコレラ菌および熱溶性腸毒素産生性大腸菌に対する分泌性IgAを介した防御効果。
Proc. Natl. Acad. Sci. USA. 2010; 107: 8794-8799
https://doi.org/10.1073/pnas.0914121107
論文で見る
スコープス (95)
PubMed
クロス
グーグル奨学生
ファガラサン S.
腸管におけるIgAの進化、発生、機構および機能。
Curr. Opin. Immunol. 2008; 20: 170-177
https://doi.org/10.1016/j.coi.2008.04.002
論文で見る
スコープス (74)
PubMed
クロス
グーグル奨学生
ストルグネルR.A.
Wijburg O.L.
感染免疫における分泌抗体の役割。
Nat. Rev. Microbiol. 2010; 8: 656-667
https://doi.org/10.1038/nrmicro2384
論文で見る
スコープス (213)
PubMed
クロス
グーグル奨学生
ドナルドソンG.P.
ラディンスキー M.S.
ユー K.B.
サンダース J.G.
ユー・ビー・ビー
チョウ W.C.
コナー M.E.
アール A.M.
ナイト R.
ビョークマンP.J.
ら
腸内細菌叢は粘膜コロニー形成に免疫グロブリンAを利用する。
Science. 2018; 360: 795-800
https://doi.org/10.1126/science.aaq0926
論文で見る
スコープス (355)
PubMed
クロス
グーグル奨学生
マクローリン K.
シュルーターJ.
ラコフ・ナホウムS.
スミス A.L.
フォスター K.R.
差動接着による微生物叢の宿主選択。
Cell Host Microbe. 2016; 19: 550-559
https://doi.org/10.1016/j.chom.2016.02.021
論文で見る
スコパス (111)
PubMed
概要
全文
全文PDF
グーグル奨学生
中島亜紀子
フォーゲルザング A.
丸谷真人
宮島雅彦
村田宗弘
孫 A.
桑原 徹
鶴山 毅
山田 聡
松浦正明
ほか
IgAは細菌間の共生を促進することにより、腸内細菌叢の組成と代謝機能を制御する。
J. Exp. Med. 2018; 215: 2019-2034
https://doi.org/10.1084/jem.20180427
論文で見る
スコープス (185)
パブコメ
クロス
グーグル奨学生
カウ A.L.
プラナーJ.D.
リュー J.
ラオ S.
ヤツネンコ T.
トレハン I.
マナリー・M.J.
リュー T.C.
スタッペンベック T.S.
マレタ K.M.
他
食餌依存性腸症を引き起こす栄養不良のマラウイ小児からのIgA標的細菌分類群の機能的特徴付け。
Sci. Transl. Med. 2015; 7: 276ra24
https://doi.org/10.1126/scitranslmed.aaa4877
論文で見る
スコープス (245)
PubMed
クロス
グーグル奨学生
パーム N.W.
デ・ゾーテM.R.
カレン T.W.
バリー N.A.
ステファノウスキー J.
ハオ L.
デグナン P.H.
フー J.
ピーター I.
チャン・W.
他。
免疫グロブリンAコーティングによる炎症性腸疾患における大腸菌の同定。
Cell. 2014; 158: 1000-1010
https://doi.org/10.1016/j.cell.2014.08.006
論文で見る
スコープス (825)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ヴィラドミウ M.
キボロウィッツC.
アブドゥルハミドA.
ドガンB.
ビクトリオ D.
カステジャーノスJ.G.
ウー V.
テン・F.
トラン N.L.
Sczesnak A.
他
クローン病脊椎関節炎に濃縮されたIgAコート大腸菌は、TH17依存性の炎症を促進する。
Sci. Transl. Med. 2017; 9
https://doi.org/10.1126/scitranslmed.aaf9655
論文で見る
スコープス (208)
PubMed
クロス
グーグル奨学生
ドミンゲス-ベロ M.G.
コステロE.K.
コントレラス M.
マグリス M.
イダルゴ G.
フィーラー N.
ナイトR.
分娩様式は、新生児の複数の身体生息地にわたって初期微生物叢の獲得と構造を形成する。
Proc. Natl. Sci. USA. 2010; 107: 11971-11975
https://doi.org/10.1073/pnas.1002601107
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
マクファーソン A.J.
イルマズB.
リメニタキスJ.P.
ガナル-ボナルバーグS.C.
腸内細菌叢とIgA機能。
Annu. Rev. Immunol. 2018; 36: 359-381
https://doi.org/10.1146/annurev-immunol-042617-053238
論文で見る
スコープス (167)
PubMed
クロス
グーグル奨学生
ラン・エイチ
鈴木英樹
永武 毅
細見和彦
池上和彦
瀬藤正樹
国沢潤一郎
コレラ毒素ベースの鼻腔ワクチンに対する抗原特異的鼻腔IgA免疫応答は粘膜繊毛運動障害により増強される。
Int. Immunol. 2020; 32: 559-568
https://doi.org/10.1093/intimm/dxaa029
論文で見る
スコープス(3)
クロスリファレンス
グーグル奨学生
スターリン D.
ファドララJ.
アダムスO.
フィエスキ C.
パリゾ C.
ドルガム K.
ラジクマール A.
オーター G.
エル・カフシ H.
シャルエル J.L.
他
ヒトIgAは多様な常在細菌と結合する。
J. Exp. Med. 2020; 217
https://doi.org/10.1084/jem.20181635
論文で見る
スコープス (47)
クロスリファレンス
グーグル奨学生
バンカー J.J.
ドリースC.
ワトソン A.R.
プランケット C.H.
ナグラーC.R.
シュネーウィンド O.
エレンA.M.
ベンデラックA.
ヒト腸内細菌叢におけるB細胞超抗原。
Sci. Transl。Med. 2019; 11
https://doi.org/10.1126/scitranslmed.aau9356
論文で見る
スコープス (56)
PubMed
クロス
グーグル奨学生
フースK.E.
バウアーK.C.
ブラウン E.M.
ボゾルメールT.
ウッドワード S.E.
セラピオ・パラシオス A.
ブーティン R.C.T.
ピーターセン C.
フィンレイ B.B.
常在細菌は宿主の栄養状態に応じて免疫グロブリンA結合を調節する。
Cell Host Microbe. 2020; 27: 909-921.e5
https://doi.org/10.1016/j.chom.2020.03.012
論文で見る
スコパス (43)
PubMed
概要
全文
全文PDF
グーグル奨学生
本田耕一
リットマンD.R.
適応免疫恒常性と疾患における微生物叢。
Nature. 2016; 535: 75-84
https://doi.org/10.1038/nature18848
論文で見る
スコパス (1106)
PubMed
クロス
グーグル奨学生
Zhang S.
Hu H.
He W.
Muhammad Z.
Wang L.
Liu F.
Pan S.
健常マウスにおけるペクチンオリゴ糖の腸内細菌叢を介した免疫グロブリン産生に対する制御的役割。
Mol. Nutr. Food Res. 2019; 63: e1801363
https://doi.org/10.1002/mnfr.201801363
論文で見る
スコープス (16)
PubMed
Crossref
グーグル奨学生
ヴレヴィッチJ.
ユリッチA.
ツォルツィスG.
ギブソンG.R.
トランス-ガラクトオリゴ糖の混合物は、メタボリックシンドロームのマーカーを低減し、太り過ぎの成人の糞便微生物叢と免疫機能を調節する。
J. Nutr. 2013; 143: 324-331
https://doi.org/10.3945/jn.112.166132
記事で見る
スコパス (259)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
Wagenaar L.
ボル=シェーンメイカーズ M.
ジュスタリーニG.
フォンク M.M.
ファンエッシュB.C.A.M.
クニッペルス L.M.J.
ガーセンJ.
スミットJ.J.
ピーテルスR.H.H.
ピーナッツアレルギーマウスモデルにおいて、難消化性オリゴ糖の食事補充はアレルギー症状を軽減し、低用量経口免疫療法をサポートする。
Mol. Nutr. Food Res. 2018; 62: e1800369
https://doi.org/10.1002/mnfr.201800369
論文で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
ブルーム S.M.
ビジャンキV.N.
ナバ G.M.
サン・L.
マルヴィン N.P.
ドナーマイヤー D.L.
ダン・ジュニア W.M.
アレン P.M.
スタッペンベック T.S.
炎症性腸疾患モデルマウスにおいて、宿主遺伝子型特異的に宿主バクテロイデス属細菌が大腸炎を誘発する。
Cell Host Microbe. 2011; 9: 390-403
https://doi.org/10.1016/j.chom.2011.04.009
論文で見る
筑波大学
PubMed
概要
全文
全文PDF
グーグル奨学生
Li H.
リメニタキスJ.P.
グライフ V.
Yilmaz B.
シェーレンO.
ウルバニアク C.
Zünd M.
ローソン M.A.E.
ヤング I.D.
ルップ S.
他。
粘膜または全身の微生物叢暴露がB細胞レパートリーを形成する。
Nature. 2020; 584: 274-278
https://doi.org/10.1038/s41586-020-2564-6
論文で見る
スコープス (101)
パブコメ
クロス
グーグル奨学生
ブラット S.E.
コナー M.E.
消化管のフロンティア:IgAとウイルス。
Front. Immunol. 2013; 4: 402
https://doi.org/10.3389/fimmu.2013.00402
論文で見る
スコープス (49)
パブコメ
クロス
グーグル奨学生
Hofer U.
IgAは腸内真菌を友好的にする。
Nat。Rev. Microbiol. 2021; 19: 617
https://doi.org/10.1038/s41579-021-00613-9
論文で見る
スコープス (0)
クロスリファレンス
グーグル奨学生
黄 P.
Cui X.
Wang Z.
Xiao C.
Ji Q.
Wei Q.
Huang Y.
Bao G.
Liu Y.
ウサギの成長成績、血清生化学、消化酵素活性、腸管形態、免疫反応、腸内細菌叢に及ぼすClostridium butyricumおよびバクテリオファージカクテルの影響。
抗生物質(バーゼル)。2021; 10
https://doi.org/10.3390/antibiotics10111347
論文で見る
Scopus (8)
クロスリファレンス
グーグル奨学生
ヤン C.
モグノ I.
コンティジョック E.J.
ボルジャーディング J.N.
アガーワラ V.
リー Z.
シウ S.
グラセット E.K.
ヘルマス D.S.
Dubinsky M.C.
他
便中IgA濃度はバクテロイデス属オバツスの菌株レベルの違いによって決定され、腸内細菌叢の操作によって修正可能である。
Cell Host Microbe. 2020; 27: 467-475.e6
https://doi.org/10.1016/j.chom.2020.01.016
論文で見る
スコープス (95)
PubMed
概要
全文
全文PDF
グーグル奨学生
イショB.
フロレスク A.
ワン A.A.
ゴマーマン J.L.
幻想的なIgA形質細胞とその発見。
Immunol. 2021; 303: 119-137
https://doi.org/10.1111/imr.12980
論文で見る
スコパス (19)
PubMed
クロス
グーグル奨学生
ケッツェル C.S.
高分子免疫グロブリン受容体:粘膜表面における自然免疫応答と適応免疫応答の橋渡し
Immunol. Rev. 2005; 206: 83-99
https://doi.org/10.1111/j.0105-2896.2005.00278.x
論文で見る
スコープス (422)
PubMed
クロス
グーグル奨学生
オールマン D.
ウィルモアJ.R.
ゴーデット B.T.
T細胞非依存性抗体の物語。
Immunol. Rev. 2019; 288: 128-135
https://doi.org/10.1111/imr.12754
論文で見る
スコープス (43)
PubMed
クロス
グーグル奨学生
マクファーソン A.J.
ガット D.
セインズベリーE.
ハリマンG.R.
ヘンガートナー H.
ジンケルナゲルR.M.
常在細菌に対する腸管粘膜IgA応答の原始T細胞非依存的メカニズム。
Science. 2000; 288: 2222-2226
https://doi.org/10.1126/science.288.5474.2222
論文で見る
スコパス (885)
PubMed
クロス
グーグル奨学生
パブストO.
スラックE.
IgAと腸内細菌叢:特異的であることの重要性。
Mucosal Immunol. 2020; 13: 12-21
https://doi.org/10.1038/s41385-019-0227-4
論文で見る
スコープス (205)
パブコメ
概要
全文
全文PDF
グーグル奨学生
マクファーソン A.J.
ウールT.
常在細菌を保有する腸管樹状細胞による防御的IgAの誘導。
Science. 2004; 303: 1662-1665
https://doi.org/10.1126/science.1091334
論文で見る
スコパス(1209)
PubMed
クロス
グーグル奨学生
コン Y.
Feng T.
藤橋和彦
シューブ T.R.
エルソンC.O.
腸内細菌叢に対する支配的で協調的なT制御細胞-IgA応答。
Proc. Natl. Acad. Sci. USA. 2009; 106: 19256-19261
https://doi.org/10.1073/pnas.0812681106
論文で見る
スコープス (333)
PubMed
クロス
グーグル奨学生
ラファイリディス P.I.
イオアニドウE.N.
ファラガスM.E.
アンピシリン/スルバクタム:重症細菌感染症における現状。
Drugs. 2007; 67: 1829-1849
https://doi.org/10.2165/00003495-200767130-00003
記事で見る
スコパス (78)
PubMed
クロス
グーグル奨学生
ブルニエーラF.R.
フェレイラ F.M.
サヴィオリL.R.
バッチ M.R.
フェダー D.
ダ・ルス・ゴンサルヴェス・ペドレイラ M.
ソルジーニ・ペテルリーニ M.A.
アッザリスL.A.
カンポス・ジュンケイラ V.B.
フォンセカ F.L.
バンコマイシンの使用とその治療効果および副作用:総説。
Eur. Rev. Med. Pharmacol. Sci. 2015; 19: 694-700
論文で見る
PubMed
グーグル奨学生
ローホー T.
ダルマヤンティA.
コリスチン:多剤耐性グラム陰性感染症における抗生物質とその役割。
Acta Med. Indones. 2015; 47: 157-168
論文で見る
グーグル・スカラー
トルナレッティ S.
ペドリーニ A.M.
DNA巻き戻し実験による4-キノロンのDNAとの相互作用に関する研究。
Biochim. Biophys. Acta. 1988; 949: 279-287
https://doi.org/10.1016/0167-4781(88)90153-4
論文で見る
スコープス (59)
PubMed
クロス
グーグル奨学生
パロンボ E.A.
エタノール処理は芽胞形成細菌を不活性化しない-MALDI-TOF MSによる同定前の細菌の安全な輸送に関する注意点。
J. Microbiol. Methods. 2020; 172: 105893
https://doi.org/10.1016/j.mimet.2020.105893
論文で見る
スコープス (1)
クロスリファレンス
グーグル奨学生
ハジシェンガリスG.
ダルボーR.P.
カーティスM.A.
キーストーン病原体仮説。
Nat. Rev. Microbiol. 2012; 10: 717-725
https://doi.org/10.1038/nrmicro2873
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
ピカード J.M.
ヌニェスG.
腸内の病原体コロニー形成抵抗性と健康増進のためのその操作。
Am. J. Pathol. 2019; 189: 1300-1310
https://doi.org/10.1016/j.ajpath.2019.03.003
論文で見る
スコープス (25)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ワイルズ S.
ドーガンG.
フランケルG.
Citrobacter rodentiumの宿主消化管通過後に出現する「高感染性」細菌状態。
Cell. Microbiol. 2005; 7: 1163-1172
https://doi.org/10.1111/j.1462-5822.2005.00544.x
論文で見る
スコープス (59)
PubMed
クロス
グーグル奨学生
ムーンC.
ボールドリッジ M.T.
ウォレス M.A.
D C.A.
バーナム
ヴァージン H.W.
スタッペンベック T.S.
糞便中IgA濃度の垂直伝播は染色体外表現型の変異を決定する。
Nature. 2015; 521: 90-93
https://doi.org/10.1038/nature14139
論文で見る
スコープス (184)
PubMed
クロス
グーグル奨学生
アブリミットA.
キューネル・H.
ストラッサーA.
ウプールH.
異常サヴダ症候群:動物モデルにおける内分泌および免疫活性に対する感情的および身体的ストレスの長期的影響。
チン。J.統合。Med. 2013; 19: 603-609
https://doi.org/10.1007/s11655-012-1094-y
論文で見る
スコープス (16)
クロスリファレンス
グーグル奨学生
バンカー J.J.
ベンデラックA.
微生物叢に対するIgA応答。
Immunity. 2018; 49: 211-224
https://doi.org/10.1016/j.immuni.2018.08.011
論文で見る
スコープス (189)
PubMed
概要
全文
全文PDF
グーグル奨学生
Cariou M.
リビエール C.
モリエール S.
ゴーティエ J.P.
シモン J.C.
ペイレ P.
Charlat S.
エンドウアブラムシの微生物相多様性解析における16S rDNAアンプリコンシークエンシングとハイブリダイゼーションキャプチャーの比較。
BMC Res. Notes. 2018; 11: 461
https://doi.org/10.1186/s13104-018-3559-3
論文で見る
スコープス (7)
クロスリファレンス
グーグル奨学生
Lu Q.
スタッペンベック T.S.
宿主と微生物叢の間の全身的コミュニケーションを構成する局所的障壁。
Science. 2022; 376: 950-955
https://doi.org/10.1126/science.abo2366
論文で見る
スコパス (15)
PubMed
クロス
グーグル奨学生
バンカーJ.J.
フリンT.M.
コバルJ.C.
ショウ D.G.
マイゼル M.
マクドナルド B.D.
石塚 I.E.
デント A.L.
ウィルソン P.C.
ジャブリB.
ほか
免疫グロブリンAによる自然および適応的体液性応答コート異なる常在細菌。
Immunity. 2015; 43: 541-553
https://doi.org/10.1016/j.immuni.2015.08.007
論文で見る
スコープス (358)
PubMed
アブストラクト
全文
全文PDF
グーグル奨学生
バンカーJ.J.
エリクソン S.A.
フリン T.M.
ヘンリー C.
コバル J.C.
マイゼル M.
ジャブリ B.
アントノプロス D.A.
ウィルソン P.C.
ベンデラックA.
天然の多反応性IgA抗体は、腸内細菌叢を被覆する。
Science. 2017; 358
https://doi.org/10.1126/science.aan6619
論文で見る
スコープス (263)
PubMed
クロス
グーグル奨学生
サングスター M.Y.
リベルディJ.M.
ゴンザレスM.
トップハム D.J.
バウムガース N.
ドハティ P.C.
重要な同族T-B相互作用が存在しない場合の、インフルエンザ感染に対するCD4+ T細胞依存性の早期免疫グロブリンA反応。
J. Exp. Med. 2003; 198: 1011-1021
https://doi.org/10.1084/jem.20021745
論文で見る
スコープス (93)
PubMed
クロス
グーグル奨学生
コッホ M.A.
ライナーG.L.
ルーゴ K.A.
クロイック L.S.
スタンベリー A.G.
アンサルド E.
セハー T.D.
ルディントン W.B.
バートン G.M.
母親のIgGおよびIgA抗体は、生後早期の粘膜Tヘルパー細胞応答を減衰させる。
Cell. 2016; 165: 827-841
https://doi.org/10.1016/j.cell.2016.04.055
論文で見る
スコープス (193)
パブコメ
概要
全文
全文PDF
グーグル奨学生
Bundgaard-Nielsen C.
ハグストロム S.
セーレンセン S.
腸内細菌叢プロファイルの個人差は、糞便保存条件の違いによる影響に勝る。
Sci. Rep. 2018; 8: 17367
https://doi.org/10.1038/s41598-018-35843-0
論文で見る
スコープス (28)
PubMed
クロス
グーグル奨学生
シュベンセン H.F.
カン C.
トレジャーJ.
Høiby N.
シェーグレンM.
神経性食欲不振症における糞便微生物叢に関する研究の系統的レビュー:今後の研究には小腸からの微生物叢を含める必要があるかもしれない。
食べる。Weight Disord. 2018; 23: 399-418
https://doi.org/10.1007/s40519-018-0499-9
論文で見る
スコープス (29)
PubMed
クロス
グーグル奨学生
リマ S.F.
ゴゴキアL.
ヴィラドミウ M.
Chou L.
プッツェル G.
ジン・W.B.
ピレス S.
グオ C.J.
ジェラルディン Y.
クロフォードC.V.
他
潰瘍性大腸炎に対する糞便微生物叢移植の反応者における、移植可能な免疫グロブリンAコートOdoribacter splanchnicusは、大腸の炎症を制限する。
Gastroenterology. 2022; 162: 166-178
https://doi.org/10.1053/j.gastro.2021.09.061
論文で見る
スコープス (35)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
Lundgren O.
スヴェンソンL.
ロタウイルス下痢の病態。
Microbes Infect. 2001; 3: 1145-1156
https://doi.org/10.1016/s1286-4579(01)01475-7
論文で見る
ロタウイルス
パブコメ
クロス
グーグル奨学生
中江洲J.
このS.
ヒュッターJ.
ブーカード=ジュルダン M.
バラトー V.
ムレタ K.G.
グッデイ L.J.
トムセン K.F.
ロペス A.G.
ウルマートI.
他
BATF3依存性樹状細胞によるαvβ8インテグリン発現は、ロタウイルスに対する初期IgA応答を促進する。
Mucosal Immunol. 2021; 14: 53-67
https://doi.org/10.1038/s41385-020-0276-8
論文で見る
スコパス (15)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ノートン P.J.
グラント G.
ユーウェン S.W.
スペンサー R.J.
ブラウン D.S.
プシュタイ A.
バルドッツ S.
Salmonella typhimuriumおよびSalmonella enteritidisは、in vivoでラット小腸の腸管増殖を誘導し、ポリアミン含量を増加させる。
FEMS Immunol. Med. Microbiol. 1995; 12: 251-258
https://doi.org/10.1111/j.1574-695X.1995.tb00200.x
論文で見る
パブコメ
クロスレフ
グーグル奨学生
Ramig R.F.
腸管および全身性ロタウイルス感染症の病態。
J. Virol. 2004; 78: 10213-10220
https://doi.org/10.1128/JVI.78.19.10213-10220.2004
論文で見る
スコープス (256)
PubMed
クロス
グーグル奨学生
ベルガーK.
バーレイ S.
リンダル M.
バッタチャリヤ A.
パティル P.
ストールブランド H.
ノルドベリ・カールソン E.
ホレニウス F.
ナイマン M.
アドラークロイツ P.
キシロオリゴ糖は、高脂肪食マウスのビフィズス菌とラクノスピラ菌を増加させ、同時に短鎖脂肪酸、特に酪酸を増加させる。
J. Agric. Food Chem. 2021; 69: 3617-3625
https://doi.org/10.1021/acs.jafc.0c06279
論文で見る
スコープス (35)
クロス
グーグル奨学生
グリマルディ R.
ギブソンG.R.
ヴレビッチJ.
Giallourou N.
カストロ-メヒアJ.L.
ハンセン L.H.
リー・ギブソン E.
ニールセン D.S.
コスタビレA.
自閉症スペクトラム障害(ASDs)の子どもたちにおけるプレバイオティクス介入研究。
マイクロバイオーム。2018; 6: 133
https://doi.org/10.1186/s40168-018-0523-3
論文で見る
スコープス (180)
PubMed
クロス
グーグル奨学生
Ding Y.
Yan Y.
Peng Y.
Peng Y.
Mi J.
Lu L.
Luo Q.
Li X.
Zeng X.
Cao Y.
Lycium barbarum果実由来多糖類の模擬唾液、胃および小腸条件下でのin vitro消化およびヒト腸内細菌叢による発酵。
Int. J. Biol. Macromol. 2019; 125: 751-760
https://doi.org/10.1016/j.ijbiomac.2018.12.081
論文で見る
スコープス (153)
Crossref
グーグル奨学生
He S.
Xiong Q.
Tian C.
Li L.
Zhao J.
林 X.
Guo X.
He Y.
Liang W.
Zuo X.
et al.
イヌリン型プレバイオティクスは腸内細菌叢の調節を介して血清尿酸値を低下させる:腹膜透析患者を対象とした無作為化対照クロスオーバー試験。
Eur. J. Nutr.
https://doi.org/10.1007/s00394-021-02669-y
論文で見る
スコパス (7)
クロス
グーグル奨学生
モーエンス F.
De Vuyst L.
ClostridiumクラスターIVおよびXIVa酪酸産生大腸菌のイヌリン型フルクタン分解能とその関連代謝結果。
ベネフィット。Microbes. 2017; 8: 473-490
https://doi.org/10.3920/BM2016.0142
論文で見る
スコープス (40)
PubMed
クロス
グーグル奨学生
ラブR.G.
ダンカン C.L.
A型Clostridium perfringensの増殖および胞子形成における炭水化物の影響
Appl. Microbiol. 1975; 29: 345-351
https://doi.org/10.1128/am.29.3.345-351.1975
論文で見る
Crossref
グーグル奨学生
Strasdine G.A.
E型ボツリヌス菌におけるアミロペクチンの蓄積。
Can. J. Microbiol. 1968; 14: 1059-1062
https://doi.org/10.1139/m68-178
論文で見る
スコープス (9)
PubMed
クロス
グーグル奨学生
ヒル K.K.
謝 巍
フォーリーB.T.
スミス T.J.
マンク A.C.
ブルース D.
スミス L.A.
ブレティン T.S.
デッターJ.C.
クロストリジウム・ボツリヌスA型、B型、E型、F型およびクロストリジウム・ブチリカム・E型株におけるボツリヌス神経毒素複合体遺伝子の組換えと挿入事象。
BMC Biol.
https://doi.org/10.1186/1741-7007-7-66
論文で見る
(121件)
PubMed
クロス
グーグル奨学生
Li J.
アダムスV.
バンナムT.L.
Miyamoto K.
ガルシア J.P.
ウザル F.A.
ルッド J.I.
マクレーン B.A.
クロストリジウム・パーフリンゲンスの毒素プラスミド。
Microbiol. Mol. Biol. Rev. 2013; 77: 208-233
https://doi.org/10.1128/MMBR.00062-12
論文で見る
スコープス (195)
PubMed
クロス
グーグル奨学生
ソンガー J.G.
人獣共通感染症の病原体としてのクロストリジウム。
Vet. Microbiol. 2010; 140: 399-404
https://doi.org/10.1016/j.vetmic.2009.07.003
論文で見る
スコープス (133)
パブコメ
クロス
グーグル奨学生
シェティ S.A.
ヒューゲンホルツF.
Lahti L.
Smidt H.
デ・ヴォス W.M.
腸内細菌叢の景観化:群集形成の洞察と微生物調節戦略への示唆。
FEMS Microbiol. Rev. 2017; 41: 182-199
https://doi.org/10.1093/femsre/fuw045
論文で見る
スコープス (126)
PubMed
クロス
グーグル奨学生
サンミゲル A.J.
マイゼルJ.S.
Horwinski J.
鄭Q.
グライス E.A.
局所抗菌薬治療は皮膚常在細菌群集のシフトを誘発し、黄色ブドウ球菌の競合菌によるコロニー形成を減少させることができる。
Antimicrob. Agents Chemother. 2017; 61
https://doi.org/10.1128/AAC.00774-17
論文で見る
スコープス (43)
クロス
グーグル奨学生
ソブラン B.
プランセJ.
ジェグーS.
ストローブ M.
ラマス B.
ナティヴィダード J.M.
アグス A.
デュプラズ L.
グロッド J.
ダ・コスタG.
他
腸内細菌は真菌による大腸炎重症度の調節に必須である。
Microbiome. 2018; 6: 152
https://doi.org/10.1186/s40168-018-0538-9
論文で見る
スコープス (112)
PubMed
クロス
グーグル奨学生
ファン・デル・ワイD.
Berghuis-de Vries J.M.
マウスおよびサルにおける消化管からの腸内細菌科細菌の選択的除去。
J. Hyg. 1974; 72: 205-211
https://doi.org/10.1017/s002217240002341x
論文で見る
PubMed
クロス
グーグル奨学生
Zhang X.S.
Yin Y.S.
Wang J.
Battaglia T.
クラウトクラマー K.
リー W.V.
リー J.
ブラウン M.
チャン M.
バドリ M.H.
et al.
母体糞便微生物叢の移入は、マウスにおける抗生物質誘発性1型糖尿病の早期発症を抑制する。
Cell Host Microbe. 2021; 29: 1249-1265.e9
https://doi.org/10.1016/j.chom.2021.06.014
論文で見る
スコパス (22)
PubMed
概要
全文
全文PDF
グーグル奨学生
鈴木啓一郎
ミーク B.
土井康弘
村松正明
千葉崇
本庄 崇
ファガラサンS.
IgA欠損腸管における分割型糸状菌の異常増殖。
Proc. Natl. Acad. Sci. USA. 2004; 101: 1981-1986
https://doi.org/10.1073/pnas.0307317101
論文で見る
スコープス (555)
PubMed
クロス
グーグル奨学生
Ayasoufi K.
ファン R.
フェアチャイルドR.L.
Valujskikh A.
リンパ球減少によるCD8 T細胞の増殖には、B細胞を介したCD4 T細胞の助けが必要である。
J. Immunol. 2016; 196: 3180-3190
https://doi.org/10.4049/jimmunol.1501435
論文で見る
スコープス (17)
PubMed
クロス
グーグル奨学生
Kruisbeek A.M.
CD4およびCD8特異的T細胞のin vivoでの枯渇。
Curr. Protoc. Immunol. 2001; 第4章(ユニット4.1)
https://doi.org/10.1002/0471142735.im0401s01
論文で見る
クロスリファレンス
グーグル奨学生
ブラウン S.L.
リール T.E.
ウォーカー M.R.
ゲスケ M.J.
ドハティ J.M.
ステンソン W.F.
スタッペンベック T.S.
Myd88に依存したPtgs2発現間質細胞の位置決めにより、傷害時の大腸上皮増殖が維持される。
J. Clin. Invest. 2007; 117: 258-269
https://doi.org/10.1172/JCI29159
論文で見る
スコープス (220)
PubMed
クロス
グーグル奨学生
カン S.S.
ブルーム S.M.
ノリアンL.A.
ゲスケ M.J.
フラベル R.A.
スタッペンベック T.S.
アレン P.M.
劇症潰瘍性大腸炎の抗生物質応答性マウスモデル。
PLoS Med. 2008; 5: e41
https://doi.org/10.1371/journal.pmed.0050041
論文で見る
スコープス (97)
パブコメ
クロス
グーグル奨学生
プラパート・ヘルビッヒU.
リベルティーニ S.
フリアウフW.
テイル D.
マルタスH.J.
γ-H2AX免疫蛍光法による生体内組織特異的遺伝毒性の検出。
Environ. Mol. Mutagen. 2019; 60: 4-16
https://doi.org/10.1002/em.22238
論文で見る
スコープス (21)
クロスリファレンス
グーグル奨学生
Zhang Q.
チェン Y.
フェアチャイルド R.L.
ヒーガー P.S.
Valujskikh A.
同種反応性メモリーCD4 T細胞のリンパ球封鎖は心臓移植片の生存を促進する。
J. Immunol. 2006; 176: 770-777
https://doi.org/10.4049/jimmunol.176.2.770
論文で見る
スコープス (92)
PubMed
クロス
グーグル奨学生
カタンザロ J.R.
ストラウスJ.D.
ビエレッカA.
ポルト A.F.
ロボ F.M.
アーバン A.
スコフィールド W.B.
パーム N.W.
IgA欠損ヒトは、代償性IgMの分泌にもかかわらず、腸内細菌叢異常症を示す。
Sci. Rep. 2019; 9: 13574
https://doi.org/10.1038/s41598-019-49923-2
論文で見る
スコープス(106)
PubMed
クロス
グーグル奨学生
コジッチ J.J.
ウェストコット S.L.
バクスターN.T.
ハイランダー S.K.
Schloss P.D.
MiSeq Illuminaシーケンスプラットフォームにおけるアンプリコンシーケンスデータ解析のためのデュアルインデックスシーケンス戦略とキュレーションパイプラインの開発。
Appl. Environ. Microbiol. 2013; 79: 5112-5120
https://doi.org/10.1128/AEM.01043-13
論文で見る
スコープス(4452)
パブコメ
クロス
グーグル奨学生
ボリエン E.
ライドアウトJ.R.
ディロン M.R.
ボクリッチ N.A.
アブネットC.C.
アル・ガリス G.A.
アレクサンダー H.
アルム E.J.
アルムガム M.
アスニカーF.
他
QIIME 2を用いた再現性、対話性、拡張性のあるマイクロバイオームデータサイエンス。
Nat. Biotechnol. 2019; 37: 852-857
https://doi.org/10.1038/s41587-019-0209-9
論文で見る
スコープス (7783)
PubMed
クロス
グーグル奨学生
キャラハン B.J.
マクマーディ P.J.
ローゼン M.J.
ハン A.W.
ジョンソン A.J.
ホームズ S.P.
DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。
Nat. Methods. 2016; 13: 581-583
https://doi.org/10.1038/nmeth.3869
論文で見る
スコープス (12418)
PubMed
クロス
グーグル奨学生
ベンジャミニ Y.
クリーガーA.M.
Yekutieli D.
偽発見率を制御する適応的線形ステップアップ手順。
Biometrika. 2006; 93: 491-507
https://doi.org/10.1093/biomet/93.3.491
論文で見る
スコープス (1768)
クロスリファレンス
グーグル奨学生
ムーン C.
バンデューセンK.L.
ミヨシ・エイチ
スタッペンベック T.S.
IgAトランスサイトーシスを調節する因子を評価するためのマウス初代腸管上皮細胞単層培養系の開発。
Mucosal Immunol. 2014; 7: 818-828
https://doi.org/10.1038/mi.2013.98
論文で見る
スコープス (168)
パブコメ
概要
全文
全文PDF
グーグル奨学生
ローレンスキーT.
ブルクハルター S.
ミューナー L.
フォン・グンテン S.
ルカシェヴィッチ J.
ワーデマン H.
マクファーソン A.J.
腸管分泌性IgAの並列性が微生物の機能的適性を形成する。
Nature. 2021; 598: 657-661
https://doi.org/10.1038/s41586-021-03973-7
論文で見る
スコープス(42)
PubMed
クロス
グーグル奨学生
ヴァイス K.
ワナーN.
クイッサーK.
フリメル M.
ナン T.
マイシャール T.
サングワン N.
エルズルム S.
Asosingh K.
マウスハウスダストマイトモデルにおけるアレルギー性気道疾患に対するバリアハウジングと性別の影響。
Immunohorizons. 2021; 5: 33-47
https://doi.org/10.4049/immunohorizons.2000096
論文で見る
スコープス (6)
クロスリファレンス
グーグル奨学生
マクマーディ P.J.
ホームズ S.
phyloseq:マイクロバイオームセンサスデータの再現性のあるインタラクティブな解析とグラフィックスのためのRパッケージ。
PLoS One. 2013; 8: e61217
https://doi.org/10.1371/journal.pone.0061217
論文で見る
日本学術振興会特別研究員
パブコメ
クロス
グーグル奨学生
ベンジャミニ Y.
Hochberg Y.
偽発見率のコントロール:多重検定への実用的で強力なアプローチ。
J. R. Stat. Soc. B Methodol. 2018; 57: 289-300
https://doi.org/10.1111/j.2517-6161.1995.tb02031.x
論文で見る
Crossref
グーグル・スカラー
ラックス S.
サングワン N.
スミス D.
ラーセン P.
ハンドリー K.M.
リチャードソン M.
ガイトン K.
クレザレック M.
ショーガン B.D.
デファジオJ.
他。
新規開院病院における細菌コロニー形成と継代。
Sci. Transl. Med. 2017; 9
https://doi.org/10.1126/scitranslmed.aah6500
論文で見る
スコープス (184)
クロスリファレンス
グーグル奨学生
ブランコ=ミゲス A.
ベギーニF.
クンボ F.
マカイバー L.J.
トンプソン K.N.
ゾルフォ M.
マンギ P.
デュボア L.
ホアン・K.D.
トーマス A.M.
et al.
MetaPhlAn 4を用いた未同定種のメタゲノム分類学的プロファイリングの拡張と改善。
Nat. Biotechnol. 2023; 4
https://doi.org/10.1038/s41587-023-01688-w
論文で見る
スコープス (16)
クロスリファレンス
グーグル奨学生
ジェイン C.
ロドリゲス-R L.M.
フィリッピー A.M.
コンスタンティニディス K.T.
アルル S.
原核生物9万ゲノムの高スループットANI解析により、明確な種の境界が明らかになった。
Nat. Commun. 2018; 9: 5114
https://doi.org/10.1038/s41467-018-07641-9
論文で見る
スコープス (1695)
PubMed
クロス
グーグル奨学生
ダスコバ N.
ヘチコバ M.
モドスI.
ヴィデンスカ P.
スプリチャロヴァ P.
ペラントワ H.
クズマ M.
ゴイダ J.
Cahova M.
腸内細菌叢における酪酸合成能の測定:糞便サンプルにおけるqPCRによるbut遺伝子量の定量化。
Biomolecules. 2021; 11
https://doi.org/10.3390/biom11091303
論文で見る
スコープ (4)
クロスリファレンス
グーグル奨学生
ミッチェル A.L.
アルメイダ A.
ベラコチャM.
ボーランド M.
バージンJ.
コクラン G.
クルーソー M.R.
ケール V.
ポッター S.C.
リチャードソンL.J.
他
MGnify:2020年のマイクロバイオーム解析リソース。
Nucleic Acids Res. 2020; 48: D570-D578
https://doi.org/10.1093/nar/gkz1035
論文で見る
スコープス (263)
パブコメ
クロス
グーグル奨学生
ハグ L.A.
ベイカーB.J.
アナンタラマンK.
ブラウン C.T.
プロブスト A.J.
カステル C.J.
バターフィールドC.N.
ハーンズドルフ A.W.
天野祐子
Ise K.
他
生命の樹の新しい見方。
Nat. Microbiol. 2016; 1: 16048
https://doi.org/10.1038/nmicrobiol.2016.48
論文で見る
スコープス (1180)
PubMed
クロス
グーグル奨学生
レトゥニックI.
ボーク P.
遺伝子系統樹の表示とアノテーションのためのオンラインツールInteractive Tree Of Life (iTOL) v5.
Nucleic Acids Res.
https://doi.org/10.1093/nar/gkab301
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
論文情報
出版履歴
出版 2023年9月29日
受理 受理:2023年9月1日
改訂版受理 2023年7月14日
受理:2023年7月14日 受理日:2023年2月27日
出版段階
インプレス、修正校正
識別
DOI: https://doi.org/10.1016/j.chom.2023.09.001
著作権
© 2023 Elsevier Inc.
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
サムネイルgr1
図1ペクチンオリゴ糖投与は糞便中IgA濃度を増加させる
図サムネイルgr2
図2ペクチンオリゴ処理ドナーから非ペクチンオリゴ処理レシピエントへのIgA高値表現型の水平転移
図サムネイルgr3
図3IgA高値表現型の垂直的伝達は細菌に依存する
図のサムネイルgr4
図4pec-oligo処理マウスのFMTはVNAM前処理レシピエントの小腸でIgA高値表現型を促進する。
図サムネイルgr5
図5IgA高値表現型はCD4+ T細胞に依存する
図5IgA高値表現型はCD4+ T細胞に依存している。
図6IgA高値表現型の誘導因子として胞子を形成するLachnospiraceaeを支持する証拠
図6IgA高値表現型の誘導因子としての胞子形成性ラクリス菌を支持する証拠。
図7ペックオリゴエタノール耐性菌は、ラクノスピラ科細菌A2および非ラクノスピラ科細菌A2微生物に指向性IgAを産生する。
関連記事
広告
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
セルレポートメソッド
セルレポート 物理科学
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
ヘリオン
免疫
アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理ジャーナル
生物物理学レポート
EBioMedicine
HGGアドバンス
分子植物
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleusコレクション
スナップショット・アーカイブ
ジャーナルを超えて
細胞キャリアネットワーク
細胞シンポジウム
ラボリンク
ウェビナー
論文を進化させる
図360
複数ジャーナル投稿
スニークピーク
STARメソッド
社会における科学
細胞写真ショー
セルプレスポッドキャスト
セルプレスビデオ
ぬりえ&コミック
リサーチ・アーク
コネクト
セルプレスについて
採用情報
お問い合わせ
ヘルプ&サポート
ニュースルーム
出版アラート
アクセス
購読申し込み
今すぐ読む
司書に薦める
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
利用規約
プライバシーポリシー
アクセシビリティ
本サイトのコンテンツは、あらゆる科学分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
