腸-肺軸と喘息: メカニズムに関する歴史的レビューと今後の展望
記事内容へスキップ
記事情報へスキップ
ワイリーオンラインライブラリー
臨床とトランスレーショナルアレルギー14巻5号e12356
レビュー記事
オープンアクセス
腸-肺軸と喘息: メカニズムに関する歴史的レビューと今後の展望
https://onlinelibrary.wiley.com/doi/10.1002/clt2.12356
宋秀玲, 梁娟, 林紹柱, 謝玉偉, 柯創紅, 柯堂, 澳丹, 盧俊, 陳雪梅, 何英志, 劉暁華, 李文
初出:2024年4月30日
https://doi.org/10.1002/clt2.12356
Xiu-Ling Song、Juan Liang、Shao-Zhu Linが均等に貢献した。
研究概要
セクション
要旨
背景
腸内細菌叢は、免疫細胞の成熟や病原体に対する抵抗性を制御することにより、宿主免疫系の発達と制御に密接に関係しており、宿主免疫に影響を及ぼす。抗生物質の早期使用は腸内細菌叢のホメオスタシスを破壊し、喘息のリスクを高める。腸内細菌叢は、腸と肺の双方向コミュニケーション経路である腸肺軸を介して、宿主免疫系と活発に相互作用している。プロバイオティクス、蠕虫治療、糞便微生物叢移植(FMT)などを通じて腸内細菌叢を操作し、喘息と闘うことが注目されている。
本文
本総説では主に、現在の喘息の免疫病態、腸内細菌叢、喘息における腸-肺軸の役割について述べている。さらに、喘息の治療戦略として腸内細菌叢とその代謝産物を操作する可能性についても論じている。
結論
腸-肺軸は喘息に双方向的な影響を及ぼす。腸内微小生態系の不均衡は、細菌の構造成分と代謝産物を通じて喘息に寄与する。喘息はまた、全身に及ぶ炎症を通じて腸管障害を引き起こす。プロバイオティクス、蠕虫療法、FMTを通じた腸内細菌叢の操作は、免疫細胞の成熟と病原体に対する抵抗性を調節することにより、喘息の治療戦略に役立つ可能性がある。
1 はじめに
喘息は、気道過敏性(AHR)、可逆的な気流制限、気道リモデリングを特徴とする一般的な慢性気道炎症性疾患である。喘息は、好酸球、肥満細胞、Tリンパ球などの多くの炎症細胞1, 2によって媒介され、喘鳴、息切れ、胸部圧迫感、咳、息切れなどの発作的かつ可逆的な発作を伴う再発性の症状を引き起こす3、 4 世界保健機関(WHO)と世界喘息イニシアチブ(Global Initiative for Asthma)は、世界で約3億人が喘息に苦しんでおり、2025年までに4億人に達すると推定している5-7。ほとんどの喘息児は、低用量の吸入コルチコステロイド(ICS)や自己管理によって良好な症状コントロールが得られているが、喘息患者の約10%は難治性であり、現在のコルチコステロイドをベースとした治療に抵抗性を示している。最近の研究では、腸内細菌叢と肺のクロストークを指す腸肺軸が喘息に重要な役割を果たしている可能性が示されている13。
腸内細菌叢は、母乳育児を通じて母親から子どもに受け継がれるもので、腸-肺軸機能の重要な調節因子であり、生理学的、免疫学的、代謝学的機能を通じて宿主の恒常性を調節する重要な役割を担っていると考えられている。そのため、喘息における腸内細菌叢と腸-肺軸の役割、ならびに腸内細菌叢がホメオスタシスと喘息感受性に影響するメカニズムに、人々は徐々に注目している19。免疫因子と腸内細菌叢、あるいは腸-肺軸のクロストークなど、喘息の病態のさらなる理解は、喘息の診断と治療に新たな機会をもたらすと期待されている。本総説では、主に現在の喘息の免疫病態と、喘息における腸内細菌叢と腸肺軸の役割について述べる。さらに、喘息予防戦略の確立と喘息治療の最適化を目指し、微生物叢の操作の可能性を探ろうとしている。
2 喘息の免疫病態
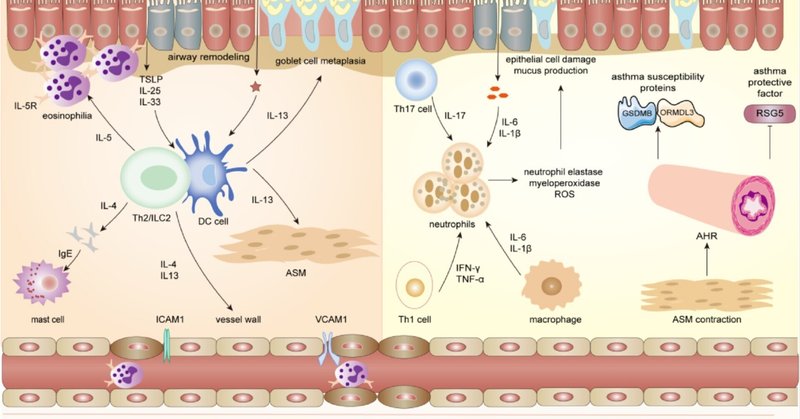
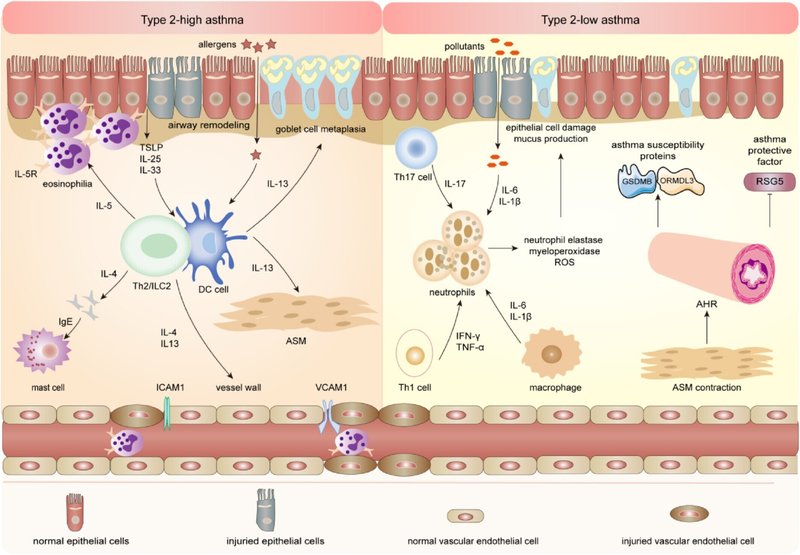
喘息は、異なる表現型とエンドタイプからなる不均一な疾患である20, 21。エンドタイプに基づき、重症喘息ではT-ヘルパー(Th)-2-高型、Th2-低型、およびその混合型が報告されている22, 23。好酸球性喘息と呼ばれるTh2-高型喘息は自然免疫と適応免疫に関連し、非好酸球性喘息と関連するTh2-低型喘息は好中球性炎症または小細胞性炎症が特徴である24、 25 マクロファージ、好中球、肥満細胞、II型自然リンパ球(ILC2)が関与する自然免疫では、インターロイキン(IL)-4、IL-5、IL-13などのさまざまなTh2サイトカインが産生され、アレルギー性炎症の持続を制御していることが研究で確認されている26。
アレルゲンが刺激されると、上皮由来のサイトカインとILC2が樹状細胞(DC)の活性化と気道における表現型の変化を促進することにより、Th2高値喘息を引き起こす。一方、気道上皮細胞は樹状細胞を活性化して抗原を提示し、ナイーブT細胞をエフェクターTh2細胞に分化させる。Th2細胞はIL-4、IL-5、IL-13などのサイトカインを分泌してII型炎症を増幅するが、Th1細胞は主にインターフェロン-γ(IFN-γ)、リンパ毒素(LT)-α、腫瘍壊死因子-α(TNF-α)などのサイトカインを分泌してI型炎症を媒介する28、 29 Th2細胞は炎症性サイトカインを分泌し、B細胞により多くのIgEを産生させる。IgEは肥満細胞と結合し、ロイコトリエン、エンドセリン、プロスタグランジン、トロンボキサンA2などの一連の炎症性メディエーターを産生する。30-32一方、気道上皮細胞は、アラミンIL-25、IL-33、胸腺間質リンパポエチン(TSLP)などの炎症性サイトカインを産生することにより、マクロファージ、DC細胞、T細胞の極性化に関与している。研究では、ILC2がアレルギー性喘息に関係していることが示されている。喘息患者における特異的サイトカインの環境下では、ILC2はTh0細胞からTh2細胞への分極化を促進し、IL-4を産生する35。IFN-γではなく、IL-5やIL-13などのサイトカインが増加すると、Th2細胞の免疫応答が逸脱する34, 36。
Th2低値喘息は、単純化して非好酸球性喘息と呼ばれ、Th1細胞とTh17細胞の活性化を特徴とする好中球性喘息と、好酸球も好中球も増加しない好酸球性喘息を含む37。汚染物質刺激により、気道上皮と肺胞マクロファージはIL-6、IL-1βなどの炎症性サイトカインを産生し、同時にTh17細胞は好中球のリクルートを媒介するIL17を産生する38。活性化された好中球は、好中球エラスターゼ、ミエロペルオキシダーゼ、活性酸素種(ROS)などの因子を放出することにより、上皮細胞障害を誘発し、粘液産生亢進の一因となり、喘息を引き起こす39。しかし、気道平滑筋収縮亢進によるAHRのために起こる小顆粒球性喘息は、気道炎症との相関は低い37。機序的には、AHRは喘息感受性遺伝子(GSDMBとORMDL3)40, 41の発現を促進し、重要なシグナル伝達分子(RGS5)42の発現を抑制する。
詳細は画像に続くキャプションを参照。
図1
図ビューアで開く
パワーポイント
キャプション
Th1/Th2不均衡の発症機序に加えて、制御性T細胞(Tregs)を介した制御機序も喘息において同様に重要である43。研究により、喘息患者の末梢血単核球におけるTh17/Tregs比の不均衡が示されており、Th17が増加しTregsが減少している。さらに、大豆食品から分離されたStaphylococcus succinus株である14BME20の経口投与は、Tregs応答を増強することによって気道炎症を抑制する45。
ILC2細胞、ILC3細胞、Th17細胞などの免疫細胞の中にも、喘息を媒介する炎症性メディエーターを産生するものがある。さらに、腸管DCは腸内細菌叢を感知してILC3を肺に移動させ、肺炎からの防御を仲介するIL-22炎症因子を産生する。
3 腸-肺軸と喘息
3.1 喘息における肺微生物叢
微生物は呼吸器や腸を含め、人体のあらゆる表面に生息している。肺微生物叢は主に鼻咽頭から吸入される。健康な肺には、ファーミキューテス門、放線菌門、バクテロイデス門の細菌が多く生息している。しかし、喘息患者ではヘモフィルス菌とモラクセラ菌が多い49。喘息児の鼻汁サンプルは、上皮障害と炎症性サイトカイン発現を誘導する細菌であるモラクセラ菌に支配された微生物叢を示した50。成人喘息患者に多いヘモフィルス菌はTh17関連遺伝子の発現を誘導し、喘息の悪化と関連している51(表1)。一般に、肺の微生物叢異常とそれに続く微生物叢関連免疫応答の調節異常は、最終的に喘息の過敏性と反応亢進をもたらす。
表1. 喘息に関連する細菌
喘息に関連する微生物叢 Ref
クロストリジウム・ディフィシル(Clostridium difficile) 6歳時の喘息と1ヵ月時の消化管クロストリジウム・ディフィシル(Clostridium difficile)コロニー形成との関連 52
ビフィズス菌 消化管 存在量の減少は喘息のリスクと関連する 53, 54
Faecalibacterium roseburia 消化器 喘息リスクのある就学前の喘息児および健常児における存在量の減少 54, 55
Rothia, Lachnospira, Veillonella, Faecalibacterium 消化器 喘息リスクのある乳幼児および小児における存在量の減少 55
ラクトバチルス・ラムノサス(Lactobacillus rhamnosus) GG関連糞便産物 消化器 T制御細胞の拡大およびIL-10産生を促進し、喘息 のリスクが高い乳幼児において耐性を促進 56
ドロシグラヌム、コリネバクテリウム(C) 上咽頭 有病率は小児のウイルス性呼吸器感染症および喘息 のリスク低下と関連;コリネバクテリウム(C) は成人の好酸球性肺炎と負の関連 57-59
Haemophilus 上咽頭呼吸器 幼児期に増加し、ウイルス感染の頻度および持続性喘息を発症する可能性と関連する 3, 51, 58
モラクセラ(Moraxella) 上咽頭、呼吸器 幼児期に多く、ウイルス感染の頻度および持続性喘鳴の発症の可能性が高い 50, 57, 58
呼吸器ナイセリア(Neisseria) 大人の喘息に関連して増加する 57-59
クロストリジウム連鎖球菌(Streptococcus clostridium) 上咽頭、呼吸器 ウイルス感染の頻度の増加および持続性喘鳴の 発症の可能性と関連して、幼少期に増加する 58, 60
Veillonella 呼吸器(R)、消化器(G) 消化器(G) 喘息リスクのある小児で生息数が減少 55
3.2 腸内微小生態系のアンバランスが喘息に関与する
腸内細菌叢のアンバランスは、宿主の免疫恒常性障害を引き起こし64、ひいては喘息などの呼吸器疾患の原因となることは明らかである。特定の腸内細菌叢の豊富さと喘息との間には関連性がある65。最近の研究では、母乳栄養の乳児は小児喘息やアレルギー疾患を効果的に予防できることが示唆されており、これは粉ミルクの乳児よりも母乳栄養の乳児の方が特定の腸内細菌叢の豊富さに関係している可能性がある66、 67 さらに、ビフィドバクテリウム、アケルマンシア、フェーカリバクテリウムの存在量の減少、真菌類であるカンジダとロドトルラの存在量の増加はすべて、小児喘息のリスクを増加させる68-70。したがって、腸内または気道の微生物叢の存在量の変化と特定の腸内微生物叢のディスバイオーシスは、喘息の病的マーカーとなる可能性があると推測される。喘息に関連する腸内細菌叢の変化を表1に示す。
リポ多糖(LPS)やペプチドグリカンなどの腸内細菌叢の細菌構造成分や代謝産物、また短鎖脂肪酸(SCFA)やデサミノチロシン(DAT)などの複数のメディエーターが、喘息のカスケード反応を混乱させることが多くの研究で証明されている、 一方、腸内細菌叢はSCFAのような代謝産物を産生することで、それ自身と宿主にエネルギーを供給するだけでなく、免疫調節特性も発揮する。さらに、SCFAは上皮のバリア機能を高め、粘膜免疫を維持する。一方、腸内細菌叢は肝臓で合成された胆汁酸を二次胆汁酸に変化させ、宿主の代謝プロセスや免疫恒常性を調節する。さらに、抗生物質や薬物への暴露も腸内細菌叢の安定性を破壊し、「栄養不良」、すなわち腸内細菌叢の異常繁殖を引き起こす可能性がある74。もちろん、腸内細菌叢は環境、遺伝、食事、ライフスタイルなど様々な要因の影響も受ける。研究により、遺伝的・環境的要因がこのような栄養失調の発生を大きく促進し、免疫恒常性維持のための腸内細菌叢の異常を招き、結果として疾病を引き起こすことが明らかになっている75。
3.2.1 LPSは喘息において双方向制御的役割を果たす
腸内細菌叢の細菌成分にはLPSとペプチドグリカンが含まれ、これらは腸内細胞に発現するパターン認識受容体(PRR)としてのtoll様受容体(TLR)またはnod様受容体(NLR)に結合し、免疫反応を制御する。LPSがPRR(TLRが主な代表)に結合することにより、宿主の抗原提示細胞が発現するPRRのリガンドとなり、肺の免疫反応を制御するさまざまな細胞プロセスを引き起こすことが、これまでの研究で明らかになっている76, 77。考えられるメカニズムは、LPS-TLR4リガンド受容体の結合がTh2およびTh1喘息の発症増強に関与しているというものである78、 79 研究によると、LPS不活性化マウスは、イエダニ喘息モデルにおいてTh2炎症に対する反応能力が低下している。80 興味深いことに、生後早期のLPS曝露は、喘息およびパターン化免疫の発生率と負の相関があり、81, 82 これは、後のTh2喘息を促進する可能性がある。さらに重要なことに、LPSの気管内灌流が宿主の腸内細菌叢に変化をもたらすことが動物モデルで観察されており、LPSが腸と肺の相互作用において双方向的な制御的役割を果たしていることが示唆されている80, 83, 84。
3.2.2 SCFAは喘息を緩和する
腸内細菌叢の最も豊富な代謝産物であるSCFAsは、腸-肺相互作用の双方向性の重要なメディエーターであると考えられている。腸内細菌叢による食物繊維の代謝に由来する酪酸、プロピオン酸、酢酸などのSCFAは、食物繊維の含有量に正比例する85。腸管内腔に放出された後、一部のSCFA(特に酪酸)は腸内で局所免疫を形成し、腸細胞にエネルギーを供給する。消化管で使用されなかったSCFAは門脈に入り、肝臓に運ばれて代謝される。未代謝のSCFAが末梢循環や骨髄に移行すると、免疫細胞の発達に影響を及ぼす。83 SCFAはGRP41などのGタンパク質共役型受容体(GRP)を活性化することにより、アレルギー性気道疾患への感受性を低下させる可能性がある、 88 この保護は、腸-細-肺軸を介した造血と樹状細胞の機能の変化によって媒介される89。
さらに、食物繊維から抽出された酪酸は、骨髄における肺の抗炎症性マクロファージ前駆体の血中産生を促進することで、浸潤好中球による免疫病理を制御して喘息を予防することも示されている。この免疫調節作用は、抗炎症性および抗アレルギー性のTregが担っている可能性がある。
3.2.3 腸内細菌叢のその他の代謝産物
DATと生体アミンもまた、腸と肺のコミュニケーションに重要な役割を果たしている。中でもDATは、I型インターフェロン応答を増強することにより、肺応答を制御することができる。DATはマウスをアレルギー性肺炎、喘息、インフルエンザウイルス感染から守ることができる91。さらに腸内細菌叢は、ヒスタミンを含む生体アミン92のような、炎症促進および抗炎症の可能性を持つ代謝産物を産生し、腸-肺相互作用を通じて喘息に多大な影響を及ぼす。自然免疫系も適応免疫系もヒスタミンによって制御される。ヒスタミンの調節作用は、4つの受容体(発見順にH1R~H4Rと命名された)への結合に依存している93。H3Rは主に神経系に発現しており、神経炎症と主に関連している94。H1RとH4Rは喘息と関連していると考えられており、これらの活性化は喘息を悪化させる95。ヒスタミンはT細胞に対する走化性作用を有し、H1Rを介したCD4 T細胞の肺への遊走は炎症反応の重要な構成要素である96。H4Rアンタゴニストによる治療は、Th2駆動性喘息を抑制し、また気道機能障害を改善することができる97。H2Rアンタゴニスト処理またはH2R欠損動物では、CD1d+樹状細胞とiNKT細胞の数が増加し、炎症細胞とTh2サイトカインが増加する。さらに、ヒスタミンはマウスOVA誘発喘息においてIL-10を促進し、TGF-αを抑制することが分かっており、それによって気管支肺胞洗浄液(BALF)中の細胞総数および肺組織中のIL-4、IL-5、IL-13などの炎症性因子の数を減少させる99。このことは、代謝産物であるヒスタミンが、腸-肺相互作用の双方向制御に対して複雑な免疫調節効果を持つことを示している。もちろん、他の腸内細菌叢代謝産物も免疫調節に関与している可能性がある。
上述したように、腸内細菌叢の異常は喘息と密接に関連している(図2)。しかし、呼吸器感染症やアレルギー性炎症性疾患に対する炎症反応が、CCL25-CCR9軸を介して呼吸器から腸粘膜への腸管傷害を引き起こすことも、研究によって明らかになっている100, 101。
詳細は画像に続くキャプションに記載
図2
図ビューアで開く
パワーポイント
キャプション
3.3 腸肺軸の喘息に対する双方向作用
102, 103 腸内細菌叢は、細菌の構造成分や代謝産物の分泌を通じて宿主の免疫系と活発に相互作用し、その結果、消化管における局所的および全身的な免疫応答の能力を調節し、肺などの宿主の様々な遠位部分に影響を及ぼし、またその逆も同様である。104 肺疾患もまた、リンパ球の遊走や炎症性メディエーターを通じて腸内細菌叢に影響を及ぼし、腸疾患を引き起こす105。
II型炎症性喘息には、Tヘルパー2型細胞、ILC2、T濾胞ヘルパー細胞、好酸球、肥満細胞、およびサイトカインIL-4、IL-5、IL-13、プロスタグランジンD2などのII型メディエーターが関与している。例えば、lachnospira、veillonella、faecalibacterium、rosiaなどの腸内細菌叢が減少すると、喘息のリスクが増加する109、 110 モラクセラ・カタルハリス(Moraxella catarrhalis)は、肺好中球浸潤、IL-6およびTNF-αの上昇、CD4T細胞由来のIFN-γおよび肺IL-17の中程度のレベルを引き起こす可能性がある。69 対照的に、好中球性喘息患者における高用量のICS治療は、ヘモフィルス菌の相対的濃縮によって示される、ステロイド感受性疾患からステロイド抵抗性疾患への転換をもたらす可能性がある、 111 カンジダ・アルビカンスは感染後、IL-13-IL-33軸を介してTh2介在性喘息を悪化させ、AHRを低下させる。69 一方、臨床研究により、喘息患者の末梢血におけるC反応性蛋白(CRP)などの炎症因子のレベルは、非喘息患者よりも有意に高いことが判明している。CRP、総腸内細菌量、胃腸症状スコア(GSRS)は正の相関があり、末梢血の炎症因子のレベルが上昇すると、喘息児の腸障害や胃腸不適応の可能性が高まることを示している112, 113。したがって、このことは、腸-肺軸と宿主免疫の双方向の制御が、腸内細菌叢異常と喘息の発生を媒介する可能性があることも示している。
双方向性の腸-肺軸と宿主免疫系との間に、活発かつ複数のクロストークが存在することを示す証拠が増えている114。このクロストークは主に以下の免疫細胞によって媒介される。
3.3.1 Tregは腸内細菌叢と代謝産物によって制御される
T細胞の亜集団であるTregは、宿主の免疫応答を仲介する重要な免疫細胞である。マウスの腸内細菌叢が、腸におけるTregの誘導と肺におけるアレルゲン寛容の役割を仲介していることを示す正確なデータがある。さらに、Tregはアレルギー疾患などの宿主免疫疾患においても重要な役割を果たしているが、両者の間の具体的なクロストークは明らかではない。しかし、この見解を確認するには、さらなる証拠が必要である。喘息モデルを用いた研究では、Tregは腸内細菌叢とその代謝産物であるSCFAによって制御されていることが示されている。例えば、クロストリジウムはTregs産生を誘導する。52, 87 SCFAは、ヒストンの脱アセチル化を阻害することで転写因子FOXP3の発現を増加させ、Tregの拡大をサポートし、IL-10の産生を増加させる。
上記に加えて、高リスクの喘息を持つ小児では、IgAパターンに著しい変化が見られる。これは、腸粘膜のトレグによるIgA抗体の誘導や、腸内細菌叢に対するIgAの反応の乱れに関係している可能性がある117。
3.3.2 Th17細胞の移動が喘息を引き起こす
炎症反応は、腸-肺軸と宿主免疫系との相互作用の典型的なケースである。つまり、腸管に由来する局所的な免疫反応が、肺の局所臓器や遠位臓器へのさまざまなタイプの宿主免疫細胞の浸潤を引き起こし、肺病理学的変化を引き起こすのである。とはいえ、喘息は体内分類によってTh1喘息とTh2喘息に分けられる。Th2喘息は主に好酸球浸潤を伴う喘息を指す。118, 119 Th1喘息は好中球浸潤に基づく喘息や肥満関連喘息に多く、Th1細胞とTh17細胞の浸潤と好中球浸潤が特徴である。Th17細胞はリンパ循環を通じて直接肺に移動し、Th2型炎症を活性化し84、好中球の炎症につながり、喘息を引き起こすという研究結果がある。120さらに、Th1型喘息は、I型インターフェロンの存在、NLRP3インフラムマソームの活性化などによっても特徴づけられる121-123。逆に、肺感染によって誘導されるTh17細胞応答は、腸の損傷にもつながる可能性がある124(図3)。
詳細は画像に続くキャプションに記載
図3
図ビューアで開く
パワーポイント
キャプション
これとは別に、環境因子の幼少期における抗生物質曝露によって引き起こされる腸内細菌叢異常症が、成人期における喘息のリスクを増加させるという研究結果もある125。このプロセスの考えられる病因は以下の通り126:(1)炎症細胞の浸潤と炎症性サイトカイン(IL-4とIL-13)の産生を増加させることによって、Th2反応が悪化する。例えば、新生児にバンコマイシンを投与すると、肺の炎症が悪化する。128(3)ストレプトマイシンによって肺のTh1/Th17の適応免疫反応を増幅させると、Th1/Th17主導の炎症性肺疾患やアレルギー性肺炎が悪化することが示されている49、 129 その上、大規模な疫学研究において、抗生物質や薬剤の使用は、初期の腸内細菌叢の組成の形成に重要な役割を果たしていることが判明している130, 131 生後早期に高用量で強力な抗生物質を様々なコースで投与された小児は、腸内細菌叢に影響を与え、それによって宿主の生理機能や免疫恒常性に影響を与え、喘息の発生につながる可能性が予測される132。133, 134 同様に、ブリティッシュコロンビア州では、抗生物質の使用を減らすことが、生後1年間の喘息リスクの低減と有意に関連することが研究で確認されている。
4 腸内細菌叢を操作して喘息と闘う
腸内細菌叢を改善することは、健康的な定常免疫バランスの確立を助けることにより、その有益な効果を刺激する可能性がある。この総説では、喘息と闘うためのプロバイオティクス、蠕虫療法、糞便微生物叢移植(FMT)による腸内細菌叢の操作について述べる。
4.1 プロバイオティクス
プロバイオティクスとは、経口摂取する生きた微生物のことである。プロバイオティクスに使用される細菌は、主に乳酸菌、放線菌、非病原性大腸菌に属している。研究では、経口プロバイオティクスが多くのシグナル伝達経路を通じて喘息を制御することがわかっている。例えば、ビフィズス菌はTh1/Th2のバランスを刺激し、肺のIFN-γ、IL-4、IL-12などの炎症因子をアップレギュレートして喘息発作を制御することができる。また、経口プロバイオティクスは、喘息モデルマウスにおいて、喘息の病理学的変化を軽減するTregを誘導することができる137, 138。さらに、経口プロバイオティクス乳酸菌ラムノサスGG(LGG)は、肺胞洗浄液および血清中のマトリックスメタロプロテイン9(MMP9)の発現を低下させ、肺における炎症細胞の浸潤を抑制し、喘息を保護することが研究で確認されている139。
上記とは別に、臨床試験でプロバイオティクスを投与した喘息児は、肺機能が改善しただけでなく、喘息発作の回数も減少した。しかし、喘息に対するプロバイオティクスの効果と免疫反応の調節の正確なメカニズムは、依然として不明である。
4.2 ヘルミンス療法
蠕虫は、宿主の免疫系のバランスを整え、宿主に抑制的な環境を作り出すタンパク質を分泌することで、アレルゲンに対する過敏症を軽減する。140 一部の研究では、蠕虫感染がアレルギー性喘息の罹患率を低下させることが確認されている。研究者らは、蠕虫が腸内細菌叢の組成に影響を与え、間接的に肺の免疫反応に影響を与え、喘息発作を予防することを発見している。142 研究によると、Heligmosomoides polygyrus bakeriに感染したマウスは、SCFAを増加させることで腸内細菌叢の組成を変化させ、最終的にダニ誘発喘息モデルの炎症を抑制することが示されている143。
4.3 糞便微生物叢移植
144, 145 FMTは腸内細菌叢を改善するもう一つの方法であり、腸疾患の改善に成功した例もあるが、喘息におけるFMTの潜在的役割については未解明である。そのため、さらなる研究が必要である。
上記の方法に加え、ヒトを対象とした試験では、食事中の果物、野菜、魚、プロバイオティック食品の割合を増やすことで、精製された代謝物が徐々に有望なターゲットとなり、喘息の補助的介入戦略として使用できることが示されている。しかし、その具体的なメカニズムはまだ明らかになっていない。
5 結論
喘息は本質的に不均一な炎症性疾患である。個人によって臨床症状の程度が異なり、発症年齢も比較的若い。さらに、喘息の複雑な病態とICS治療に対する一部の小児の抵抗性から、人々は別の予防法や治療法を模索する必要がある。
肺や腸の微生物異常は、汚染、アレルゲン、抗生物質の使用、ウイルスなど、複数の環境要因に影響される可能性がある。現在、喘息における炎症は、微生物の構成や気道閉塞の重症度と関連しているようであることが、より多くの研究で明らかになっている147。喘息患者の肺微生物叢の量には健常人と比べて有意な差があり、これが炎症経路を活性化し、気管支収縮や気管支過敏症の一因となっている。炎症性疾患における腸内細菌叢の重要な役割を考慮すると、腸内細菌叢は喘息研究にとって画期的なものとなっている。幼少期の腸内細菌叢異常が喘息に及ぼすメカニズムを探ることで、研究者は喘息性免疫反応に介入し、予防することを期待している56。
腸内細菌叢は免疫調節を通じて遠位臓器や肺でも重要な役割を果たしており、それは双方向の腸-肺軸と宿主免疫によって達成されることは明らかである。したがって、腸内細菌叢、腸-肺軸、および免疫相互作用の間のクロストークを応用して、喘息の特異的な予防・治療モデルを確立することは、喘息のパンデミックを軽減するためのよい展望となるかもしれない3, 148。プロバイオティクス、蠕虫療法、FMT、または精製代謝産物によって腸内細菌叢のディスバイオージスを改善し、腸内細菌叢のバランスを回復させ、喘息の予防・治療の管理を達成できることが研究で示されているように、このクロストークは生物学的に妥当であり、最終的には実用的である。しかし、プロバイオティクスやFMTは、まだ臨床的なルーチンにはなっていない。したがって、腸内細菌叢の働きを臨床的に喘息患者に役立てるには、どのように普及させるかをさらに探求する必要がある。喘息患者がプロバイオティクスを標的とした新たな治療戦略を試みており、そのほとんどのケースで有望な結果が得られていることが、臨床および実験室での研究を通じて観察されている。
結論として、腸内細菌叢は喘息と密接な関係があり、その異常は喘息のリスクと重症度を高める。その結果、腸内細菌叢の構造成分と代謝産物の変化と喘息の背後にある正確な役割とメカニズムについては、さらなる探求が必要であり、特に宿主の免疫反応と喘息を媒介する腸-肺軸については、149のように、腸内細菌叢と腸-肺軸と喘息の因果関係さえも、まだ解明されていない。
著者の貢献
Xiu-Ling Song:調査(補助);視覚化(リード);執筆-原案(リード)。Juan Liang:調査(補助)、可視化(リード)、原案執筆(リード)。林紹柱: 概念化(サポート)、形式分析(サポート)、調査(リード)。Yu-Wei Xie:調査(サポート)、執筆-校閲・編集(サポート)。柯創紅: 監督(サポート)。ダン・アオ: 柯創宏:監修(補助)。Jun Lu:監修(支援)。陳雪梅:調査(補助)。何英志: 何英志:調査(サポート)。劉暁華:調査(支援)。Wen Li:概念化(リード)、正式分析(リード)、資金獲得(リード)、監督(リード)、プロジェクト管理(リード)、執筆-校閲・編集(リード)。
謝辞
原稿作成にあたり示唆をいただいたYu-Ge Huang教授に感謝する。本研究は、中国国家自然科学基金(32100602)、中国広東省自然科学基金(2023A1515012755)、広東医科大学附属病院ハイレベル人材科学研究スタートアップ基金(GCC2021009)の助成を受けた。
利益相反声明
すべての著者に申告すべき利益相反はない。
参考文献
PDFダウンロード
戻る
その他のリンク
ワイリーオンラインライブラリーについて
プライバシーポリシー
利用規約
クッキーについて
クッキーの管理
アクセシビリティ
ワイリーリサーチDE&Iステートメントと出版ポリシー
発展途上国へのアクセス
ヘルプ&サポート
お問い合わせ
トレーニングとサポート
DMCAと著作権侵害の報告
チャンス
購読エージェント
広告主・企業パートナー
ワイリーとつながる
ワイリーネットワーク
ワイリープレスルーム
著作権 © 1999-2024 John Wiley & Sons, Inc または関連会社。テキストマイニング、データマイニング、人工技術または類似技術のトレーニングに関する権利を含む。
ワイリーホームページ
この記事が気に入ったらサポートをしてみませんか?
