PQQ/ピロロキノリンキノンは、抗酸化物質以上の存在。健康や病気の予防に重要なビタミン様補助因子である。
概要
ピロロキノリンキノン(PQQ)は、ミトコンドリア形成、生殖、成長、老化などの生物学的プロセスに関連している。さらに、PQQは、臨床的に関連する機能障害(虚血、炎症、脂質毒性に関連するものなど)を減衰させる。PQQは、現在ビタミンや条件付きビタミンとして認められていない生体因子の中では新規のものである。例えば、食事にPQQが含まれていないと、ビタミン関連の欠乏症のような反応が生じ、PQQの補充により用量依存的に回復する。さらに、PQQの補給は、代謝の柔軟性の向上や免疫・神経保護といった潜在的な健康効果も期待されています。ここでは、酵素の補酵素やアクセサリー因子としてのPQQの役割を取り上げ、PQQの作用の基礎となるメカニズムを明らかにする。新生児期あるいは周産期のPQQ欠乏がミトコンドリア量とミトコンドリア関連遺伝子発現を減少させることを示す大規模データセットと標的データセットの両方について検討する。PQQが乳酸酸やおそらく他のデヒドロゲナーゼを調節することにより、NAD+依存性のサーチュイン活性と、PGC-1α、NRF-1、NRF-2、TFAMなどのサーチュイン標的が増強され、ミトコンドリア機能を媒介するというデータをレビューした。これらのことから、ビタミン様物質であるPQQは、強力な治療用栄養補助食品としての可能性を持っていることが示唆された。
キーワード:ピロロキノリンキノン、PQQ、細胞シグナル伝達、栄養、ビタミン、炎症、抗酸化物質
1. はじめに
ピロロキノリンキノン(PQQ)は、1960年代後半に初めてバクテリアの脱水素酵素の補酵素として報告されました[1]。当時、細菌の脱水素酵素の補酵素と考えられていたのはニコチンアミド補酵素とフラビンだけだったため、PQQが補酵素として認められたことは重要でした。その後15年かけて、PQQの構造は完全に解明された[2,3,4,5,6,7,8]。その結果、PQQは、デヒドロゲナーゼやオキシダーゼで利用されるキノン補酵素の一群、キノプロテインに分類されるものとして理解されるようになった。他のキノタンパク質補酵素には、2,4,5-トリヒドロキシフェニルアラニンキノンまたはトパキノン(TPQ)、リジンチロシルキノン(LTQ)、システイントリプトフィルキノン(CTQ)およびトリプトファンフィロキノン(TTQ)などがあります [7、8]。
PQQは、栄養や環境への暴露を通じて、ミトコンドリア形成、生殖、成長、老化に影響を与え、重要な生物学的プロセスに影響を与えます。真菌類から哺乳類までの生物において、栄養源からPQQが欠乏すると、様々な異常が生じることを示す複数の証拠がある。さらに、栄養補助食品として、PQQは虚血、炎症、脂質毒性などの臨床的に関連する症状を軽減し、また、向精神薬としての特性も持っています[9,10]。この点で、脂肪酸代謝とミトコンドリア機能に必須な遺伝子は、特にPQQの標的となる。
このレビューを通して、細胞シグナル伝達におけるPQQの役割に焦点が当てられる。PQQは、重要な発見として浮上したNADHからNAD+への酸化において、乳酸や他のデヒドロゲナーゼの触媒アクセサリー因子として機能する[11]。PQQは、NAD+依存性のサーチュイン活性と、サーチュインが標的とするPGC-1α、NRF-1および2、TFAMなどの発現を増強します[10]。注目すべきは、PQQほど効率的に活性酸化種のレベルを低下させる生物活性食品成分はほとんどないことです[9]。
2. 作用の化学および生物学的メカニズム
2.1. 一般的な特性
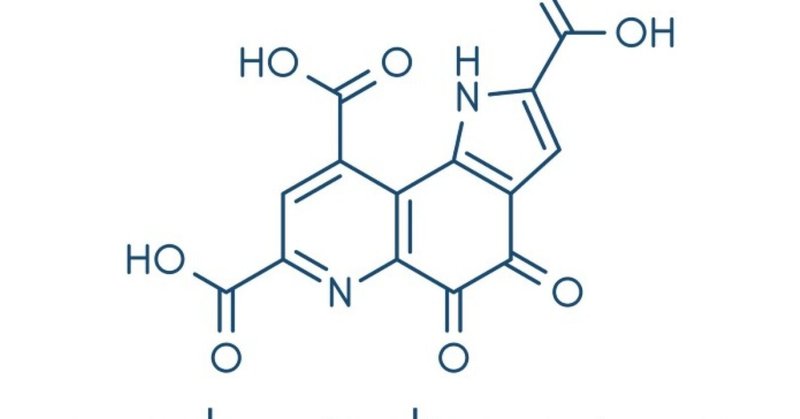
ピロロキノリンキノン(PQQ;4,5-dihydro-4,5-dioxo-1H-pyrrolo [2,3-f] quinoline-2,7,9-tricarboxylic acid)は、芳香族水溶性キノンで、化学特性は、Ascorb酸、リボフラビン、ピリドキサル5りん酸の化学特性を一分子にまとめたようなものである。例えば、PQQは酸化型(PQQox)と還元型(PQQH2)の両方が酸化還元サイクルを行うことができる。また、PQQは脱水素酵素の補因子、フリーラジカルスカベンジャー、アミンオキシダーゼの触媒としても機能する[12,13]。PQQは親電子性が高く、多くの物質(例えば、ヒドラジン、ヒドロキシルアミン、セミカルバジドなどの各種カルボニル試薬)と反応する。さらに、PQQはアセトン、アミノグアニジン、尿素、各種ジアミン、2価の金属と錯体を形成する[12,13]。さらに、PQQはアンモニアと反応してイミノキノンを生成し、酸性条件下では内部ラクトンが形成されるが、中性および塩基性条件下では二水和物が形成されるのとは対照的である [14].
PQQは容易に自己酸化したり、不活性型に縮合することはない。したがって、モルベースで比較すると、PQQはアスコルビン酸やメナジオンなどの他のエネジオールや、多くのイソフラボノイド、フィトアレクシン、ポリフェノール化合物よりも酸化還元サイクルアッセイにおいて100~1000倍効率的である可能性があります [12]。酸化還元補酵素として、PQQはチオール[12]、リボフラビン[12]、ユビキノン、末端シトクロム[15]、α-トコフェロキシルラジカル[16]、ニコチンアミド・アデニンジヌクレオチド補因子[17]の酸化を伴う連続的酸化還元反応の触媒が可能である。抗酸化物質として、PQQH2はペルオキシルラジカルに対して、α-トコフェロールよりもさらにアロキシルラジカルスカベンジャーとして作用することができます[16]。さらに、PQQH2はα-トコフェロールと組み合わせることで、多価不飽和脂質の酸化で発生するα-トコフェロキシルラジカルを低減し、α-トコフェロールを保護することができます。図1は、PQQの酸化還元過程と抗酸化剤としての役割に関する重要な関係をまとめたものである。
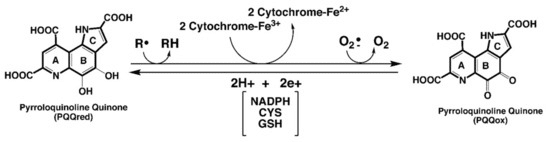
酸化されたPQQは、銅のような金属の存在下で評価できる抗酸化活性を発揮しません。しかし、PQQoxは、エラスチンやコラーゲンなどのタンパク質中のリシル基のεアミン機能をアルデヒド機能へと非酵素的に酸化すること、ピリドキサミンとピリドキサミン5-リン酸をピリドキサールとピリドキサル5-リン酸に酸化することを触媒します[12]。

2.2. 酵素の補酵素としてのPQQ
PQQが補酵素として機能する細菌酵素のうち、ほとんどはグルコースまたはアルコールのデヒドロゲナーゼである。例外は、Pseudomonas属のルピニンヒドロキシラーゼである[13]。このPQQ依存性キノエンザイムは、ルピナスのキノリジンアルカロイドであるルピニンを基質とするアミンデヒドロゲナーゼとして機能します。グルコースやアルコールを基質とする酸化反応では、ヒドリドイオンの移動が関与する機構が提案されている。また、K+、Mg2+、Li+、Ca2+などの金属イオンも触媒的な役割を果たす[13]。
基本的に重要なのは、赤川ら [18,19] が、PQQが乳酸脱水素酵素 (LDH) などの哺乳類の脱水素酵素において機能的な役割を果たすことを報告している点である。LDHに結合したPQQは、NADHのNAD+への酸化とピルビン酸の産生を促進する[18,19]。酸化的代謝の最適化は、抗酸化防御の改善や免疫機能の向上と表裏一体である。この点、NAD+はサーチュイン、特にサーチュイン1および3(SIRT1およびSIRT3)によって触媒される脱アシル化反応の基質となる。サーチュインは、酸化プロセスに関連した代謝制御に不可欠なシグナル伝達タンパク質のファミリーである。その関係の一部を図2に概説する。

図2. PQQと細胞内NAD+。PQQとNAD+によって惹起される事象が強調されている。図の上部、Aには、NAD+の生成に重要なナイアシン関連血清成分が描かれている。PQQはニコチンアミドホスホリボシルトランスフェラーゼ(Namptと命名)の発現を増強することにより、このプロセスに関与している。Namptの活性を高めると、NAD+の細胞内レベルが上昇する。NAD+は2つの主要な機能を果たす。第1に、乳酸デヒドロゲナーゼ(LDH)、Cなどのデヒドロゲナーゼやレダクターゼの補因子として、第2に、Dで述べたようにサーチュイン触媒によるタンパク質脱アセチル化の共同基質として。同様に、PQQはLDH、Cの触媒補因子で、PQQによって乳酸からピルビン酸の変換を促進する。核内ではE、NAD+がサーチュインの共同基質として、細胞シグナルに関与するタンパク質の標的アセチル化・脱アセチル化を促進します。6つの例を列挙する。(1) ニトコンドリア形成とP-酸化速度の制御に重要なLKBl/AMP-Kinase経路、(2) 細胞の増殖と生存に重要なフォークヘッドボックス0転写因子(FoxO)、 (3) 自然および適応免疫応答性の多くの側面を制御するNF-KBおよびP53タンパク質に関わる転写因子、。(4) 造血、授乳、免疫反応に関わるプロセスに不可欠なヤヌスキナーゼ-シグナルトランスデューサーおよび転写活性化因子JAK-STAT)経路、 (5) 細胞代謝とATP生産に中心的役割を果たすペルオキシソーム増殖因子活性化受容体-γコアクチベーター(PGC-α)、 (6) ミトコンドリア転写因子(TFAM)とミトコンドリアゲノム複製に必須の他の因子を制御します。最後に、ミトコンドリアでは、F. PQQとNAD+が、ミトコンドリアのサーチュインやUCP2などのアンカップリングプロテインが制御するイベントを通じて、酸化的代謝、活性酸素制御、熱制御に大きな影響を与える。
さらに詳しく説明すると、SIRT1は主に核に存在し、細胞質にはあまり存在しない[11,20]。一方、SIRT3は一般的にミトコンドリアに局在し、ミトコンドリアDNA転写に関連している[11,21]。ペルオキシソーム増殖剤活性化受容体-γコアクチベーター(PGC)-lαは、サーチュイン活性によって制御される最も重要な因子の一つであり、SIRT1による脱アセチル化を通じて活性化される。PGC-lαは、核呼吸因子1および2(NRF-1およびNRF-2)のような他の転写エンハンサーの集合を可能にすることによって、転写コアクチベーターとして作用する。このような因子は、エネルギーの恒常性を維持し、抗酸化反応遺伝子に関与するために必要な細胞内の要素である[22]。さらに、Tchaparianら[23]は、食事性PQQの補給に反応する他の転写ネットワークの同定を報告している。これらのうち、5′-アデノシン一リン酸活性化プロテインキナーゼ(AMPK)、マイトジェン活性化プロテインキナーゼ(MAPK)、およびヤヌスキナーゼのシグナルトランスデューサーおよび転写活性化因子JAK-STAT)経路は、細胞増殖、分裂、アポトーシスおよび免疫応答のほとんどの側面の制御を助けるものである[24、25、26、27、28、29、30、31および32]。
3. 原核生物と菌類におけるPQQの役割
3.1. PQQの合成
100種類以上の原核生物がPQQ合成能力を持ち、PQQを酵素の補酵素として使用することが確認されている [33] 。その多くはグラム陰性で、植物共生生物(例:根関連根粒菌)から昆虫病原体まで、その機能は多岐にわたる。細菌のPQQ要求性アルコールおよびグルコースデヒドロゲナーゼは、多種多様な一次および二次アルコールの酸化を触媒し、非環状テルペンの異化を触媒する[13]。グルコースデヒドロゲナーゼ(GDH)は、膜結合型と可溶性型の両方が存在する[34,35]。しかし、これらのDNA由来のタンパク質配列は非類似であり、免疫学的な交差反応性はほとんどないに等しい。最も注目されているのは、細胞質膜のペリプラズム表面に局在する膜結合型GDHで、細菌の呼吸、酸化的代謝、および成長に不可欠である[35]。さらに、その制御は、酸素濃度の変化や細胞増殖に関連する因子に敏感である。また、PQQを作らない生物でも、利用できる場合は利用するものがあることも重要です。その好例が腸内細菌である大腸菌(Escherichia coli)で、膜結合型のPQQ依存性GOHとNADH依存性GDHを有しています。PQQ依存性GDHは、PQQが利用できる場合に優先的に使用される[13]。
PQQを作る細菌では、PqqA、PqqB、PqqC、PqqD、PqqEと名付けられた5つのタンパク質遺伝子産物がPQQ生産に必要である(図3)。pqqオペロンに含まれる3つの遺伝子産物、PqqB、PqqC、PqqEは大きなタンパク質スーパーファミリーのメンバーである。各遺伝子産物の役割は、ZhuとKlinmanによって説明されている[36]。PQQは合成後、β-プロペラ配列の性質を持つ結合ドメインで、細菌のグルコースやアルコール脱水素酵素などのキノ酵素に結合する。β-プロペラ配列は、中心軸を中心にトロイダルに配置された4~8個の対称性の高いブレード状のβシートが特徴である。β-プロペラ配列は、生命界のあらゆる分野に存在する。β-プロペラは、主に高分子相互作用や触媒部位でのリガンド結合のための足場として機能している[37]。

3.2. PQQと菌類
真核生物で初めてPQQを含む酵素を示したのは、竹田、松村ら [38,39,40,41] で、担子菌のCoprinopsis cinerea(Cc)から新規PQQ依存性糖酸化還元酵素を単離して特徴付けた。担子菌類は、真菌の性・交配型、キノコの発生、多細胞化に不可欠なプロセスなどを研究するモデル生物である。この酵素は、細胞外PQQ依存性糖脱水素酵素(CcSDH)で、細胞外分泌のためのシグナルドメインと、セルロース吸着、PQQ結合、シトクロム結合のドメインから構成されています。その後、Varnaiらも同様の見解を示している[15]。酵母がPQQを含むという報告はあるが、特定のPQQ含有酵素はまだ同定されていない[42]。しかし、Matsumuraら[38]が強調しているように、BLAST検索により、細菌、古細菌、アメーバ動物、真菌にCcSDHと相同なタンパク質をコードする多くの遺伝子が存在することが示された。さらに、系統解析の結果、キノタンパク質と同定されたものは、原核生物と真菌類に広く分布していることが示唆された。
4. PQQ と植物の成長
植物がPQQを生成するという証拠はないが,PQQの暴露は植物の成長を促進する [43,44,45,46,47,48,49,50,51].植物にとってのPQQの供給源は、主に土壌と植物の根(根茎)に関連する細菌である。PQQを介した成長刺激のメカニズムは、土壌ミネラルのバイオアベイラビリティの向上から、活性酸化種に対する防御力の向上まで多岐にわたる[44,49,50]。例えば、根粒菌はミネラルリン酸塩の可溶化を助けるが [43,44,45,46,47,48] 、PQQ合成に関わる遺伝子を欠くPseudomonas変異体は成長を促進しない [47].葉ディスクをPQQまたは野生型Pseudomonas fluorescensで処理すると、活性酸素が消去され、過酸化水素の減少が見られる。わずか100 nMのPQQはCucumis sativus(キュウリ)の苗の成長を刺激する[44]。また、PQQは、リン酸を含まない条件下で培養した場合でも、リン酸可溶化根粒菌の紫外線に対する耐性を向上させる[50]。マイトマイシンCに対する細菌の耐性の向上も明らかであり、すなわち、PQQ曝露後に観察されるDNA鎖切断はより少ない[50]。最後に、植物病原性微生物の有害な影響を減少させることによって、成長促進が起こる可能性があります。複製にPQQを依存する多くの根粒菌は、茎組織のがん化増殖を引き起こすアグロバクテリウム・ツメファシエンスや、好気性で植物病原性細菌であるラルストニア・ソラナセアラムなどの植物根の病原菌から守る抗菌化合物を生成する[51]。
5. PQQ と昆虫 (キイロショウジョウバエと線虫)
5.1. ショウジョウバエ・メラノガスター
キイロショウジョウバエや線虫は、腸内細菌学や長寿に焦点を当てた研究のモデルとして、また細胞シグナルや遺伝子レベルで疾患ベクターを評価するサロゲートとして、しばしば用いられている[52]。例えば、パーキンソン病のD. melanogasterモデルにおいて、哺乳類のPGC-1α.のD. melanogasterホモログを遺伝的または薬理的に活性化すると、疾患の表現型が救済されます。[53]. 一方、D. melanogaster PGC-1αをサイレンシングすると、パーキンソン病の表現型が発現するようになる[54]。ショウジョウバエもまた、正常なマイクロバイオーム機能を維持するために常在菌に依存しています。興味深いことに、Shinら[55]は、ショウジョウバエの常在菌である酢酸産生菌Acetobacter pomorumのPQQ依存性アルコール脱水素酵素(PQQ-ADH)活性がインスリン/インスリン様成長因子(I/IL-GF)シグナルを調節することを報告しました。無菌状態のD. melanogasterでは、宿主のI/IL-GFシグナルを増強するか、餌に酢酸を補充すると、I/IL-GFシグナル関連の欠陥が回復する。I/IL-GFシグナルは、D. melanogasterの発生、体格、エネルギー代謝、および腸管幹細胞活性に影響を与える。
5.2. 線虫類
線虫(Caenorhabditis elegans)において、PQQ曝露は線虫の抗酸化力を高め、延命に関与する因子であるDAF-16/FOXO, SKN-1/NRF2, SOD-3の転写活性を高めることで寿命を延ばす[56]。DAF-16は、線虫における転写因子FOXOファミリーのオルソログであり、生存に関わる遺伝子(例えば、テロメアの延長や酸化ストレスに関わる遺伝子)を活性化する役割を担っています。SKN-1遺伝子は、哺乳類のNRF-2に似た転写因子をコードしており、酸化的損傷や炎症からの保護に関連している。最後に、Sasakuraら[57]は、PQQがDUOXタンパク質BLI-3を活性化することを報告した。BLI-3は、反応性オキシダント種のレベルを制御し、最適な成長に必要なレベルでありながら、炎症を促進するレベル以下であることを保証しています。
6. 動物モデルとヒト被験者における栄養の重要性
6.1. マウス・げっ歯類
腸内細菌叢で合成されるPQQがほとんどないことから、動物におけるPQQの供給源は食事であると考えられる(参照:3.原核生物と菌類におけるPQQの役割[58,59])。栄養学的研究において、PQQを含まない飼料を与えたマウスやラットでは、成長遅延や新生児発育が特徴的である(図4;[60,61])。マウス[60,61]とラット[62]の新生児成長率は、PQQに用量依存的に反応する。新生児の最適な成長は、PQQを含まない基礎飼料に約1μmolのPQQ/kgを添加した時点で達成される。さらに、妊娠前にPQQへの曝露を開始すると、PQQを最も奪われたマウスの産子数が減少する [61] 。

重要なことは、PQQ誘導体は食餌から容易に吸収されるということである。例えば、Smidtら[58]は、C14-PQQ(0.42μCi/μmol)の用量をSwiss-Websterマウスにガベージで投与した。投与量の60%が吸収され、吸収された投与量の80%以上が腎臓から排泄された。また、血中のC14-PQQの大部分(95%以上)は、血漿ではなく血球分画に関連していた。
6.2. 豚
他の動物種については、Yinら[63]が、離乳期のブタを用いて、成長、腸の形態、酸化還元状態、および選択したサイトカインのレベルを測定しました。PQQを添加しない場合、28日間の観察期間中、1日の平均体重増加は336g/日であった。4.5mgのPQQ/kg食餌では、体重増加率は-380g/日であった。また、十二指腸、空腸、回腸でSODとグルタチオンペルオキシダーゼ(GPX)レベルが上昇した。さらに、PQQ曝露により、インターロイキン(IL)-1β、IL-2、インターフェロン-Yなどの炎症性サイトカインが減少した。同様に、Wangら[64]は、PQQを添加した飼料または添加しない飼料を与えた母豚の子豚を調査しました。この飼料は、妊娠期と授乳期を通じて与えられた。PQQに暴露された子豚の腸では、ヘムオキシゲナーゼ1(HMOXl)、SOD1および2、カタラーゼ(CAT)、GPX1および4、グルタチオン合成の第一律速酵素であるグルタミン酸-システインリガーゼ(GCL)の活性とmRNA発現レベルがすべて増加した。Zhangら[65]によって報告された追加の観察も、Wangら[64]とYinら[63]の観察と相補的である。
6.3. ニワトリ
同様に、PQQは鳥類において、酸化還元状態および免疫状態の改善と一致する反応を引き起こす。Samuelら[66]は、約20μgのPQQ/kgを含む基礎飼料を用い、PQQを800μg/Kgまで段階的に添加すると、抗酸化防御が改善し、炎症が減少し、若鶏220羽の成長に好影響を与えると報告しています。さらに、Zhengら[67]は、10mg/kgのPQQがリポポリサッカライド(LPS)によって誘発される炎症作用に対抗することを報告している。モルベースで、PQQはアセチルサリチル酸やメクロフェナマートなどの抗炎症剤[68]やメラトニン[69]などのバイオファクターよりも10~100倍、LPSの効果を減衰させる効果があった。
6.4. ヒト
大学生年代のヒトを対象に、Harrisら[70]は、PQQの補充(1日あたり5~10mg)によって、血漿中のC反応性タンパク質、インターロイキン6レベル、血漿中のマロンアルデヒドレベルが低下したと報告しました。さらに、血中乳酸とピルビン酸の比や尿中代謝物のプロファイル(1H-核磁気共鳴法により推定)は、ミトコンドリアの酸化が促進されたことと一致しました。同様に、Hwangら[71]は、20mgのPQQを毎日補充することで、ヒト被験者のミトコンドリア生合成を最適化することを示しています。注目すべきは、認知機能と記憶もまた、PQQの補給(1日あたり10~20mg)により、ヒト被験者で改善されることです[72,73,74]。
7. 食事およびサプリメント中の PQQ およびその誘導体
PQQの定量に用いられるアッセイは、分光光度法と酵素法の両方で、高感度かつ高精度であるが、一般的にはPQQのみを測定する[75, 76, 77, 78]。残念なことに、PQQとその誘導体を正確に定量することは困難である。PQQの気相でのフラグメンテーションが複雑であるため、質量分析ベースの分析アプローチを用いることは困難である[75]。PQQ由来のイオンは、酸触媒によるPQQの互変異性ラクトン化とそれに続くPQQラクトン(PQQL)の酸化によって生じる(図5を参照)。また、PQQの脱炭酸も容易に起こる。従って、誘導体を含む全PQQの定量は、通常、せいぜい定性的である。質量分析法を用いてPQQと関連する誘導体の測定に成功した場合、そのレベルはPQQ単独の場合よりも1桁以上大きくなることがある[75]。例えば、ヒトの乳汁中では、PQQの濃度は20~30μg/Lと推定される。一方、PQQに非分岐鎖アミノ酸と反応して生成しやすい誘導体であるイミダゾロピロロキノリン(IPQ)を加えたものは、140〜180μg/L(〜0.5μM)または500〜750μg/乳固形分kg(〜2μM)の範囲である。半精製食の水性懸濁液に添加したPQQは、Steinbergら[60,61]とStitesら[79]が観察したように、誘導体や付加物を急速に形成する。例えば、PQQの付加物の形成または消失速度の半減期は、pH7.0で45分、pH2.5で〜60分である [60] 。

しかしながら、第6節で報告したように、PQQの必要性に関して強い推論がなされることがある。例えば、動物モデルの実験食を用いると、PQQの明らかな欠乏を作り出すことが可能である。これは、現在ビタミンとされているものを除き、他の有機バイオファクターでは欠乏症状は報告されていないという点で新規なものである。さらに、PQQ栄養補助食品の効果が報告される場合、それはしばしば低mg/kg/dietまたは1000kcalあたりの範囲で観察されるものである。アントシアニン[80]を除き、他のバイオファクター(ケルセチン、レスベラトロール、カテキン)は、動物モデルやヒトで測定可能な抗酸化作用や免疫保護関連の効果を得るためには、100〜400mg/kg食の摂取を必要とする。
さらに、IPQはバイオアッセイにおいてPQQと同等の効果を発揮することが多い。IPQは、L-グリシンなどのアミノ酸のイミド化によって酸化還元サイクルが駆動されるときの中間体であり[81,82,83]、したがって、PQQの潜在的供給源となり得る(図6)。Naitoら[84]は、培養線維芽細胞DNAへの[3H]チミジンの取り込みを測定した。PQQはnMの範囲で、IPQはμMの範囲で、チミジンの取り込みを有意に促進した。Yamadaら[85]は、ヒトの神経芽腫と肝細胞癌の細胞株、および6-ヒドロキシドパミン暴露からの神経保護を試験するために設計されたアッセイを用いてPQQとIPQを比較した。その結果、IPQの生物学的活性はPQQと同様であることが示されました。さらに、土田ら [86]は、PQQとIPQの両方が、ラットの四塩化炭素誘発肝障害に対してin vivoで保護することを実証した。

最後のポイントとして、サプリメントとしてのPQQは安全です。PQQは、米国FDAの「一般に安全とみなされる」(GRAS)要件をすべて満たしている[87]。Liangら[88]は、PQQ二ナトリウムのNOAEL(No-observed-adverse-effect-level)は、両性ラットの0.4 g/kg体重/日であると報告しています。ラットにおけるPQQの致死量の中央値は、雄で1.0~2.0 g/kg体重、雌で0.5~1.0 g/kg体重である [89,90].
8. PQQに応答する選択された臨床的および臓器固有の機能障害
8.1. 腎臓・肝臓
慢性腎臓病(CKD)は、世界人口の15%近くが罹患している [91]。合併症には、心血管疾患(CVD)、糖尿病、高血圧、貧血、腎臓病の進行、急性腎障害、ミネラルおよび骨の障害 [92]、認知機能の低下 [93,94,95,96] などがあります。腎臓は、物質のろ過と再吸収によって体液組成を制御しています。再吸収にはATPが必要であり、そのほとんどはミトコンドリアによって生成される[97]。腎臓のミトコンドリアの高い酸化活性は、酸化ストレスを上昇させ、腎機能障害とCKDの進行をもたらします[98,99]。ヒトおよび動物モデルの両方において、抗酸化防御活性の枯渇と活性酸素の産生の増加は、主に腎尿細管上皮細胞を標的とする炎症性損傷を誘発する。核因子赤血球2関連因子2(NFE2L2/NRF2)-抗酸化応答因子(ARE)は、細胞の抗酸化防御を制御することにより、急性腎障害(AKI)からCKDへの進行を防止する[100,101][102]。複数の研究において、NFE2L2の保護的役割の基礎となるメカニズムは、SOD2やヘムオキシゲナーゼ(HMOX1)などの標的遺伝子に作用し、それによって細胞内環境における活性酸素を減少させることです。実験的CKDモデルにおいて、腎臓保護能を有する天然生物活性化合物は、NFE2L2の活性化と関連している[103,104]。この点に関して、in vivo [105]およびin vitro [106]における最近の研究は、PQQがNFE2L2経路をターゲットにしているようであることを示唆している。化学療法剤であるシクロホスファミド(CTX、免疫抑制剤)で誘発された腎毒性のマウスモデルにおいて、Linら[105]は、CTX処理マウスへのPQQ補充が、NFE2L2標的遺伝子の発現変化によって特徴づけられるNFE2L2シグナルのCTX媒介2阻害を救済することによって、腎毒性を改善することを示した[105]。
高グルコースで処理すると、HK-1ヒト近位尿細管上皮細胞株は、腎臓における糖尿病の進行をモデル化する。HK-1細胞を高グルコースで処理すると、活性酸素の上昇と炎症性遺伝子の発現が起こり、それに伴ってNFE2L2とその標的が阻害される。Wangら[106]は、高グルコースで処理したHK-1細胞にPQQを補充すると、核へのNFE2L2の転位が増加することにより、NFE2L2シグナルが活性化することを発見しました。さらに、PQQはin vivoとin vitroの両方で炎症性シグナルを緩和し、LinらはNLRP3インフラマソームを通じて制御されていることを明らかにした[105]。
新生児発育のプログラミングに重要な因子(例えば、母親の肥満や高脂肪食への早期暴露)は、肝炎を促進する。このようなプロセスは、マウスモデルにおいて、非アルコール性脂肪性肝疾患から脂肪性肝炎へと進行させる可能性がある[参照:POO、腸管バリア機能とマイクロバイオーム]。腎臓と同様に、NFE2L2とその標的であるHMOX1の発現は、NLRP3とともに、西洋風の食事を与え、PQQで処理したマウスの子孫の肝臓で減少している[107]。さらに、PQQの補充は、肥満ラットの肝炎を減衰させる[108]。ラットでは、カドミウムおよび水銀による肝臓および腎臓の損傷の改善も、PQQの曝露後に報告されている[109]。
8.2. 腸管バリア機能とマイクロバイオーム
無傷の腸管バリアは、現在、健康の不可欠な制御因子として認識されています [110,111,112]。細菌とその産物は、腸管バリアの障害と透過性の重要な要因であり、その結果、細菌、エンドトキシン、細菌DNA、および代謝物の宿主循環への流入が増加する。最近の総説によると、微生物異常とバリア機能の低下は、消化器疾患 [113,114,115]、神経変性疾患 [116,117,118,119]、自己免疫疾患 [120,121,122,123,124,125] および肥満、インスリン抵抗性および心血管合併症を呈する宿主の代謝状態の障害と関連している [126,127,128,129,130,131,132,133,134,135]. いくつかの動物モデル [63,64,107,136,137] において、PQQへの曝露はタイトジャンクションタンパク質のmRNA発現レベルを増加させ、空腸バリア機能を改善することから、PQQは腸を介して末梢の組織に影響を及ぼす可能性が示唆される。この点に関して、短鎖脂肪酸である酪酸がバリア機能と大腸のホメオスタシスの重要な調節因子であることを示唆する最近の証拠が現れた [138,139]. 興味深いことに、PQQに暴露されると酪酸レベルが上昇する[137,140]が、これは酪酸が大腸菌の膜結合型ヘキソースおよびアルコール脱水素酵素の補因子として優先的に使用されるためと考えられる [141]。前述のように、膜結合型ヘキソースおよびアルコールデヒドロゲナーゼはグルコン酸の合成に関与しており、グルコン酸は乳酸菌によって乳酸と酢酸に発酵され、酸利用菌によって酪酸が生成される [142]。酪酸は、エネルギー消費の促進、ペルオキシソーム増殖剤活性化受容体コアクチベーター活性の刺激、インスリン抵抗性の改善、ミトコンドリア機能の強化など、腸内および全身で幅広いプラスの効果を発揮する[138,143]。さらに、酪酸はヒストン脱アセチル化酵素活性の阻害剤として作用する[144]。したがって、PQQを介した酪酸レベルの変化は、エピジェネティックな変化をもたらすかもしれない。実際、ブタ[137]およびげっ歯類[107,136]を用いた研究では、PQQの補給により子動物のバリア機能が改善したことが示されている。微生物叢の組成や機能に対するPQQの影響を直接調査した研究はほとんどないが、現在考えられているのは、一部の腸内細菌は最適な機能のためにPQQを必要とするかもしれないということである。
非アルコール性脂肪性肝疾患の発達プログラミングのマウスモデルを用いて、Jonscherら[107,145]は、PQQ曝露に応じた腸内細菌組成の差異を初めて検出した。ダムにPQQを補充すると、子孫の細菌組成で観察された、食事に起因するバクテロイデーテスの減少とファーミキューテスの増加が有意に逆転した(図7)。バクテロイデスやアロバクラムといった両門の属は存在量が増加し、疣贅菌(ゆうぜいきん)類門のアッカーマンスィアは減少しました。ラードベースの高脂肪食を与えた高齢ラットでは、Clostridiales属は食餌の影響を最も受ける目であり、その減少は腸内微生物の機能不全に関与していると思われた[146]。年齢や脂肪の種類がClostridialesの存在量に影響するかどうかはまだ不明だが、この順位が肥満や脂質毒性の動的で縦断的なバイオマーカーになる可能性は示唆的である。

8.3. 心筋・骨格筋の保護
骨格筋や心筋は、効率的な収縮のために高いATP回転率を必要とします。この点で、PQQを欠乏させたラットは、心臓虚血/再灌流傷害プロトコルに供されると著しく低下する。例えば、Bauerlyら[147]は、PQQ欠乏食を与えたラットの20%が虚血再灌流を生き延びなかったが、PQQを補充したラットはすべて生き延びたと報告している。これらの研究は、PQQの心保護効果をβ(l)-選択的アドレナリン受容体拮抗薬であるメトプロロールと比較した以前の研究 [148,149,150] の延長であった。ラットは、30分間の左前下行冠動脈閉塞と2時間の再灌流を受けた。PQQとメトプロロールはともに心機能の指標を改善したが,PQQは虚血/再灌流の酸化的損傷からミトコンドリアを保護する点でメトプロロールより優れていた.PQQの補給が健常人や動物モデルの心筋や骨格筋の機能に影響を及ぼすかどうかは、まだ不明である。例えば、Hwangら[71]は、6週間の持久力トレーニング/サプリメントプログラムを行った男性において、有酸素運動パフォーマンスとミトコンドリア生合成の指標に対するPQQサプリメントの効果を調査しました。有酸素運動性能に差は見られなかったが、ピーク酸素消費量と総運動負荷試験時間および回復量に改善が見られた。また、PQQ群では、非サプリメント群と比較して、ベースラインから持久力トレーニング後まで、PGC-lαタンパク質レベルの有意な上昇がみられました。マウスでは、Luiら[151]が、PQQが運動誘発性疲労から保護し、ミトコンドリア機能を改善することによって、おそらく酸化的損傷を低減することを実証しました。
マーケティングの観点から、PQQと運動能力に関する多くの主張がなされている。このような主張は、酸素が運動パフォーマンスに影響を与える最も制限的な栄養素であることを考慮せずになされることが多い。PQQのような生物学的特性を持つ化合物への暴露はミトコンドリア量を増加させますが、定期的な運動は同様の(あるいはそれ以上の)効果をもたらすかもしれません。また、体温調節についてもあまり考慮されていません。よく機能するミトコンドリアの表面温度は、50℃と推定されている[152]。心筋細胞のミトコンドリアは、熱の分散が損なわれたり、温度が40℃以上に維持されたりすると、ATP産生が減少し、ミトコンドリア内膜の透過性が高まるようです[153]。したがって、PQQの補給が独立して運動パフォーマンスを向上させることができると結論づけるのは早計である。実際、Hwangら[71]は最近、持久的な運動トレーニングを受けている男性にPQQを補給しても、PGC-lαの上昇を除けば、パフォーマンスにはほとんど影響しないと報告しています。
8.4. PQQと神経保護
PQQは、パーキンソン病、脳卒中、外傷性脳損傷など、脳の老化や神経変性の症例やモデルにおいて保護作用を示す。おそらく現在の例で最も優れているのは、ロテノンなどの神経系薬剤からPQQを保護する能力であろう [154,155,156,157,158,159,160] 。さらに、PQQがα-シヌクレイン線維形成を減少させることを考えると、神経変性を保護するPQQの能力は、ミトコンドリア形成を超えるかもしれない[161]。PQQはまた、脳卒中や脳損傷の齧歯類モデルにおいて、神経認知の喪失に対する抵抗性を付与する。Jensenら[162]は、頸動脈結紮を利用して、PQQの腹腔内注射後の神経保護特性を評価した最初の人たちである。血流が遮断された結果、皮質の大部分に梗塞の徴候が見られた。PQQを投与していないラットでは、皮質の95%に梗塞が見られたのに対し、PQQで前処理したラットでは70%に梗塞が見られた。同様の研究で、Zhangら[163]は可逆的な中大脳動脈閉塞を用い、成体ラットの脳への血液循環の遮断をシミュレートしています。閉塞と同時または虚血開始3時間後にPQQを頸静脈に注射したところ、梗塞サイズの縮小とともに神経行動学的スコアの顕著な改善が観察された。外傷性脳損傷に関しては、Zhangら[155,163,164]がラットの空間記憶をモリス水迷路試験で評価し、PQQを損傷の3日前に腹腔内投与すると空間記憶が改善することを実証した。
ヒト臨床試験において、PQQは高齢者の認知機能を促進し、局所血流を改善することが報告された[74]。無作為化プラセボ対照二重盲検臨床試験において、高齢者にPQQを経口投与(20mg PQQ/日)したところ、認知指標が改善された。このPQQの投与量は、PQQがモリス水迷路で測定したラットの空間記憶を改善することを示す以前の動物実験に基づくものであった[164]。
9. 結論
表1に概説したように、バイオファクターとしてのPQQの多くの側面は新規のものである。PQQは、栄養不足と潜在的な栄養要求が定義できる数少ないバイオファクターの1つである。PQQは、NADHからNAD+への酸化において、乳酸酸および潜在的に他の脱水素酵素の付属因子として作用する。老化、免疫、活性酸素の防御、神経系の完全性に重要な関係は、最適なNAD+レベルの維持に関与している。PQQの暴露の効果は、in vivoとin vitroの両方で、細胞のNAD+増強の効果を模倣している [165]。さらに、PQQは虚血、炎症、脂質毒性などの臨床的に関連する機能障害の減衰と関連している。重要な観察は、このような効果に必要なPQQのレベルは通常nMからμMの範囲であり、他の一般的なバイオファクターに必要なmM濃度とは対照的であることである。従って、PQQは治療用栄養補助食品としての強い可能性を持っています。また、PQQが必須ビタミン様因子として機能することを示唆する強力なケースも生まれつつある。
表1. ピロロキノリンキノンの 新規属性。
Funding
This work was funded by NIH/NIDDK, grant number R01DK121951 (to KRJ) and a grant from the UCD Emeriti Association (to RBR).
Institutional Review Board Statement
Not applicable.
Informed Consent Statement
Not applicable.
Data Availability Statement
Not applicable.
Conflicts of Interest
The authors declare no conflict of interest.
References
Hauge, J.G. Glucose dehydrogenase of Bacterium anitratum: An enzyme with a novel prosthetic group. J. Biol. Chem. 1964, 239, 3630–3639. [Google Scholar] [CrossRef]
Frank, J.; Dijkstra, M.; Duine, J.A.; Balny, C.; Jzn, J.F. Kinetic and spectral studies on the redox forms of methanol dehydrogenase from Hyphomicrobium X. JBIC J. Biol. Inorg. Chem. 1988, 174, 331–338. [Google Scholar] [CrossRef]
Duine, J.A.; Jzn, J.F.; Verwiel, P.E.J. Structure and activity of the prosthetic group of methanol dehydrogenase. JBIC J. Biol. Inorg. Chem. 1980, 108, 187–192. [Google Scholar] [CrossRef]
Duine, J.A. Quinoproteins: Enzymes containing the quinonoid cofactor pyrroloquinoline quinone, topaquinone or tryptophan-tryptophan quinone. JBIC J. Biol. Inorg. Chem. 1991, 200, 271–284. [Google Scholar] [CrossRef]
Anthony, C.; Ghosh, M. The structure and function of the PQQ-containing quinoprotein dehydrogenases. Prog. Biophys. Mol. Biol. 1998, 69, 1–21. [Google Scholar] [CrossRef]
Salisbury, S.A.; Forrest, H.S.; Cruse, W.B.T.; Kennard, O. A novel coenzyme from bacterial primary alcohol dehydrogenases. Nat. Cell Biol. 1979, 280, 843–844. [Google Scholar] [CrossRef] [PubMed]
Klinman, J.P.; Mu, D. Quinoenzymes in biology. Annu. Rev. Biochem. 1994, 63, 299–344. [Google Scholar] [CrossRef]
Anthony, C. Pyrroloquinoline quinone (PQQ) and quinoprotein enzymes. Antioxid. Redox Signal. 2001, 3, 757–774. [Google Scholar] [CrossRef]
Jonscher, K.R.; Rucker, R.B. Pyrroloquinoline quinone: Its profile. Effects on the liver and implications for health and disease prevention. In Dietary Interventions in Liver Disease; Watson, R.M., Preedy, V., Eds.; Academic Press: Cambridge, MA, USA, 2019; pp. 157–168. [Google Scholar]
Zhao, L.; Gong, N.; Liu, M.; Pan, X.; Sang, S.; Sun, X.; Yu, Z.; Fang, Q.; Zhao, N.; Fei, G.; et al. Beneficial synergistic effects of microdose lithium with pyrroloquinoline quinone in an Alzheimer’s disease mouse model. Neurobiol. Aging 2014, 35, 2736–2745. [Google Scholar] [CrossRef][Green Version]
Nogueiras, R.; Habegger, K.M.; Chaudhary, N.; Finan, B.; Banks, A.S.; Dietrich, M.O.; Horvath, T.L.; Sinclair, D.A.; Pfluger, P.T.; Tschöop, M.H. Sirtuin 1 and sirtuin 3: Physiological modulators of metabolism. Physiol. Rev. 2012, 92, 1479–1514. [Google Scholar] [CrossRef] [PubMed][Green Version]
Stites, T.E.; Mitchell, A.E.; Rucker, R.B. Physiological importance of quinoenzymes and the O-quinone family of cofactors. J. Nutr. 2000, 130, 719–727. [Google Scholar] [CrossRef]
McIntire, W.S. Newly discovered redox cofactors: Possible nutritional, medical, and pharmacological relevance to higher animals. Annu. Rev. Nutr. 1998, 18, 145–177. [Google Scholar] [CrossRef]
Jayagobi, M.; Raghunathan, R.; Sainath, S.; Raghunathan, M. Synthesis and antibacterial property of pyrrolopyrano quinolinones and pyrroloquinolines. Eur. J. Med. Chem. 2011, 46, 2075–2082. [Google Scholar] [CrossRef]
Várnai, A.; Umezawa, K.; Yoshida, M.; Eijsink, V.G.H. The Pyrroloquinoline-quinone-dependent pyranose dehydrogenase from Coprinopsis cinerea drives lytic polysaccharide monooxygenase action. Appl. Environ. Microbiol. 2018, 84, 00156–18. [Google Scholar] [CrossRef][Green Version]
Ouchi, A.; Ikemoto, K.; Nakano, M.; Nagaoka, S.I.; Mukai, K. Kinetic study of aroxyl radical scavenging and alpha-tocopheroxyl regeneration rates of pyrroloquinoline quinol (PQQH2, a reduced form of pyrroloquinoline quinone) in dimethyl sulfoxide solution: Finding of synergistic effect on the reaction rate due to the coexistence of alpha-tocopherol and PQQH2. J. Agric. Food Chem. 2013, 61, 11048–11060. [Google Scholar] [PubMed]
Chan, S.I.; Chuankhayan, P.; Nareddy, P.K.R.; Tsai, I.-K.; Tsai, Y.-F.; Chen, K.H.-C.; Yu, S.S.-F.; Chen, C.-J. Mechanism of pyrroloquinoline quinone-dependent hydride transfer chemistry from spectroscopic and high-resolution X-ray structural studies of the methanol dehydrogenase from Methylococcus capsulatus (Bath). J. Am. Chem. Soc. 2021, 143, 3359–3372. [Google Scholar] [CrossRef]
Akagawa, M.; Minematsu, K.; Shibata, T.; Kondo, T.; Ishii, T.; Uchida, K. Identification of lactate dehydrogenase as a mammalian pyrroloquinoline quinone (PQQ)-binding protein. Sci. Rep. 2016, 6, 26723. [Google Scholar] [CrossRef][Green Version]
Akagawa, M.; Nakano, M.; Ikemoto, K. Recent progress in studies on the health benefits of pyrroloquinoline quinone. Biosci. Biotechnol. Biochem. 2016, 80, 13–22. [Google Scholar] [CrossRef] [PubMed][Green Version]
Tanno, M.; Sakamoto, J.; Miura, T.; Shimamoto, K.; Horio, Y. Nucleocytoplasmic Shuttling of the NAD+-dependent Histone Deacetylase SIRT1. J. Biol. Chem. 2007, 282, 6823–6832. [Google Scholar] [CrossRef][Green Version]
Onyango, P.; Celic, I.; McCaffery, J.M.; Boeke, J.D.; Feinberg, A.P. SIRT3, a human SIR2 homologue, is an NAO-dependent deacetylase localized to mitochondria. Proc. Natl. Acad. Sci. USA 2002, 99, 13653–13658. [Google Scholar] [CrossRef] [PubMed][Green Version]
Liu, P.; Kerins, M.J.; Tian, W.; Neupane, D.; Zhang, D.D.; Ooi, A. Differential and overlapping targets of the transcriptional regulators NRF1, NRF2, and NRF3 in human cells. J. Biol. Chem. 2019, 294, 18131–18149. [Google Scholar] [CrossRef]
Tchaparian, E.; Marshal, L.; Cutler, G.; Bauerly, K.; Chowanadisai, W.; Satre, M.; Harris, C.; Rucker, R.B. Identification of transcriptional networks responding to pyrroloquinoline quinone dietary supplementation and their influence on thioredoxin expression, and the JAK/STAT and MAPK pathways. Biochem. J. 2010, 429, 515–526. [Google Scholar] [CrossRef] [PubMed][Green Version]
Arthur, J.S.C.; Ley, S.C. Mitogen-activated protein kinases in innate immunity. Nat. Rev. Immunol. 2013, 13, 679–692. [Google Scholar] [CrossRef]
Dong, C.; Davis, R.J.; Flavell, R.A. MAP kinases in the immune response. Annu. Rev. Immunol. 2002, 20, 55–72. [Google Scholar] [CrossRef] [PubMed]
Kim, E.K.; Choi, E.-J. Compromised MAPK signaling in human diseases: An update. Arch. Toxicol. 2015, 89, 867–882. [Google Scholar] [CrossRef]
Lyons, C.L.; Roche, H.M. Nutritional modulation of AMPK-impact upon metabolic-inflammation. Int. J. Mol. Sci. 2018, 19, 3092. [Google Scholar] [CrossRef] [PubMed][Green Version]
Peti, W.; Page, R. Molecular basis of MAP kinase regulation. Protein Sci. 2013, 22, 1698–1710. [Google Scholar] [CrossRef] [PubMed]
Salminen, A.; Kauppinen, A.; Kaarniranta, K. AMPK activation inhibits the functions of myeloid-derived suppressor cells (MDSC): Impact on cancer and aging. J. Mol. Med. 2019, 97, 1049–1064. [Google Scholar] [CrossRef][Green Version]
Sun, Y.; Liu, W.Z.; Liu, T.; Feng, X.; Yang, N.; Zhou, H.F. Signaling pathway of MAP Kl ERK in cell proliferation, differentiation, migration, senescence and apoptosis. J. Recept. Signal Transduct. Res. 2015, 35, 600–604. [Google Scholar] [CrossRef]
Villarino, A.V.; Kanno, Y.; O’Shea, J.J. Mechanisms and consequences of Jak–STAT signaling in the immune system. Nat. Immunol. 2017, 18, 374–384. [Google Scholar] [CrossRef]
Xin, P.; Xu, X.; Deng, C.; Liu, S.; Wang, Y.; Zhou, X.; Ma, H.; Wei, D.; Sun, S. The role of JAK/STAT signaling pathway and its inhibitors in diseases. Int. Immunopharmacol. 2020, 80, 106210. [Google Scholar] [CrossRef]
Shen, Y.-Q.; Bonnot, F.; Imsand, E.M.; RoseFigura, J.M.; Sjölander, K.; Klinman, J.P. Distribution and properties of the genes encoding the biosynthesis of the bacterial cofactor, pyrroloquinoline quinone. Biochemistry 2012, 51, 2265–2275. [Google Scholar] [CrossRef][Green Version]
Nguyen, T.M.; Naoki, K.; Kataoka, N.; Matsutani, M.; Ano, Y.; Adachi, O.; Matsushita, K.; Yakushi, T. Characterization of a cryptic, pyrroloquinoline quinone-dependent dehydrogenase of Gluconobacter sp. strain CHM43. Biosci. Biotechnol. Biochem. 2021, 85, 998–1004. [Google Scholar] [CrossRef]
Yakushi, T.; Terada, Y.; Ozaki, S.; Kataoka, N.; Akakabe, Y.; Adachi, O.; Matsutani, M.; Matsushita, K. Aldopentoses as new substrates for the membrane-bound, pyrroloquinoline quinone-dependent glycerol (polyol) dehydrogenase of Gluconobacter sp. Appl. Microbiol. Biotechnol. 2018, 102, 3159–3171. [Google Scholar] [CrossRef]
Zhu, W.; Klinman, J.P. Biogenesis of the peptide-derived redox cofactor pyrroloquinoline quinone. Curr. Opin. Chem. Biol. 2020, 59, 93–103. [Google Scholar] [CrossRef] [PubMed]
Pereira, J.; Lupas, A.N. The VCBS superfamily forms a third supercluster of beta-propellers that includes tachylectin and integrins. Bioinformatics 2021, 36, 5618–5622. [Google Scholar] [CrossRef] [PubMed]
Matsumura, H.; Umezawa, K.; Takeda, K.; Sugimoto, N.; Ishida, T.; Samejima, M.; Ohno, H.; Yoshida, M.; Igarashi, K.; Nakamura, N. Discovery of a eukaryotic pyrroloquinoline quinone-dependent oxidoreductase belonging to a new auxiliary activity family in the database of carbohydrate-active enzymes. PLoS ONE 2014, 9, e104851. [Google Scholar] [CrossRef] [PubMed][Green Version]
Takeda, K.; Ishida, T.; Yoshida, M.; Samejima, M.; Ohno, H.; Igarashi, K.; Nakamura, N. Crystal structure of the catalytic and cytochrome b domains in a eukaryotic pyrroloquinoline quinone-dependent dehydrogenase. Appl. Environ. Microbiol. 2019, 85, e01692–19. [Google Scholar] [CrossRef][Green Version]
Takeda, K.; Matsumura, H.; Ishida, T.; Samejima, M.; Ohno, H.; Yoshida, M.; Igarashi, K.; Nakamura, N. Characterization of a novel pqq-dependent quinohemoprotein pyranose dehydrogenase from Coprinopsis cinerea Classified into auxiliary activities family 12 in carbohydrate-active enzymes. PLoS ONE 2015, 10, e0115722. [Google Scholar] [CrossRef]
Takeda, K.; Umezawa, K.; Várnai, A.; Eijsink, V.G.; Igarashi, K.; Yoshida, M.; Nakamura, N. Fungal PQQ-dependent dehydrogenases and their potential in biocatalysis. Curr. Opin. Chem. Biol. 2019, 49, 113–121. [Google Scholar] [CrossRef] [PubMed]
Ohsugi, M.; Noda, H.; Muro, K.; Ishiba, A.; Kondo, Y.; Nakao, S. Effects of the yeast extract components pyrroloquinoline quinone and aspartic acid on vitamin B12 production in Klebsiella pneumoniae IFO 13541. J. Nutr. Sci. Vitaminol. 1989, 35, 661–665. [Google Scholar] [CrossRef]
Bharwad, K.; Rajkumar, S. Modulation of PQQ-dependent glucose dehydrogenase (mGDH and sGDH) activity by succinate in phosphate solubilizing plant growth promoting Acinetobacter sp. SK2. 3 Biotech 2020, 10, 5. [Google Scholar] [CrossRef]
Choi, O.; Kim, J.; Kim, J.G.; Jeong, Y.; Moon, J.S.; Park, C.S.; Hwang, I. Pyrroloquinoline quinone is a plant growth promotion factor produced by Pseudomonas fluorescens B16. Plant Physiol. 2008, 146, 657–668. [Google Scholar] [CrossRef] [PubMed][Green Version]
Choudhary, P.; Bhowmik, A.; Chakdar, H.; Khan, M.A.; Selvaraj, C.; Singh, S.K.; Murugan, K.; Kumar, S.; Saxena, A.K. Understanding the biological role of PqqB in Pseudomonas stutzeri using molecular dynamics simulation approach. J. Biomol. Struct. Dyn. 2020, 8, 1–13. [Google Scholar] [CrossRef] [PubMed]
Crespo, J.M.; Boiardi, J.L.; Luna, M.F. Mineral phosphate solubilization activity of Gluconacetobacter diazotrophicus under P-limitation and plant root environment. Agric. Sci. 2011, 2, 16–22. [Google Scholar] [CrossRef][Green Version]
Eotieno, N.; Lally, R.D.; Ekiwanuka, S.; Elloyd, A.; Eryan, D.; Germaine, K.J.; Dowling, D.N. Plant growth promotion induced by phosphate solubilizing endophytic Pseudomonas isolates. Front. Microbiol. 2015, 6, 745. [Google Scholar] [CrossRef][Green Version]
You, M.; Fang, S.; MacDonald, J.; Xu, J.; Yuan, Z.-C. Isolation and characterization of Burkholderia cenocepacia CR318, a phosphate solubilizing bacterium promoting corn growth. Microbiol. Res. 2019, 233, 126395. [Google Scholar] [CrossRef] [PubMed]
Naveed, M.; Sohail, Y.; Khalid, N.; Ahmed, I.; Mumtaz, A.S. Evaluation of glucose dehydrogenase and pyrroloquinoline quinine (pqq) mutagenesis that renders functional inadequacies in host plants. J. Microbiol. Biotechnol. 2015, 25, 1349–1360. [Google Scholar] [CrossRef]
Shrivastava, M.; Rajpurohit, Y.S.; Misra, H.S.; D’Souza, S.F. Survival of phosphate-solubilizing bacteria against DNA damaging agents. Can. J. Microbiol. 2010, 56, 822–830. [Google Scholar] [CrossRef][Green Version]
Li, L.; Jiao, Z.; Hale, L.; Wu, W.; Guo, Y. Disruption of gene pqqA or pqqb reduces plant growth promotion activity and biocontrol of crown gall disease by Rahnella aquatilis HX2. PLoS ONE 2014, 9, e115010. [Google Scholar] [CrossRef] [PubMed]
Mukherjee, K.; Twyman, R.M.; Vilcinskas, A. Insects as models to study the epigenetic basis of disease. Prog. Biophys. Mol. Biol. 2015, 118, 69–78. [Google Scholar] [CrossRef] [PubMed]
Ng, C.H.; Basil, A.H.; Hang, L.; Tan, R.; Goh, K.L.; O’Neill, S.; Zhang, X.; Yu, F.; Lim, K.L. Genetic or pharmacological activation of the Drosophila PGC-1alpha ortholog spargel rescues the disease phenotypes of genetic models of Parkinson’s disease. Neurobiol. Aging 2017, 55, 33–37. [Google Scholar] [CrossRef] [PubMed]
Puschmann, A. Monogenic Parkinson’s disease and parkinsonism: Clinical phenotypes and frequencies of known mutations. Parkinsonism Relat. Disord. 2013, 19, 407–415. [Google Scholar] [CrossRef][Green Version]
Shin, S.C.; Kim, S.-H.; You, H.; Kim, B.; Kim, A.C.; Lee, K.-A.; Yoon, J.-H.; Ryu, J.-H.; Lee, W.-J. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science 2011, 334, 670–674. [Google Scholar] [CrossRef][Green Version]
Wu, J.; Huang, J.; Khanabdali, R.; Kalionis, B.; Xia, S.; Cai, W. Pyrroloquinoline quinone enhances the resistance to oxidative stress and extends lifespan upon DAF-16 and SKN-1 activities in C. elegans. Exp. Gerontol. 2016, 80, 43–50. [Google Scholar] [CrossRef]
Sasakura, H.; Moribe, H.; Nakano, M.; Ikemoto, K.; Takeuchi, K.; Mori, I. Lifespan extension by peroxidase/dual oxidase-mediated ROS signaling through pyrroloquinoline quinone in C. elegans. J. Cell Sci. 2017, 130, 2631–2643. [Google Scholar] [CrossRef] [PubMed][Green Version]
Smidt, C.R.; Unkefer, C.J.; Houck, D.R.; Rucker, R.B. Intestinal absorption and tissue distribution of [14C]pyrroloquinoline quinone in mice. Exp. Biol. Med. 1991, 197, 27–31. [Google Scholar] [CrossRef]
Smidt, C.R.; Bean-Knudsen, D.; Kirsch, D.G.; Rucker, R.B. Does the intestinal microflora synthesize pyrroloquinoline quinone? BioFactors 1991, 3, 53–59. [Google Scholar]
Steinberg, F.; Stites, T.E.; Anderson, P.; Storms, D.; Chan, I.; Eghbali, S.; Rucker, R. pyrroloquinoline quinone improves growth and reproductive performance in mice fed chemically defined diets. Exp. Biol. Med. 2003, 228, 160–166. [Google Scholar] [CrossRef] [PubMed]
Steinberg, F.M.; Gershwin, M.E.; Rucker, R.B. Dietary pyrroloquinoline quinone: Growth and immune response in BALB/c mice. J. Nutr. 1994, 124, 744–753. [Google Scholar] [CrossRef]
Rucker, R.; Killgore, J.; Duich, L.; Romero-Chapman, N.; Smidt, C.; Tinker, D. Nutritional essentiality of pyrroloquinoline quinone. In PQQ and Quinoproteins: Proceedings of the First International Symposium on PQQ and Quinoprotein, Delft, The Netherlands; Jongejan, J.A., Duine, J.A., Eds.; Kluwer Academic Publishers: Dordrecht, The Netherlands, 1989; pp. 159–161. [Google Scholar]
Yin, X.; Ming, D.; Bai, L.; Wu, F.; Liu, H.; Chen, Y.; Sun, L.; Wan, Y.; Thacker, P.A.; Wu, G.; et al. Effects of pyrroloquinoline quinone supplementation on growth performance and small intestine characteristics in weaned pigs. J. Anim. Sci. 2019, 97, 246–256. [Google Scholar] [CrossRef]
Wang, C.; Zhang, B.; Zhang, H.; Yang, W.; Meng, Q.; Shi, B.; Shan, A. Effect of dietary pyrroloquinoline quinone disodium in sows on intestinal health of the offspring. Food Funct. 2020, 11, 7804–7816. [Google Scholar] [CrossRef]
Zhang, H.; Li, J.; Cao, C.; Zhang, B.; Yang, W.; Shi, B.; Shan, A. Pyrroloquinoline quinone inhibits the production of inflammatory cytokines via the SIRTl/NF-κΒ signal pathway in weaned piglet jejunum. Food Funct. 2020, 11, 2137–2153. [Google Scholar] [CrossRef] [PubMed]
Samuel, K.; Zhang, H.; Wang, J.; Wu, S.; Yue, H.; Sun, L.; Qi, G. Effects of dietary pyrroloquinoline quinone disodium on growth performance, carcass yield and antioxidant status of broiler chicks. Animal 2015, 9, 409–416. [Google Scholar] [CrossRef] [PubMed]
Zheng, Y.; Zhang, J.; Zhou, H.; Guo, Y.; Ma, Q.; Ji, C.; Zhao, L. Effects of dietary pyrroloquinoline quinone disodium supplementation on inflammatory responses, oxidative stress, and intestinal morphology in broiler chickens challenged with lipopolysaccharide. Poult. Sci. 2020, 99, 5389–5398. [Google Scholar] [CrossRef]
Wideman, R.; Bowen, O.; Erf, G. Broiler pulmonary hypertensive responses during lipopolysaccharide-induced tolerance and cyclooxygenase inhibition. Poult. Sci. 2009, 88, 72–85. [Google Scholar] [CrossRef] [PubMed]
Li, R.; Li, J.; Zhang, S.; Mi, Y.; Zhang, C. Attenuating effect of melatonin on lipopolysaccharide-induced chicken small intestine inflammation. Poult. Sci. 2018, 97, 2295–2302. [Google Scholar] [CrossRef]
Harris, C.B.; Chowanadisai, W.; Mishchuk, D.O.; Satre, M.A.; Slupsky, C.M.; Rucker, R.B. Dietary pyrroloquinoline quinone (PQQ) alters indicators of inflammation and mitochondrial-related metabolism in human subjects. J. Nutr. Biochem. 2013, 24, 2076–2084. [Google Scholar] [CrossRef][Green Version]
Hwang, P.S.; Machek, S.B.; Cardaci, T.D.; Wilburn, D.; Kim, C.S.; Suezaki, E.S.; Willoughby, D.S. Effects of pyrroloquinoline quinone (PQQ) supplementation on aerobic exercise performance and indices of mitochondrial biogenesis in untrained men. J. Am. Coll. Nutr. 2019, 39, 547–556. [Google Scholar] [CrossRef] [PubMed]
Wen, H.; He, Y.; Zhang, K.; Yang, X.; Hao, D.; Jiang, Y.; He, B. Mini-review: Functions and action mechanisms of PQQ in osteoporosis and neuro injury. Curr. Stem Cell Res. Ther. 2020, 15, 32–36. [Google Scholar] [CrossRef]
Shiojima, Y.; Takahashi, M.; Takahashi, R.; Moriyama, H.; Bagchi, D.; Bagchi, M.; Akanuma, M. Effect of dietary pyrroloquinoline quinone disodium salt on cognitive function in healthy volunteers: A randomized, double-blind, placebo-controlled, parallel-group study. J. Am. Coll. Nutr. 2021, 20, 1–14. [Google Scholar] [CrossRef]
Nakano, M.; Murayama, Y.; Hu, L.; Ikemoto, K.; Uetake, T.; Sakatani, K. Effects of antioxidant supplements (BioPQQ™) on cerebral blood flow and oxygen metabolism in the prefrontal cortex. Adv. Exp. Med. Biol. 2016, 923, 215–222. [Google Scholar] [CrossRef] [PubMed]
Mitchell, A.; Jones, A.; Mercer, R.; Rucker, R. Characterization of pyrroloquinoline quinone amino acid derivatives by electrospray ionization mass spectrometry and detection in human milk. Anal. Biochem. 1999, 269, 317–325. [Google Scholar] [CrossRef] [PubMed]
Kato, C.; Kawai, E.; Shimizu, N.; Mikekado, T.; Kimura, F.; Miyazawa, T.; Nakagawa, K. Determination of pyrroloquinoline quinone by enzymatic and LC-MS/MS methods to clarify its levels in foods. PLoS ONE 2018, 13, e0209700. [Google Scholar] [CrossRef][Green Version]
Stites, T.E.; Sih, T.R.; Rucker, R.B. Synthesis of [14C]pyrroloquinoline quinone (PQQ) in E. coli using genes for PQQ synthesis from K. pneumoniae. Biochim. Biophys. Acta (BBA)-Gen. Subj. 2000, 1524, 247–252. [Google Scholar] [CrossRef]
Misset-Smits, M.; Oltshoorn, A.; Dewanti, A.; Duine, J. [11] Production, assay, and occurrence of pyrroloquinoline quinone. Methods Enzymol. 1997, 280, 89–98. [Google Scholar] [CrossRef]
Stites, T.; Storms, D.; Bauerly, K.; Mah, J.; Harris, C.; Fascetti, A.; Rogers, Q.; Tchaparian, E.; Satre, M.; Rucker, R.B. Pyrroloquinoline quinone modulates mitochondrial quantity and function in mice. J. Nutr. 2006, 136, 390–396. [Google Scholar] [CrossRef] [PubMed]
Wallace, T.C.; Giusti, M.M. Anthocyanins. Adv. Nutr. 2015, 6, 620–622. [Google Scholar] [CrossRef][Green Version]
Flückiger, R.; Apaz, M.; Gallop, P.M. [11] Redox-cycling detection of dialyzable pyrroloquinoline quinone and quinoproteins. Methods Enzymol. 1995, 258, 140–149. [Google Scholar] [CrossRef]
Fluckiger, R.; Paz, M.; Mah, J.; Bishop, A.; Gallop, P. Characterization of the glycine-dependent redox-cycling activity in animal fluids and tissues using specific inhibitors and activators: Evidence for presence of PQQ. Biochem. Biophys. Res. Commun. 1993, 196, 61–68. [Google Scholar] [CrossRef]
Rucker, R.; Chowanadisai, W.; Nakano, M. Potential physiological importance of pyrroloquinoline quinone. Altern. Med. Rev. J. Clin. Ther. 2009, 14, 268–277. [Google Scholar]
Naito, Y.; Kumazawa, T.; Kino, I.; Suzuki, O. Effects of pyrroloquinoline quinone (PQQ) and PQQ-oxazole on DNA synthesis of cultured human fibroblasts. Life Sci. 1993, 52, 1909–1915. [Google Scholar] [CrossRef]
Yamada, Y.; Nishii, K.; Kuwata, K.; Nakamichi, M.; Nakanishi, K.; Sugimoto, A.; Ikemoto, K. Effects of pyrroloquinoline quinone and imidazole pyrroloquinoline on biological activities and neural functions. Heliyon 2020, 6, e03240. [Google Scholar] [CrossRef] [PubMed]
Tsuchida, T.; Yasuyama, T.; Higuchi, K.; Watanabe, A.; Urakami, T.; Akaike, T.; Sato, K.; Maeda, H. The protective effect of pyrroloquinoline quinone and its derivatives against carbon tetrachloride-induced liver injury of rats. J. Gastroenterol. Hepatol. 1993, 8, 342–347. [Google Scholar] [CrossRef]
GRAS Notice for Pyrroloquinoline Quinone (PQQ) Disodium Salt; (GRN) No. 694; Office of Food Additive Safety (FHS-200) Center for Food Safety and Applied Nutrition Food and Drug Administration: Washinton, DC, USA, 2017.
Liang, C.; Zhang, X.; Wang, W.; Song, Y.; Jia, X. A subchronic oral toxicity study on pyrroloquinoline quinone (PQQ) disodium salt in rats. Food Chem. Toxicol. 2015, 75, 146–150. [Google Scholar] [CrossRef]
Nakano, M.; Suzuki, H.; Imamura, T.; Lau, A.; Lynch, B. Genotoxicity of pyrroloquinoline quinone (PQQ) disodium salt (BioPQQ™). Regul. Toxicol. Pharmacol. 2013, 67, 189–197. [Google Scholar] [CrossRef] [PubMed]
Nakano, M.; Takahashi, H.; Koura, S.; Chung, C.; Tafazoli, S.; Roberts, A. Acute and subchronic toxicity studies of pyrroloquinoline quinone (PQQ) disodium salt (BioPQQ™) in rats. Regul. Toxicol. Pharmacol. 2014, 70, 107–121. [Google Scholar] [CrossRef]
Hill, N.R.; Fatoba, S.T.; Oke, J.L.; Hirst, J.; O’Callaghan, C.A.; Lasserson, D.; Hobbs, R. Global prevalence of chronic kidney—A systematic review and meta-analysis. PLoS ONE 2016, 11, e0158765. [Google Scholar] [CrossRef]
Pendse, S.; Singh, A.K. Complications of chronic kidney disease: Anemia, mineral metabolism, and cardiovascular disease. Med. Clin. N. Am. 2005, 89, 549–561. [Google Scholar] [CrossRef] [PubMed]
Choi, B.; Crouzet, C.; Lau, W.L.; Cribbs, D.H.; Fisher, M.J. Cerebral blood flow in chronic kidney disease. J. Stroke Cerebrovasc. Dis. 2021, 30, 105702. [Google Scholar] [CrossRef]
Koren, M.J.; Blumen, H.M.; Ayers, E.I.; Verghese, J.; Abramowitz, M.K. Cognitive dysfunction and gait abnormalities in CKD. Clin. J. Am. Soc. Nephrol. 2021, 16, 694–704. [Google Scholar] [CrossRef]
Lee, Y.J.; Yoon, E.; Park, S.; Kim, Y.W.; Kim, S.E.; Ko, J.; Park, J.H.; Park, K.M.; Kim, I.H.; Park, B.S. Alteration of brain connectivity in neurologically asymptomatic patients with chronic kidney disease. Medicine 2021, 100, e25633. [Google Scholar] [CrossRef]
Miller, L.M.; Rifkin, D.; Lee, A.K.; Tamura, M.K.; Pajewski, N.M.; Weiner, D.E.; Al-Rousan, T.; Shlipak, M.; Ix, J.H. Association of urine biomarkers of kidney tubule injury and dysfunction with frailty index and cognitive function in persons with CKD in SPRINT. Am. J. Kidney Dis. 2021, 78, 530–540. [Google Scholar] [CrossRef]
Irazabal, M.V.; Torres, V.E. Reactive oxygen species and redox signaling in chronic kidney disease. Cells 2020, 9, 1342. [Google Scholar] [CrossRef]
Che, R.; Yuan, Y.; Huang, S.; Zhang, A. Mitochondrial dysfunction in the pathophysiology of renal diseases. Am. J. Physiol. Renal. Physiol. 2014, 306, F367–F378. [Google Scholar] [CrossRef]
Daenen, K.; Andries, A.; Mekahli, D.; Van Schepdael, A.; Jouret, F.; Bammens, B. Oxidative stress in chronic kidney disease. Pediatr. Nephrol. 2019, 34, 975–991. [Google Scholar] [CrossRef][Green Version]
Nezu, M.; Suzuki, N.; Yamamoto, M. Targeting the KEAP1-NRF2 system to prevent kidney disease progression. Am. J. Nephrol. 2017, 45, 473–483. [Google Scholar] [CrossRef] [PubMed]
Lu, M.; Wang, P.; Qiao, Y.; Jiang, C.; Ge, Y.; Flickinger, B.; Malhotra, D.K.; Dworkin, L.D.; Liu, Z.; Gong, R. GSK3β-mediated Keap1-independent regulation of Nrf2 antioxidant response: A molecular rheostat of acute kidney injury to chronic kidney disease transition. Redox Biol. 2019, 26, 101275. [Google Scholar] [CrossRef]
Surh, Y.-J.; Kundu, J.K.; Na, H.-K. Nrf2 as a master redox switch in turning on the cellular signaling involved in the induction of cytoprotective genes by some chemopreventive phytochemicals. Planta Medica 2008, 74, 1526–1539. [Google Scholar] [CrossRef] [PubMed][Green Version]
Yamawaki, K.; Kanda, H.; Shimazaki, R. Nrf2 activator for the treatment of kidney diseases. Toxicol. Appl. Pharmacol. 2018, 360, 30–37. [Google Scholar] [CrossRef] [PubMed]
Choi, B.-H.; Kang, K.-S.; Kwak, M.-K. Effect of redox modulating NRF2 activators on chronic kidney disease. Molecules 2014, 19, 12727–12759. [Google Scholar] [CrossRef][Green Version]
Lin, X.; Yang, F.; Huang, J.; Jiang, S.; Tang, Y.; Li, J. Ameliorate effect of pyrroloquinoline quinone against cyclophosphamide-induced nephrotoxicity by activating the Nrf2 pathway and inhibiting the NLRP3 pathway. Life Sci. 2020, 256, 117901. [Google Scholar] [CrossRef]
Wang, Z.; Han, N.; Zhao, K.; Li, Y.; Chi, Y.; Wang, B. Protective effects of pyrroloquinoline quinone against oxidative stress-induced cellular senescence and inflammation in human renal tubular epithelial cells via Keap1/Nrf2 signaling pathway. Int. Immunopharmacol. 2019, 72, 445–453. [Google Scholar] [CrossRef]
Friedman, J.E.; Dobrinskikh, E.; Alfonso-Garcia, A.; Fast, A.; Janssen, R.C.; Soderborg, T.K.; Anderson, A.L.; Reisz, J.A.; D’Alessandro, A.; Frank, D.N.; et al. Pyrroloquinoline quinone prevents developmental programming of microbial dysbiosis and macrophage polarization to attenuate liver fibrosis in offspring of obese mice. Hepatol. Commun. 2018, 2, 313–328. [Google Scholar] [CrossRef] [PubMed][Green Version]
Devasani, K.; Kaul, R.; Majumdar, A. Supplementation of pyrroloquinoline quinone with atorvastatin augments mitochondrial biogenesis and attenuates low grade inflammation in obese rats. Eur. J. Pharmacol. 2020, 881, 173273. [Google Scholar] [CrossRef]
Raghuvanshi, R.; Chaudhari, A.; Kumar, G.N. Amelioration of cadmium- and mercury-induced liver and kidney damage in rats by genetically engineered probiotic Escherichia coli Nissle 1917 producing pyrroloquinoline quinone with oral supplementation of citric acid. Nutrition 2016, 32, 1285–1294. [Google Scholar] [CrossRef] [PubMed]
Assimakopoulos, S.F.; Triantos, C.; Maroulis, I.; Gogos, C. The role of the gut barrier function in health and disease. Gastroenterol. Res. 2018, 11, 261–263. [Google Scholar] [CrossRef][Green Version]
Massier, L.; Blüher, M.; Kovacs, P.; Chakaroun, R.M. Impaired intestinal barrier and tissue bacteria: Pathomechanisms for metabolic diseases. Front. Endocrinol. 2021, 12, 616506. [Google Scholar] [CrossRef] [PubMed]
Pat, Y.; Ogulur, I. The epithelial barrier hypothesis: A 20-year journey. Allergy 2021. [Google Scholar] [CrossRef] [PubMed]
Aldars-García, L.; Chaparro, M.; Gisbert, J. Systematic review: The gut microbiome and its potential clinical application in inflammatory bowel disease. Microorganisms 2021, 9, 977. [Google Scholar] [CrossRef]
Axelrad, J.E.; Cadwell, K.H.; Colombel, J.-F.; Shah, S.C. The role of gastrointestinal pathogens in inflammatory bowel disease: A systematic review. Ther. Adv. Gastroenterol. 2021, 14, 17562848211004493. [Google Scholar] [CrossRef] [PubMed]
Tong, Y.; Gao, H.; Qi, Q.; Liu, X.; Li, J.; Gao, J.; Li, P.; Wang, Y.; Du, L.; Wang, C. High fat diet, gut microbiome and gastrointestinal cancer. Theranostics 2021, 11, 5889–5910. [Google Scholar] [CrossRef] [PubMed]
Boddy, S.L.; Giovannelli, I.; Sassani, M.; Cooper-Knock, J.; Snyder, M.P.; Segal, E.; Elinav, E.; Barker, L.A.; Shaw, P.J.; McDermott, C.J. The gut microbiome: A key player in the complexity of amyotrophic lateral sclerosis (ALS). BMC Med. 2021, 19, 13. [Google Scholar] [CrossRef] [PubMed]
Lorente-Picón, M.; Laguna, A. New avenues for Parkinson’s Disease therapeutics: Disease-modifying strategies based on the gut microbiota. Biomolecules 2021, 11, 433. [Google Scholar] [CrossRef]
Niesler, B.; Kuerten, S.; Demir, I.E.; Schäfer, K.-H. Disorders of the enteric nervous system—A holistic view. Nat. Rev. Gastroenterol. Hepatol. 2021, 18, 393–410. [Google Scholar] [CrossRef]
Ojeda, J.; Ávila, A.; Vidal, P. Gut Microbiota interaction with the central nervous system throughout life. J. Clin. Med. 2021, 10, 1299. [Google Scholar] [CrossRef]
Snethlage, C.M.F.; Nieuwdorp, M.; van Raalte, D.H.; Rampanelli, E.; Verchere, B.C.; Hanssen, N.M. Auto-immunity and the gut microbiome in type 1 diabetes: Lessons from rodent and human studies. Best Pract. Res. Clin. Endocrinol. Metab. 2021, 35, 101544. [Google Scholar] [CrossRef]
Takewaki, D.; Yamamura, T. Gut microbiome research in multiple sclerosis. Neurosci. Res. 2021, 168, 28–31. [Google Scholar] [CrossRef]
Akdis, C.A. Does the epithelial barrier hypothesis explain the increase in allergy, autoimmunity and other chronic conditions? Nat. Rev. Immunol. 2021, 1–13. [Google Scholar] [CrossRef]
Li, R.; Meng, X.; Chen, B.; Zhao, L.; Zhang, X. Gut Microbiota in Lupus: A Butterfly Effect? Curr. Rheumatol. Rep. 2021, 23, 27. [Google Scholar] [CrossRef]
Murdaca, G.; Greco, M.; Borro, M.; Gangemi, S. Hygiene hypothesis and autoimmune diseases: A narrative review of clinical evidences and mechanisms. Autoimmun. Rev. 2021, 20, 102845. [Google Scholar] [CrossRef] [PubMed]
Olejniczak-Staruch, I.; Ciążyńska, M.; Sobolewska-Sztychny, D.; Narbutt, J.; Skibińska, M.; Lesiak, A. Alterations of the skin and gut microbiome in psoriasis and psoriatic arthritis. Int. J. Mol. Sci. 2021, 22, 3998. [Google Scholar] [CrossRef] [PubMed]
Arora, A.; Behl, T.; Sehgal, A.; Singh, S.; Sharma, N.; Bhatia, S.; Sobarzo-Sanchez, E.; Bungau, S. Unravelling the involvement of gut microbiota in type 2 diabetes mellitus. Life Sci. 2021, 273, 119311. [Google Scholar] [CrossRef] [PubMed]
Duttaroy, A.K. Role of gut microbiota and their metabolites on atherosclerosis, hypertension and human blood platelet function: A review. Nutrients 2021, 13, 144. [Google Scholar] [CrossRef]
He, L. Alterations of gut microbiota by overnutrition impact gluconeogenic gene expression and insulin signaling. Int. J. Mol. Sci. 2021, 22, 2121. [Google Scholar] [CrossRef]
Liébana-García, R.; Olivares, M.; Bullich-Vilarrubias, C.; López-Almela, I.; Romaní-Pérez, M.; Sanz, Y. The gut microbiota as a versatile immunomodulator in obesity and associated metabolic disorders. Best Pract. Res. Clin. Endocrinol. Metab. 2021, 35, 101542. [Google Scholar] [CrossRef]
Massey, W.; Brown, J.M. The gut microbial endocrine organ in type 2 diabetes. Endocrinology 2021, 162, 235. [Google Scholar] [CrossRef]
Petraroli, M.; Castellone, E.; Patianna, V.; Esposito, S. Gut microbiota and obesity in adults and children: The state of the art. Front. Pediatr. 2021, 9, 657020. [Google Scholar] [CrossRef]
Régnier, M.; Van Hul, M.; Knauf, C.; Cani, P.D. Gut microbiome, endocrine control of gut barrier function and metabolic diseases. J. Endocrinol. 2021, 248, R67–R82. [Google Scholar] [CrossRef]
Rovella, V.; Rodia, G.; Di Daniele, F.; Cardillo, C.; Campia, U.; Noce, A.; Candi, E.; Della-Morte, D.; Tesauro, M. Association of gut hormones and microbiota with vascular dysfunction in obesity. Nutrients 2021, 13, 613. [Google Scholar] [CrossRef]
Salamone, D.; Rivellese, A.A.; Vetrani, C. The relationship between gut microbiota, short-chain fatty acids and type 2 diabetes mellitus: The possible role of dietary fibre. Acta Diabetol. 2021, 58, 1131–1138. [Google Scholar] [CrossRef] [PubMed]
Van Son, J.; Koekkoek, L.; La Fleur, S.; Serlie, M.; Nieuwdorp, M. The role of the gut microbiota in the gut–brain axis in obesity: Mechanisms and future implications. Int. J. Mol. Sci. 2021, 22, 2993. [Google Scholar] [CrossRef]
Zhang, B.; Yang, W.; Zhang, H.; He, S.; Meng, Q.; Chen, Z.; Shan, A. Effect of pyrroloquinoline quinone disodium in female rats during gestating and lactating on reproductive performance and the intestinal barrier functions in the progeny. Br. J. Nutr. 2019, 121, 818–830. [Google Scholar] [CrossRef]
Huang, C.; Ming, D.; Wang, W.; Wang, Z.; Hu, Y.; Ma, X.; Wang, F. Pyrroloquinoline quinone alleviates jejunal mucosal barrier function damage and regulates colonic microbiota in piglets challenged with enterotoxigenic Escherichia coli. Front. Microbiol. 2020, 11, 1754. [Google Scholar] [CrossRef]
Gasaly, N.; Hermoso, M.; Gotteland, M. Butyrate and the fine-tuning of colonic homeostasis: Implication for inflammatory bowel diseases. Int. J. Mol. Sci. 2021, 22, 3061. [Google Scholar] [CrossRef]
Huang, X.; Oshima, T.; Tomita, T.; Fukui, H.; Miwa, H. Butyrate alleviates cytokine-induced barrier dysfunction by modifying claudin-2 levels. Biology 2021, 10, 205. [Google Scholar] [CrossRef] [PubMed]
Singh, A.K.; Pandey, S.K.; Kumar, G.N. Pyrroloquinoline quinone-secreting probiotic Escherichia coli Nissle 1917 ameliorates ethanol-induced oxidative damage and hyperlipidemia in rats. Alcohol. Clin. Exp. Res. 2014, 38, 2127–2137. [Google Scholar] [CrossRef]
Yamada, M.; Elias, M.D.; Matsushita, K.; Migita, C.T.; Adachi, O. Escherichia coli PQQ-containing quinoprotein glucose dehydrogenase: Its structure comparison with other quinoproteins. Biochim. Biophys. Acta (BBA)-Proteins Proteom. 2003, 1647, 185–192. [Google Scholar] [CrossRef]
Canani, R.B.; Di Costanzo, M.; Leone, L.; Pedata, M.; Meli, R.; Calignano, A. Potential beneficial effects of butyrate in intestinal and extraintestinal diseases. World J. Gastroenterol. 2011, 17, 1519–28. [Google Scholar] [CrossRef]
Gao, Z.; Yin, J.; Zhang, J.; Ward, R.E.; Martin, R.J.; Lefevre, M.; Cefalu, W.T.; Ye, J. Butyrate improves insulin sensitivity and increases energy expenditure in mice. Diabetes 2009, 58, 1509–1517. [Google Scholar] [CrossRef][Green Version]
Sun, J.; Wu, Q.; Sun, H.; Qiao, Y. Inhibition of histone deacetylase by butyrate protects rat liver from chemic reperfusion injury. Int. J. Mol. Sci. 2014, 15, 21069–21079. [Google Scholar] [CrossRef] [PubMed]
Jonscher, K.R.; Stewart, M.S.; Alfonso-Garcia, A.; De Felice, B.C.; Wang, X.X.; Luo, Y.; Levi, M.; Heerwagen, M.J.R.; Janssen, R.C.; de la Houssaye, B.A.; et al. Early PQQ supplementation has persistent long-term protective effects on developmental programming of hepatic lipotoxicity and inflammation in obese mice. FASEB J. 2017, 31, 1434–1448. [Google Scholar] [CrossRef] [PubMed][Green Version]
Guirro, M.; Costa, A.; Gual-Grau, A.; Herrero, P.; Torrell, H.; Canela, N.; Arola, L. Effects from diet-induced gut microbiota dysbiosis and obesity can be ameliorated by fecal microbiota transplantation: A multiomics approach. PLoS ONE 2019, 14, e0218143. [Google Scholar] [CrossRef][Green Version]
Bauerly, K.; Harris, C.; Chowanadisai, W.; Graham, J.; Havel, P.J.; Tchaparian, E.; Satre, M.; Karliner, J.S.; Rucker, R.B. Altering pyrroloquinoline quinone nutritional status modulates mitochondrial, lipid, and energy metabolism in rats. PLoS ONE 2011, 6, e21779. [Google Scholar] [CrossRef]
Tao, R.; Karliner, J.S.; Simonis, U.; Zheng, J.; Zhang, J.; Honbo, N.; Alano, C.C. Pyrroloquinoline quinone preserves mitochondrial function and prevents oxidative injury in adult rat cardiac myocytes. Biochem. Biophys. Res. Commun. 2007, 363, 257–262. [Google Scholar] [CrossRef][Green Version]
Zhu, B.Q.; Simonis, U.; Cecchini, G.; Zhou, H.Z.; Li, L.; Teerlink, J.R.; Karliner, J.S. Comparison of pyrroloquinoline quinone and/or metoprolol on myocardial infarct size and mitochondrial damage in a rat model of ischemialreperfusion injury. J. Cardiovasc. Pharmacol. Ther. 2006, 11, 119–128. [Google Scholar] [CrossRef]
Zhu, B.Q.; Zhou, H.Z.; Teerlink, J.R.; Karliner, J.S. Pyrroloquinoline quinone (PQQ) decreases myocardial infarct size and improves cardiac function in rat models of ischemia and ischemial reperfusion. Cardiovasc. Drugs Ther. 2004, 18, 421–431. [Google Scholar] [CrossRef]
Liu, L.; Zhang, Y.; Liu, T.; Ke, C.; Huang, J.; Fu, Y.; Lin, Z.; Chen, F.; Wu, X.; Chen, Q. Pyrroloquinoline quinone protects against exercise-induced fatigue and oxidative damage via improving mitochondrial function in mice. FASEB J. 2021, 35, e21394. [Google Scholar] [CrossRef]
Chrétien, D.; Bénit, P.; Ha, H.H.; Keipert, S.; El-Khoury, R.; Chang, Y.T.; Jastroch, M.; Jacobs, H.T.; Rustin, P.; Rak, M. Mitochondria are physiologically maintained at close to 50 degrees C. PLoS Biol. 2018, 16, e2003992. [Google Scholar] [CrossRef] [PubMed][Green Version]
Wilkening, A.; Rüb, C.; Sylvester, M.; Voos, W. Analysis of heat-induced protein aggregation in human mitochondria. J. Biol. Chem. 2018, 293, 11537–11552. [Google Scholar] [CrossRef] [PubMed][Green Version]
Zhang, Q.; Zhou, J.; Shen, M.; Xu, H.; Yu, S.; Cheng, Q.; Ding, F. Pyrroloquinoline quinone inhibits rotenone-induced microglia inflammation by enhancing autophagy. Molecules 2020, 25, 4359. [Google Scholar] [CrossRef] [PubMed]
Zhang, Q.I.; Chen, S.; Yu, S.; Qin, J.; Zhang, J.; Cheng, Q.; Ke, K.; Ding, F. Neuroprotective effects of pyrroloquinoline quinone against rotenone injury in primary cultured midbrain neurons and in a rat model of Parkinson’s disease. Neuropharmacology 2016, 108, 238–251. [Google Scholar] [CrossRef] [PubMed]
Qin, J.; Wu, M.; Yu, S.; Gao, X.; Zhang, J.; Dong, X.; Ji, J.; Zhang, Y.; Zhou, L.; Zhang, Q.; et al. Pyrroloquinoline quinone-conferred neuroprotection in rotenone models of Parkinson’s disease. Toxicol. Lett. 2015, 238, 70–82. [Google Scholar] [CrossRef] [PubMed]
Lu, J.; Chen, S.; Shen, M.; He, Q.; Zhang, Y.; Shi, Y.; Ding, F.; Zhang, Q. Mitochondrial regulation by pyrroloquinoline quinone prevents rotenone-induced neurotoxicity in Parkinson’s disease models. Neurosci. Lett. 2018, 687, 104–110. [Google Scholar] [CrossRef] [PubMed]
Chowanadisai, W.; Bauerly, K.A.; Tchaparian, E.; Wong, A.; Cortopassi, G.A.; Rucker, R.B. Pyrroloquinoline quinone stimulates mitochondrial biogenesis through cAMP response element-binding protein phosphorylation and increased PGC-1α expression. J. Biol. Chem. 2010, 285, 142–152. [Google Scholar] [CrossRef] [PubMed][Green Version]
Cheng, Q.; Chen, J.; Guo, H.; Lu, J.-L.; Zhou, J.; Guo, X.-Y.; Shi, Y.; Zhang, Y.; Yu, S.; Zhang, Q.; et al. Pyrroloquinoline quinone promotes mitochondrial biogenesis in rotenone-induced Parkinson’s disease model via AMPK activation. Acta Pharmacol. Sin. 2021, 42, 665–678. [Google Scholar] [CrossRef]
Betarbet, R.; Sherer, T.B.; MacKenzie, G.; Garcia-Osuna, M.; Panov, A.V.; Greenamyre, J.T. Chronic systemic pesticide exposure reproduces features of Parkinson’s disease. Nat. Neurosci. 2000, 3, 1301–1306. [Google Scholar] [CrossRef]
Kim, J.; Harada, R.; Kobayashi, M.; Kobayashi, N.; Sode, K. The inhibitory effect of pyrroloquinoline quinone on the amyloid formation and cytotoxicity of truncated alpha-synuclein. Mol. Neurodegener. 2010, 5, 20. [Google Scholar] [CrossRef][Green Version]
Jensen, F.E.; Gardner, G.J.; Williams, A.P.; Gallop, P.M.; Aizenman, E.; Rosenberg, P.A. The putative essential nutrient pyrroloquinoline quinone is neuroprotective in a rodent model of hypoxiclischemic brain injury. Neuroscience 1994, 62, 399–406. [Google Scholar] [CrossRef]
Zhang, L.; Liu, J.; Cheng, C.; Yuan, Y.; Yu, B.; Shen, A.; Yan, M. The neuroprotective effect of pyrroloquinoline quinone on traumatic brain injury. J. Neurotrauma 2012, 29, 851–864. [Google Scholar] [CrossRef][Green Version]
Zhang, Y.; Feustel, P.; Kimelberg, H.K. Neuroprotection by pyrroloquinoline quinone (PQQ) in reversible middle cerebral artery occlusion in the adult rat. Brain Res. 2006, 1094, 200–206. [Google Scholar] [CrossRef] [PubMed]
Ralto, K.M.; Rhee, E.P.; Parikh, S.M. NAD+ homeostasis in renal health and disease. Nat. Rev. Nephrol. 2020, 16, 99–111. [Google Scholar] [CrossRef] [PubMed]
この記事が気に入ったらサポートをしてみませんか?
