
52.コロナウイルスワクチンにおけるパターン識別:DNA-Origamiの自己組織化の徴候
january 3, 2022
mikandersen
元記事のこちら。
コロナウイルスワクチンにおけるパターンの識別で最も難しい点の1つは、観察されたオブジェクト(マイクロ/ナノルーター、マイクロ/ナノレクテナ...)が形成された方法または手順である。
電子線リソグラフィー、集束イオンビームFIB(Focused Ion Beam)、さらには合成DNAテンプレートなど、ナノルーターのQCA回路を定義するさまざまな製造技術を指摘する文献が多数見受けられるようになったのです。
しかし、ワクチンサンプルには、まだ明確な自己組織化の証拠はなかった。しかし、このプロセスに関する根拠十分以上の疑いは、2021年12月27日にリカルド・デルガドがファイザー社製ワクチンのサンプルに含まれる数千個の粒子の動きを撮影したビデオによって確認された。これらの粒子は、より複雑な構造に合体し、単純な幾何学模様を定義しているように見えました(以下のビデオ1の抜粋を参照)。
動画1.ファイザー社製ワクチンサンプルで観察された自己組織化。原典:https://www.twitch.tv/videos/1245191848?t=00h34m56s(Delgado, R. 2021)。
科学文献では、この粒子の準指向的な振る舞いや動きは、法人内ナノ通信ネットワークにおけるマイクロ/ナノ電子物体やデバイスの構築という文脈では、DNAベースの自己組織化、エピタキシャル成長、折り紙などのプロセスに相当する可能性が高いとされていました。その結果、回路、基板、ルーター、センサーなどのマイクロ/ナノエレクトロニクス部品やデバイスを含む複雑な物体の自己組織化を高い確率で確認できる科学的なアーティキュレーションが位置づけられたのだ。この発見により、ブルートゥースのMACアドレス放送現象を担うコンポーネントが自己組織化する仕組みが説明された(Sarrangue, G; Devilleger, J.; Trillaud, P.; Fouchet, S.; Taillasson, L.; Catteau, G. 2021).また、企業内ナノ通信ネットワークのハードウェアを構成するナノデバイス、ナノセンサー、ナノノード、マイクロ/ナノインターフェイス、マイクロ/ナノルーター、マイクロ/ナノアンテナ、マイクロ/ナノレテナの組み立てについても説明することができるだろう。
図1は、科学文献で観察された自己組織化の兆候と、分析したファイザー社製ワクチンのサンプルとの対応を示している。形態学的な観点から、自己組織化が検証可能な現実であることを推論し、ほぼ想定できるような重要な偶然の一致がある。
ファイザー社製ワクチンにおけるDNA-Origamiの自己組織化の示唆

図1. ファイザー社製ワクチンにおけるDNA-オリガミの自己組織化の証拠
自己組織化のテーマは複雑であり、また発見された証拠の関連性も高いため、ここでは、a) 指向性自己組織化、b) ソフトエピタキシャル成長による自己組織化、c) 折り紙自己組織化の3つの主要項目で詳細に分析することにする。
指向性自己組織化
Kumar, P. 2010)の論文では、ワクチンサンプルで観察される「指向性自己組織化」を初めて明確に示しています(図2、動画1参照)。 観察されたナノ粒子は、より大きなクラスターに合体して、サンプル液滴の中を移動する、より複雑な構造体に見えるのです。
ワクチンサンプルには、明らかに自己組織化運動をする粒子が見られ、ハイブリダイゼーションDNA技術が標的の自己組織化に使われている疑いがある。

図 2. ワクチンサンプルには自己組織化運動が見られる粒子があり、標的自己組織化のためのDNAハイブリダイゼーション技術が使用されている疑いがある。(Kumar, P. 2010)
(Kumar, P. 2010)によると、自己組織化は小型化された電子・磁気・光学デバイスの開発の鍵であり、ワクチンサンプルに含まれるグラフェン由来の材料と合致する。実際、「ナノ粒子は、超常磁性、化学発光、触媒作用などそのサイズ依存性のユニークな特性により、このようなコンポーネントとして大きな注目を集めている」と述べられている。ナノ粒子の潜在能力を最大限に活用するためには、ナノ粒子を有用なパターンや構造に組み立てるための新しい方法を開発する必要がある。これらの自己組織化構造は、小型化された光学、電子、光電子、磁気デバイスの開発に新たな可能性をもたらすものである。
(Kumar, P. 2010)によると、自己組織化は小型の電子・磁気・光学デバイスの開発の鍵であり、ワクチンサンプルに含まれるグラフェン由来の材料と合致する。実際、「ナノ粒子は、超常磁性、化学発光、触媒作用などのサイズに依存したユニークな特性を持つため、そのようなコンポーネントとして大きな注目を集めている」と述べられている。ナノ粒子の潜在能力を最大限に活用するためには、ナノ粒子を有用なパターンや構造に組み立てるための新しい方法を開発する必要がある。これらの自己組織化構造は、小型化された光学、電子、光電子、磁気デバイスの開発に新たな可能性をもたらすものである。
さらに、Kumarは、「指向性自己組織化」法は、量子ドットやナノドットを使用できるため、ナノ・マイクロスケールのデバイスの生成に適していることを明らかにしている。デバイスのサイズや機能が小さくなればなるほど、従来のリソグラフィープロセスでは製造に限界があります」と説明する。この困難を回避するための代替方法を開発する必要がある。光リソグラフィーのような従来の製造技術が発展するにつれ、基本的な限界に直面するようになる...さらに、既存の技術の寿命と応用範囲を広げるために、新しい製造技術が必要となる...自己組織化の技術は、例えば、ナノワイヤーやナノドット(量子ドット)の組織化配列などの機能性ナノ構造の製造に適切に利用することができる。つまり、「有向自己組織化」とは、ある材料の量子ドット(例えば、グラフェンGQD グラフェン量子ドット)を、あらかじめ定義されたパターンに従って自己組織化させることである。
ガイド付き自己組織化または指向性自己組織化の可能なタイプのうち、Kumarは「原子表面パターンを用いたテンプレートガイド付きアセンブリ、電磁場または電場ガイド付きアセンブリ、電子ビーム、光、レーザー、その他」を認めている。さらに、「自己組織化は、再現可能で堅牢な技術であり、将来的には産業規模での利用が期待されている。つまり、よく秩序立った、しばしば興味をそそる構造を構築するということであり、ナノスケール材料を秩序立った構造に組織化し、大規模複雑構造を生成する機能が注目されている」ことを認めている。これは、何千ものデバイスを作成しなければ機能しないため、企業内ネットワークのナノ通信やナノ/マイクロデバイスの文脈では重要であると思われる(Zhang, R; Yang, K; Abbasi, Q.H.; Qaraqe, K.A.; Alomainy, A. 2017 | Galal, A.; Hesselbach, X. 2018|Galal、 A.; Hesselbach, X. 2020)。
あらゆる自己組織化の中で、最も可能性が高く、形態的にも一貫しているのが、生物学的なDNAを鋳型として誘導される自己組織化である。ナノワイヤー製造は、集積化の問題を解決する(個々のナノワイヤーを操作する必要がない)」とKumar氏はその利点を指摘する。また、電気・磁気輸送の接触に関する問題も解決しています。これは、マイクロ/ナノレクチェナやグラフェン由来の材料であるグラフェン量子ドットGQDなど、観測されたナノデバイスの種類と一致する。実際、「物理的なDNAテンプレートを使用すると、ナノ材料があらかじめ定義された位置に成長するため、成長後の操作が不要になり、さらに特性を調べるための電気的接続も可能になります」とKumar教授は言う。このことは、ワクチンサンプルで観察された四角形の形状が、PCB、マイクロチップ、センサー、集積回路に酷似した形で構築・定義されていることの理解に役立つと言える。さらに、「このようなテンプレートは、ナノポイント(量子ドット)や垂直ナノワイヤーの成長をもたらし、これを制御してFET(電界効果トランジスタ)デバイス、磁気トンネル接合デバイス、光応用デバイスを作製することができます」と述べ、自己組織化により、既知のあらゆる電子デバイスの小型化ナノテクノロジーを実現することが可能であることを確認している。
つまり、生物学的DNAテンプレートによって導かれる自己組織化は、体内ナノネットワークに必要なすべてのデバイスを作るために用いることができ、観察された画像や科学文献の記述から、これがワクチンに用いられている技術である可能性があります(Catania, V.; Mineo, A.; Monteleone, S.; Patti, D. 2014; Keren, K.; Berman, R., Keren, K., R.., Berman, R. 2014)。
DNAを鋳型としたカーボンナノチューブFET電界効果型トランジスタ

図3 DNAを鋳型としたカーボンナノチューブFET電界効果トランジスタ。(Keren, K.; Berman, R.S.; Buchstab, E.; Sivan, U.; Braun, E. 2003)
さらにKumarは、「生体分子指向戦略(生体DNAテンプレート)は、その高効率性、高い特異性、および遺伝的プログラム可能性から、多種多様なアーキテクチャのナノ粒子の組み立てに大きな可能性を示している(McMillan, R.A.; Paavola, C.D.; Howard, J.; Chan, S.L.; Zaluzec, N.J.; Trent, J.D. 2002)」と述べている。これらのナノ集積化材料は、バイオセンサー(Taton, T.A.; Mirkin, C.A.; Letsinger, R.L. 2000)や化学センサー(Liu, J.; Lu, Y. 2003|リュー、ジェイ、ルー、ヤー)などの新規センシングシステムへの応用の可能性が示されている。2006)、ナノエレクトロニクスデバイスの構築(Keren, K.; Berman, R.S.; Buchstab, E.; Sivan, U.; Braun, E. 2003)[カーボンナノチューブで逆説的に構成]」人体へのナノテクノロジー実装において、便利な手法/方法であることが再確認されました。
ソフトエピタキシャル成長による自己組織化
自己組織化の兆候が完全に根拠のある仮説と見なされるなら、「ソフトエピタキシャル成長による自己組織化」は、さらに明白な証拠を示している。図4は、科学文献と医師が分析したファイザー社製ワクチンサンプルの間に正確な同等性があることを示しています(Campra, P. 2021)。より多数の四角形やピラミッド型のものは、実際には「集積回路製造のプロセスの一つ」であるエピタキシャル自己組織化技術の結果であろう(Shen, J.; Sun, W.; Liu, D.; Schaus, T.; Yin, P.)。2021年|Burns, M.A.; Mastrangelo, C.H.; Sammarco, T.S.; Man, F.P.; Webster, J.R.; Johnsons, B.N.; Burke, D.T. 1996|Esener、 S.C.; Hartmann、 D.M... Heller, M.J.; Cable, J.M. 1998 | Krahne, R.; Yacoby, A.; Shtrikman, H.; Bar-Joseph, I.; Dadosh, T.; Sperling, J. 2002 | Chen, Y.; Pepin, A. 2001). エピタキシーとは、一次核形成基板上に材料(グラフェン量子ドット、酸化グラフェン、ハイドロゲルなど)の層を成膜することである。しかし、従来の成長プロセスとは異なり、この場合はDNAのハイブリダイゼーションによって実現される。この時点で、(Liu, J.; Wei, J.; Yang, Z. 2021)は研究対象の一つを開発することになる。
科学文献(Liu, J.; Wei, J.; Yang, Z. 2021)にあるソフトエピタキシャル成長で自己組織化した物体とファイザー社のワクチンで観察された物体とは完全に一致することが確認された。

図4 科学文献からソフトエピタキシャル成長で自己組織化した物体(Liu, J.; Wei, J.; Yang, Z. 2021)とファイザー社のワクチンで観察した物体(Campra, P. 2021)が完全に一致することが観察された。
Liu, J.; Wei, J.; Yang, Z. 2021)によると、「無機ナノ粒子をメゾスコピックあるいはマクロスコピックなナノ粒子集合体に自己組織化することは、ナノスケールで新たな機能を持つ先進デバイスを作製するための効率的戦略である」という。また、基板上でナノ粒子を集合させることで、基板上での原子結晶の成長と同様に、基板一体型のデバイスを作製することが可能である。最近のナノ粒子集合体の進歩は、エピタキシャルソフトグロースと呼ばれる、選択した基板上に秩序あるナノ粒子集合体を良好に作製できることを示唆している。この定義により、マイクロ/ナノ電子デバイス(集積回路)の作製が、DNA基板またはテンプレート上でのガイド付き結晶成長によって実現できることが確認された。これは、「DNAのハイブリダイゼーションを応用して、ナノ粒子を超格子に組み立て、驚くほど豊かな結晶構造を実現した」という説明からも明らかである。DNAの三次元二重らせん構造(固定ピッチ、固定直径)は、ナノ粒子を秩序ある三次元集合体に導く上で、他の材料よりも有利であることがわかった(Nykypanchuk, D.; Maye, M.M.; Van-Der-Lelie, D.; Gang, O. 2008)。
塩基対の間を特異的に認識し、DNA鎖の長さや塩基配列を制御できることから、ナノスケールの組み立てのための強力な武器となる。DNAのプログラム可能性は、構造指向のリガンドとして非常に魅力的である。このことから、DNAの自己組織化では2次元構造だけでなく、DNAの二重らせん結合を利用して3次元構造を作ることができ、図4のような立方体やプリズムなど、あらゆる形状を構成できることが確認されました。
Liu, J.; Wei, J.; Yang, Z. 2021)が引用した経験の中に、エピテキシャル自己組織化に関する以下のパラグラフがあり、DNAベースの結晶構造体の実験において、誤差(ミスマッチ)がわずか1%であるという豊富な経験があることが明らかにされている。
"(Lewis, D.J.; Zornberg, L.Z.; Carter, D.J.; Macfarlane, R.J. 2020)らによると、この技術とDNA機能化ナノ粒子およびDNA鎖機能化基板の組み合わせを用いて、エピタキシー組立プロセスを設計したとのことです。彼らは、結晶と流体、基板と結晶、基板と流体の間の界面エネルギーを制御することで、ナノ粒子結晶の単結晶ウィンターボトム形態が形成されることを見いだしたのです。他の例では、2次元コロイド膜中の自己組織化DNAグラフトナノ粒子をソフトエピタキシャルアセンブリの基板として応用できることを示した。例えば、(Wang, M.X.; Seo, S.E.; Gabrys, P.A.; Fleischman, D.; Lee, B.; Kim, Y.; Mirkin, C.A. 2017)によれば、格子ミスマッチにうまく対応するため、より弾性的で可鍛性の高い構築ブロックとしてDNA被覆ナノ粒子を使用しました。さらなる研究(Gabrys, P.A.; Seo, S.E.; Wang, M.X.; Oh, E.; Macfarlane, R.J.; Mirkin, C.A. 2018)により、DNA機能化ナノ粒子によって組み立てられた超格子薄膜は、変形や再編成時に弾性歪みを保存でき、格子ミスマッチは最大±7.7%と原子薄膜が許容する格子ミスマッチ±1%を大きく超えることが示された。重要なことは、これらのDNAコーティングされたナノ粒子は、漸進的かつコヒーレントな緩和を起こし、転位や空孔の形成を通じて弾性的にかつ回復不能に歪みを消散させるということである。したがって、ソフトな圧縮性高分子材料で被覆した剛直なナノ結晶を用いて、プログラム可能な原子当量-ソフト-ナノメートルと微細構造を制御することにより、ヘテロエピタキシャルコロイド膜の成長が可能である。" (Liu, J.; Wei, J.; Yang, Z. 2021)
折り紙の自己組織化
最後に、最も独創的な自己組織化の方法として、DNAをテンプレートとする「折り紙法」がある。この場合、「Active generation of nano-holes in DNA origami scaffolds for programmed catalysis in nanocavities」と題する(Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. 2019)の研究成果に手がかりが見出されることになる。四角い構造の中に点や穴があるパターンは、形態学的に見ても印象的で特徴的である。このディテールは、カンプラ博士が得た画像から発見され、研究対象の自己組織化オブジェクトと合わせて、パズルのもう一つのピースであり、現実にはもっと大きなオブジェクトが折り紙の手法で自己組織化されているはずだと推論することができました。図5を参照すると、対象物の四角形構造、表面内に刻まれたナノホールの位置、ファイザー社製ワクチンサンプルで観察されたその数や量などが一致しており、その類似性は明らかである。
ファイザー社のワクチンサンプルで観察された物体は、折り紙の自己組織化に関する科学文献と直接対応しており、ナノホールは紛れもない特徴的な要素であることが確認されています。

図5 ファイザー社製ワクチンのサンプルで観察された物体は、ナノホールが明確な特徴的要素である折り紙の自己組織化に関する科学文献と直接対応していることが確認された。(Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. 2019).
しかし、四角い物体の穴の問題を論じる前に、著者らが論文で紹介した技術の導入と現状を確認することは、この技術の能力を位置づけ、ワクチンに使われているナノテクノロジーとの関連を示すのに役立つからです。実際、折り紙の自己組織化は「2次元(2D)および3次元(3D)DNAナノ構造のプログラムされた組み立てであり、DNAナノテクノロジーにおける大きなブレークスルーを示す」(Hong, F.; Zhang, F.; Liu, Y.; Yan, H. )として、驚くべき主張が指摘されています。2017 | Rothemund, P. W. 2006 | Endo, M.; Sugiyama, H. 2014)、これは、自己組織化の可能な寸法または軸だけでなく、折り紙法がソフトエピテキシャル成長自己組織化、したがって誘導または指示自己組織化に適合することを確認するものである。すべての場合において、適切に構成された合成DNA構造の使用は、ワクチンサンプルで観察される構造およびオブジェクトの開発に必要な前駆体である。
さらに、(Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. 2019)は、DNA折り紙自己組織化法によって、人体中心型ナノネットワークの一部としてワクチンサンプルで以前に確認されたプラズモンアンテナを、他のデバイスと組み合わせて構成するための部品の固定化ができることを確認しました。このことは、「プログラムされたDNAの折りたたみによって生成された折り紙構造の独創的な形状を作り出すことに加え、折り紙構造は、突出した核酸鎖や、縁を修正したオリゴヌクレオチド鎖で機能化されていた。この突出したストランドは、それぞれの折り紙の足場にポリマー、タンパク質、ナノ粒子を組織化するためのアンカーサイトとして使用された。折り紙足場上に組み立てられたナノ構造体が、酵素カスケードの機能、プラズモンアンテナの設計、キーロプラズモン構造の組み立てなど、ユニークな機能を持つことが実証された。" この説明は、DNAパターンに導かれ、ナノ粒子(グラフェン量子ドットなど)で機能化されたビルディングブロックが突出した鎖を介して連結し、プラズモン特性や量子ホール特性をもたらし、トランジスタの自己組織化や必要な複雑さのマイクロ/ナノチップを実現する超構造の形成過程を理解する上で基本となるものだ。
また、(Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. 2019)はその紹介の中で、折り紙技術の可能性や、分子相互作用パターンに応じて動きを開始し、曲がり、止まる運動能力を持つDNAウォーカーの設計について興味深い注釈と引用を掲載しています。実際、(Lund, K.; Manzo, A.J.; Dabby, N.; Michelotti, N.; Johnson-Buck, A.; Nangreave, J.; Yan, H. 2010)によれば、これらのDNAウォーカーは、本質的に、一連のDNA折り紙構造(テンプレート)の中で基質分子(前駆体)によって導かれる分子ロボットなのです。このことは、以下のLundの全文引用でも確認されており、(Omabegho, T.; Sha, R.; Seeman, N.C. 2009 | Gu, H.; Chao, J.; Xiao, S.J.; Seeman, N.C. 2010)でも裏付けられている。
「ロボット工学を1分子レベルにまで高めることは先験的に可能ですが、1分子が複雑な情報やプログラムを保存する能力の限界に取り組む必要があります。この問題を克服する一つの方策は、単純なロボットと環境との相互作用から複雑な振る舞いを導き出すことができるシステムを利用することである。その第一歩として、DNAウォーカーが開発され、非自律的であったのが、一次元の軌道上で指示された短い動きをすることができるようになった。この研究では、ストレプトアビジン分子を不活性な「本体」として、3つのデオキシリボザイムを触媒の「脚」として構成されるランダムウォーカー(分子クモとも呼ばれる)が、正確に定義された環境と相互作用する際に、初歩的なロボット動作をすることを実証しています。1分子顕微鏡観察により、これらのウォーカーは、2次元DNA折り紙ランドスケープに配置された基質分子の足跡を検出し、修正することで方向性を持った動きをすることが確認されました」(Lund, K.; Manzo, A.J.; Dabby, N.; Michelotti, N.; Johnson-Buck, A.; Nangreave, J.; Yan, H. 2010).
これは、ビデオ1の観察から示唆されるように、合成DNAパターンやテンプレートに適合した、複雑な電子デバイスを構成する自己集合、移動、配向、自己組織化の能力を持つ分子やパーツが、ワクチン様溶液の中でより近接して存在していることを確認することができるかもしれません。
分析したファイザー社製ワクチンサンプル中のGQDグラフェン量子ドットの成分、粒子、クラスターの動きを説明する折り紙DNAウォーカーの機能概略図。
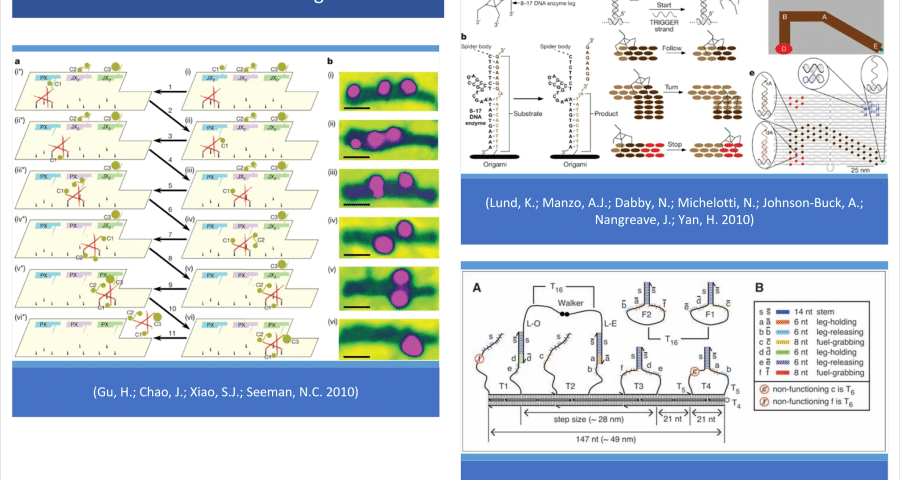
図6. ファイザー社製ワクチンの分析試料に含まれるグラフェンGQD量子ドットの成分、粒子、クラスターの動きを説明する折り紙DNAウォーカーの動作スキーム。この動きは、動画1や参考文献(Delgado, R. 2021)で全文を観察することができます。
Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. 2019)の分析を続けると、「(DNAテンプレートの)折り紙モザイクのエッジ機能化、プログラムされた多成分折り紙構造の設計、特に、交換可能折り紙ダイマーの開発に応用した」と追加されています。つまり、DNAテンプレートは、あらかじめ決められたプログラムやパターンに従って、特定のパーツ(粒子、タンパク質、量子ドットなど)で構成されるように定義することができるのです。
しかし、DNA折り紙技術は他の分野もカバーできる。王氏らの最先端の経験が示すように、「独創的な3D折り紙システムが作製されている」。例えば、折り紙ボックスの自己組織化、ギガダルトンスケールのプログラマブルDNA構造の段階的な組み立て、3次元折り紙束の光駆動による可逆的なカイロプティック機能の発現などが実証されています。折り紙ナノ構造体は、プログラム触媒、薬物放出制御、論理ゲート動作、センシングなど、さまざまな応用が提案された。中でも、QCA(量子セルオートマトン)回路設計の特徴であり、ワクチンで観察されるパターンの中からナノルーターを特定する際に既に議論された、論理ゲートとセンシングの演算は、特筆すべき応用例である。これは、配線や回路の秩序ある構築を制御できることから、DNA折り紙の手法が量子ドットを用いた電子デバイスの開発にも有効であることを示す証拠といえます。
Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. 2019)による論文の前文についての検討を終えたところで、科学的言説は、ワクチンではその領域内に点が内接する四角形の構造として示される「折り紙の筏」の空洞または穴の対象に焦点を当てている。これらの機能性折り紙構造物のほとんどは、折り紙の筏をボトムアップで改造するか、折り紙タイルの端を改造するか、タイルを筒状に折りたたむかのいずれかであった」と述べている。しかし、折り紙構造にナノキャビティ(穴またはバレル)を機能させることで、化学変換を誘導するための封じ込めやチャネルとして機能させることが考えられる。現在までに、このような空洞は折り紙タイルの受動的な組み立ての中で作製されており、これらの空洞は抗体の部位特異的ドッキング、膜タンパク質の再構成、選択的輸送のための固体孔の機能化などに利用されている。さらに、DNA構造体(折り紙ではない)を膜に導入し、これが膜を介した貨物種の潜在的な刺激輸送のチャネルとして機能するようになった。これに対して、本研究では、折り紙タイルにナノホールを能動的に作製するというコンセプトを導入している。折り紙足場におけるDNAzyme誘導による能動的なナノホール形成と、被覆した窓ドメインを持ち上げることによるナノホールの分子力学的なブロッキング解除について報告する。2種類のDNAzymeを適用することで、折り紙構造におけるナノホールのプログラムされた活性化された作製を実証しています。さらに、さまざまな折り紙の足場にある空洞を、選択的かつ特異的な触媒作用のための閉じ込められたナノ環境として利用している。さらに、光で可逆的にナノホールを機械的に開閉する設計や、ナノキャビティ内での触媒反応のスイッチングにも注目したい」と述べている。このように、折り紙製造技術の意図的なものを疑う余地のない説明の中に、真剣に考えなければならない基本的なディテールがあるのです。これは、DNA折り紙構造の空洞が抗体を捕捉、固定化、付着させる能力である(Ouyang, X; De-Stefano, M; Krissanaprasit, A.; Bank-Kodal, A.L.; Bech-Rosen, C.; Liu, T.; Gothelf, K.V. 2017)、本来は血清学的な研究を目的としていたが、マイクロ/ナノスケールの体内電子デバイスの構築に適用すると、自己形成構造の貪食と固定化を防ぐという目的を達成することができる。また、図7の説明(Kurokawa, T; Kiyonaka, S; Nakata, E; Endo, M; Koyama, S; Mori, E.; Mori, Y. 2018)のように、これらの穴は他のDNA折り紙配列との相互作用に非常に重要な役割を果たし、(レゴのピースのように)一緒にはめ込んで新しい建設足場を追加できることが明らかにされた。
四角いプレートの穴にDNA折り紙を組み立てたもので、これもDNA折り紙構造でできたプレートです。

図7. DNA折り紙構造からなるプレートでもある四角いプレートの穴にDNA折り紙を組み立てる(Kurokawa, T; Kiyonaka, S; Nakata, E; Endo, M; Koyama, S; Mori, E; Mori, Y. 2018). これは、DNAが事実上のビルディングブロックとして、他の分子成分やグラフェン量子ドットなどの材料を統合し、電子デバイスを構築するためのガイドとして機能していることを示している。
Wang氏らが挙げた穴の別の用途は、バイオセンサーを開発するためにDNA折り紙の板や構造体を貫くチャネルや孔として機能することであり、次のように裏付けられる(Seifert, A.; Göpfrich, K.; Burns, J.R.; Fertig, N.; Keyser, U.F.; Howorka, S. 2015|バーンズ、ジェイアール、シーフェルト、ア、ファーティグ、ノ、ハオルカ、ソ 2016|Burns、 J.R.;Seifert, A.; Fertig, N.; Howorka, S.))。実際、「折りたたみDNAからの膜横断ナノポアは、バイオセンサー、ドラッグデリバリー、ナノフルイディクスへの応用を可能にする人工的な生体模倣ナノ構造の最近の例である...我々はDNAポアが電圧依存の二つのコンダクタンス状態を示すことを立証した」と述べられている。膜貫通電圧は低い方が安定した高コンダクタンスになり、DNA孔が塞がれていないことに対応する。予想される開口チャネルの内幅は、ポリ(エチレングリコール)(PEG)サイズの関数としてコンダクタンスの変化を測定することで確認され、それによってより小さいPEGが細孔に入ることが想定される。これは、ファイザー社製ワクチンの賦形剤リストに記載されている成分の1つと合致するだけでなく、人体向けナノネットワーク部品に求められる導電性にも合致している(Yang, J. マー(Ma, M)、リー(Li, L)、チャン(Zhang, Y)、ファン(Huang, W)、ドン(Dong, X. 2014)、アバシ(Abbasi, Q. H)、ヤン(Yang, K)、チョプラ(Chopra, N)、ジョネット(Jornet, J.M.) アブアリー(Abrari, N.A.) カラケ(Qaraqe, K.A.) アロマニ(Alomainy, A. 2016) ウクハタル(Oukhatar, A)バクヒャ(Bakhouya, M)エルワジ(El Ouadghiri, D. 2021).
書誌情報
1. Abbasi, Q. H.; Yang, K.; Chopra, N.; Jornet, J.M.; Abuali, N.A.; Qaraqe, K.A.; Alomainy, A. (2016)(2016). バイオメディカルアプリケーションのためのナノ通信:物理層から新しいネットワークコンセプトまでの最先端技術に関するレビュー。IEEE Access, 4, pp.3920-3935。https://doi.org/10.1109/ACCESS.2016.2593582。
2. Burns, J.R.; Seifert, A.; Fertig, N.; Howorka, S. (2016). A biomimetic DNA-based channel for ligand-controlled transport of charged molecular cargo across the biological membrane = 生体膜を介した荷電分子の輸送をリガンドで制御するための生体模倣DNAベースチャンネル。Nature nanotechnology, 11(2), pp.152-156。https://doi.org/10.1038/nnano.2015.279。
3. Burns, M.A.; Mastrangelo, C.H.; Sammarco, T.S.; Man, F.P.; Webster, J.R.; Johnsons, B.N.; Burke, D.T.です。(1996). 統合DNA解析のための微細加工構造=統合DNA解析のための微細加工構造。Proceedings of the National Academy of Sciences, 93(11), pp. 5556-5561。https://doi.org/10.1073/pnas.93.11.5556。
4. カンプラ、P. (2021a). COVID RNAm Version1ワクチンに含まれる可能性のある微生物の観察結果 https://corona2inspect.net/documentacion-y-publicaciones-del-doctor-pablo-campra-madrid/campra-p-2021-oct-microscopic-objects-frequently-observed-in-mrna-covid-19-vaccines/|http://dx.doi.org/10.13140/RG.2.2.13875.55840
5. カンプラ、P. (2021b). Micro-RAMAN spectroscopyによるCOVID19ワクチン中のグラフェンの検出 https://corona2inspect.net/documentacion-y-publicaciones-del-doctor-pablo-campra-madrid/campra-p-2021-nov-deteccion-de-grafeno-en-vacunas-covid-19-por-espectroscopia-micro-raman/.
6. カンプラ、P. (2021c). MICROSTRUCTURES IN COVID VACCINES: Inorganic Crystals or Wireless Nanosensors Network? https://corona2inspect.net/documentacion-y-publicaciones-del-doctor-pablo-campra-madrid/campra-p-2021-nov-microstructures-in-covid-vaccines-inorganic-crystals-or-wireless-nanosensors-network/
7. Catania, V.; Mineo, A.; Monteleone, S.; Patti, D. (2014). Descubrimiento de topología distribuida en nano redes en chip autoensambladas = Distributed topology discovery in self-assembled nano network-on-chip. Computers & Electrical Engineering, 40(8), pp.292-306。https://doi.org/10.1016/j.compeleceng.2014.09.003。
8. Chen, Y.; Pepin, A. (2001). Nanofabricación: métodos convencionales y no convencionales = Nanofabrication: 従来の方法と非従来の方法。https://doi.org/10.1002/1522-2683(200101)22:2%3C187::AID-ELPS187%3E3.0.CO;2-0
9. デルガド、R. (2021). Directo del contenido de un vacuna Pfizer al microscopio [Programa especial](ファイザー製ワクチンの内容物を顕微鏡で直接観察する)。La Quinta Columna. https://www.twitch.tv/videos/1245191848
10. 遠藤真由美・杉山博之(2014).Imágenes de una molécula de movimientos dinámicos de biomoléculas en nanoestructuras de origami de ADN utilizando microscopía de fuerza atómica de alta velocidad = 高速原子間力顕微鏡によるDNA折り紙ナノ構造における生体分子の動的運動の1分子イメージング. Accounts of chemical research, 47(6), pp. 1645-1653。https://doi.org/10.1021/ar400299m。
11. Esener, S.C.; Hartmann, D.M.; Heller, M.J.; Cable, J.M. (1998). Microensamblaje asistido por ADN: una tecnología de Integración heterogénea para optoelectrónica = DNA-assisted microassembly: a hetrogeneous integration technology for optoelectronics. En: ヘテロジニアス・インテグレーション: Systems on a Chip: A Critical Review (Vol.10292, p.1029208). International Society for Optics and Photonics(国際光学光学会) https://doi.org/10.1117/12.300616
12. Gabrys, P.A.; Seo, S.E.; Wang, M.X.; Oh, E.; Macfarlane, R.J.; Mirkin, C.A. (2018). Discrepancia de celosía en películas delgadas de nanopartículas cristalinas = Lattice mismatch in crystalline nanoparticle thin films(結晶性ナノ粒子薄膜の格子不整合). Nano letters, 18(1), pp. 579-585. https://doi.org/10.1021/acs.nanolett.7b04737
13. ガラル,A.;ヘッセルバッハ,X. (2018). Arquitectura de comunicación de nano-redes: modelado y funciones = ナノネットワーク通信アーキテクチャ: モデリングと機能. ナノ通信ネットワーク, 17, pp.45-62. https://doi.org/10.1016/j.nancom.2018.07.001
14. ガラル,A.;ヘッセルバッハ,X. (2020). Protocolo de descubrimiento de ruta basado para nano-redes electromagnéticas = Probability-based path discovery protocol for electromagnetic nano-networks. Computer Networks, 174, 107246. https://doi.org/10.1016/j.comnet.2020.107246
15. Gu, H.; Chao, J.; Xiao, S.J.; Seeman, N.C. (2010). Una línea de montaje de nanoescala de ADN programable basada en proximidad = A proximity-based programmable DNA nanoscale assembly line. Nature, 465(7295), pp.202-205. https://doi.org/10.1038/nature09026
16. Hong, F.; Zhang, F.; Liu, Y.; Yan, H. (2017). Origami de ADN: andamios para crear estructuras de orden superior = DNA origami: scaffolds for creating higher order structures. ケミカルレビュー, 117(20), pp.12584-12640。https://doi.org/10.1021/acs.chemrev.6b00825。
17. ケレン、K.;バーマン、R.S.;ブフスタブ、E.;シヴァン、U.;ブラウン、E.(2003)。DNA Templated Carbon Nanotube Field-Effect Transistor = Transistor de efecto de campo de nanotubos de carbono con plantilla de ADN. Science , 302 (5649), pp. 1380-1382. https://doi.org/10.1126/science.1091022|https://sci-hub.yncjkj.com/10.1126/science.1091022
18. Krahne, R.; Yacoby, A.; Shtrikman, H.; Bar-Joseph, I.; Dadosh, T.; Sperling, J. (2002). Fabricación de huecos a nanoescala en circuitos integrados = Fabrication of nanoscale gaps in integrated circuits.(集積回路におけるナノスケールの空隙の作製)。Applied Physics Letters, 81(4), pp.730-732。https://doi.org/10.1063/1.1495080。
19. Kumar, P. (2010). Autoensamblaje dirigido: expectativas y logros = 指向性自己組織化:期待と成果。Nanoscale research letters, 5(9), pp.1367-1376. https://doi.org/10.1007/s11671-010-9696-9|https://sci-hub.yncjkj.com/10.1007/s11671-010-9696-9
20. 黒川 崇・清中 聡・中田 瑛・遠藤 真・小山 聡・森 瑛・森 祐子 (2018). Andamios de ADN Origami como plantillas para canales funcionales tetraméricos Kir3 K+ = DNA origami scaffolds as template for functional tetrameric Kir3 K+チャンネル. Angewandte Chemie International Edition, 57(10), pp.2586-2591。https://doi.org/10.1002/anie.201709982。
21. Lewis, D.J.; Zornberg, L.Z.; Carter, D.J.; Macfarlane, R.J. (2020). Construcciones Winterbottom monocristalinas de superredes de nanopartículas = 単結晶ウィンターボトム構造によるナノ粒子超格子の構築. Nature materials, 19(7), pp.719-724。https://doi.org/10.1038/s41563-020-0643-6。
22. Liu, J.; Lu, Y. (2003). Un biosensor de plomo colorimétrico que utiliza un ensamblaje de nanopartículas de oro dirigido por ADNzima = A colorimetric lead biosensor using DNAzyme-directed assembly of gold nanoparticles.邦訳:金ナノ粒子のDNA酵素による組み立てを利用した鉛の比色センサ. Journal of the American Chemical Society, 125(22), pp.6642-6643。https://doi.org/10.1021/ja034775u。
23. Liu, J.; Lu, Y. (2006). Detección colorimetrica rápida de adenosina y cocaína based on un diseño general de sensor incluye aptámeros y nanopartículas = Fast colorimetric sensing of adenosine and cocaine based on a general sensor design involving aptamers and nanoparticles. Angewandte Chemie, 118(1), pp.96-100。https://doi.org/10.1002/ange.200502589。
24. Liu, J.; Wei, J.; Yang, Z. (2021). Construyendo ensamblajes ordenados de nanopartículas inspirados en la epitaxia atómica = Building ordered nanoparticle assemblies inspired by atomic epitaxy. Physical Chemistry Chemical Physics, 23(36), pp.20028-20037. https://doi.org/10.1039/D1CP02373J|https://sci-hub.yncjkj.com/10.1039/D1CP02373J
25. Lund, K.; Manzo, A.J.; Dabby, N.; Michelotti, N.; Johnson-Buck, A.; Nangreave, J.; Yan, H. (2010). この論文では、分子ロボットがどのような役割を担っているのかを明らかにしました。Nature , 465 (7295), pp.206-210. https://doi.org/10.1038/nature09012
26. McMillan, R.A.; Paavola, C.D.; Howard, J.; Chan, S.L.; Zaluzec, N.J.; Trent, J.D. (2002). Matrices de nanopartículas ordenadas formadas en plantillas de proteína chaperonina diseñadas = シャペロニン蛋白質テンプレートを用いて形成した秩序あるナノ粒子アレイ(Matrices de nanopartículas ordenadas formadas en plantillas de chaperonina diseñadas). Nature materials, 1(4), pp.247-252。https://doi.org/10.1038/nmat775。
27. Nykypanchuk, D.; Maye, M.M.; Van-Der-Lelie, D.; Gang, O. (2008). Cristalización guiada por ADN de nanopartículas coloidales = DNA-guided crystallization of colloidal nanoparticles(コロイドナノ粒子のDNA誘導結晶化). Nature, 451(7178), pp.549-552. https://doi.org/10.1038/nature06560
28. Omabegho, T.; Sha, R.; Seeman, N.C. (2009). Un motor browniano de ADN bípedo con patas coordinadas = A bipedal DNA Brownian motor with coordinated legs(調整された脚を持つ二足歩行DNAブラウンモーター). Science, 324(5923), pp.67-71. https://doi.org/10.1126/science.1170336
29. Oukhatar, A.; Bakhouya, M.; El Ouadghiri, D. (2021). Red de nano sensores inalámbricos de base electromagnética: arquitecturas y aplicaciones = Electromagnetic-Based Wireless Nano-Sensors Network: アーキテクチャとアプリケーション。J. Commun., 16(1), 8. http://dx.doi.org/10.12720/jcm.16.1.8-19
30. Ouyang, X; De-Stefano, M; Krissanaprasit, A.; Bank-Kodal, A.L.; Bech-Rosen, C; Liu, T; Gothelf, K.V. (2017). DNA折り紙構造のキャビティに抗体をドッキングさせる=Docking of antibodies into the cavities of DNA origami structures. Angewandte Chemie, 129(46), pp.14615-14619。https://doi.org/10.1002/ange.201706765。
31. Rothemund, P. W. (2006). DNAを折ってナノスケールの形やパターンを作る=Folding DNA para crear formas y patrones a nanoescala=DNAを折ってナノスケールの形やパターンを作る。Nature, 440(7082), pp.297-302。https://doi.org/10.1038/nature04586。
32. Sarlangue, G; Devilleger, J.; Trillaud, P.; Fouchet, S.; Taillasson, L.; Catteau, G. (2021). COVID抗原療法およびCOVID検出PCR検査接種後のBluetooth周波数帯域における検出可能なMACアドレスの有無の客観的検証 https://gloria.tv/post/vHCyNRQ246TC3jehvWkAVt2GG
33. ザイフェルト、A.;ゲップフリヒ、K.;バーンズ、J.R.;フェルティグ、N.;キーサー、U.F.;ホウォルカ、S.(2015)。開閉電圧切替型二層DNAナノポア=開閉電圧切替型二層DNAナノポア。ACS nano, 9(2), pp. 1117-1126。https://doi.org/10.1021/nn5039433。
34. Shen, J.; Sun, W.; Liu, D.; Schaus, T.; Yin, P. (2021). DNAモジュールエピタキシーによる3次元ナノリソグラフィー=DNAモジュールエピタキシーによる3次元ナノリソグラフィー。Nature Materials, 20(5), pp.683-690。https://doi.org/10.1038/s41563-021-00930-7。
35. タトン、T.A.、ミルキン、C.A.、レッツィンガー、R.L. (2000). ナノ粒子プローブを用いたスキャノメトリックDNAアレイ検出=ナノ粒子プローブを用いたスキャノメトリックDNAアレイ検出。Science, 289(5485), pp. 1757-1760。https://doi.org/10.1126/science.289.5485.1757。
36. Wang, J.; Yue, L.; Li, Z.; Zhang, J.; Tian, H.; Willner, I. (2019). ナノキャビティにおけるプログラム触媒のためのDNA折り紙足場におけるナノホールの活性生成=ナノキャビティにおけるプログラム触媒のためのDNA折り紙足場におけるナノホールの活性生成。Nature communications, 10(1), pp.1-10. https://doi.org/10.1038/s41467-019-12933-9
37. Wang, M.X.; Seo, S.E.; Gabrys, P.A.; Fleischman, D.; Lee, B.; Kim, Y.; Mirkin, C.A. (2017). エピタキシー:プログラマブルアトム等価対原子=エピタキシー:プログラマブルアトム等価対原子=エピタキシー:プログラマブルアトム等価対原子。ACS nano, 11(1), pp.180-185。https://doi.org/10.1021/acsnano.6b06584。
38. Yang, J.; Ma, M.; Li, L.; Zhang, Y.; Huang, W.; Dong, X.(ヤン・ジェイ)。(2014). グラフェンナノメッシュ:新万能材料=グラフェンナノメッシュ:新万能材料。Nanoscale, 6(22), pp. 13301-13313. https://doi.org/10.1039/C4NR04584J | https://sci-hub.yncjkj.com/10.1039/c4nr04584j
39. Zhang, R.; Yang, K.; Abbasi, Q.H.; Qaraqe, K.A.; Alomainy, A. (2017). TS-OOK通信方式に基づく干渉存在下でのテラヘルツ帯生体内ナノネットワークの解析的特性評価=TS-OOK通信方式に基づく干渉存在下でのテラヘルツ帯生体内ナノネットワークの解析的特性評価。IEEE Access, 5, pp.10172-10181。https://doi.org/10.1109/ACCESS.2017.2713459。
関連記事サイト
当記事収録マガジン
この記事が気に入ったらサポートをしてみませんか?
