
1-3. 同位体
こんにちは、おのれーです。
前回は「原子の構造」について見ていきましたが、今日はその中でも「原子の質量」に注目をしてみたいと思います。
■同じ元素の原子でも、質量の異なるものがある!
ドルトンの「原子説」によると、「原子は、種類によって質量や大きさが決まっている」とあります。
決してこれは間違いではないのですが、現在では、同じ元素どうしであっても、質量が少しずつ異なる原子が存在することが分かっています。このように、原子番号が等しい(同じ元素どうしだ)が、質量数が異なる原子同士のことを、「同位体(アイソトープ)」とよんでいます。
たとえば水素には、質量数が1,2,3の同位体があることが知られています。このうち、質量数が1,2のものを比べてみると次のようになります。
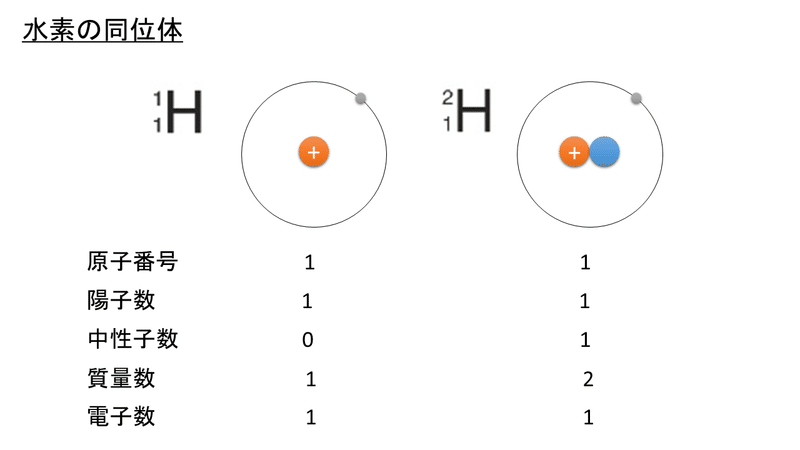
もちろん、質量数が異なるわけですが、他に違うところは発見できましたか?
実は、中性子数が異なるのです。
前回学んだように、原子の質量は原子核にかたよっており、「質量数=陽子数+中性子数」で表されます。
このうち、陽子数は原子の種類を決める要素であり、原子番号ともよばれる数です。陽子数が違ってしまうと、原子の種類も変わってしまいます。また、陽子は正電荷を持つ粒子ですので、陽子の数が変わってしまうと、電子数とつり合いが取れず、原子が電気的に中性でいられなくなってしまいます。
一方、中性子は電荷をもたない粒子ですから、原子に含まれる数が変わっても、その質量が変化するだけです。
よって、「同じ元素だけど、質量数が違う」ためには、陽子数や電子数はそのままに、中性子数が異なる必要があります。
なお、化学反応の多くは電子が関係しているので、中性子数が異なっても、化学反応には大きくは影響しません。つまり、同位体どうしでは、化学的性質はほぼ同じと考えることができます。
■多くの元素に、同位体は存在する!
水素だけでなく、多くの元素には同位体があります。
そして驚くべきことに(?)、地球上でそれぞれの同位体がどのくらいずつ存在しているのか(=存在比)は、一定の割合と決まっているのです。
下に示すのは、炭素 C、酸素 O、塩素 Cl の同素体の存在比(全体を1としたとき、その同位体が存在する個数が何個かを表したもの)です。
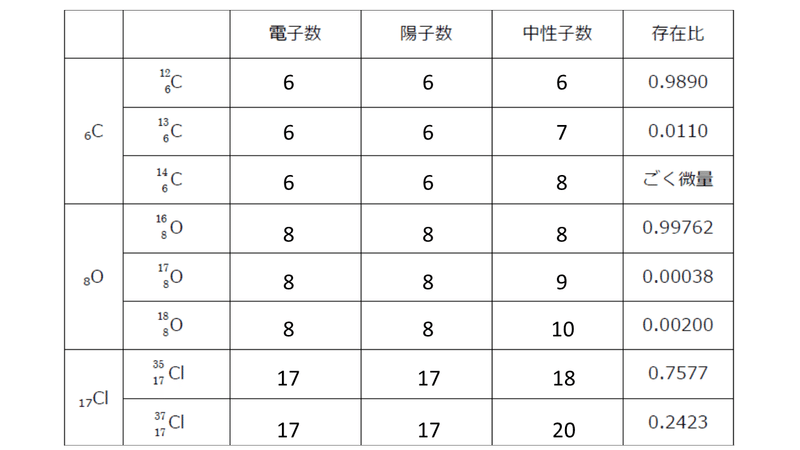
例えば炭素なら、地球上にある炭素原子の98.9 %が質量数12であり、質量数13のものが1.1 %、この他に質量数14のものがごく微量存在するということになります。
■実は、原子は変身することができる!
ドルトンの「原子説」によると、「原子は、あたらしくできたり、別の原子に変わったり、なくなったりしない」とあります。

だからこそ、化学者の祖先でもある錬金術師たちが、"安い金属を「金」に変えて金もうけをしてやろう"とどれだけ頑張っても、実現できなかったのです。
しかし、今では別の原子に変身することができる原子があることが知られています。
原子の中には、原子核が不安定で、放射線とよばれる粒子やエネルギーを放出して別の原子核に変わるものがあります。このような性質を持つ同位体を放射性同位体(=ラジオアイソトープ)といい、他の原子核に変わることを原子核の崩壊といいます。また、放射線を出す性質のことを放射能といいます。
放射性同位体が出す放射線には、α線、β線、γ線などがあります。

これを見ても分かるように、α線やβ線を放出した原子は、なんと!
原子番号が変わる=別の元素の原子になる
のです。まさに、"錬金術師の夢かなう"という感じで、ドルトンもびっくりですね。
ただ「放射線」「放射能」という言葉を聞くと、ちょっと怖いなと思う人もいるかもしれません。
確かに、人体が放射線を浴びると、細胞や遺伝子に損傷を与えます。何らかの原因で短期間に大量の放射線を受けると、白血病やがんの発生などの障害を受けることもあります。
しかし放射線は、レントゲンやCTなどのX線検査、がんなどの放射線治療、医療機器の殺菌に使われたり、放射性同位体も考古学や自然科学の研究に利用されたりするなど、有効活用されている例もあります。
ここでは、放射性同位体を用いた年代測定について、少しだけ見てみたいと思います。
■考古学に役立っている放射性同位体
上にも書きましたが、放射性同位体は、原子核が不安定であり、放射線を出して安定な原子核に変わっていきます。
つまり、放射能をもっている原子は、時間が経つと次々に放射能をもたない別の原子に変化していくのです。
このとき、もとの放射性同位体の数が半分になるまでの時間は、半減期とよばれ、放射性同位体の種類によって決まっています。
下のグラフは、放射性同位体である質量数14の炭素原子14Cが、時間経過とともにどのくらいずつ減少していくかを表したものです。
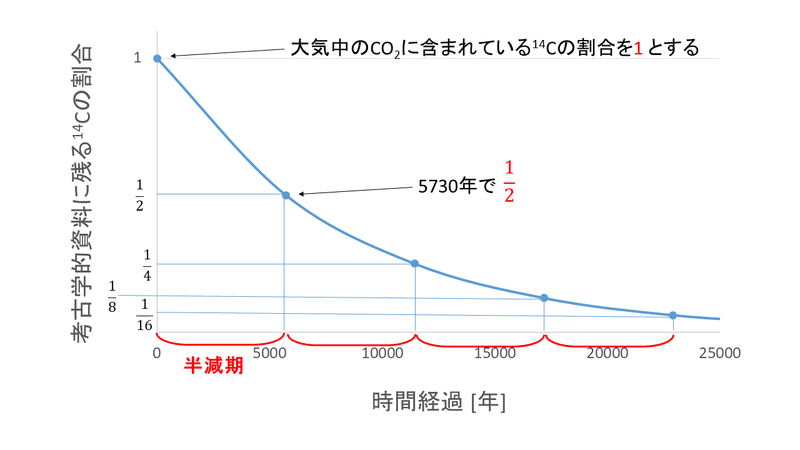
大気中では、14Cの割合はほとんど一定であり、生物が生きている間は二酸化炭素として絶えず補給されていますが、死んでしまうと補給は止まってしまいます。
すると、生物の体内に残っている14Cの量は時間が経つとともに、一定の割合で減少していきます。
この性質を利用して、14Cが生物の体内に残っている割合を調べることで、遺跡などの年代を特定しています。
つまり、14Cの量が、現在の大気中に含まれる量の半分になっていたら5730年前のもの、4分の1(2の2乗分の1)になっていたら 5730×2=11460年前のもの、8分の1(2の3乗分の1)になっていたら 5730×3=17190年前のもの・・・というように求めることができるのです。
今日はここまでです。化学って、いろいろなところで役立っているのですね。
最後にワンポイントチェック
1.同位体とはどんなもの?
2.同位体どうしで同じものと、異なるものは?
3.放射性同位体とはどんなもの?
4.半減期とは何?
次回は電子についてのお話です。"電子が分かると化学反応が分かる!"ということで、頑張っていきましょう。
この記事が気に入ったらサポートをしてみませんか?
