
4-3. 物質量(1)
こんにちは、おのれーです。
ついに、高校化学の最初の砦とも言われる「mol」にたどり着きました。と、大それた感じで書いてしまいましたが、ゆっくり考えていけば、そんなに難しくありません。のんびり、じっくりやっていきましょう。
■まずは、比の計算を復習しよう!
molの計算も含め、これから化学の計算をしていく上で、比の計算の考え方が利用できると便利なことが多いです。なぜなら、化学反応における量的関係は比例関係にあるものが多いからです。
例えば、1個10 gのものがあったとして、それが3個あったとしたら、どのように計算しますか?
この問題の場合、10 g×3 = 30 g という計算式ですぐに求めることができますが、もしこれを比の考え方を使って式を立てると、次のようになります。
1個:10 g = 3個:w [g]
この式は、「1個のとき10 gのものが、3個あるとw [g]になる」という意味を表しています。では、この式はどのようにして解けばよいのでしょうか?
比の計算には、次のように”「=」をはさんで内側どうしをかけたものと、外側どうしをかけたものが等しくなる”という約束があります。
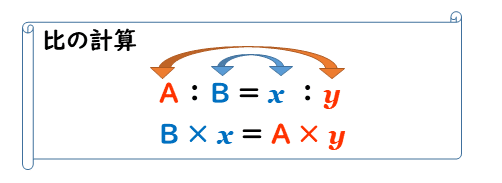
したがって、先ほどの問題では、A=1、B=10、x=3、y=wとなりますので、
10 × 3 = 1 × w より、w=30 g
と求めることができます。
この問題の場合だと、比の考え方を使うと逆にややこしくなるかもしれませんが、少し複雑な問題の場合、比の計算式を立てて計算すると分かりやすいかと思いますので、ぜひ覚えておいてください。
■"mol"の考え方は"ダース"に似ている!
後で詳しく見ていきますが、"mol"とは粒子の「個数」を表す単位です。ただ物質をつくる原子や分子などの粒子は、あまりにも小さいため、実際に実験などで扱う量は膨大な数になってしまいます。そこで、「個」ではなく、「mol」という、たくさんの粒子を集めたまとまりで表しています。
この考え方は、まとまった物の個数を数えるときに使う「ダース」と非常に似ています。
「1ダース」とは数量の単位であり、12個のことを意味しています。ですから、2ダースといったら、2倍の24個のことを指します。
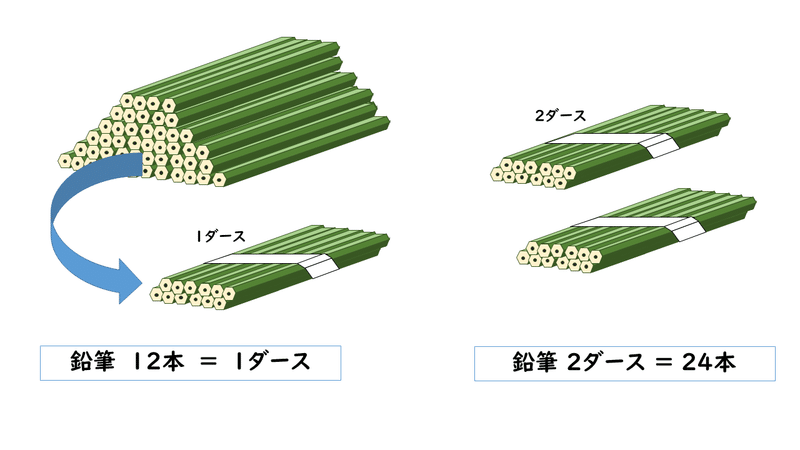
ちょっと話が脱線しますが、なぜ1ダースという単位ができたのでしょうか?
みなさんは「12」という数を聞いて、どんなことを思い出しますか?
恐らく、1年の月の数とか、半日の時間とか、時間に関係したことを思い出すのではないでしょうか。
1年間の満月、新月の回数はおよそ12回です。古代メソポタミア文明において、1年を12か月とする暦(こよみ)ができ、主に時間を示すための基準の数となりました。1日を24時間、1 時間を60分、1分を60秒とする時間の単位は、例外なくすべて12進法、またはそれをもとにした考え方です。また、古代メソポタミアでは、天文学者兼占星術師が暦をつくると同時に天体観測もしたことから、天体観測で使用する単位(度、分、秒)もまた12を基本とする 60進数が使われるようになりました。
このように、西洋の文化は「12」を基準とするものも多く、それが「1ダース=12個」という単位ができる原因になったとも考えられます。
ではここで、ダースに関する問題を解いてみましょう。

ここまではOKでしょうか? 実は、このダースの計算ができていたら、molの計算ももうマスターしたも同然なのです。
■「mol」とはどのような単位なのだろう?
実は、「mol」という単位の定義は最近変わったばかりなのです。現行の教科書(2020年3月現在)も、まだ古い定義で書かれていますが、とりあえずここでは新しい定義の紹介から入ってみたいと思います。
さて、新しい「mol」の定義は次の通りです。

要は、6.02214076×10^23という数をアボガドロ数といっており、物質をつくる粒子がアボガドロ数個集まったまとまりのことを、1molとよんでいるわけです。
ただし、計算をする時にいちいち6.02214076×10^23という数を使うのは大変なので、問題を解く時には、6.0×10^23 や 6.02×10^23 といった概数値を用いることが多いです。どの値を使うかは、問題で与えられている、アボガドロ定数NA [/mol]を使う約束になっています。
つまり、「12個=1ダース」と同じように、「6.02×10^23個=1 mol」と考えてあげればよいのです。

では、なぜこの6.0×10^23という不思議な数が出てくるのでしょうか?
その謎を探っていくと、これまでの定義にたどり着くことができます。
4-1. 原子量 で学んだように、原子はとても軽いので、扱いやすい値にするために質量数が12の炭素原子Cを基準とした相対質量として表しました。しかし、相対的な値なので、単位をつけることができません。それでは、実験で電子天びんを使ってはかりとろうとするときなど、不便ですよね。やっぱり、"g”とか"kg"などの単位をつけた値として扱いたいわけです。
そこで「原子量に“g”をつけた値を使うためには、原子を何個集めればいいか?」と考えた人がいました。実際には次のような計算をしたのです。

こうして求められたのが、6.0×10^23という数だったのです。
原子量は相対的な値ですから、原子量をもとにしている分子量や式量についても同じことがいえます。つまり、物質をつくる粒子をアボガドロ数(=6.02×10^23)個集めれば、原子量・分子量・式量に“g”をつけて表すことができるのです。
このように、「mol」を単位として表した物質の量(個数)を、「物質量」とよんでいます。問題で「物質量を求めよ」と書いてあったら、「あ、molを求めるのね」と思ってください。
ちなみに、1971 年から2019年までは、1 mol の定義として「0.012 kg の12C の中に存在する原子の数に等しい要素粒子を含む系の物質量であり、単位の記号はmol である」と定義されていました。しかし、2019年に質量の基準となっていた「キログラム原器」が引退し、質量の定義が変わったことから、連鎖的にmolの定義も変わりました。その経緯について詳しく知りたい方は、こちらの論文を読んでみて下さい。
■いろんな物質を1mol集めると、何gになるか?
前述のとおり、物質をつくる粒子をアボガドロ数(=6.02×10^23)個集めれば、原子量・分子量・式量に“g”をつけて表すことができます。
このことから、物質をつくる粒子1molあたりの質量(g)をモル質量といい、原子量・分子量・式量などの数値に単位 [g/mol](1 molあたり何gか)をつけた値で表します。
例えば、炭素原子、水分子、金属アルミニウム、塩化ナトリウムのモル質量は次のようにして求めることができます。
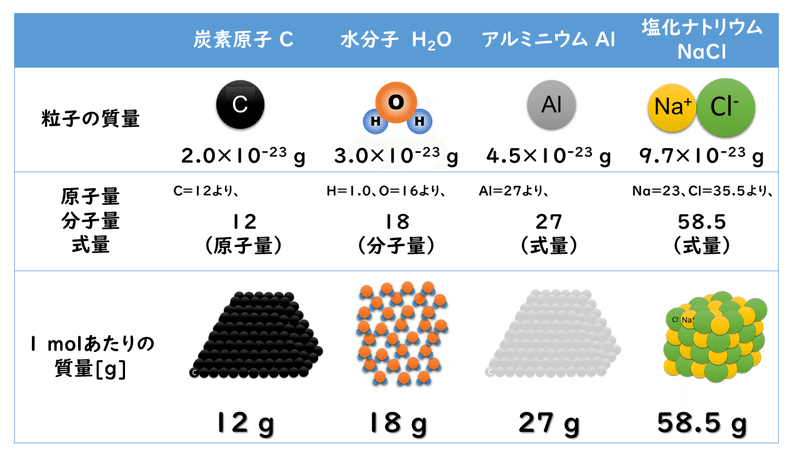
さて、ここまで大丈夫そうですか? もし分からなくなってしまったら、少し戻って、どこで分からなくなってしまったかを考えて、少し立ち止まって考えてみましょう。
とにかく理解のコツは、「mol=ものの個数を表している」というところです。個数の単位だということが腑に落ちると、割とすんなり受け入れられるようになると思うので、そのあたりを丁寧に、理解に努めるようにしましょう。
では、最後に練習問題です。

とりあえず、ここまでができれば、molの基本はバッチリです。
というわけで、今回はここまでです。
最後にワンポイントチェック
1.モルとはどのような単位か?
2.アボガドロ数は何個か?
3.モル質量とは何か?
4.分子量が44の二酸化炭素1molの質量は何gか?
5.式量が27のアルミニウム2.7 gは、何molか?
大変お疲れさまでした!次回は、物質量(2)ということで、molの続きです。引き続き、頑張っていきましょう!
この記事が気に入ったらサポートをしてみませんか?
