
M2マクロファージの極性化:疼痛緩和の潜在的標的
100
総閲覧数
1
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは2
レビュー記事
Front. 免疫学、2023年8月29日
炎症
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1243149
この論文は次の研究テーマの一部です
炎症性疾患およびアレルギー性疾患における神経免疫コミュニケーション
全ての論文を見る
M2マクロファージの極性化:疼痛緩和の潜在的標的
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1243149/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit
Wenjing Zhao1,2,3† Lulin Ma1,2,3† Daling Deng1,2,3 Tianhao Zhang1,2,3 Linlin Han1,2,3 Feng Xu1,2,3 Shiqian Huang1,2,3 Yuanyuan Ding1,2,3 Xiangdong Chen1,2,3*‡ 1.
1中国・武漢市・華中科技大学同済医科大学連合病院麻酔科
2中国・武漢市・華中科技大学同済医科学院組合病院麻酔重症治療医学研究所
3中国武漢市教育部華中科技大学麻酔・蘇生重点実験室
痛みは患者に大きな負担をかけ、身体的、心理的、経済的に影響を及ぼす。痛みの病態に関する研究は数多くなされているが、その臨床管理は依然として最適とは言えず、多くの痛み患者の治療不足につながっている。近年、痛みのプロセスにおけるマクロファージの役割に関する研究が増加し、新たな治療アプローチの可能性を提示している。マクロファージは自然免疫系に不可欠な免疫細胞であり、驚くべき多様性と可塑性を示す。しかし、これまでの研究の大半は、疼痛促進におけるM1マクロファージの寄与に焦点を当てたものであった。組織損傷や炎症性浸潤の後期には、M1マクロファージは通常M2マクロファージに移行する。近年、疼痛緩和におけるM2マクロファージの役割を強調する証拠が増えつつある。本総説では、M2マクロファージの極性化に関与するメカニズムを要約し、疼痛緩和におけるM2マクロファージの新たな役割について論じる。注目すべきは、M2マクロファージが疼痛緩和を促進する複数の内因性経路において重要な役割を果たしていることである。さらに、M2マクロファージが痛みを緩和する可能性のある経路を分析する。
1 はじめに
痛みは組織の損傷や炎症の侵襲によって誘発される。ほとんどの患者は、傷が治り炎症が治まるにつれて徐々に痛みが軽減していくが、中には慢性的な痛みに移行するケースもある。例えば、化学療法誘発性末梢神経障害(CIPN)患者の30%は、化学療法の6ヵ月後も痛みを経験している(1)。さらに、外科手術を受けた患者の約10%が、効果的な管理ができない慢性疼痛に苦しんでいる(2)。不快な主観的感覚である慢性疼痛は、身体的・精神的健康に重大な悪影響を及ぼし、世界中の患者の約30%が罹患している(3)。現在、オピオイドと非ステロイド性抗炎症薬(NSAIDs)が疼痛に対する主な治療薬である。しかし、オピオイドは中毒性、忍容性、鎮痛性の副作用があるため、ますます悪者扱いされており(4)、一方、NSAIDは胃腸や心血管系の反応を引き起こす可能性がある(5)。また、新たな研究では、急性期のNSAIDsが慢性疼痛の発症に寄与する可能性が示唆されている(6)。したがって、疼痛管理は依然として満足のいくものではない。広範な前臨床研究で疼痛発症のメカニズムが研究されている一方で(7-10)、疼痛緩和のメカニズムはあまり注目されていない。すなわち、疼痛緩和のメカニズムに介入し、このメカニズムを強化することで、疼痛を緩和するのである。
マクロファージは身体の免疫システムの重要な構成要素である。数多くの研究から、免疫細胞は痛みの発生に重要な調節的役割を果たしていることが示唆されている(10-12)。マクロファージは、さまざまな刺激を受けて、それぞれ異なる特徴や機能を示すさまざまな表現型に分化し、生理的・病理的プロセスにおいて多様な調節的役割を果たす。末梢神経損傷後、マクロファージはM1表現型に変化し、神経障害性疼痛を促進する炎症性因子を産生する(13)。対照的に、M2表現型に移行すると、炎症を抑制し、組織の治癒を促進し、神経障害性疼痛を緩和することができる。疼痛におけるM1マクロファージの促進的役割については、これまで広くまとめられてきたが、本総説では疼痛緩和におけるM2マクロファージの役割を強調する(14, 15)。本総説では、疼痛緩和の過程におけるM2マクロファージの役割を強調する。注目すべきことに、多くの疼痛緩和手段は、M2マクロファージの分極化を促進することによって機能している。その結果、M2マクロファージがどのように疼痛緩和に寄与しているかを解明することに焦点を当てる。本総説の目的は、M2マクロファージの制御による疼痛緩和の証拠を提供し、疼痛治療のための新しいアイデアを提示することである。
2 疼痛緩和は能動的プロセスである
疼痛緩和は、従来、炎症の沈静化、組織の治癒、疼痛誘発因子の消散に関連する受動的なプロセスと考えられてきたが、現在では能動的かつ動的な現象であると認識されつつある。神経系は、侵害受容が起こると容易にはベースライン状態に戻らず、代わりに「潜在性感作」または「痛覚過敏プライミング」の状態に移行し、刺激に再びさらされるとより強い痛みを引き起こす(16, 17)。最近の研究では、疼痛緩和は、疼痛の維持とは異なる、能動的で動的なプロセスであることが示されている。腰痛の場合、痛みが緩和された患者は、緩和期間中に末梢血中の5500以上の遺伝子において、急性期と比較して有意な変化を示す。逆に、痛みが解消しない患者では、痛みの前後で遺伝子発現レベルに有意な変化は見られない(6)。プロラクチン誘発マウス疼痛モデルでは、雌雄両方のマウスの後根神経節(DRG)と後肢組織において、疼痛緩和期に遺伝子発現が有意に変化することが明らかになった(18)。これらの知見は、疼痛緩和時に起こる数多くの活発な生物学的プロセスが関与していることを強調している。さらに、最近の証拠によると、リポキシン、マレシン、レゾルビン、プロテクチンなどのような特異的な痛み消失促進メディエーター(SPM)の分泌が、免疫細胞(マクロファージ、T細胞、好中球など)の表現型転換と並んで、炎症の消失と痛みの緩和を媒介する上で極めて重要な役割を果たしていることが示唆されている(19)。これらの消失経路を標的とすることで、痛みの治療に新たな視点がもたらされ、急性痛を効果的に管理し、慢性痛を予防する可能性が期待される。
3 M2マクロファージ極性化の制御
マクロファージは自然免疫反応に関与する重要な免疫細胞である。その活性化は、炎症反応、組織の回復、恒常性維持に重要な役割を果たしている(20)。マクロファージは、最新の分類では、炎症性表現型を持つM1マクロファージと、抗炎症性表現型を持つM2マクロファージに分類される。M2マクロファージはさらに、M2a(IL-4/IL-13)、M2b(免疫複合体とToll様受容体またはIL-1Rアゴニスト)、M2c(IL-10)に分けられる(21, 22)。マクロファージは厳密には二極状態に存在するのではなく、M1とM2の間で絶えず切り替わり、移行する。このことは、炎症性表現型と抗炎症性表現型の両方を持つ中間状態の可能性を示唆している(23)。この研究では、M1マクロファージとM2マクロファージを区別するために、極性化の過程で変化する既知のマクロファージマーカーを利用した。具体的には、M1マクロファージはCD80、CD86、iNOS、STAT-1、MHC-IIの過剰発現によって同定され(24)、M2マクロファージはCD200R、CD206、CD163、Arg-1、STAT-3、IL-10の発現によって特徴付けられた(25)。マクロファージの極性化の制御には、いくつかのシグナル伝達経路と代謝再プログラミングが関与している。本稿では主にM2マクロファージに焦点を当てるので、以下の内容はM2マクロファージの極性化に関与するメカニズムを要約したものである。
3.1 JAK/STATsシグナル伝達経路
ヤヌスキナーゼ(JAK)は、JAK1、JAK2、JAK3、TYK2の4つのタイプを持つチロシンキナーゼである。シグナル伝達物質および転写活性化因子(STAT)には、STAT1-6の6つのアイソフォームがある。JAK/STATシグナル伝達経路はM2マクロファージの極性化の際に活性化され、関連遺伝子の転写を制御する役割を果たす。例えば、IL4によって誘導されるM2マクロファージ極性化は、JAK1-STAT6シグナル伝達経路の活性化と表裏一体であり(26)、YM1、Arg1、Fizz1、IL-10、MGL1などのM2様遺伝子の活性化につながる(27)。JAK2-STAT3シグナル伝達経路の阻害はM1マクロファージの極性化をもたらし、JAK2-STAT3シグナル伝達経路の活性化はM2極性化を促進する(28)。JAK1-STAT1シグナル伝達経路の活性化は、マクロファージのM1型への転換を促進する(29)。一方、STAT3の活性化はSTAT1の発現を阻害するため、M1マクロファージの極性化を媒介するSTAT1の役割を抑制する一方で、M2マクロファージの極性化を促進する(30)。全体として、STAT3とSTAT6の活性化は、M2マクロファージ関連遺伝子の転写を促進し、M2マクロファージの代謝的・機能的変化をもたらし、抗炎症作用を増強する。
3.2 TGF-βシグナル伝達経路
トランスフォーミング増殖因子β(TGF-β)は多機能性サイトカインであり、M2マクロファージの極性化プロセスにおいて重要な役割を果たしている。TGF-βは単球をM2マクロファージに分極させるだけでなく、LPSで誘導されたM1マクロファージをM2マクロファージに再分極させる(31)。このプロセスには、TGF-βが2型TGF-β受容体に結合し、1型TGF-β受容体がリクルートされ、次いでSmad2/3が活性化される。活性化されたSmad2/3はSmad4とヘテロ二量体を形成して核内に入り、そこでM2マクロファージ関連遺伝子の発現を制御し、M2マクロファージの分極化過程を促進する(32)。さらに、TGF-βは非Smad経路を通してM2マクロファージの極性化を促進することもできる(33)。まとめると、TGF-βはM2マクロファージの極性を制御し、免疫応答を調節する上で重要な役割を果たしている。
3.3 PPARγシグナル伝達経路
ペルオキシソーム増殖因子活性化受容体γ(PPARγ)は核内受容体であり、核内でのリガンド結合により標的遺伝子の転写を直接制御し、細胞機能に影響を与える。PPARγの活性化は、Mrc1とArg1の遺伝子発現を増加させる一方、iNOSの遺伝子発現を減少させ、M2型への転換を促進する。逆に、PPARγを阻害すると、M2マクロファージが抑制され、M1マクロファージの割合が増加する(34)。Heらは、定量的タイムコースプロテオミクスとリン酸化プロテオミクスを用いて、マクロファージ極性化過程における細胞シグナル伝達と代謝のダイナミックな変化を包括的に解析した。彼らはまた、M2型マクロファージの極性化を阻止できる薬理学的阻害剤を同定した。研究の結果、PPARγ/レチノイン酸がM2型マクロファージの極性化を誘導する上で重要な役割を果たしていることが示された。さらに、このプロセスが起こるためには、マイトジェン活性化プロテインキナーゼの活性化が必要であることがわかった(35)。
3.4 M2マクロファージ極性化の代謝制御
一連の外部からの合図に応答して、マクロファージは代謝経路の重要な転換を受ける。多くの研究から、M1マクロファージでは解糖が著しく亢進するのに対し、M2マクロファージでは脂肪酸酸化と酸化的リン酸化(OXPHOS)に依存することが明らかになっている(36)。解糖から生成したピルビン酸はOXPHOSに入るが、M2マクロファージではOXPHOSはこの経路とは無関係に起こりうる。OXPHOSが機能している限り、解糖を阻害してもM2マクロファージの極性化には影響しない(37)。脂肪酸の酸化は、トリグリセリドの分解によって促進される。M2マクロファージは、脂肪組織からCD36を介してトリグリセリドに富んだ脂質滴を獲得し、それを取り込んでエネルギーのために異化することができる。さらに、M2マクロファージはde novoトリグリセリド合成が可能である(38)。リソソーム酸性リパーゼはトリグリセリドの分解と脂肪酸の放出に関与する。M2マクロファージはM1マクロファージよりもはるかに高いレベルでリソソーム酸性リパーゼを発現している(38)。脂肪酸の酸化的代謝は、Arg-1やIL-10といったM2マクロファージに特徴的な遺伝子の発現に寄与している(39)。トリグリセリドの異化や脂肪酸の酸化に関与する成分は、M2マクロファージの極性化に影響を与える可能性がある。例えば、脂肪分解阻害剤であるオルリスタットは、M2マクロファージの極性化を阻害することが示されている(38)。ディオシンは、mTORC2/PPAR-γシグナル伝達経路を通して脂肪酸異化を促進することにより、M2マクロファージの極性化を促進することが分かっている。しかし、脂肪酸異化阻害剤エトモキシルはディオシンのM2マクロファージ極性化促進作用を逆転させることができる。重要なアミノ酸代謝産物であるグルタミンは、細胞代謝において重要な役割を果たしており、M2マクロファージの極性化に不可欠である。骨髄由来マクロファージにおいてグルタミンが欠乏すると、M2マクロファージの極性化が阻害される(40)。グルタミンはグルタミン酸デヒドロゲナーゼ1によって異化され、α-ケトグルタル酸(αKG)を産生するが、このαKGはM2マクロファージの極性を誘導し、SENP1-Sirt3によって制御されている(41)。グルタミンの異化は、トリカルボン酸サイクルの中間産物であるαKGを生成する。αKGはミトコンドリアのOXPHOS代謝経路に入ってATPを産生し、ヒストン修飾にも関与する。H3K27トリメチル化を伴うヒストン修飾は、遺伝子発現の一般的な制御メカニズムである。αKGは核内のH3K27トリメチル化を減少させることができ、その結果、M2極性化に関連する遺伝子の発現を上昇させる(41)。さらに、αKGは脂肪酸酸化にも関与しており(42)、間接的にM2マクロファージの極性化に影響を与えている。このように、マクロファージの代謝を調節することは、マクロファージのM2型への極性化を調節する方法である。
4 痛みの緩和におけるM2マクロファージの役割
炎症性傷害や組織傷害の後、循環単球由来のマクロファージが組織に浸潤する。浸潤マクロファージも組織常在マクロファージも活性化し、損傷部位や侵害受容ニューロンのDRG周辺に集積する。最近の研究では、神経損傷後のDRGでは骨髄由来のマクロファージが増加するが、この領域のマクロファージの大部分は組織由来であることが示されている(43)。DRGのマクロファージは、損傷部位周辺ではなく、神経障害性疼痛や炎症性疼痛の発症・進展の主な原因であると考えられている(13, 44, 45)。しかし、Shepherdらは、DRG内のマクロファージと比較して、損傷部位周辺のマクロファージが疼痛においてより重要な役割を果たしていることを示唆している(46)。DRGのマクロファージと損傷部位のマクロファージ、あるいはその両方が痛みに正確に寄与しているかどうかは、まだ不明である。しかし、傷害部位のマクロファージはしばしば痛みの発症に一貫性のない挙動を示すので(45)、DRGのマクロファージが痛みの制御に一役買っていると考える方が妥当であろう。とはいえ、マクロファージとニューロンの対話は、痛みの発生と発症に調節的な役割を果たしている。
身体が損傷を受けると、マクロファージは活性化され、M1に極性化する。M1マクロファージは、IL6、IL-1β、TNF-α、IGF-1などの炎症因子を大量に放出する。これらの炎症因子は、侵害受容ニューロンの興奮性を亢進させ、痛みの発生を促進するという重要な役割を担っている(15)。傷害後数日間は、傷害部位や炎症部位とそれに対応するDRGはM1マクロファージが支配的であるが、数日後、痛みが消失すると、M1マクロファージのレベルはベースラインレベルに戻り、M2マクロファージが支配的になる(13, 45, 47, 48)。正常な状態では、DRGニューロンはサテライトグリア細胞に囲まれており、その間隔はわずか20nmである(49)。神経損傷後、ニューロンとサテライトグリア細胞との間のギャップが拡大し、M2マクロファージが肥大化し、幽体離脱した形状になる。この形状により、M2マクロファージは神経細胞とグリア細胞の間に入り込むことができる。この現象は、傷害を受けた神経細胞でも、そうでない神経細胞でも観察される。M2マクロファージと密接に接触しているニューロンは、ニューロン死から保護される(43)。受傷後7日目に、受傷側のDRGで対側と比較してM2マクロファージの有意な増加が観察され、痛みの軽減と一致した。しかし、M1マクロファージの数には両側で有意差はなかった(43)。損傷後のマクロファージの経時的変化という同様の現象は、脊髄でも見られる(50)。
さらに、疼痛緩和におけるM2マクロファージの重要な役割を示す直接的な証拠が豊富にあり、表1にまとめてある。脊髄におけるM2マクロファージのマーカーであるMRC1+マクロファージは、疼痛緩和中に増殖し、疼痛緩和におけるその重要性を強調している(50)。しかし、表在性損傷の場合と比較すると、神経損傷における脊髄M2マクロファージの増殖は顕著に鈍化しており、疼痛緩和の遅延を伴っている(50)。この現象がDRGや損傷部位にまだ存在するかどうかを直接扱った研究はないが、疼痛緩和におけるM2マクロファージの重要性を支持する証拠は他にもある。Michielらは、単球とマクロファージの完全な減少を誘導するジフテリア毒素が、カラギーナンによる急性炎症性疼痛の回復を遅らせることを発見した。M1マクロファージではなくM2マクロファージを髄腔内に注入すると、この状況を逆転させることができる(47)。さらに、M2マクロファージの髄腔内注入は、変形性関節症(OA)モデルにおけるモノヨード酢酸塩によって誘発される持続性の炎症性疼痛を消失させることができる(13)。m-クロドロソームの髄腔内注射によってM2マクロファージを選択的に枯渇させると、シスプラチンによって低下した機械的疼痛閾値の回復を遅らせるのに十分であった(52)。さらに、M2様骨髄由来マクロファージの髄腔内注射は、神経損傷(SNI)誘発性の疼痛を緩和することができる(51)。これらは、疼痛緩和におけるM2マクロファージの関与を示す直接的な証拠である。
表1
www.frontiersin.org
表1 さまざまな疼痛モデルにおけるM2マクロファージの役割。
M2マクロファージは、疼痛緩和を促進する複数の内因性経路に共通して関与している可能性がある。T細胞、SPM、IL-4はすべて、疼痛緩和の自然経過において重要な役割を果たしている(55-57)。これらの過程では、M2マクロファージの極性化が必須である。これらの因子は、さまざまなメカニズムを通してM2マクロファージの分極を制御し、それによって疼痛緩和を促進する。シスプラチン誘発性疼痛緩和では、CD8+T細胞によるIL-13の分泌が、マクロファージのM2表現型への転換を促進する。T細胞からのIL-13シグナル伝達を遮断すると、この転換過程が阻害され、疼痛緩和が妨げられる(52)。慢性狭窄傷害(CCI)モデルでは、傷害を受けた神経にIL-4を1回注射すると、傷害部位に存在するマクロファージからオピオイドペプチドが放出され、痛みが緩和された。しかし、この効果は短時間であり、損傷部位のマクロファージは主にM1表現型のままである(58)。傷害を受けた神経にIL-4を数日間にわたって長期間投与すると、マクロファージは炎症性のM1表現型から抗炎症性のM2表現型へとシフトする。このマクロファージ分極のシフトは、結果的にプロリゾルブ効果を有意に延長させる(53)。特筆すべきことに、IL-4の投与を中止した後でも、痛みを和らげる効果が持続し、痛みの調節におけるマクロファージの重要な役割を示している(59)。複数の前臨床研究により、様々なタイプの病的疼痛に対するSPMの疼痛緩和効果が証明されている。マクロファージはNPD1(SPMの一種)の受容体であるGPR37を発現しており、この受容体がないとM2マクロファージの分極が阻害され、最終的に痛みの緩和がうまくいかず、痛みが持続することになる(54)。逆に、マクロファージGPR37の活性化は、疼痛様行動に対して緩和効果を発揮する(60)。まとめると、M2マクロファージの極性化は、複数の鎮痛促進メディエーターが作用する共通のメカニズムである。したがって、M2マクロファージの分極を調節することは、痛みを緩和する有望な戦略となりうる。
5 痛み緩和におけるM2マクロファージのメカニズム
5.1 IL-10
IL-10を欠損させたマウスや抗IL-10抗体を髄腔内に投与したマウスでは、CIPNからの回復が困難であるという研究がある(61)。T細胞もマクロファージもIL-10を分泌することができる。しかし、IL-10-/-マウスのCD8+ T細胞は、パクリタキセルによって誘導された痛みの消失を促進する能力を保持していることから、少なくともこのモデルでは、CD8+ T細胞は痛みの緩和の際のIL-10の供給源ではないことがわかる(62)。一方、CD8+ T細胞はIL-13を介してマクロファージと相互作用し、CIPNの消失時にマクロファージをM2(CD206+CD11c-)マクロファージへとシフトさせることができる。このシフトはマクロファージによるIL-10産生を増加させる(52)。これらの研究から、CIPNの消失時にはM2マクロファージがIL-10の主な供給源であることが示唆される。この結論が他のモデルでも有効かどうかは、さらなる研究が必要である。M2マクロファージ上のCD163はIL-10の産生と分泌を媒介する(50, 63)。一方では、IL-10はマクロファージ自身を誘導して排出を促進し、神経炎症を抑制することができる(64)が、これについては後に詳述する。一方、IL-10は感覚ニューロンのIL-10Rと直接相互作用して、DRGの電位依存性ナトリウムチャネルをダウンレギュレートし、自発活動を調節し、自発性ゆらぎを脱分極させる(65)。
5.2 オピオイド
オピオイドペプチドは内因性の神経伝達物質であり、オピオイドペプチド受容体に結合することで鎮痛作用を発揮する(66)。オピオイドペプチドは、ニューロンの興奮性を低下させ、痛みシグナルの伝達を抑制することで、痛みを和らげる。マクロファージやT細胞など、さまざまな種類の白血球がオピオイドペプチドを産生することができる(67-71)。マクロファージの中でもM2マクロファージは、M1マクロファージやM0マクロファージに比べて、in vivoでもin vitroでも、Met-エンケファリン、ダイノルフィン、β-エンドルフィンなどのオピオイドペプチドを高レベルで放出する(72)。これらのマクロファージを損傷部位に移植すると、疼痛過敏が緩和される。しかし、この効果はオピオイド受容体拮抗薬によって逆転する(72)。IL4が抗炎症性サイトカインとして、傷害を受けた神経系に神経保護作用を及ぼし、疼痛を緩和することが、かなりの研究によって示されている。神経損傷部位にIL4を投与すると、マクロファージがオピオイドペプチドを放出するM2マクロファージに分極し、疼痛が緩和される。同様に、この効果は、オピオイド受容体拮抗薬によって逆転させることができる(53)。
5.3 特異化された解決促進メディエーター
M2マクロファージは、炎症性メディエーターよりも解決促進メディエーターの比率が高いことがわかっている(73)。異なるサブタイプのヒトマクロファージの脂質メディエータープロファイルを調べた研究では、M2マクロファージがM1マクロファージに比べて有意に高レベルのSPMを合成することが観察された。これらのSPMには、D/Eシリーズのレゾルビン、プロテクチン、マレシン、リポキシンが含まれる(74)。特にSPMは、神経障害性、炎症性、術後、癌性など、様々なタイプの痛みを緩和する効果があることが証明されている(75, 76)。SPMはGタンパク質共役受容体(GPCR)の活性化を通じて抗侵害受容作用を発揮する(77)。これらのSPM受容体は、感覚ニューロンやマクロファージ、グリア細胞、好中球などの免疫細胞に広く発現している(76)。SPMは、マクロファージの貪食を促進し、ミクログリアの活性化を抑制し、好中球の動員を防ぎ、炎症因子の放出を抑制して痛みを緩和するという重要な役割を担っている(78-80)。一方、SPMは侵害受容感覚ニューロンのTRPV1とTRPA1を強力に阻害し、興奮性シナプス伝達と痛みのシグナル伝達に影響を与える(80, 81)。
5.4 細胞外小胞
マクロファージは、miRNA、タンパク質、脂質、その他多くの生物学的に活性な物質を含む細胞外小胞(EV)を大量に産生することができ、それらはいくつかのシグナル伝達イベントや生理的・病理的プロセスに寄与している。中でもmiRNAは、一本鎖の短いRNA(21-24ヌクレオチド)で、痛みの制御に重要な役割を果たしている。CFA、SNI、神経破砕、CCI、神経切断、脊髄神経結紮などの炎症性疼痛や末梢神経損傷に伴い、DRGや脊髄のmiRNA発現が有意に変化することが、広範な研究で示されている(82, 83)。変化したmiRNAは、miRNAを送達するM2マクロファージ由来のEV(M2φ-EV)を髄腔内に注入することで回復し、疼痛閾値の回復につながる(83, 84)。EV中のこれらの機能的miRNAは、一次皮質ニューロン、ミクログリア、アストロサイトに取り込まれ、そこで炎症性miRNA標的遺伝子の発現がダウンレギュレートされる(85)。
5.5 ミトコンドリア移行
神経細胞はその特殊な構造により、他の細胞種に比べてエネルギー需要が大きい(86)。ミトコンドリア病患者の約66.7%は慢性疼痛を伴い、その多くは神経障害性である(87)。ミトコンドリアのOXPHOS、酸化ストレス、Ca2+緩衝能の障害は、炎症性疼痛と神経障害性疼痛の両方に密接に関連しており、疼痛の発症と維持を促進し、急性疼痛から慢性疼痛への移行を促す可能性がある(88-90)。活性酸素種の消去(91)、アポトーシス経路の阻害(92)、ミトコンドリア膜電位の変化(91)、ミトコンドリア動態の変化(93)などによって痛みを和らげようとする前臨床研究がいくつかある。しかし、これらの研究はミトコンドリア機能不全の特定の側面の改善を目指したものでしかなく、その臨床応用は今のところ達成されていない。M1マクロファージとは対照的に、M2マクロファージのミトコンドリアは解糖ではなく、OXPHOSによって支配されている(47)。疼痛緩和の生理的過程において、DRGの感覚ニューロンを取り囲むM2マクロファージは、M2マクロファージ上のCD200Rと感覚ニューロン上の非正規CD200RリガンドiSec1との相互作用を介して、ミトコンドリアを感覚ニューロンに移送する。この移動は、感覚ニューロンのOXPHOSとCa2+緩衝を含むミトコンドリアの機能不全の回復に役立つかもしれない(52)。ひとたびこのプロセスが阻害されると、痛みの消失は困難になる。
5.6 エフェロサイトーシス
エフェロサイトーシスとは、細胞死やアポトーシスの後、マクロファージ、特にM2マクロファージが細胞の残骸を貪食し、その後マクロファージからサイトカインが放出される過程である(94)。このプロセスは、炎症寛解において極めて重要である。神経障害性疼痛では、M2マクロファージ上のMerTKのような排出関連分子の発現が、正常部位のM2マクロファージと比較して、損傷部位で有意に低下する。その結果、排出能が著しく低下し、死細胞や死にかけた細胞は完全に排出されなくなる(95)。OA患者の滑膜マクロファージの排出細胞能は、健常人のそれに比べて著しく低下していることもわかった(96)。しかし、3,3'-ジインドリルメタン(DIM)はマクロファージの排出を促進し、内臓痛の緩和につながる。また、マクロファージの排出を阻害すると、3,3'-ジインドリルメタンの鎮痛効果が逆転した(97)。このことは、M2様マクロファージの排膿が不十分であることが、損傷した神経における慢性炎症の発症に重要な役割を果たしていることを示唆しており、痛みの緩和過程におけるM2様マクロファージの正常な排膿の重要な役割を反映している。
5.7 バリア安定性の増加
血液-脊髄関門(BSCB)は、神経細胞周囲の毛細血管内皮細胞、基底膜、周皮細胞、アストロサイト・ペドンクルが強固に結合して形成されている。BSCBは、免疫系と神経系の相互作用を仲介する架け橋の役割を果たしている(98)。BSCBの内皮細胞間のタイトジャンクションは、血液と脊髄を隔てる物理的障壁を作り出し(99)、クローディン-1、クローディン-5、オクルディング、ZO-1がBSCBの完全性を維持する上で重要な役割を果たしている(100)。クローディン-1は、血液細胞や神経毒性物質の脊髄への流入を防ぎ、それによって神経細胞周囲の環境の安定性を維持し、正常な神経細胞機能を確保する上で重要な役割を果たしている(99)。末梢神経障害によって誘発される痛みは、しばしばBSCBの完全性の崩壊を伴う(100-102)。T細胞を含む炎症性因子や免疫細胞が脊髄ニューロンの周囲に侵入することで、侵害受容性痛覚過敏が誘発される。最近の研究では、M2マクロファージがTGF-βを大量に分泌することで、BSCBの完全性の回復に役立つことが示されている。TGF-βは内皮細胞や周皮細胞上の受容体に結合し、ZO-1、オクルディン、N-カドヘリンのアップレギュレーションを引き起こす(103)。一方、内皮細胞は乳酸を放出することによって、M2マクロファージの分極化を促進することもできる(104)。BSCB以外にも、血液-神経関門や血液-DRG関門も痛みの維持に重要な役割を果たしている(105)。糖尿病性神経障害性疼痛モデルでは、血管関連マクロファージの含量が有意に低下していた(105)。このことは、疼痛緩和時のバリア保全におけるマクロファージの役割をある程度反映している。しかし、この分野でのさらなる研究が必要である。
6 考察と結論
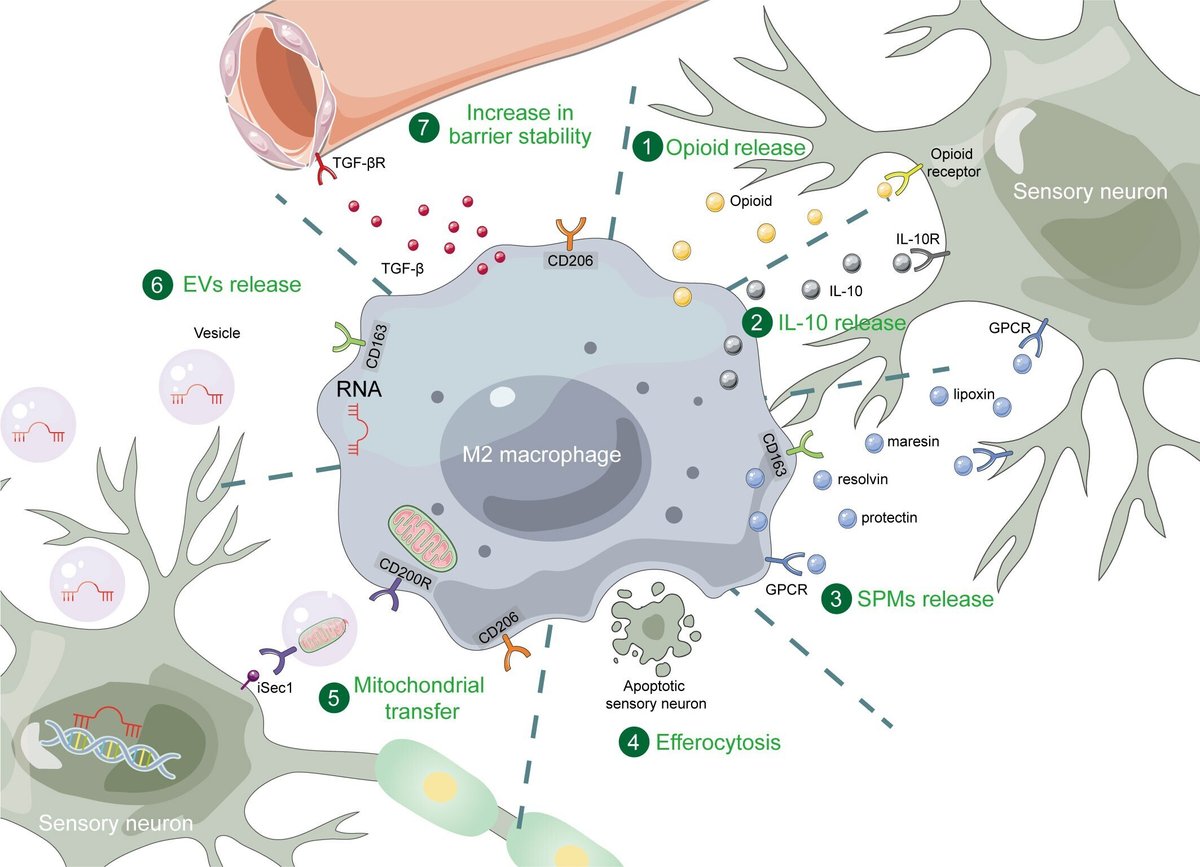
免疫系の重要な構成要素として、マクロファージは疼痛調節の過程で重要な役割を果たしている。近年、疼痛緩和におけるM2マクロファージの役割に焦点を当てた研究が増えている。本総説では、M2マクロファージの制御と疼痛緩和における重要な役割についてまとめた。M2マクロファージの極性化は、主にJAK-STAT、TGF-β、PPARγシグナル伝達経路、および複数の代謝経路と関連している。これらの経路を標的とすることで、M2マクロファージの分極化を調節することができる。疼痛緩和の過程で、M2マクロファージの数は著しく増加した。M2マクロファージを操作することによっても疼痛を緩和することができる。このように極性化したM2マクロファージは、さまざまな直接的または間接的な機序によって効果を発揮する。まず、M2マクロファージはIL-10、オピオイド、SPMなどの物質を放出し、侵害受容感覚ニューロンの関連受容体に作用することができる。さらに、M2マクロファージはmiRNAやミトコンドリアをEVを介して侵害受容感覚ニューロンに伝達する。さらに、M2マクロファージは、アポトーシスした感覚ニューロンを排出細胞として貪食し、血管の安定性を高めることができる。
図1
www.frontiersin.org
図1 痛み緩和におけるM2マクロファージのメカニズム。M2マクロファージは、オピオイド、IL-10、SPM、排出細胞、ミトコンドリア移行、EV、およびバリア安定性の増加を通じて、疼痛緩和を発揮する。SPM、特殊化された痛み緩和メディエーター、GPCR、Gタンパク質共役型受容体、EV、細胞外小胞。
しかし、いくつかの未解決の問題が残っている。M1マクロファージは傷害後の疼痛発症に不可欠な役割を果たしており、マクロファージがM1表現型からM2表現型に移行できないことが、急性疼痛の持続や慢性疼痛への進行に関与している可能性がある。もちろん、M1マクロファージが傷害の初期段階で必要とされる殺菌作用や貪食作用を阻害するのは軽率である(106)。従って、M2マクロファージの極性化の最適なタイミングを決定するためには、さらなる研究が必要である。その上、M2マクロファージ極性化の過程は動的であり、組織、傷害、時間に依存する。ある傷害や組織型におけるM2マクロファージ分極の機序を、別の傷害や組織型における機序から推測することは厳密ではない。したがって、マクロファージを時空間特異的に研究する必要がある。最後に、いくつかの研究によって、排出細胞貪食がM2を介した疼痛緩和において最も重要なメカニズムの一つであることが確認されている。しかし、エフェロサイトーシスに関与する分子や他のスカベンジャー受容体が果たす役割については、ほとんど研究されていない。エフェロサイトーシスに関与する分子の一つであるGas6は、肥満に関連したOA発症時にエフェロサイトーシスを制御することが報告されている(107)。OAと痛みは密接に関係している(108)。我々は、Gas6がエフェロサイトーシスを制御することで、M2を介した疼痛緩和に関与していると推測している。したがって、エフェロサイトーシスに関与する分子や他のスカベンジャー受容体も、M2介在性疼痛緩和において重要な役割を果たしている可能性があり、今後の研究の方向性でもある。
痛みはしばしば多くの疾患の症状として併存しており(109-111)、M2マクロファージが関節リウマチやOAなどの様々な疾患の症状緩和に積極的な役割を果たしていることは、数多くの研究で証明されている(112-114)。M2マクロファージが疼痛緩和を促進するメカニズムについて理解を深めることで、対症療法的な緩和だけでなく、疼痛の根本原因に積極的に働きかけ、症状と根本原因の両方を治療するという二重の効果を実現する、疼痛管理の新たな戦略を開発することができる。
結論として、M2マクロファージは疼痛緩和に好影響を及ぼし、M2マクロファージの分極制御を標的とすることは、疼痛緩和の有効なアプローチとして有望である。
著者貢献
WZとLMが原稿を執筆し、DD、TZ、LH、FX、SH、YDが文献収集と考察に貢献し、XCが原稿を編集した。XCは原稿を編集した。著者全員が最終原稿を承認した。
資金提供
本研究は、中国国家重点研究開発計画(XCへの助成金2018YFC2001802)、中国国家自然科学基金(XCへの助成金82071251)、湖北省重点研究開発計画(XCへの助成金2021BCA145)の支援を受けた。
利益相反
著者らは、本研究が、利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
略語
CIPN、化学療法誘発性末梢神経障害;NSAID、非ステロイド性抗炎症薬;DRG、後根神経節;SPM、特殊化プロ溶解メディエーター;JAK、ヤヌスキナーゼ;STAT、シグナル伝達物質および転写活性化因子;TGF-β、トランスフォーミング増殖因子-β; PPARγ、ペルオキシソーム増殖因子活性化受容体γ、OXPHOS、酸化的リン酸化、αKG、α-ケトグルタル酸、SNI、神経損傷、CCI、慢性狭窄損傷、OA、変形性関節症、GPCR、Gタンパク質共役受容体、EV、細胞外小胞、BSCB、血液脊髄関門。
参考文献
化学療法による末梢神経障害の発生率、有病率、および予測因子: システマティックレビューとメタアナリシス。疼痛(2014)155(12):2461-70. doi: 10.1016/j.pain.2014.09.020.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Glare P, Aubrey KR, Myles PS. 手術後の急性疼痛から慢性疼痛への移行。Lancet (2019) 393(10180):1537-46. doi: 10.1016/S0140-6736(19)30352-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cohen SP, Vase L, Hooten WM. 慢性疼痛:負担、ベストプラクティス、新たな進歩に関する最新情報。Lancet (2021) 397(10289):2082-97. doi: 10.1016/S0140-6736(21)00393-7.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nickerson K, Lieschke G, Rajappa H, Smith A, Inder KJ. この論文では、慢性的な非がん性疼痛に対する処方オピオイドの減量を支援するための外来介入に関するスコープレビューを行っている。J Clin Nurs (2022) 31(23-24):3368-89. doi: 10.1111/jocn.16235.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
非ステロイド性抗炎症薬(NSAIDs)、疼痛および加齢: 患者の特徴に合わせた処方。BioMed Pharmacother (2022) 150:112958. doi: 10.1016/j.biopha.2022.112958.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
好中球の活性化を介した急性炎症反応は、慢性疼痛の発症を予防する。Sci Transl Med (2022) 14(644):eabj9954. doi: 10.1126/scitranslmed.abj9954.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
牙XX、王H、宋HL、王J、張ZJ。糖尿病に関連する痛みやかゆみに関与する神経炎症。糖尿病に関連する痛みや痒みに神経炎症が関与していることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
慢性疼痛の潜在的治療標的としてのインターロイキン17。(2022年) 13:999407. doi: 10.3389/fimmu.2022.999407.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
周YQ、田XB、田YK、梅W、劉DQ、葉DW。Wntシグナル: 慢性疼痛に対する有望な治療標的。このような疾患は、慢性的な疼痛を引き起こす可能性がある。
パブコメ要旨|クロスリファレンス全文|Google Scholar
Finnerup NB, Kuner R, Jensen TS. 神経因性疼痛:メカニズムから治療まで。Physiol Rev (2021) 101(1):259-301. doi: 10.1152/physrev.00045.2019.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Baral P, Udit S, Chiu IM. 痛みと免疫:宿主防御への示唆。Nat Rev Immunol (2019) 19(7):433-47. doi: 10.1038/s41577-019-0147-2.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pinho-Ribeiro FA, Verri WA Jr., Chiu IM. 痛みと炎症における侵害受容器感覚ニューロンと免疫の相互作用。Trends Immunol (2017) 38(1):5-19. doi: 10.1016/j.it.2016.10.001.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
後根神経節マクロファージは変形性関節症の痛みを維持する。J Neurosci (2021) 41(39):8249-61. doi: 10.1523/JNEUROSCI.1787-20.2021.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen O, Donnelly CR, Ji RR. マクロファージと侵害受容器感覚ニューロンの神経免疫相互作用による痛みの制御。Curr Opin Neurobiol (2020) 62:17-25. doi: 10.1016/j.conb.2019.11.006.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
末梢性疼痛制御因子としてのマクロファージ。細胞 (2021) 10(8):1881.
PubMed Abstract|RefRef Full Text|Google Scholar
Rivat C, Laboureyras E, Laulin JP, Le Roy C, Richebe P, Simonnet G. Non-nociceptive environmental stress induces hyperalgesia, not analgesia, in pain and opioid-experienced rat. 神経精神薬理学(2007)32(10):2217-28.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Reichling DB, Levine JD. 慢性疼痛における侵害受容器可塑性の重要な役割。トレンド神経科学(2009)32(12):611-8。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
プロラクチンによって誘発される性差のある痛みの軌跡は、痛みの消失に炎症反応を必要とする。脳行動免疫(2022)101:246-63. doi: 10.1016/j.bbi.2022.01.016
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Halade GV, Lee DH. 心臓修復と心不全における炎症と解決シグナル。EBioMedicine (2022) 79:103992. doi: 10.1016/j.ebiom.2022.103992.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yunna C, Mengru H, Lei W, Weidong C. Macrophage M1/M2 polarization. Eur J Pharmacol (2020) 877:173090. doi: 10.1016/j.ejphar.2020.173090.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージ分化の遺伝子制御ネットワークモデリングは、極性化状態の連続性仮説を裏付ける。Front Physiol (2018) 9:1659. 10.3389/fphys.2018.01659
PubMedアブストラクト|Google Scholar
Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M. The chemokine system in diverse forms of macrophage activation and polarization. トレンド免疫学 (2004) 25(12):677-86. doi: 10.1016/j.it.2004.09.015
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Van den Bossche J, Baardman J, Otto NA, van der Velden S, Neele AE, van den Berg SM, et al. ミトコンドリア機能障害は炎症性マクロファージの再分極を妨げる。セルレップ(2016)17(3):684-96. doi: 10.1016/j.celrep.2016.09.008
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージ極性と疾患制御。Int J Mol Sci (2021) 23(1):144.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bhattacharya S, Aggarwal A. M2マクロファージとリウマチ性疾患におけるその役割。Rheumatol Int (2019) 39(5):769-80. doi: 10.1007/s00296-018-4120-3.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
IL-4 switchches microglia/macrophage M1/M2 polarization and alleviates neurological damage by modulating the JAK1/STAT6 pathway following ICH. 神経科学(2020)437:161-71.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang X, Chen S, Lu R, Sun Y, Song T, Nie Z, et al. 脂肪由来幹細胞分泌エクソソームは、JAK/STAT6経路を介して、四肢虚血を起こした2型糖尿病マウスのマクロファージM2分極を促進し、血管新生を促進する。ヘリヨン (2022) 8(11):e11495. doi: 10.1016/j.heliyon.2022.e11495
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
JAK2/STAT3軸は、脳虚血/再灌流障害におけるミクログリア/マクロファージの分極化を仲介する。神経科学 (2022) 496:119-28. doi: 10.1016/j.neuroscience.2022.05.016
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
SOCS1の発現低下は、JAK1/STAT1経路を活性化し、マクロファージのM1型への分極化を促進する。Mol Med Rep (2017) 16(5):6405-11. doi: 10.3892/mmr.2017.7384.
PubMed Abstract|クロスリファレンス全文|Google Scholar
SENP1はSTAT3-SOCS3の負のフィードバックループを介してIFN-γ-STAT1シグナルを制御する。J Mol Cell Biol (2017) 9(2):144-53. doi: 10.1093/jmcb/mjw042.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
MSC分泌TGF-βは、Akt/FoxO1経路を介して、リポ多糖刺激マクロファージM2様分極を制御する。Stem Cell Res Ther (2019) 10(1):345. doi: 10.1186/s13287-019-1447-y
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
WDR74はTGF-β/Smad経路の活性化を促進し、マウスにおけるM2マクロファージ分極化と糖尿病性足潰瘍創傷治癒を促進する。細胞生物学 (2022) 39(4):1577-91. doi: 10.1007/s10565-022-09748-8
PubMed Abstract|クロスリファレンス全文|Google Scholar
GDF11は、TGFbetaR1/SMAD-2経路を標的とすることで、マクロファージのM1およびM2偏極を調節し、重症急性膵炎を改善する。この論文では、GDF11がTGFbetaR1/SMAD-2経路を標的とすることで、マクロファージM1およびM2の極性化を調節し、重症急性膵炎を改善することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
プロポフォールは、PPARγ/STAT3シグナルを介してマクロファージM2の極性化を促進することにより、腎虚血/再灌流障害を改善する。加齢(Albany NY)(2021)13(11):15511-22。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージ極性化機構のグローバルな特徴づけとM2型極性化阻害剤の同定。この論文では、マクロファージ極性化機構のグローバルな解明とM2型極性化阻害剤の同定を行った。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang S, Liu G, Li Y, Pan Y. 代謝リプログラミングは、腫瘍微小環境におけるマクロファージの分極化を誘導する。論文タイトル:Front Immunol(2022)13:840029.doi:10.3389/fimmu.2022.840029。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang F, Zhang S, Vuckovic I, Jeon R, Lerman A, Folmes CD, et al. 解糖刺激はM2マクロファージ分化の必要条件ではない。Cell Metab (2018) 28(3):463-75.e4. doi: 10.1016/j.cmet.2018.08.012
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Huang SC, Everts B, Ivanova Y, O'Sullivan D, Nascimento M, Smith AM, et al. Cell-intrinsic lysosomal lipolysis is essential for alternative activation of macrophages. Nat Immunol (2014) 15(9):846-55. doi: 10.1038/ni.2956.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wu、MM、Wang、QM、Huang、BY、Mai、CT、Wang、CL、Wang、TT、他:ディオシンは、マクロファージ分極を制御することにより、マウス潰瘍性大腸炎を改善する。また、その作用機序は、マクロファージ分極を制御することにより、潰瘍性大腸炎を改善することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
マクロファージ応答における代謝リプログラミング。バイオマーク研究(2021)9(1):1。
PubMedアブストラクト|Google Scholar
SENP1-Sirt3シグナルはM2マクロファージ極性化においてα-ケトグルタル酸産生を促進する。細胞内シグナル伝達はM2マクロファージの極性化においてα-ケトグルタル酸産生を促進する。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
α-ketoglutarate orchestrates macrophage activation through metabolic and epigenetic reprogramming. Nat Immunol (2017) 18(9):985-94. doi: 10.1038/ni.3796.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
神経損傷後の感覚神経節では、組織常在性のM2マクロファージが一次感覚ニューロンに直接接触する。J Neuroinflammation (2021) 18(1):227. doi: 10.1186/s12974-021-02283-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
後根神経節マクロファージは、神経障害性疼痛の発症と持続の両方に寄与する。Nat Commun (2020) 11(1):264. doi: 10.1038/s41467-019-13839-2
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
後根神経節CX3CR1発現単球/マクロファージは関節痛に寄与する。脳行動免疫(2022)106:289-306. doi: 10.1016/j.bbi.2022.09.008
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
マクロファージのアンジオテンシンII2型受容体が神経障害性疼痛を誘発する。Proc Natl Acad Sci U S A (2018) 115(34):E8057-E66. doi: 10.1073/pnas.1721815115
PubMed Abstract|クロスリファレンス全文|Google Scholar
van der Vlist M, Raoof R, Willemen H, Prado J, Versteeg S, Martin Gil C, et al. マクロファージはミトコンドリアを感覚ニューロンに転送し、炎症性疼痛を解決する。Neuron (2022) 110(4):613-26.e9. doi: 10.1016/j.neuron.2021.11.020.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Louiselle AE, Niemiec SM, Zgheib C, Liechty KW. マクロファージの分極化と糖尿病性創傷治癒。Doi:10.1016/j.trsl.2021.05.006。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hanani M, Spray DC. 神経系の機能と機能障害におけるサテライトグリアの新たな重要性。神経系の機能と機能障害におけるサテライトグリアの重要性の出現。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Niehaus JK, Taylor-Blake B, Loo L, Simon JM, Zylka MJ. 脊髄マクロファージは末梢傷害後の侵害受容過敏を解消する。Neuron (2021) 109(8):1274-82.e6. doi: 10.1016/j.neuron.2021.02.018.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
感覚ニューロンのmiR-21-5pを抑制すると、マクロファージにおけるTGFB関連経路の活性化を介して神経障害性アロディニアが回復する。J Clin Invest (2023) 133(11):e164472.
PubMed Abstract|クロスリファレンス全文|Google Scholar
CD8+T細胞由来のIL-13は、マクロファージIL-10を増加させ、神経障害性疼痛を改善する。JCI Insight (2022) 7(5):e154194. doi: 10.1172/jci.insight.154194.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
IL-4はM2マクロファージを誘導し、オピオイドを介した持続的鎮痛をもたらす。JCI Insight (2020) 5(4):e133093.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bang S, Xie YK, Zhang ZJ, Wang Z, Xu ZZ, Ji RR. GPR37はマクロファージの貪食と炎症性疼痛の解消を制御する。J Clin Invest (2018) 128(8):3568-82. doi: 10.1172/JCI99888.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kavelaars A, Heijnen CJ. 痛み解消の守護神としてのT細胞。トレンド医学(2021)27(4):302から13。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tao X, Lee MS, Donnelly CR, Ji RR. 神経調節、特殊化された自己解決促進メディエーター、および痛みの消失。神経治療学(2020)17(3):886-99.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
プラドJ、ウェスタリンクRHS、ポポフ-セレケティックJ、スティーン-ロウズC、パンディットA、フェルステーグS、他。人工サイトカイン融合タンパク質を用いた感覚ニューロンにおけるサイトカイン受容体のクラスタリングが、ユニークな疼痛解決経路を引き起こす。米国科学アカデミー紀要(2021年)118(11):e2009647118.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
インターロイキン4は、病的疼痛におけるM1マクロファージからのオピオイドペプチドの放出を誘導する。神経科学 (2021) 41(13):2870-82. doi: 10.1523/JNEUROSCI.3040-20.2021
パブコメ要旨|全文|Google Scholar
木口直之、小林恭子、雑賀文雄、坂口博之、前田高志、岸岡修一。末梢性インターロイキン-4は炎症性マクロファージ依存性神経障害性疼痛を改善する。痛み (2015) 156(4):684-93. doi: 10.1097/j.pain.000000000097
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージにおけるGPR37の活性化は、マウスの感染誘発敗血症および疼痛様行動に対する防御をもたらす。Nat Commun (2021) 12(1):1704. doi: 10.1038/s41467-021-21940-8
PubMed Abstract|クロスリファレンス全文|Google Scholar
インターロイキン10は、感覚ニューロンの過剰興奮性を逆転させることで、シスプラチンで誘発される疼痛過敏症を消失させる。痛み(2020)161(10):2344-52. doi: 10.1097/j.pain.00000000001921
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Krukowski K, Eijkelkamp N, Laumet G, Hack CE, Li Y, Dougherty PM, et al. CD8+ T細胞と内因性IL-10は、化学療法誘発性神経障害性疼痛の消失に必要である。J Neurosci (2016) 36(43):11074-83. doi: 10.1523/JNEUROSCI.3708-15.201.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヘモグロビンのスカベンジャー受容体CD163は、インターロイキン10の放出とヘムオキシゲナーゼ-1の合成を媒介する。(2004)94(1):119-26。doi: 10.1161/01.RES.0000109414.78907.F9
PubMed Abstract | CrossRef Full Text | Google Scholar
Proto JD, Doran AC, Gusarova G, Yurdagul A, Sozen E, Subramanian M, et al. Regulatory T cells promote macrophage efferocytosis during inflammation resolution. Immunity (2018) 49(4):666-77.e6. doi: 10.1016/j.immuni.2018.07.015.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
インターロイキン10は、ラット後根神経節ニューロンの電位依存性ナトリウムチャネルをダウンレギュレートする。この論文では、ラット後根神経節ニューロンの電位依存性ナトリウムチャネルをインターロイキン10がダウンレギュレートすることを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
疼痛における内因性オピオイドと外因性オピオイド。Annu Rev Neurosci (2018) 41:453-73. doi: 10.1146/annurev-neuro-080317-061522.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Smith EM, Morrill AC, Meyer WJ, Blalock JE. 白血球由来免疫反応性ACTHおよびエンドルフィンのコルチコトロピン放出因子誘導。Nature (1986) 321(6073):881-2.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Heijnen CJ, Kavelaars A, Ballieux RE. β-エンドルフィン:サイトカインと神経ペプチド。Immunol Rev (1991) 119:41-63. doi: 10.1111/j.1600-065X.1991.tb00577.x.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ヒトT細胞増殖および単球IL-6産生における内因性プロエンケファリンA由来ペプチドの役割。このような研究は、日本ではほとんど行われていない。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rittner HL, Brack A, Machelska H, Mousa SA, Bauer M, Schäfer M, et al. オピオイドペプチド発現白血球:同定、動員、および同時に増加する炎症性疼痛の抑制。麻酔科学 (2001) 95(2):500-8. doi: 10.1097/00000542-200108000-00036
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kavelaars A, Ballieux RE, Heijnen CJ. ヒト末梢血単核球による免疫反応性β-エンドルフィンのコルチコトロピン放出因子およびアルギニン・バソプレシン誘導性分泌におけるIL-1の役割。J Immunol (1989) 142(7):2338-42.
PubMed Abstract|Google Scholar
Pannell M, Labuz D, Celik MO, Keye J, Batra A, Siegmund B, et al. M2マクロファージの養子移入は、オピオイドペプチドを介して神経障害性疼痛を軽減する。J Neuroinflammation (2016) 13(1):262. doi: 10.1186/s12974-016-0735-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dalli J, Serhan C. Macrophage proresolving mediators-the when and where. Microbiol Spectr (2016) 4(3). doi: 10.1128/microbiolspec.MCHD-0001-2014.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Dalli J, Serhan CN. ヒト食細胞の特異的脂質メディエーターシグネチャー:マイクロパーティクルはマクロファージの排出を刺激し、プロ溶解メディエーターを刺激する。血液 (2012) 120(15):e60-72. doi: 10.1182/blood-2012-04-423525
パブコメ抄録|クロスリファレンス|Google Scholar
神経障害性疼痛における特異的なプロレゾルビングメディエーターの役割。Front Pharmacol (2021) 12:717993. 10.3389/fphar.2021.717993
PubMedアブストラクト|Google Scholar
Ji RR. 痛みとかゆみの制御のための解決薬理学としての特殊化されたプロ解決メディエーター。Annu Rev Pharmacol Toxicol (2023) 63:273-93. doi: 10.1146/annurev-pharmtox-051921-084047.
パブコメ抄録|クロスリファレンス全文|Google Scholar
陳G、張YQ、カドリYJ、セルハンCN、智RR。痛みにおけるミクログリア:痛みの発症と解消における有害な役割と保護的な役割。Neuron (2018) 100(6):1292-311. doi: 10.1016/j.neuron.2018.11.009.
PubMed Abstract|RefRef Full Text|Google Scholar
Sulciner ML, Serhan CN, Gilligan MM, Mudge DK, Chang J, Gartung A, et al. Resolvins suppress tumor growth and enhance cancer therapy. J Exp Med (2018) 215(1):115-40. doi: 10.1084/jem.20170681.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
リポキシンA4はミクログリアの活性化を抑制し、脊髄切断後の神経炎症と神経障害性疼痛を軽減する。J Neuroinflammation (2016) 13(1):75. doi: 10.1186/s12974-016-0540-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マレシン2は、好中球および単球の動員、侵害受容ニューロンTRPV1およびTRPA1の活性化、CGRP放出を阻害することにより、マウスにおいて鎮痛作用に特化した解離促進脂質メディエーターである。神経薬理学 (2022) 216:109189.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
レゾルビンD3は、マウスおよびヒトのTRPV1陽性ニューロンと乾癬の前臨床進行を制御する。この論文では、レゾルビンD3がマウスおよびヒトのTRPV1陽性ニューロンを制御し、乾癬の前臨床経過を制御することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マイクロRNAと痛み。鈴木博之:マイクロRNAと痛み. Adv Exp Med Biol (2015) 888:17-39.
PubMedアブストラクト|全文|Google Scholar
マクロファージ由来細胞外小胞は、USP5を介したHDAC2/NRF2軸を制御し、炎症性疼痛を改善する。FASEB J (2021) 35(9):e21332. doi: 10.1096/fj.202001185RR
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージ由来細胞外小胞のmicroRNA-216a担持による抗侵害受容作用。Am J Transl Res (2021) 13(4):1971-89.
PubMed Abstract|Google Scholar
炎症性疼痛の軽減におけるマクロファージ由来小細胞外小胞の治療および予防効果。脳行動免疫(2021)94:210-24. doi: 10.1016/j.bbi.2021.02.005
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vergara RC, Jaramillo-Riveri S, Luarte A, Moenne-Loccoz C, Fuentes R, Couve A, et al. The energy homeostasis principle: neuronal energy regulation drives local network dynamics generating behavior. Front Comput Neurosci (2019) 13:49. doi: 10.3389/fncom.2019.00049.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
van den Ameele J, Fuge J, Pitceathly RDS, Berry S, McIntyre Z, Hanna MG, et al. ミトコンドリア病では慢性疼痛が多い。神経筋疾患(2020)30(5):413-9. doi: 10.1016/j.nmd.2020.02.017
PubMed Abstract|クロスリファレンス全文|Google Scholar
炎症性疼痛および神経因性疼痛におけるミトコンドリアと感覚処理。この論文では、炎症性疼痛と神経障害性疼痛におけるミトコンドリアと感覚処理について解説している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
グッドDJ、モリバーDC。epac2によるミトコンドリア機能の制御は、急性炎症性痛覚過敏に寄与する。J Neurosci (2021) 41(13):2883-98. doi: 10.1523/JNEUROSCI.2368-20.2021.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Doyle TM, Salvemini D. ミニレビュー: ミトコンドリア機能障害と化学療法誘発性神経因性疼痛。神経科学レッツ(2021)760:136087。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
McCormick、Lowes DA、Colvin L、Torsney C、Galley HF。ミトコンドリアを標的とした抗酸化剤MitoVitEは、in vitroにおいてパクリタキセル誘発酸化ストレスとミトコンドリア損傷を制限し、ラット疼痛モデルにおいてパクリタキセル誘発機械的過敏症を制限する。Br J Anaesth (2016) 117(5):659-66. doi: 10.1093/bja/aew309.
PubMed Abstract|RefRef Full Text|Google Scholar
CX3CL1を介したマクロファージ活性化は、パクリタキセル誘発性DRG神経細胞アポトーシスおよび有痛性末梢神経障害に寄与した。脳行動免疫(2014)40:155-65. doi: 10.1016/j.bbi.2014.03.014
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
SRT1720 による SIRT1 活性化は、Drp1 を介したミトコンドリア分裂の阻害を介して骨癌性疼痛を軽減する。Biochim Biophys Acta Mol Basis Dis (2019) 1865(3):587-98. doi: 10.1016/j.bbadis.2018.12.017.
PubMed Abstract|RefRef Full Text|Google Scholar
Raymond MH, Davidson AJ, Shen Y, Tudor DR, Lucas CD, Morioka S, et al. Drosophila embryo development during macrophage efferocytosis in vivoのライブセルトラッキング。科学(2022)375(6585):1182-7.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
神経損傷による神経障害性疼痛のメカニズムとして考えられるM2様マクロファージによる排泄不全。Biochem Biophys Res Commun (2020) 525(1):216-23. doi: 10.1016/j.bbrc.2020.02.032
CrossRef 全文|Google Scholar
Del Sordo L, Blackler GB, Philpott HT, Riviere J, Gunaratnam L, Heit B, et al. Impaired efferocytosis by synovial macrophage in patients with knee osteoarthritis. Arthritis Rheumatol (2023) 75(5):685-96.
PubMed Abstract|RefRef Full Text|Google Scholar
楊L、鄭C、夏YF、戴Y、魏ZF。3,3'-ジインドリルメタンはマクロファージの排出を促進し、その後AhR/Nrf2/Arg-1を介したアルギニン代謝経路を介して内臓痛を緩和する。(1)マクロファージから分泌されるアルギニンは、マクロファージから分泌されるアルギニンの代謝経路を介し、マクロファージから分泌されるアルギニンの代謝経路を介し、内臓痛を緩和する。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Reinhold AK, Rittner HL. 末梢および中枢神経系におけるバリア機能-総説。Pflugers Arch (2017) 469(1):123-34. doi: 10.1007/s00424-016-1920-8.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
脊髄損傷における血液-脊髄関門: A review. J Neurotrauma (2021) 38(9):1203-24. doi: 10.1089/neu.2020.7413.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
末梢神経障害における血液-脊髄バリア破壊とペリサイト欠損。Ann N Y Acad Sci (2017) 1405(1):71-88. doi: 10.1111/nyas.13436.
PubMed Abstract|RefRef Full Text|Google Scholar
脊髄カンナビノイド受容体2の活性化は、骨がん疼痛に伴う知覚過敏を軽減し、血液脊髄関門の完全性を改善する。(1)骨髄性疼痛、(2)骨髄性疼痛、(3)骨髄性疼痛、(4)骨髄性疼痛、(5)骨髄性疼痛、(6)骨髄性疼痛。
PubMedアブストラクト|クロス全文|Google Scholar
C-X-Cモチーフケモカイン10は、血液脊髄関門の透過性を増加させることにより、神経障害性疼痛の発症に寄与する。論文名:C-X-C motif chemokine 10(C-X-Cモチーフ・ケモカイン10)は血液脊髄関門の透過性を高めることにより神経障害性疼痛の発症に寄与する。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
中崎真紀子、森田卓也、Lankford KL、Askenase PW、Kocsis JD. 間葉系間質細胞が放出する小細胞外小胞は、M2マクロファージを標的とし、TGF-βの上昇、微小血管の安定化、重症脊髄損傷のげっ歯類モデルにおける機能回復を促進する。細胞外小胞 (2021) 10(11):e12137.
パブコメ抄録|全文|Google Scholar
内皮乳酸は、M2様マクロファージの分極化を誘導することで、虚血からの筋再生を制御する。細胞代謝(2020)31(6):1136-53.e7. doi: 10.1016/j.cmet.2020.05.004
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
糖尿病性多発神経炎におけるクローディン-1および血管関連マクロファージ喪失による選択的血液-神経関門漏出。J Mol Med (Berl) (2021) 99(9):1237-50. doi: 10.1007/s00109-021-02091-1
PubMed Abstract|クロスリファレンス全文|Google Scholar
皮膚創傷治癒におけるマクロファージを介した炎症。細胞 (2022) 11(19):2953.
パブコメ抄録|全文|Google Scholar
GAS6の発現低下は滑膜マクロファージの排出を阻害し、肥満に伴う変形性関節症を促進する。論文タイトル:「肥満が変形性関節症を促進する」。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vincent TL. 変形性関節症における末梢痛メカニズム。疼痛(2020)161(サプリメント1):S138-S46.DOI:10.1097/j.pain.000000001923
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
変形性関節症の痛み。Int J Mol Sci (2022) 23(9):4642. doi: 10.3390/ijms23094642.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pazmino S, Verschueren P, Westhovens R. JAK阻害と早期RAにおける疼痛コントロールの聖杯。RMD Open (2022) 8(1):e002068. doi: 10.1136/rmdopen-2021-002068.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ウォルシュDA、マクウィリアムズDF。関節リウマチにおける痛みのメカニズム、影響、管理。Nat Rev Rheumatol (2014) 10(10):581-92. doi: 10.1038/nrrheum.2014.64.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
孫怡、鄒Z、姜Y. 変形性関節症との闘いにおける新たな標的:マクロファージの分極化。この論文では、変形性関節症に対する新たな標的として、マクロファージの極性化が挙げられている。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージ再分極を介した関節リウマチ治療のためのM2型エクソソームナノ粒子。この論文では、M2型エクソソームナノ粒子によるマクロファージ再分極を介した関節リウマチ治療について検討した。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
関節リウマチ滑膜炎におけるM1/M2マクロファージ分極の役割。この論文では、関節リウマチにおけるM1/M2マクロファージ極性化の役割を明らかにした。
PubMedアブストラクト|全文|Google Scholar
キーワード:痛み、M2マクロファージ、マクロファージ極性化、痛みのメカニズム、痛みの治療
引用 趙W、馬L、鄧D、張T、韓L、徐F、黄S、丁Yおよび陳X(2023)M2マクロファージ極性化:疼痛緩和における潜在的標的。Front. Immunol. 14:1243149.
受理された: 2023年6月20日;受理された: 2023年8月16日;
発行:2023年8月29日
編集者
Xiqun Chen、マサチューセッツ総合病院・ハーバード大学医学部、米国
査読者
トビー・K・アイゼンシュタイン、テンプル大学、米国
アレッサンドロ・レウティ、キャンパス・バイオ・メディコ大学、イタリア
Copyright © 2023 Zhao, Ma, Deng, Zhang, Han, Xu, Huang, Ding and Chen. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Xiangdong Chen, xdchen@hust.edu.cn
これらの著者は、本研究に等しく貢献し、筆頭著者である。
‡ORCID: Xiangdong Chen, orcid.org/0000-0003-3347-2947
免責事項:本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
喘息における脳反応:神経免疫クロストークによって媒介される「肺-脳」軸の役割
ヤオ・ワン、ヤー・クイ・モウ、ハン・ルイ・ワン、シャオ・ユー・ソン、シー・ズァン・ウェイ、チャオ・レン、シー・チェン・ソン
TNF受容体スーパーファミリーのシグナル伝達におけるクラスタリングの利点
エバ・S・ヴァナミー、デニス・L・ファウストマン
T細胞表面の事前組織化された景観
ユン・ユンミン
膀胱癌におけるビタミンAの洞察、腸内細菌叢への注目不足?
羅培岳、鄭立英、鄒俊栄、陳涛、鄒俊、李伟、陳琪、銭彪
ヘパリンはエクトヌクレオチドピロホスファターゼ/ホスホジエステラーゼ-1(NPP1)の強力な阻害剤である-癌の免疫療法の有望な標的である
ヴィットリア・ロペス、H. J. マクシミリアン・シュー、サラフディン・ミルザ、ヴィクトリア・J. ヴァーセン、ミヒャエル・S. シュミット、カタリーナ・シルヴェスター、リハム・M. イドリス、クリスチャン・レン、ラウラ・シェーケル、ジュリー・ペレティエ、ジャン・セヴィニー、アナマリア・ナッジ、ビョルン・シェフラー、サンヨン・リー、ゲルト・ベンダス、クリスタ・E. ミュラー
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
