
経腸ACE2の維持は1型糖尿病の糖尿病性網膜症を予防する
フリーアクセス研究論文
経腸ACE2の維持は1型糖尿病の糖尿病性網膜症を予防する
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.122.322003ss
ラム・プラサード
,
ジェイソン・L・フロイド
,
マリアナ・デュポン
,
アンジェラ・ハーバー
,
イヴォンヌ・アドゥ・アギェイワァー
,
ブライト アサレ=ベディアコ
,
ディビェンドゥ・チャクラボルティー
,
カーラ・キクラー
,
アーユーシュ・ロヘラ
,
セルジオ・リ・カルジ
,
レジーナ・ランメンデラ
,
ジャスティン・ライト
,
マイケル・E・ボールトン
,
ギャビン・Y・オウディット
,
モハン・K・ライザダ
,
ブルース・R・スティーブンス
,
李秋宏
と
マリア・B・グラント
Originally published30 Nov 2022https://doi.org/10.1161/CIRCRESAHA.122.322003Circulation Research. 2023;132:e1-e21
この記事の他のバージョン(複数可
アブストラクト
背景
我々は、ヒトおよび1型糖尿病(T1D)マウスにおいて、腸管バリア透過性、グルコースホメオスタシス、全身性炎症、糖尿病網膜症(DR)の進行に対する全身および腸管レニン・アンジオテンシン系の構成要素を調査した。
方法
DRを発症したT1D個体(n=18)と発症していない個体(n=20)およびコントロール(n=34)を対象に、腸管で制御される免疫系成分、腸管漏出マーカー(FABP2 [fatty acid binding protein 2] およびpeptidoglycan)、Ang II(angiotensin II)の変化について検討しました; 秋田県産マウスに、予防または介入として、ヒト化ACE2(アンジオテンシン変換酵素2)タンパク質(LP-ACE2)を発現するLactobacillus paracasei(LP)プロバイオティクスを経口投与した。小腸上皮細胞でヒトACE2を遺伝的に過剰発現させた秋田マウス(Vil-Cre.hAce2KI-Akita)についても同様に検討しました。T1D発症9ヶ月後、循環器、腸管、眼球のエンドポイントを評価した。
結果は以下の通り:
T1D被験者は、腸由来の循環免疫細胞(ILC1細胞)の上昇と腸管漏出マーカーの上昇を示し、これらは血漿中Ang IIおよびDR重症度と正の相関があった。LP-ACE2予防コホートと腸管ACE2の遺伝的過剰発現は、バリア統合性を維持し、炎症反応を抑制し、高血糖を改善し、DRの発症を遅らせた。グルコースホメオスタシスの改善は、腸MasRの活性化により、GSK-3β(グリコーゲン合成酵素キナーゼ-3β)/c-Myc(細胞性骨髄球腫症遺伝子)を介した腸内グルコース輸送体発現量の減少がもたらされた。LP-ACE2介入コホートでは、腸管バリアの完全性が改善され、DRが逆転しましたが、高血糖の改善は認められませんでした。これらのデータは、DRに対するLP-ACE2の有益な効果は、グルコースホメオスタシスの改善ではなく、ACE2の作用によるものであることを裏付けている。
結論
全身および腸管レニン-アンジオテンシン系の制御異常は、ヒト被験者において、腸管バリア透過性の悪化、腸管由来免疫細胞の活性化、全身炎症、およびDRの進行と関連していた。秋田県産マウスでは、腸管ACE2の発現を維持することでDRを予防・回復させ、糖尿病とDRにおける腸管レニン・アンジオテンシン系の多面的な役割を強調した。
図ダウンロード
パワーポイントのダウンロード
新規性・有意性
どのようなことが知られているのでしょうか?
全身性のレニン-アンジオテンシン系(RAS)機能障害とともに、小腸や網膜などの標的組織には、糖尿病で制御不能となる局所RAS系が存在する。
糖尿病で腸管アンジオテンシン変換酵素2(ACE2)が失われると、腸管透過性が高まり、全身的な炎症が起こる。
ACE2を発現するラクトバチルス・パラカゼイ(LP)-ACE2が、1型糖尿病(T1D)秋田マウスにおいて糖尿病性網膜症の進行を抑制することがこれまでに示されています。
この論文はどのような新しい情報を提供しているのでしょうか?
糖尿病網膜症を有するT1Dヒト被験者は、網膜症を有しない糖尿病患者や健常対照者と比較して、腸管透過性の増加や内毒素血症の血清マーカーに関連する全身性のRAS機能不全を示す。
糖尿病発症時にLP-ACE2を投与すると(Akita-ACE2、予防コホート)、核因子κB(NF-κB)の活性化を抑制することにより、腸管上皮および内皮のバリア障害を一部予防した、 と、GSK-3β(グリコーゲン合成酵素キナーゼ-3β)とc-Myc(細胞性骨髄球腫症腫瘍遺伝子)を介した腸管GLUT2(グルコース輸送体アイソフォーム-2)の発現減衰による高血糖の抑制が認められた。
糖尿病発症6カ月後のLP-ACE2投与(Akita-ACE2:介入コホート)では、腸管バリア機能障害と糖尿病性網膜症を回復させることができたが、腸管グルコースホメオスタシスには影響を与えなかった。
T1Dヒト被験者コホートにおいて、腸管バリア漏出と全身性内毒素血症は、全身性Ang II(アンジオテンシンII)レベルの上昇と糖尿病性網膜症の重症度と関連していました。我々は、秋田マウスの腸管RASシステムが、新たなメカニズムで全身のグルコースホメオスタシスを制御していることを明らかにした。LP-ACE2は、秋田マウスに典型的に見られる腸管上皮ACE2の喪失を抑制した。LP-ACE2は、Ang 1-7の生成を増加させ、MasRを活性化し、腸内のグルコーストランスポーターGLUT2の発現を減少させた。これにより、糖尿病が誘発する腸のグルコース吸収の増加が抑制された。糖尿病が6ヶ月間継続すると、LP-ACE2の投与により腸管バリア機能障害が改善され、糖尿病性網膜症が回復したが、高血糖は改善されなかった。これらの結果は、腸管RASの制御不全が全身性の炎症を悪化させ、糖尿病性網膜症の発症に寄与しているという主張の貴重な裏付けとなります。腸管ACE2を維持することで、上皮と内皮の完全性が維持され、腸が誘発する炎症が減少し、糖尿病性網膜症が予防または回復される。
本号では、P2参照
ファーストオーサーの紹介、P3参照
1型糖尿病(T1D)1 は、糖尿病患者の約10%が罹患しており、米国では340万人が罹患しています。1,2型糖尿病は、糖尿病網膜症、腎症、神経障害などの微小血管合併症や、心疾患、末梢血管疾患などの大血管疾患を引き起こす可能性があります3,4。糖尿病網膜症は、すべての微小血管合併症の中で最も一般的であり、大血管機能障害の強力な予測因子である5。
レニン・アンジオテンシン系(RAS)は、血行動態、細胞の成長・増殖、塩分保持・分泌、心血管リモデリングの主要な制御因子であり、循環する古典的RASによってグローバルに、またRAS成分の組織特異的制御によってローカルに支配されている6。ACE2は、Ang II(アンジオテンシンII)からAng 1-7(アンジオテンシン1-7)への触媒作用を担っており、RASの制御に不可欠である6。Ang IIとAng 1-7は、それぞれアンジオテンシン1型受容体(AT1R)とMAS受容体(MasR)の活性化を介してRASで相反する役割を果たす7。 -Ang IIによるAT1Rの活性化は、RASの血管拡張作用(主に血管収縮、肥大、線維化)をもたらし、一方、Ang 1-7によるMasRの活性化は、RASの血管保護作用(特に血管拡張、抗肥大・抗線維化)をもたらす7〜9。
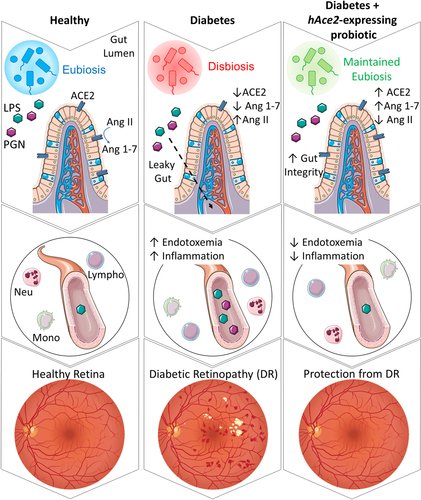
全身性RAS(内分泌系RAS)は、組織特異的に恒常性を維持するために局所的なRASネットワークと連携しており、糖尿病によってグローバルに変化するシステムにおいて、複雑なレイヤーを追加する結果となった。以前、我々は、網膜などの糖尿病ネズミの主要な標的組織でACE2が減少し、微小血管障害と網膜症が増加すること、また骨髄で骨髄症や全身の炎症に寄与することを示しました10。 -さらに、Ace2/y-Akitaマウスは、タイトジャンクションおよびアドヘレンスジャンクションタンパク質の発現低下により、腸管上皮および内皮の透過性が増加している。15 腸には独自のRAS軸があり、T1Dモデルである秋田マウスは、腸のディスバイオシスを示し、ACE2の遺伝子欠損(Ace2-/y-秋田)と複合すると悪化する。このような腸のバリア機能の低下により、ペプチドグリカンなどの腸内細菌抗原(GMA)の全身循環への移行が増加し、末梢に移動してTLR(toll-like receptor)の活性化により局所および全身の炎症が増強されます。 15 小腸は、体内のどの組織よりもACE2の発現量が多く、RASの直接的なメディエーターとして、また中性アミノ酸トランスポーターB0AT1(SLC6A19)の必要な輸送パートナーとして働く16、17;ACE2とB0AT1は腸細胞膜で二量体のヘテロ二量体を形成し、腸の局所インクレチン分泌を制御すると推測されている18。
本研究では、T1D被験者の末梢血シグネチャーが、全身のRASだけでなく、内因性の腸管免疫機能についても情報を提供することを示した。T1Dに起因する障害により、Th17とTregの間の調和的相互作用が損なわれ、これらの細胞の数が変化した。また、腸管透過性の循環的マーカーであるAng II、ペプチドグリカン、FABP2(脂肪酸結合タンパク質2)の血漿レベルが、健常対照者と比較してT1Dのヒト被験者で増加し、これらの測定値が糖尿病性網膜症の重症度に基づいてさらに変化することを示しました。我々は、ヒトACE2(hAce2)発現プロバイオティクス(Lactobacillus paracasei [LP]-ACE2)の投与または小腸上皮細胞におけるヒトhAce2の遺伝子過剰発現(Vil-Cre. hAce2KI-Akita )のいずれかによって秋田マウスのACE2の病的喪失を防ぐことにより、腸のバリア保全性が維持されることを示す。秋田マウスにおけるACE2持続の有益な効果をさらに裏付けるように、主要な血管修復細胞、骨髄性血管新生細胞、M2マクロファージの極性化の増加が観察された。高血糖は、秋田-ACE2予防コホートとVil-Cre.hAce2KI-秋田マウスの双方で減少した。重要なことは、この血清グルコース減少のメカニズムが、Ang1-7生成の増加とMasR活性化であり、GSK-3β(グリコーゲン合成酵素キナーゼ3β)/c-Myc(細胞性骨髄球腫症遺伝子)阻害を介して腸のGLUT2(グルコース輸送体アイソフォーム2)発現が減少したことを示していることであった。秋田の両コホートにおいて、ACE2:B0AT1の二量体化が進み、インクレチンの発現が増加したことにより、腸の炎症が減少したことが確認されました。秋田のACE2介入コホートでは、腸管バリア機能障害と糖尿病網膜症の回復が確認されたが、グルコースレベルの改善は見られなかった。これらの結果から、T1D患者は、末梢血中の自然リンパ系1型細胞(ILC1)の増加によって示されるように、Th17/Tregの調節障害と腸管免疫細胞の活性化によって特徴づけられることが示唆された。網膜症の重症度は、腸管バリア障害の悪化と強い相関があります。我々のマウス研究は、秋田マウスの腸内でACE2を持続的に発現させることが、腸管バリア機能と糖尿病性網膜症の転帰に多面的な利益をもたらすことを実証している。
研究方法
詳細な材料と方法14,15,19-28の情報は、補足資料に掲載されています。
データの入手方法
著者らは、すべての裏付けデータが論文およびその補足資料の中で利用可能であることを宣言する。
結果
T1D糖尿病患者における網膜症重症度と血清中の腸管バリア機能障害マーカーとの関連について
末梢血の免疫型分類では、T1D被験者では対照群と比較して、IL-1β+骨髄系細胞(CD15+;図1B)の増加を伴う顆粒球症(図1A)の存在が確認された。また、T1D被験者では、コントロールと比較して、循環B細胞(CD19+、図1C)および制御性T細胞(CD4+ CD25+FoxP3+、図1D)の増加、Th17細胞(CD4+RORγt+、図1E)の減少、腸由来ILC1(CD127+ CD161+CD117-CD294- )が増加しました(図1F)。さらに、免疫細胞集団とT1D被験者の人口統計学的特性との相関分析により、被験者のA1CとTreg (r=0.458; P=0.007) およびILC1 (r=0. 452; P=0.018) の間に統計的に有意な相関が認められた。 452、P=0.018)、IL-1β+骨髄系細胞は、血漿B細胞(r=0.486、P=0.041)、pDC(r=0.631、P=0.004)、Th17(r=0.691、P=0.002、図S1A)の存在量と統計的に有意な相関があることを示しています。これらの結果から、T1D患者は、自然免疫系と適応免疫系の両方の活性化と、Th17やILC1細胞などの腸に特異的な細胞タイプの調節を伴う、末梢免疫反応の誇張を示すことが裏付けられた。
図ダウンロード
パワーポイントのダウンロード
キャプション
このT1Dコホートを糖尿病性網膜症の有無と重症度に基づいて層別化すると、対照群と比較して、糖尿病性網膜症患者は、B細胞の主要な抗体産生サブタイプである循環血漿B細胞(CD19+CD24-CD38+)が増加する傾向が見られた(図S1B)。これは、網膜症がない人と比較して、NPDR被験者の末梢循環において、抗原提示細胞の自然エフェクターサブ集団である形質細胞性樹状細胞(pDC、CD303+)とTh17細胞の存在量の増加を伴っていた(図S1CおよびS1D)。糖尿病網膜症患者では、B細胞(図S1E)が高レベルで検出されたが、抗体産生を行わない静止メモリーB細胞は減少していた(図S1F)。これらの変化から、糖尿病網膜症を有するT1D患者は、抗体産生B細胞や形質細胞様樹状細胞の増加に加えて、Th17細胞の増加も含む強固な末梢血適応免疫細胞シグネチャーを示していることが示唆される。Th17細胞が血液中に存在する場合、これは恒常的な状態から病原性の状態へと移行したことを示すものである30-32。
次に、このT1Dコホートにおいて、RAS成分を調べた。糖尿病患者の血漿中ではAng IIレベルが上昇し、網膜症の重症度と相関していた(図1G)。血漿ペプチドグリカン(図1H)、FABP2(図1I)、LBP(リポポリサッカライド結合タンパク質;図S1G)は、糖尿病の存在下で増加し、糖尿病網膜症の重症度が悪化するとさらに増加した。T1D被験者では、血漿FABP2が血漿ペプチドグリカン(r=0.674;P<0.0001)、Ang II(r=0.54;P<0.0001)、LBP(r=0.812;P<0.0001)と有意な相関があり、血漿FABP2 (r=0. 548;P=0.0012)、ペプチドグリカン(r=0.466;P=0.0072)、LBP(r=0.652;P<0.0001)、Ang II(r=0.422;P=0.016) も被験者のA1Cと相関した(図S1A;表S2)。これらの結果から、糖尿病網膜症を有するT1D患者は、適応免疫系の活性化とTh17細胞の病的な活性化を示し、この反応がさらに腸管透過性の上昇とGMAの循環への移行を促し、この悪循環を永続させることが示唆されました。
秋田県産マウスにおけるLP-ACE2の視機能改善と糖尿病性網膜症病態の抑制効果について
腸管RASのアンバランスを防ぐことで腸管バリア透過性を改善し、網膜症の進行を防ぐことができるかどうかを調べるため、T1Dの遺伝子モデルマウスである秋田モデルを使用するようになりました。近年、治療用酵素を安全かつ効果的に腸管内腔に送り込み、吸収・利用させるベクターとして、生菌のプロバイオティクスが注目されている。このため、我々は有益な常在菌であるLPを利用することを選択しました。プロバイオティクスを9ヶ月間投与した後、犠牲にする前に、網膜機能と視力をそれぞれ網膜電図と視運動性眼振で評価しました。しかし、Akita-ACE2マウスでは、糖尿病に起因する視標b波の欠損が修正されました(図2B)。スコトピックa波およびb波の振幅は、秋田マウスと比較して秋田-ACE2マウスで増加した(図2Cおよび図2D)。視運動性眼振は、視覚の快適性を客観的に測定する指標であり34、視運動性眼振の測定値が低い者は視覚機能が低下していると推察される。その結果、視運動性眼振の空間周波数は、秋田-ACE2マウスでは秋田マウスと比較して増加しており、LP-ACE2投与による視力の向上が示唆されました(図2E)。
図ダウンロード
パワーポイントのダウンロード
キャプション
糖尿病網膜症による内皮機能障害と血管非灌流の特徴である細胞性毛細血管を網膜フラットマウントで定量化した。網膜中央部の毛細血管を定量化し、顕微鏡視野あたりの毛細血管の数として検出した。我々の以前の知見22を確認すると、秋田-ACE2マウスでは、秋田マウスと比較して、細胞性毛細血管の数が減少していた(図2Fおよび図2G)。これらのデータは、LP-ACE2投与が秋田マウスの網膜症進行遅延と関連していることを示し、T1Dにおける腸管ACE2喪失の予防が網膜症予防の新しいメカニズムになり得るという考えを支持するものである。
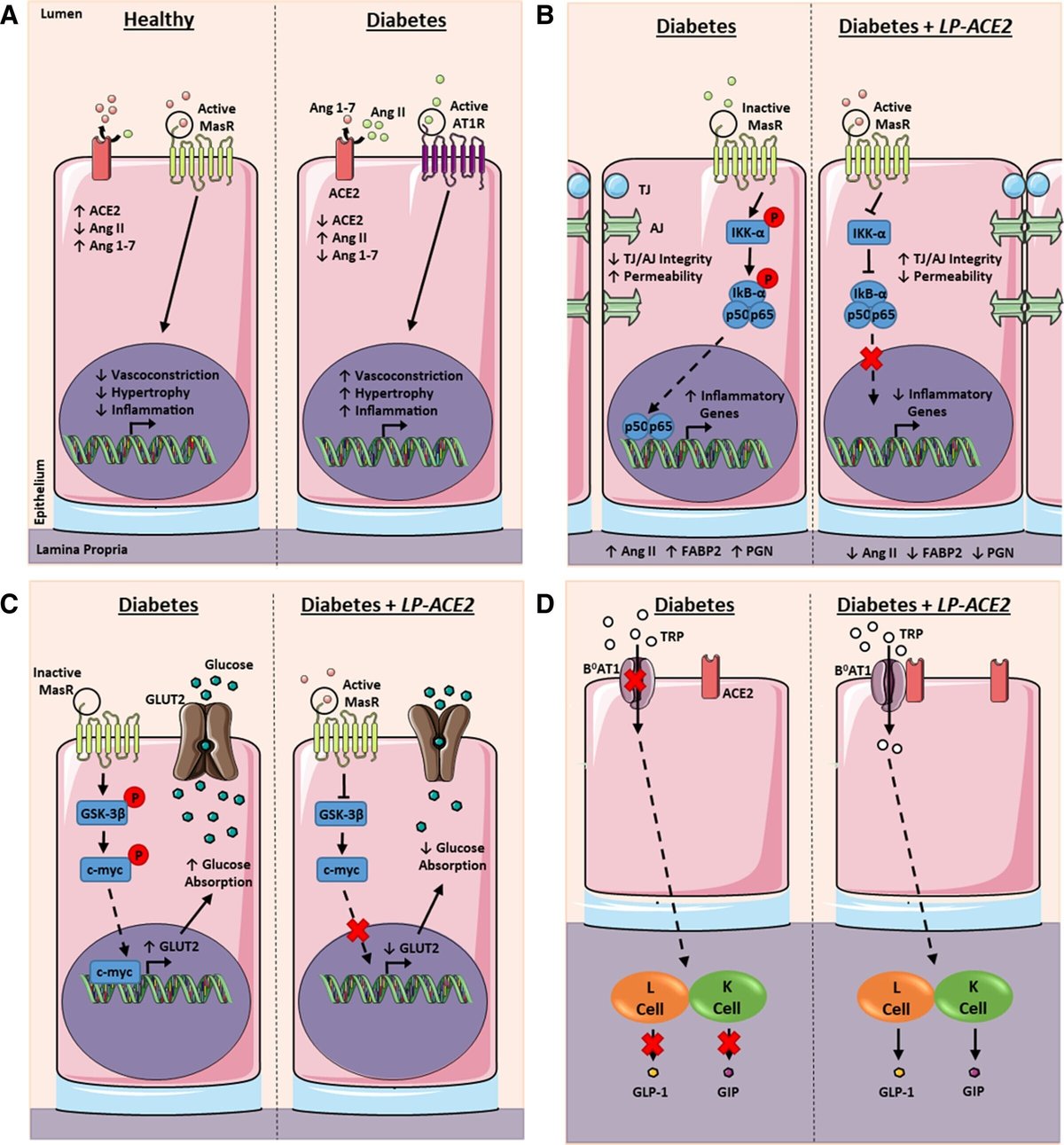
LP-ACE2の経口投与は糖尿病による劇症型RAS軸の活性化を抑制する
次に、LP-ACE2投与がT1D糖尿病における腸管RAS機能障害からの保護をもたらすかどうかを検討した。小腸の組織切片におけるACE2の免疫蛍光染色により、秋田マウスではACE2の消失が認められ、この効果は秋田-ACE2マウスでは認められなかった(図3Aおよび3B)。次に、LP-ACE2が提供するhACE2(ヒトACE2)が小腸内の局所的なRAS系を調節するかどうかを評価するために、腸管タンパク質抽出液中のRASファミリーメンバーのレベルをELISAで測定した。秋田-ACE2マウスでは、秋田マウスと比較してAng 1-7の発現が増加した(図3C)。AngⅡは秋田・ACE2マウスで秋田マウスに比べ発現が減少していた(図3D)。ACE2活性の代理指標であるAng II:Ang 1-7の比は、秋田マウスと比較して秋田-ACE2マウスで低く、秋田-ACE2マウスのACE2活性の上昇を支持した(図3E)。ACEおよびAT1Rのレベルは、秋田県の同腹子と比較して秋田-ACE2マウスで存在量が減少していた(図3Fおよび3G)。AT2Rの発現は、すべてのコホートで検出されなかった(図S2A)。秋田-ACE2マウスは、秋田マウスと比較して血漿ACE2の増加を示し、LP-ACE2投与による全身および局所的な血管保護RAS軸への有益な移行を支持した(図3H)。
図をダウンロード
パワーポイントのダウンロード
キャプション
LP-ACE2の効果は、腸内細菌叢の組成を変えることによってはもたらされない
タンパク質治療のベクターとして生きた細菌のプロバイオティクスを使用するという本質的な性質を考慮すると、LP-ACE2の慢性的な投与は、消化管のコロニー形成と腸内細菌叢の組成/機能の変化をもたらす可能性があると考えられます。そこで、LP-ACE2がもたらす効果が、腸内細菌叢の改変によるものかどうかを明らかにしたいと考えました。その結果、LP-ACE2の投与により、秋田県および野生型(WT)マウスと比較して、Faithの系統的多様性指数は軽度上昇したものの、観察された種の数、シャノンの多様性指数、Pielouの均等性は傾向的に増加するのみであることがわかりました(図S2B~S2E)。コホート間の微生物群集組成の違いを明らかにするため、糞便サンプルの16S rRNAシーケンスから得られた重み付きUniFrac距離のクラスタリングを、教師なしと教師ありの両方の方法、Principle Coordinate Analysis(PCoA)35とPartial Least-Squares Discriminant Analysis(PLS-DA)分析36によってそれぞれ実施しました。PCoAによる教師なしクラスタリングでは、3つのコホート間で明確なクラスタは見つかりませんでした(PERMANOVA P=0.248)。しかし、PLS-DAによる教師ありクラスタリングでは、各微生物群のコミュニティ構造について明確なクラスタを生成しました(図3Iおよび3J)。これらのデータから、教師ありクラスタリングによって決定された各コホートの微生物叢のコミュニティ構造には小さな違いがあるものの、コホートの微生物叢間の総体的な違いは、PCoAによって観察されたように、互いに異なるグループとみなすほど広くないことがわかります。したがって、LP-ACE2マウスの有益な効果は、腸内細菌叢の組成を変化させることによって達成されたものではないと結論づけられました。次に、LP-ACE2を投与した秋田県産マウスの腸内バリア改善のメカニズムを解明することを目指しました。
LP-ACE2投与により、秋田県産マウスの腸管バリアが維持された
次に、LP-ACE2が接合タンパク質の発現に与える影響を調べるため、小腸の免疫蛍光染色を実施した。上皮タイトジャンクションタンパク質zonula occludens 1(ZO-1)、上皮アドヘレンスジャンクションタンパク質p120-cateninおよびβ-cateninは、秋田の同腹子に比べ秋田-ACE2マウスでは発現が増加した(図4A〜4D)。内皮透過性の上昇に伴って上昇するタンパク質である血漿レーマ小胞関連タンパク質1(PV-1)37は、秋田マウスと比較して秋田-ACE2マウスでは減少した(図4Aおよび4E)。
図ダウンロード
パワーポイントのダウンロード
キャプション
腸のバリア機能は、上皮単層に挟まれた杯細胞によるムチンの産生と密接に関連している38。杯細胞が産生するムコ多糖に結合する色素Alcian blueで腸管切片を免疫組織化学的に染色した結果39、秋田-ACE2マウスが秋田マウスに比べて杯細胞の数が増加していることを確認した(図4Aおよび4F)。また、腸粘膜の健康状態を示す小腸内のジアミンオキシダーゼ活性も、LP-ACE2処理後に増加した(図4G)。
腸バリアの完全性をさらに立証するために、腸の透過性の循環マーカーであるFABP2(図S3A)およびZonulin(図S3B)を測定し、秋田マウスと比較して秋田-ACE2マウスの血漿中で減少していることを示した。血漿中のペプチドグリカンは、秋田-ACE2マウスでは秋田の対応するマウスと比較して低く、WTマウスのそれと変化はなかった(図4H)。
LP-ACE2は、糖尿病性腸管で減少し、増加すると腸管バリア統合性を改善できることを以前に示した免疫集団である骨髄性血管新生細胞(MAC;図S3C)の腸内レベルを増加させました15。これらのデータを総合すると、T1D発症時にLP-ACE2を摂取し9ヶ月間の期間を通して継続摂取すると、糖尿病によく見られる腸管バリア統合性の病的喪失を防ぎ、健康な腸の解剖学および機能の両方の特性を維持しながら粘膜衛生度を保つことができます。その結果、これらのマウスは、腸管透過性マーカーおよび腸内細菌由来のGMAの血漿中濃度が低下していることが確認されました。
LP-ACE2が腸の炎症を抑える
次に、Akita-ACE2マウスが腸の炎症を抑制しているかどうかを調べました。正規の核因子κB(NF-κB)シグナルの活性化は、腸バリアの安定性を低下させ、腸管透過性の増加40-42、グルコーストランスポーター発現の増加をもたらすことが示されている43。したがって、腸のNF-κBシグナルの阻害は、秋田マウスの腸バリアの完全性とグルコースホメオスタシスに対する LP-ACE2 の有益な効果に寄与すると考えられた。
LP-ACE2を介したACE2補充が腸のNF-κB活性化を低下させるかどうかを判断する際、秋田-ACE2マウスの腸組織溶解液では、秋田の対応するマウスと比較して細胞質IKK-α(阻害性κBキナーゼ-α)の割合に変化がないことがわかった(図5Aおよび5B)。NF-κBの活性化に伴いプロテオソーム的に分解されるタンパク質であるIκB(阻害性κBキナーゼ)44とNF-κB p50(サブユニットタンパク質50)の細胞質存在量は、秋田マウスと比較して秋田-ACE2マウスで増加した;秋田マウスと比較してNF-κB p65(サブユニットタンパク質65)の細胞質比率に差異は認められなかった(図5A、5Cから5E)。NF-κB複合体の活性化により、NF-κBサブユニットp50およびp65は核に移動し、炎症性遺伝子の転写因子として作用する45。秋田・ACE2マウスにおけるNF-κB活性化の阻害を確認するために、腸組織溶解液の核画分中のNF-κBサブユニットの存在量を測定した。その結果、NF-κB p50およびNF-κB p65の核内割合は、秋田県産マウスと比較して有意に減少していた(図5F〜5H)。さらに、抗炎症性M2マクロファージの存在量は、秋田マウスと比較して、秋田-ACE2マウスで増加していることがわかった(図5I)。これらのデータは、T1Dに関連するRAS機能障害が秋田マウスの小腸内でNF-κBシグナルの活性化を増加させ、LP-ACE2投与がそれを抑制するという考えを支持するものである。
図ダウンロード
パワーポイントのダウンロード
キャプション
NF-κBは、小腸内の多数の炎症性サイトカインおよび抗炎症性サイトカインの発現を制御することが示されている46。そこで、小腸内の炎症性サイトカインの存在量をELISAで評価した。秋田・ACE2マウスでは、腸内のIL-1β(インターロイキン1β)、IL-2、IL-6、IL-17、IFNγ(インターフェロンγ)の存在量が減少し、抗炎症サイトカインであるIL-12p40とIL-22の存在量は増加しました。しかし、秋田-ACE2マウスでは、秋田マウスと比較して、腫瘍壊死因子α(TNFα)、IL-10、トランスフォーミング成長因子β(TGFβ)に違いは見られなかった(表S4)。対照的に、秋田マウスは、IL-1β、IL-2、IL-6、IL-17、IFNγ、およびTNFαの増加を示し、抗炎症性サイトカインIL-10、IL-12p40、IL-22、およびTGFβの存在量が減少する(Table S4)。これらのデータは、LP-ACE2の投与が秋田マウスの小腸内の炎症を抑制し、T1Dにおける小腸の健康と機能の向上に寄与するという考えを支持するものである。
LP-ACE2はACE2:B0AT1を介したインクレチンの分泌を促進する
インクレチンは、腸において直接的な抗炎症作用を有する47-50。したがって、観察された抗炎症反応に寄与している可能性があるかどうかを検討する。インクレチンの分泌は、ナトリウム共役型中性アミノ酸トランスポーターであるB0AT1によって支配されている。B0AT1は、トリプトファン、グルタミン、その他の中性アミノ酸の腸管内腔からの吸収を制御している。ACE2は、in vitroで腸管上皮の頂膜に安定化したヘテロ二量体([ACE2:B0AT1]2)を形成し、B0AT116、57、58の腸上皮細胞輸送をシャペロンすることが示されている16、18、59。ACE2:B0AT1によるトリプトファンのナトリウム共役輸送は、腸内分泌K細胞およびL細胞によるインクレチンのグルカゴン様ペプチド1(GLP-1)およびグルコース依存性インスリントロピックポリペプチド(GIP)の放出にそれぞれ信号を与える60、61)。我々は糖尿病小腸において、腸内ACE2発現が持続するLP-ACE2投与がB0AT1発現持続につながることを提案した。WTおよび秋田・ACE2マウスでは、ACE2、B0AT1およびACE2:B0AT1二量体の発現が強固であったのに対し、秋田マウスではACE2発現、B0AT1発現および小腸上皮細胞表面のACE2:B0AT1二量体化が低下した(図6A〜図6C)。ACE2:B0AT1二量体化の増加で予想されるように、腸内のインクレチンGLP-1およびGIPの存在量は、WT対応マウスと比較して、Akita-ACE2マウスでは増加し、秋田マウスでは減少した(図6Dおよび6E)。秋田-ACE2は、WTマウスと同等の血漿中GLP-1およびGIPを呈した。これらのデータは、LP-ACE2によって生成されたACE2が、糖尿病によるACE2の喪失から腸上皮を保護し、腸細胞の健康を維持するのに十分であるという考えを支持するものであった。T1D存在下でACE2:B0AT1が二量体化し、その結果、GLP-1とGIPの濃度が上昇した。したがって、我々が観察した抗炎症作用は、我々が観察したインクレチンの増加に一因があるのかもしれない。しかし、我々は次に、インクレチンがパラクリン(抗炎症)作用と内分泌(グルコース調節)作用のどちらで作用しているのかを調べようとした。
図ダウンロード
パワーポイントのダウンロード
キャプション
LP-ACE2投与による秋田県産マウスの高血糖の抑制について
秋田-ACE2マウスの血漿中のグルコース濃度は、秋田マウスよりも低かった(図S4A)。秋田-ACE2マウスはWTマウスと比較して血糖値の有意な上昇が認められたものの、高血糖の程度は糖尿病領域(>250mg/dL;図S4A)とみなされるほど高くはなかった。過去3ヶ月間の血糖値の指標である糖化ヘモグロビンは、秋田-ACE2マウスでは秋田マウスと比較して有意に低く、WTマウスと有意差はなかった(図S4B)。これらのデータは、LP-ACE2がT1Dマウスの血糖コントロールを改善するという極めて新規な知見を示すものである。
LP-ACE2が秋田マウスの血糖値を改善するメカニズムを調べるため、膵臓ホルモンであるインスリンと、循環系で安定した状態を保つプロインスリンの切断断片であるC-ペプチドの血漿レベルを調べました。秋田-ACE2マウスの血漿インスリン濃度は、WTマウスと比較して低下し、秋田マウスよりも低い値であった(図S4C)。秋田マウスおよびAkita-ACE2マウスの両方において、血漿C-ペプチドはWTマウスよりも低かった(図S4D)。インスリンを介したグルカゴン産生の島内抑制の喪失/不在のため、グルカゴンレベルは秋田マウスで高かった。62,63 秋田-ACE2マウスは秋田マウスと比較して、同様のレベルのグルカゴンを示した(図S4E)。これらのデータから、LP-ACE2投与による血糖値およびHbA1cに対する有益な効果は、膵島細胞のインスリンまたはグルカゴン産生の調節とは無関係であることが示唆され、LP-ACE2によるグルコース恒常性への恩恵は腸に内在する可能性が高いという我々の考えを支持します。また、インクレチン産生によって刺激される主要な血清ホルモンであるインスリンとグルカゴンに変化が見られなかったことから、LP-ACE2投与によって観察された抗炎症効果には、インクレチンの増加が寄与していると結論づけられました。このマウスはT1Dであったため、分泌されたインクレチンが膵臓の機能に影響を与えることができなかったことは驚くことではありません。そこで、LP-ACE2が秋田県産マウスの腸管グルコースホメオスタシスを改善する潜在的な分子メカニズムをさらに解明することを目的としました。
LP-ACE2は腸管グルコーストランスポーターの発現を低下させる
腸は食事によるグルコース吸収の主要な場所である。LP-ACE2投与に伴い、腸管上皮のグルコーストランスポーターの発現に変化が生じる可能性がある。一方、A-779 と DX600 を用いて MasR と ACE2 の活性を薬理学的に阻害すると、グルコースの吸収が増加した64。そこで、LP-ACE2 の投与が、腸管グルコーストランスポーターである SGLT1 (sodium-dependent glucose transporter 1) と GLUT2 の発現に影響するかどうかを検討した。腸管タンパク質の溶解液とELISAを用いて、SGLT1(図S4F)の発現が秋田-ACE2マウスでは秋田マウスと比較して低下していることを見出した。また、ウェスタンブロットにより、秋田-ACE2マウスでGLUT2が同様に減少していることを確認した(図S4GおよびS4H)。
腸管SGLT1およびGLUT2の発現量減少のメカニズムを明らかにするために、in vitroでグルコーストランスポーターの転写を調節することが示されているGSK3β/c-Mycについて検討した65, 66。実験コホートの腸管タンパク質溶解物を用いて、細胞質および核タンパク質画分のウェスタンブロット分析を実施した。GSK-3βおよびGSK-3β-pS9の細胞質存在量は、秋田-ACE2コホートでは秋田グループと比較して減少し、c-Mycの核発現も同様に減少した(図S4G、S4IからS4K)。これらのデータは、Ang 1-7の産生増加によるMasRの活性化が、Akita-ACE2マウスにおいてGSK3β/C-Mycの発現を低下させ、結果としてグルコーストランスポーターの発現が低下したことを示唆している。
小腸上皮細胞におけるhAce2の遺伝的過剰発現は、秋田マウスのグルコースホメオスタシスの改善と腸内炎症の抑制を示す
次に、ACE2過剰発現の第二のモデルにおいて、これらの研究結果を確認することを試みた。CRISPR/Cas9およびCre-lox遺伝学を利用して、秋田マウスが腸上皮細胞内で特異的にヒトAce2遺伝子の遺伝子過剰発現を示す新規マウス系統を開発した(Vil-Cre.hAce2KI-秋田;図S5A)。LP-ACE2補充と同様に、Vil-Cre.hAce2KI-Akitaマウスは、糖尿病期間9ヶ月後に秋田マウスと比較して網膜フラットマウント内の細胞性毛細血管の存在量が減少し、糖尿病網膜症の発症における腸ACE2の役割を確認する(図S5B及びS5C)。
次に、Vil-Cre.hAce2KI-Akitaマウスの小腸内の血管保護性及び血管拡張性のRAS構成成分の存在量を評価した。Vil-Cre.hAce2KI-Akitaマウスは、腸上皮細胞内でACE2の持続的発現を示した(図S6AおよびS6B)。このことは、Ang 1-7の腸内存在量の増加とAng II、Ang II: Ang 1-7、ACE、およびAT1Rの存在量の減少につながった(図S6C〜図S6G)。全身性RASバランスの指標である血漿ACE2の存在量も同様に、Vil-Cre.hAce2KI-秋田マウスでは、秋田の同等品と比較して増加した(図S6H)。
腸ACE2の遺伝的過剰発現が腸バリアの完全性の増加をもたらすかどうかを評価する際に、Vil-Cre.hAce2KI-秋田マウスは、腸組織切片の免疫蛍光染色によって、ZO-1、p120-カテニン、βカテニンの発現の増加およびPV-1の低下を示し(図S7AからS7E)バリアの完全性の増加を裏付けることを見いだした。Vil-Cre.hAce2KI-秋田マウスは、秋田マウスと比較してアルシアンブルーの染色が増加し、小腸ジアミン酸化酵素の発現が増加し、粘膜の完全性が向上したことを支持した(図S7A、S7F、およびS7G)。ペプチドグリカン(図S7H)、FABP2(図S8A)およびゾヌリン(図S8B)の血漿存在量は、秋田マウスと比較してVil-Cre.hAce2KI-秋田マウスでは減少した。Vil-Cre.hAce2KIコントロールマウスにおける免疫蛍光染色の代表的な画像は、図S8Cに見ることができる。これらのデータを総合すると、LP-ACE2の外因性投与およびVil-Cre.hAce2KI-秋田マウスにおけるACE2の遺伝子過剰発現の両方が、タイトおよびアドヘレンス接合タンパク質の発現を増加させて粘膜の完全性を高めることによって、腸バリアの完全性を高める結果となったことが裏付けられる。
Vil-Cre.hAce2KI-秋田マウスは、秋田マウスと比較して血糖値およびHbA1cの低下を示したが、WTマウスと比較して上昇したままだった(図S9AおよびS9B)。血漿インスリン、C-ペプチド、およびグルカゴンの変化は、秋田マウスと比較して観察されなかった(図S9CからS9E)。Vil-Cre.hAce2KI-秋田マウスは、秋田マウスと比較して、統計的に有意なレベルではないが、上皮性B0AT1の発現およびACE2:B0AT1二量体化がわずかに増加していた(図S10A〜S10C)。しかし、インクレチンGLP-1およびGIPは、Vil-Cre.hAce2KI-秋田マウスの腸において、秋田県の対応するマウスと比較して増加した(図S10Dおよび図S10E)。Vil-Cre.hAce2KI-Akitaマウスの小腸溶解物は、ELISAによるSGLT1およびGLUT2の腸内発現の低下を示した(図S10FおよびS10G)。さらに、Vil-Cre.hAce2KI-Akitaマウスは、炎症性サイトカインの腸内存在量の減少と抗炎症メディエーターの代償的増加を示した(表S5)。これらのデータは、T1Dにおける代謝、機能、および炎症プロセスの維持における上皮性ACE2の役割を支持するものである。
網膜症を有する糖尿病マウスにLP-ACE2を投与すると、グルコースホメオスタシスを改善することなく網膜の病態が回復した
最後に、細胞性毛細血管の減少による糖尿病網膜症病態の予防に対する LP-ACE2 の有益な効果が、腸管での ACE2 発現の維持によるものか、グルコースコントロールの改善によるものかを明らかにすることを目的としました。我々は、6ヶ月のT1Dを有する秋田県産マウスを用い、LP-ACE2を3ヶ月間経口投与する介入パラダイムを実施しました。これまでの研究と同様に、T1D発症9ヶ月目に秋田マウスを犠牲にし、腸管RASバランス、腸管バリアー、グルコースコントロール、網膜病変を評価しました。秋田-ACE2マウスでは、秋田マウスと比較して、腸内ACE2発現の有意な増加(図7Aおよび7B)、ならびに腸内Ang II(図7C)およびACE(図7D)の減少を見いだしました。さらに、小腸内のZO-1、p120-カテニンの発現の増加およびPV-1の発現の減少によって示されるように、腸バリアの完全性の増加を認めた(図S11AからS11D)。秋田-ACE2マウスは、秋田マウスと比較して、血漿FABP2(図7E)およびゾヌリン(図S11E)が減少したが、血漿ペプチドグリカン(図S11F)は減少しなかった。予防パラダイムでLP-ACE2を受けた秋田マウスとは異なり、介入コホートのものは、血糖値(図7F)またはHbA1C(図7G)に変化がないことによって観察されるように、グルコースホメオスタシスの改善を示さなかった。しかし、介入スキームでLP-ACE2を受けた秋田マウスは、網膜内の細胞性毛細血管の数の減少を示した(図7Hおよび図7I)。これらのデータから、糖尿病網膜症の進行に対するLP-ACE2の保護効果は、血糖コントロールの改善というよりも、腸内ACE2の持続的な発現によるRASの保護腕の活性化によってもたらされると考えられる。
図をダウンロード
パワーポイントのダウンロード
キャプション
ディスカッション
腸とその微生物叢は、代謝物組成、腸管透過性、および免疫応答の制御に影響を与えることにより、T1Dの疾患修飾因子となる可能性がある67,68。今回発表した研究の意義は、腸のRASが制御されないと、GMAが血漿中に移行することを実証したことにある。これらの細菌ペプチドは、TLRを介して内皮を活性化し、糖尿病網膜症を含む血管疾患69-72の病因に強く関与している炎症性内皮を作り出します。我々は、腸管バリアバイオマーカーを用いて、糖尿病患者における腸管バリア機能の喪失を証明した。この透過性の増加は、腸管由来の免疫細胞の活性化に関連していた。
T1Dの発症を促進する免疫反応の過敏化に関する多くの文献を考慮すると、腸内細菌叢と腸内の自然免疫系/適応免疫系の細胞との継続的かつ大規模な相互作用がT1Dとその合併症に寄与している可能性は非常に高いと思われます。これまでの研究と同様に、T1D患者はIL-1β+顆粒球の増加を伴う顆粒球減少を示し、これは循環GMAの増加に対する確立した反応であることが示された。重要なことは、腸内細菌叢の複雑さが顆粒球形成の程度に直接影響することであり、これはT1Dにおける微小血管合併症と関連している73-76。また、T1D被験者において、循環する抗体産生血漿B細胞の増加を検出した。全B細胞および血漿B細胞の割合の増加は、糖尿病網膜症の進行と関連していた。一方、休止期のメモリーB細胞は、糖尿病網膜症が進行した被験者では減少していた。B細胞量は血漿ペプチドグリカン量と正の相関があり、血漿B細胞は総B細胞と相関があり、T細胞を介した炎症を持続させる自己抗体や免疫複合体の産生により糖尿病合併症の悪化に関与することが知られています81。
糖尿病では、自己反応性CD4+およびCD8+サブセットの拡大やTregの寛容形成能の変化を通じて、T細胞の分布と表現型の異常がT1D病理の中心に位置している82。我々は、糖尿病網膜症の被験者において、Th17細胞の上昇とともに、T1D被験者の循環においてTregの存在量が増加することを発見した。さらに、網膜症コホートでは、循環樹状細胞の増加が観察された。樹状細胞は、T細胞をTreg、Th17、Th1、Th2細胞へと分化させ、炎症性サイトカインや抗炎症性サイトカインを産生する役割を担っています。血中に存在するTh17細胞は、恒常性から病原性へと変化していることを示している。30-32 Th17細胞は、自然免疫系と適応免疫系の接点にある。しかし、腸管Th17細胞は、多様なシグナルを細胞プログラムに統合することで、組織の恒常性を維持しながらも、病原性を持ち、組織炎症の主要なドライバーとなる。Th17細胞のディスバイオシス特異的な誘導は、腸管外の部位における疾患の悪化につながる。96 Th17細胞の活性化の悪化は、T1D95などの自己免疫疾患や血管炎症の発症や進行の原因となりうる。 -100 このように、我々の研究は、T1Dのヒト被験者における網膜症が、全身的なRASの調節障害と腸管透過性の重大な欠陥に関連しており、それが適応免疫(B細胞、Treg/Th17、DC)および自然免疫(顆粒球)の両方の成分の活性化と腸由来のILC1の変化を誘発することを裏付けています。
私たちの研究は、インクレチンの分泌におけるACE2の役割を強調しています。インクレチンは、免疫細胞の活性を調節することができます。GLP-1 の分泌は Th17 細胞の増殖を抑制し、炎症性サイトカインである IL-17、IL-22、インターフェロン IFN-γ の発現を減少させる可能性があります101 。また、Ex-4の投与は、心血管疾患の実験モデルにおいて、単球の接着を減少させた。
また、CD4 + T細胞はGLP1RとGIPRを発現し、それらの活性化はTh17/Treg細胞の分化と機能に影響を与えることから、インクレチンは適応免疫反応に有益な影響を与えることができます106。特に、リラグルチドは、マウスにGLP-1アナログを投与し、TregとCD8の共培養系でCD8 +増殖の減少が見られたように、Treg細胞の抑制機能を高めるようだ107。したがって、GLP-1の活性化は、Th17プログラムを抑制し、一方でTreg生成を促進するという二重機能を果たすと考えられる108。GIPシグナルを遮断するとTreg細胞が減少し、GLP-1シグナルを増加させるとTregが誘導され、Th17細胞は減少した。このように、LP-ACE2治療とVil-Cre.hAce2KI-Akitaの有益な効果の一部は、インクレチン分泌の増加によって媒介されることが示され、代謝効果のみならず、腸と全身の免疫機能を調節するインクレチンの新しい役割が示唆されました。
活性化した内皮細胞は自然免疫系のTLRを発現しており、免疫細胞の接着や炎症性サイトカインの発現を促進する。特に、ICAM-1の発現増加は、白血球の内皮への接着と経内皮ルートによる血管外遊出を促進し、糖尿病性網膜症の病態を加速させる。糖尿病発症時にプロバイオティクスであるLP-ACE2を経口投与すると、内皮、上皮、粘膜の複数のレベルで腸管バリアが維持され、粘膜の完全性、GMAの全身循環への移行抑制、小腸内でのNF-κB活性化の減少が見られた。LP-ACE2の補給は、腸のグルコース吸収を抑えることで秋田マウスのグルコースコントロールを改善し、RASを介したグルコースホメオスタシス調節の新しいin vivoメカニズムを特定した。
秋田マウスの腸管上皮細胞内に特異的にhAce2を過剰発現させるという腸管ACE2発現の遺伝子モデルを用いて、LP-ACE2研究から得られた知見を確認しました。秋田県産ACE2マウスとVil-Cre.hAce2KI-秋田県産マウスの両方が、ACE2:B0AT1の二量体化の増加とその後の小腸によるインクレチンの分泌を示した。GLP-1とGIPは小腸と血漿で検出されたが、インクレチンはインスリン分泌の増加やグルカゴン生成の減少といった典型的な内分泌機能とは関係なく、腸の炎症を抑制し、透過性を低下させることが確認された。
我々の知る限り、腸管バリアの障害が糖尿病網膜症の発症に関与し、T1D患者における網膜症の重症度と直接関連することは、これが初めてである。また、本研究は、ACE2およびB0ATの発現をin vivoで持続させるとインクレチンの放出が増加することを初めて示したものである。他の組織とは異なり、小腸のACE2は、B0AT1と複合化したヘテロ二量体(ACE2:B0AT1)2として特異的に存在し、低温電子顕微鏡を用いて決定された18。B0AT1は、Stevensによって最初に発見、特徴付けられた腸管頂膜Na+共役中性アミノ酸トランスポーターです52、54。健康な状態では、ACE2:B0AT1二量体複合体は、トリプトファンの取り込みを仲介する腸管トランスポーターであり、その結果、腸内分泌細胞の栄養センサーに信号を送り、GLP-1(L細胞)およびGIP(K細胞)の循環分泌を促進します60、61インクレチンはα細胞およびβ細胞を保護しますが、本研究では、インクレチン放出の際立った特徴は、腸炎を抑える効果やバリア保護によるものと考えられています。秋田犬マウスはインスリン不足であり、LP-ACE2を投与した秋田犬マウスはインスリン不足のままであるため、インクレチンの増加は膵臓のインスリン分泌に直接影響を与えず、むしろ腸の炎症を抑え、腸管漏出や全身性内毒素血症を減少させるだろう112。
これまで我々は、秋田マウス(Ace2-/y-Akita)におけるACE2の欠損が機能障害を悪化させ、ペプチドグリカンの全身循環への移行を促進し、網膜に移動して非正規TLR2-MyD88-ARNO-ARF6シグナルカスケードを活性化することを明らかにしてきました。その結果、血液網膜関門の透過性が高まり、秋田マウスの網膜病態は悪化する。本研究では、LP-ACE2およびVil-Cre.hAce2KI-Akitaを投与した秋田マウスは、細胞性毛細血管の減少によって評価される網膜症が軽減することを見いだしました13,22。ACE2の持続的な腸管発現(Vil-Cre.hAce2KI-Akita)またはLP-ACE2投与により、糖尿病による小腸上皮および内皮のタイトタンパク質(ZO-1)およびアドヘレンスジャンクション(p120-カテニン、βカテニン)の減少が抑制され、より無傷な腸管バリアが実現した。このことは、血漿中の腸管透過性マーカー、ジアミン酸化酵素活性、FABP2、ゾヌリン、ペプチドグリカンの減少によってさらに確認され、これらのコホートにおける腸管透過性の低下を裏付けるものである。
プロバイオティクスの経口投与によりACE2を導入したため、LP-ACE2の効果がACE2の分泌によるものであり、単にLPの存在や腸内細菌叢の変調によるものではないことを確認しました。各コホートのマウスの糞便サンプルの16S rRNA配列決定を行ったところ、秋田-ACE2マウスは、秋田のマウスと比較して腸内細菌叢の組成に変化を認めなかったことが判明しました。したがって、LP-ACE2投与による有益な効果は、プロバイオティクスそのものではなく、ACE2バイオアベイラビリティの増加によるものと思われます。
本研究には一定の限界がある。本研究は、T1Dの長期的な結果である糖尿病性網膜症を検討することを意図している。本研究ではインスリン感受性を直接測定していないが、MehayらはAng 1-7がインスリン抵抗性を改善することを明らかにしている114。ペプチドグリカンと全身性エンドトキシン血症の減少が全身性炎症を抑え、インスリン抵抗性を改善することを考えると115、ACE2発現が持続したコホートでは、対照となる秋田マウスに比べてインスリン感受性が向上し、我々が観察した糖恒常性改善に寄与すると推測された。今後の研究により、このような観察結果をさらに発展させる必要がある。
結論として、我々は、糖尿病性網膜症患者において、全身性RASが制御不能であることを示し、このことは、腸管バリアの破壊とGMAの上昇を伴うことを示した。これらのレベルは、糖尿病性網膜症の重症度に応じて上昇することから、糖尿病患者において腸管バリアの完全性を維持すれば糖尿病性網膜症および他の微小血管合併症を最小限に抑えることができると考えられる(図8)。我々は、小腸上皮細胞でhAce2を遺伝的に過剰発現させるか、hACE2発現プロバイオティクスを外因的に投与すると、上皮と内皮の両方のレベルで腸のバリア破壊を防ぎ、循環GMAを減少させて、全身性炎症を抑制することを明らかにしました。この有益な効果は、NF-κB p50/p65経路の腸内活性化を減少させることによって媒介されました。腸管ACE2の増加は、ACE2:B0AT1を介したインクレチン分泌を増加させ、腸の炎症および腸から循環へのグルコースの漏出を含む漏出を軽減する役割を果たした。グルコースホメオスタシスに対するLP-ACE2およびhACE2の遺伝子過剰発現の有益な効果は、Ang 1-7/MasR活性化により、腸管トランスポーターSGLT1およびGLUT2の発現が減少し、この効果はGSK3β/c-Myc発現が減少することにより促進されている可能性もあった。腸管Ang 1-7の調節は、糖尿病患者の微小血管合併症と代謝機能を改善する新しい戦略として浮上した。
図ダウンロード
パワーポイントのダウンロード
キャプション
記事情報
著者からの寄稿
R. Prasad 調査と概念化、執筆を行った。J.L.フロイドは、調査および概念化、執筆を行った。M. Dupont, Y. Adu Aggyeiwaah, B. Asare-Bediako, D. Chakraborty, K. Kichler, and A. Rohellaが調査を行った。Harbour 博士が査読と編集を行った。R. LammendellaとJ. Wrightは、方法論と調査に参加した。M.E. Boulton、G.Y. Oudit、M.K. Raizadaが執筆、査読、編集を行った。B.R. Stevensは、概念化、執筆、レビュー、編集を行った。Q. Liは、概念化、調査、執筆、レビュー、編集を行った。M.B. Grantは、コンセプト立案、監督、資金獲得、執筆、レビュー、編集を行った。
資金提供元
この研究は、M.E.Boultonへの国立衛生研究所助成金R01EY012601, R01EY028858, R01EY028037, R01EY025383, R01EY032753 によって支援されています。助成金;T32HL134640-01をM. Dupontに、T32HL105349をJ.L. Floydに、カナダ保健研究所(883612)および心臓・脳卒中財団(55542)をG. Y. Ouditに。Research to Prevent Blindnessの無制限助成金をUABのDepartment of Ophthalmology and Visual Sciencesに授与した。このプロジェクトは、NIH S10RR026887 instrumentation grant、National Eye InstituteからのP30EY003039 core grant、National Institute of Diabetes and Digestive and Kidney DiseasesからのP30DK079626 core grantにより支援されました。内容はあくまで著者の責任であり、必ずしもNational Institute of Diabetes and Digestive and Kidney DiseasesまたはNational Institutes of Healthの公式見解を表すものではありません。
補足資料
詳細な材料と方法
表S1および表S2
図S1〜S13
参考文献14,15,19-28
非標準的な略語と頭字語
エースツー
アンギオテンシンコンバーティングエンザイム2
デマンド・レスポンス
糖尿病性網膜症
ファブリープ2
脂肪酸結合蛋白質2
エッチエーシーツー
ヒトACE2
エルピー盤
パラカゼイ
RAS
レニンアンジオテンシン系
ティーワンディー
1型糖尿病
WT
野生型
情報開示 なし
脚注
*R. Prasad と J.L. Floyd は同等に貢献した。
補足資料は https://www.ahajournals.org/doi/suppl/10.1161/CIRCRESAHA.122.322003 でご覧いただけます。
資金源および開示事項については、e18ページを参照。
通信先 Maria B. Grant, MD, Heersink School of Medicine, University of Alabama at Birmingham, 1670 University Blvd, VH490, Birmingham, AL 35294, Ophthalmology and Visual Sciences, Department of Ophthalmology and Visual Sciences. 電子メール mariagrant@uabmc.edu
参考文献
1.アトキンソンMA、アイゼンバースGS、ミケルスAW. 1型糖尿病.Lancet. 2014; 383:69-82. doi: 10.1016/S0140-6736(13)60591-7CrossrefMedlineGoogle Scholar
2.Riddle MC, Herman WH. The cost of diabetes care-an elephant in the room.Diabetes Care. 2018; 41:929-932. doi: 10.2337/dci18-0012CrossrefMedlineGoogle Scholar
3.米国疾病管理予防センター. 全米糖尿病統計報告書、2020年。アトランタ、ジョージア州: 米国保健社会福祉省疾病管理予防センター; 2020.Google Scholar
4.Nathan DM; DCCT/EDIC Research Group. The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: overview.Diabetes Care. 2014; 37:9-16. doi: 10.2337/dc13-2112CrossrefMedlineGoogle Scholar
5.Antonetti DA、Klein R、Gardner TW. 糖尿病性網膜症.N Engl J Med. 2012; 366:1227-1239. doi: 10.1056/NEJMra1005073CrossrefMedlineGoogle Scholar
6.Fyhrquist F, Saijonmaa O. Renin-angiotensin system revisited.J Intern Med. 2008; 264:224-236. doi: 10.1111/j.1365-2796.2008.01981.xCrossrefMedlineGoogle Scholar
7.Patel VB, Zhong JC, Grant MB, Oudit GY. Role of the ACE2/Angiotensin 1-7 Axis of the Renin-Angiotensin System in Heart Failure.Circ Res. 2016; 118:1313-1326. doi: 10.1161/CIRCRESAHA.116.307708LinkGoogle Scholar
8.Penninger JM, Grant MB, Sung JJY. 腸内細菌叢、腸内炎症、コロナウイルス感染の調節におけるアンジオテンシン変換酵素2の役割.Gastroenterology.The role of angiotensin converting enzyme 2 in modulating gut microbiota, intestinal inflammation, and coronavirus infection. 2021; 160:39-46. doi: 10.1053/j.gastro.2020.07.067CrossrefMedlineGoogle Scholar
9.Rodrigues Prestes TR, Rocha NP, Miranda AS, Teixeira AL, Simoes ESAC. ACE2/Angiotensin-(1-7)/Mas receptor axisの抗炎症性:基礎および臨床研究からの証拠(Curr Drug Targets). 2017; 18:1301-1313. doi: 10.2174/1389450117666160727142401CrossrefMedlineGoogle Scholar
10.Figueiredo VP, Barbosa MA, de Castro UGM, Zacarias AC, Bezerra FS, de Sa RG, de Lima WG, Dos Santos RAS, Alzamora AC. 経口Ang-(1-7)の抗酸化作用は、インスリン経路とRAS成分を回復させ、ラットの心代謝障害を改善する.Oxid Med Cell Longev. 2019; 2019:5868935. doi: 10.1155/2019/5868935CrossrefMedlineGoogle Scholar
11.Dominguez JM, Hu P, Caballero S, Moldovan L, Verma A, Oudit GY, Li Q, Grant MB. Adeno-associated virus overexpression of angiotensin-converting enzyme-2 reverses diabetic retinopathy in type 1 diabetes in mice.Am J Pathol. 2016; 186:1688-1700. doi: 10.1016/j.ajpath.2016.01.023CrossrefMedlineGoogle Scholar
12.Jarajapu YPR, Bhatwadekar AD, Caballero S, Hazra S, Shenoy V, Medina R, Kent D, Stitt AW, Thut C, Finney EM, et al. ACE2/angiotensin-(1-7)/Mas receptor axis activation enhances the reparative function of dysfunctional diabetic endothelial progenitors.Diabetes. 2013; 62:1258-1269. doi: 10.2337/db12-0808CrossrefMedlineGoogle Scholar
13.Verma A, Shan Z, Lei B, Yuan L, Liu X, Nakagawa T, Grant MB, Lewin AS, Hauswirth WW, Raizada MK, et al. ACE2 と Ang-(1-7) confer protection against development of diabetic retinopathy.Mol Ther. 2012; 20:28-36. doi: 10.1038/mt.2011.155CrossrefMedlineGoogle Scholar
14.Duan Y, Beli E, Li Calzi S, Quigley JL, Miller RC, Moldovan L, Feng D, Salazar TE, Hazra S, Al-Sabah J, et al.Loss of angiotensin-converting enzyme 2 exacerbates diabetic retinopathy by promoting bone marrow dysfunction.Stem Cells. 2018; 36:1430-1440. doi: 10.1002/stem.2848CrossrefMedlineGoogle Scholar
15.Duan Y, Prasad R, Feng D, Beli E, Li Calzi S, Longhini ALF, Lamendella R, Floyd JL, Dupont M, Noothi SK, et al. Bone marrow-derived cells restore functional integrity of gut epithelial and vascular barriers in a model of diabetes and ACE2 deficiency.Circ Res. 2019; 125:969-988. doi: 10.1161/CIRCRESAHA.119.315743LinkGoogle Scholar
16.Stevens BR, Ellory JC, Preston RL. B(0)AT1 amino acid transporter complexed with SARS-CoV-2 Receptor ACE2 forms a heterodimer functional unit: in situ conformation using radiation inactivation analysis.Function (Oxf). 2021; 2:zqab027. doi: 10.1093/function/zqab027CrossrefMedlineGoogle Scholar
17.Fairweather SJ, Broer A, O'Mara ML, Broer S. Intestinal peptidases form functional complexes with the neutral amino acid transporter B(0)AT1.Biochem J. 2012; 446:135-148. doi: 10.1042/bj20120307CrossrefMedlineGoogle Scholar
18.Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for recognition of SARS-CoV-2 by full-length human ACE2.Science. 2020; 367:1444-1448. doi: 10.1126/science.abb2762CrossrefMedlineGoogle Scholar
19.Bugger H, Boudina S, Hu XX, Tuinei J, Zaha VG, Theobald HA, Yun UJ, McQueen AP, Wayment B, Litwin SE, et al. Type 1 diabetic akita mouse hearts are insulin sensitive but manifest structurally abnormal mitochondria that remain coupled though increased uncoupling protein 3.Diabetes. 2008; 57:2924-2932. doi: 10.2337/db08-0079CrossrefMedlineGoogle Scholar
20.Smokvina T, Wels M, Polka J, Chervaux C, Brisse S, Boekhorst J, van Hylckama Vlieg JE, Siezen RJ. Lactobacillus paracasei comparative genomics: towards species pan-genome definition and exploitation of diversity.PLoS One. 2013; 8:e68731. doi: 10.1371/journal.pone.0068731CrossrefMedlineGoogle Scholar
21.Sanders ME. 2015年のプロバイオティクス: その範囲と使用.J Clin Gastroenterol. 2015; 49:S2-S6. doi: 10.1097/MCG.000000000350CrossrefMedlineGoogle Scholar
22.Verma A, Xu K, Du T, Zhu P, Liang Z, Liao S, Zhang J, Raizada MK, Grant MB, Li Q. Expression of Human ACE2 in Lactobacillus and Beneficial Effects in Diabetic Retinopathy in Mice.Mol Ther Methods Clin Dev. 2019; 14:161-170. doi: 10.1016/j.omtm.2019.06.007CrossrefMedlineGoogle Scholar
23.Buford TW, Sun Y, Roberts LM, Banerjee A, Peramsetty S, Knighton A, Verma A, Morgan D, Torres GE, Li Q, et al. Angiotensin (1-7) delivered orally via probiotic, but not subcutaneously, benefits the gut-brain axis in older rats.Geroscience. 2020; 42:1307-1321. doi: 10.1007/s11357-020-00196-yCrossrefMedlineGoogle Scholar
24.Qi X, Pay SL, Yan Y, Thomas J, Lewin AS, Chang LJ, Grant MB, Boulton ME. RPE65をプログラムした骨髄由来細胞の全身注射は、慢性網膜変性の進行を防ぐ.Mol Ther. 2017; 25:917-927. doi: 10.1016/j.ymthe.2017.01.015CrossrefMedlineGoogle Scholar
25.Hammer SS, Vieira CP, McFarland D, Sandler M, Levitsky Y, Dorweiler TF, Lydic TA, Asare-Bediako B, Adu-Agyeiwaah Y, Sielski MS, et al. ファスティングとファスティングミミック治療がSIRT1/LXRαを活性化して糖尿病に起因する全身および微細血管機能障害を緩和させることDiabetologia. 2021; 64:1674-1689. doi: 10.1007/s00125-021-05431-5CrossrefMedlineGoogle Scholar
26.Bhatwadekar AD, Duan Y, Chakravarthy H, Korah M, Caballero S, Busik JV, Grant MB. Ataxia telangiectasia mutated dysregulation result in diabetic retinopathy.Stem Cells. 2016; 34:405-417. doi: 10.1002/stem.2235CrossrefMedlineGoogle Scholar
27.Leger H, Santana E, Beltran WA, Luca FC. Preparation of mouse retinal cryo-sections for immunohistochemistry.J Vis Exp. 2019;( 149):e59683.doi: 10.3791/59683CrossrefGoogle Scholar
28.Kansal V, Agarwal A, Harbour A, Farooqi H, Singh VK, Prasad R. Regular intake of green tea polyphenols suppresses the development of nonmelanoma skin cancer through mir-29-mediated epigenetic modification.J Clin Med. 2022; 11:398. doi: 10.3390/jcm11020398CrossrefMedlineGoogle Scholar
29.Beam CA, Beli E, Wasserfall CH, Woerner SE, Legge MT, Evans-Molina C, McGrail KM, Silk R, Grant MB, Atkinson MA, et al. Peripheral immune circadian variation, synchronisation and possible dysrhythmia in established type one diabetes.Diabetologia. 2021; 64:1822-1833. doi: 10.1007/s00125-021-05468-6CrossrefMedlineGoogle Scholar
30.Li S, Yin H, Zhang K, Wang T, Yang Y, Liu X, Chang X, Zhang M, Yan X, Ren Y, et al. Effector T helper cell populations are elevated in bone marrow of rheumatoid arthritis patients and correlate with disease severity.Sci Rep.2017; 7:4776. doi: 10.1038/s41598-017-05014-8CrossrefMedlineGoogle Scholar
31.Gartlan KH, Varelias A, Koyama M, Robb RJ, Markey KA, Chang K, Wilkinson AN, Smith D, Ullah MA, Kuns RD, et al. Th17 plasticity and transition towards pathogenic cytokine signature are regulated by cyclosporine after allogeneic SCT.Blood Adv. 2017; 1:341-351. doi: 10.1182/bloodadvances.2016002980CrossrefMedlineGoogle Scholar
32.Shi Y, Wang H, Su Z, Chen J, Xue Y, Wang S, Xue Y, He Z, Yang H, Zhou C, et al. Differentiation imbalance of Th1/Th17 in peripheral blood mononuclear cells might contribute to pathogenesis of Hashimoto's thyroiditis.Scand J Immunol. 2010; 72:250-255. doi: 10.1111/j.1365-3083.2010.02425.xCrossrefMedlineGoogle Scholar
33.Holopigian K, Seiple W, Lorenzo M, Carr R. A comparison of photopic and scotopic electroretinographic changes in early diabetic retinopathy.Invest Ophthalmol Vis Sci. 1992; 33:2773-2780.MedlineGoogle Scholar
34.Kretschmer F, Sajgo S, Kretschmer V, Badea TC. A system to measure the Optokinetic and Optomotor response in mice.J Neurosci Methods. 2015; 256:91-105. doi: 10.1016/j.jneumeth.2015.08.007CrossrefMedlineGoogle Scholar
35.Gower JC. 多変量解析で使用される潜在根とベクトル法のいくつかの距離特性.Biometrika. 1966; 53:325-338. doi: 10.2307/2333639CrossrefGoogle Scholar
36.Barker M, Rayens W. Partial least squares for discrimination.J Chemom. 2003; 17:166-173. doi: 10.1002/cem.785CrossrefGoogle Scholar
37.Bodor C, Nagy JP, Vegh B, Nemeth A, Jenei A, MirzaHosseini S, Sebe A, Rosivall L. Angiotensin II increases permeability and PV-1 expression of endothelial cells.Am J Physiol Cell Physiol.2012; 302:C267-C276. doi: 10.1152/ajpcell.00138.2011CrossrefMedlineGoogle Scholar
38.Ghosh SS, Wang J, Yannie PJ, Ghosh S. Intestinal barrier dysfunction, LPS translocation, and disease development.J Endocr Soc. 2020; 4:bvz039. doi: 10.1210/jendso/bvz039CrossrefMedlineGoogle Scholar
39.Thorpe D, Butler R, Sultani M, Vanhoecke B, Stringer A. Irinotecan-induced mucositis is associated with goblet cell dysregulation and neural cell damage in a tumour bearing DA rat model.Pathol Oncol Res. 2020; 26:955-965. doi: 10.1007/s12253-019-00644-xCrossrefMedlineGoogle Scholar
40.Al-Sadi R, Guo S, Ye D, Rawat M, Ma TY. TNF-alpha modulation of intestinal tight junction permeability is mediated by NIK/IKK-alpha axis activation of the canonical NF-kappaB pathway.Am J Pathol. 2016; 186:1151-1165. doi: 10.1016/j.ajpath.2015.12.016CrossrefMedlineGoogle Scholar
41.Luo H, Guo P, Zhou Q. Role of TLR4/NF-kappaB in damage to intestinal mucosa barrier function and bacterial translocation in rats exposed to hypoxia.PLoS One. 2012; 7:e46291. doi: 10.1371/journal.pone.0046291CrossrefMedlineGoogle Scholar
42.Chen S, Liu H, Li Z, Tang J, Huang B, Zhi F, Zhao X. Epithelial PBLD attenuates intestinal inflammatory response and improves intestinal barrier function by inhibiting NF-kappaB signaling.Cell Death Dis. 2021; 12:563. doi: 10.1038/s41419-021-03843-0CrossrefMedlineGoogle Scholar
43.Norlin S, Ahlgren U, Edlund H. Nuclear factor-{kappa}B activity in {beta}-cells is required for glucose-stimulated insulin secretion.Diabetes. 2005; 54:125-132. doi: 10.2337/diabetes.54.1.125CrossrefMedlineGoogle Scholar
44.Mathes E, O'Dea EL, Hoffmann A, Ghosh G. NF-κBはIkappaBalphaの分解経路を規定する.EMBO J. 2008; 27:1357-1367.doi: 10.1038/emboj.2008.73CrossrefMedlineGoogle Scholar
45.Vermeulen L, De Wilde G, Notebaert S, Vanden Berghe W, Haegeman G. Regulation of the transcriptional activity of the nuclear factor-kappaB p65 subunit.Biochem Pharmacol. 2002年; 64:963-970. doi: 10.1016/s0006-2952(02)01161-9CrossrefMedlineGoogle Scholar
46.Liu T, Zhang L, Joo D, Sun SC. 炎症におけるNF-κBシグナル.Signal Transduct Target Ther. 2017; 2:17023. doi: 10.1038/sigtrans.2017.23CrossrefMedlineGoogle Scholar
47.Lee YS, Jun HS. グルコースコントロールを超えたGLP-1ベースの治療法の抗炎症効果.Mediators Inflamm.The GLP-1-based therapy of Anti-inflammatory effects beyond glucose control. 2016; 2016:3094642. doi: 10.1155/2016/3094642CrossrefMedlineGoogle Scholar
48.Sazgarnejad S, Yazdanpanah N, Rezaei N. Anti-inflammatory effects of GLP-1 in patients with COVID-19.Expert Rev Anti Infect Ther. 2022; 20:373-381. doi: 10.1080/14787210.2021.1964955CrossrefMedlineGoogle Scholar
49.Bendotti G, Montefusco L, Lunati ME, Usuelli V, Pastore I, Lazzaroni E, Assi E, Seelam AJ, El Essawy B, Jang J, et al. The anti-inflammatory and immunological properties of GLP-1 receptor agonists.Pharmacol Res. 2022; 182:106320.doi: 10.1016/j.phrs.2022.106320CrossrefMedlineGoogle Scholar
50.Kodera R, Shikata K, Kataoka HU, Takatsuka T, Miyamoto S, Sasaki M, Kajitani N, Nishishita S, Sarai K, Hirota D, et al. Glucagon-like peptide-1 receptor agonist amelates renal injury through its anti-inflammatory action without lowering blood graucose level in a rat model of type 1 diabetes.Diabetologia.2011. 2011; 54:965-978. doi: 10.1007/s00125-010-2028-xCrossrefMedlineGoogle Scholar
51.Pan M, Stevens BR. 分化およびプロテインキナーゼCに依存したシステムBを介したアラニン輸送の制御.J Biol Chem. 1995; 270:3582-3587. doi: 10.1074/jbc.270.8.3582CrossrefMedlineGoogle Scholar
52.Stevens BR, Kaunitz JD, Wright EM. アミノ酸と糖の腸内輸送:膜ベシクルを用いた進歩.Annu Rev Physiol. 1984; 46:417-433. doi: 10.1146/annurev.ph.46.030184.002221CrossrefMedlineGoogle Scholar
53.Souba WW, Pan M, Stevens BR. ヒト腸管細胞コンフルエントモノレイヤーにおけるナトリウム依存性グルタミントランスポーターの動態.Biochem Biophys Res Commun. 1992; 188:746-753. doi: 10.1016/0006-291x(92)91119-bCrossrefMedlineGoogle Scholar
54.Pan M, Souba WW, Wolfgang CL, Karinch AM, Stevens BR. ヒト腸管Caco-2細胞における双性イオン性アミノ酸輸送系の翻訳後アラニントランス刺激.J Surg Res. 2002; 104:63-69. doi: 10.1006/jsre.2002.6406CrossrefMedlineGoogle Scholar
55.Kekuda R, Torres-Zamorano V, Fei YJ, Prasad PD, Li HW, Mader LD, Leibach FH, Ganapathy V. Molecular and functional characterization of intestinal Na(+)-dependent neutral amino acid transporter B0.Am J Physiol. 1997; 272:G1463-G1472. doi: 10.1152/ajpgi.1997.272.6.G1463CrossrefMedlineGoogle Scholar
56.Broer S. Apical transporters for neutral amino acids: physiology and pathophysiology.Physiology (Bethesda). 2008; 23:95-103. doi: 10.1152/physiol.00045.2007CrossrefMedlineGoogle Scholar
57.Andring JT, McKenna R, Stevens BR. 腸、腎臓、心筋細胞で仮発現したSARS-CoV-2受容体ACE2とADAM17との相互作用におけるアミノ酸トランスポーターB0AT1の影響。bioRxiv. 2020; doi: org/10.1101/2020.10.30.361873:1-12Google Scholar
58.Stevens BR. 腸、心筋細胞、腎臓におけるSARS-CoV-2およびB0AT1と複合化したACE2とTMPRSS2およびADAM17の相互作用の推定.bioRxiv. Preprint posted online November 1, 2020. doi: 10.1101/2020.10.31.363473CrossrefGoogle Scholar
59.Kozakov D, Hall DR, Xia B, Porter KA, Padhorny D, Yueh C, Beglov D, Vajda S. The ClusPro web server for protein-protein docking.Nat Protoc. 2017; 12:255-278. doi: 10.1038/nprot.2016.169CrossrefMedlineGoogle Scholar
60.Hashimoto T, Perlot T, Rehman A, Trichereau J, Ishiguro H, Paolino M, Sigl V, Hanada T, Hanada R, Lipinski S, et al. ACE2 links amino acid malnutrition to micro ecology and intestinal inflammation.Nature. 2012; 487:477-481. doi: 10.1038/nature11228CrossrefMedlineGoogle Scholar
61.Tolhurst G, Zheng Y, Parker HE, Habib AM, Reimann F, Gribble FM. グルタミンは、細胞質Ca2+とcAMPを上昇させることにより、グルカゴン様ペプチド-1分泌を誘発し、増強させる.Endocrinology. 2011; 152:405-413. doi: 10.1210/en.2010-0956CrossrefMedlineGoogle Scholar
62.Roder PV, Geillinger KE, Zietek TS, Thorens B, Koepsell H, Daniel H. The role of SGLT1 and GLUT2 in intestinal glucose transport and sensing.PLoS One. 2014; 9:e89977. doi: 10.1371/journal.pone.0089977CrossrefMedlineGoogle Scholar
63.Loo DF and Wright EM. Sugar transport across epithelia.Hamiliton KL, Devor DC, eds. In: 健康と病気における上皮のイオンチャネルとトランスポーター。Springer International Publishing; 2021.Google Scholar
64.Wong TP, Ho KY, Ng EK, Debnam ES, Leung PS. 1型糖尿病ラットの空腸腸細胞におけるACE2-ANG-(1-7)-Mas軸のアップレギュレーション:グルコース輸送への示唆.Am J Physiol Endocrinol Metab. 2012; 303:E669-E681. doi: 10.1152/ajpendo.00562.2011CrossrefMedlineGoogle Scholar
65.Fong MY, Wang SE. The exploits of cancer's greedy sweet-tooth.Cell Cycle. 2015; 14:1768-1769. doi: 10.1080/15384101.2015.1046786CrossrefMedlineGoogle Scholar
66.Cao H, Chu Y, Lv X, Qiu P, Liu C, Zhang H, Li D, Peng S, Dou Z, Hua J. GSK3 inhibitor-BIO regulates proliferation of immortalized pancreatic mesenchymal stem cells (iPMSCs).PLoS One. 2012; 7:e31502. doi: 10.1371/journal.pone.0031502CrossrefMedlineGoogle Scholar
67.Dedrick S, Sundaresh B, Huang Q, Brady C, Yoo T, Cronin C, Rudnicki C, Flood M, Momeni B, Ludvigsson J, et al. The role of gut microbiota and environmental factors in type 1 diabetes pathogenesis.Front Endocrinol(Lausanne). 2020; 11:78. doi: 10.3389/fendo.2020.00078CrossrefMedlineGoogle Scholar
68.Kostic AD, Gevers D, Siljander H, Vatanen T, Hyotylainen T, Hamalainen AM, Peet A, Tillmann V, Poho P, Mattila I, et al. The dynamics of the human infant gut microbiome in development and in progression toward type 1 diabetes.Cell Host Microbe. 2015; 17:260-273. doi: 10.1016/j.chom.2015.01.001CrossrefMedlineGoogle Scholar
69.Xiao W, Oldham WM, Priolo C, Pandey AK, Loscalzo J. Immunometabolic endothelial phenotypes: integrating inflammation and glucose metabolism.Circ Res. 2021; 129:9-29. doi: 10.1161/CIRCRESAHA.120.318805LinkGoogle Scholar
70.Sansbury BE, Spite M. Resolution of acute inflammation and role of resolvins in immunity, thrombosis, and vascular biology.Circ Res. 2016; 119:113-130. doi: 10.1161/CIRCRESAHA.116.307308LinkGoogle Scholar
71.Doran AC. 炎症の解決:アテローム性動脈硬化症への示唆.Circ Res. 2022; 130:130-148. doi: 10.1161/CIRCRESAHA.121.319822LinkGoogle Scholar
72.Grebe A, Hoss F, Latz E. NLRP3 inflammasome and IL-1 pathway in atherosclerosis.Circ Res. 2018; 122:1722-1740. doi: 10.1161/CIRCRESAHA.118.311362LinkGoogle Scholar
73.Nagai Y, Garrett KP, Ohta S, Bahrun U, Kouro T, Akira S, Takatsu K, Kincade PW. 造血前駆細胞上のToll様受容体が自然免疫系の補充を促す.Immunity. 2006; 24:801-812. doi: 10.1016/j.immuni.2006.04.008CrossrefMedlineGoogle Scholar
74.Takizawa H, Fritsch K, Kovtonyuk LV, Saito Y, Yakkala C, Jacobs K, Ahuja AK, Lopes M, Hausmann A, Hardt WD, et al. Pathogen-induced TLR4-TRIF innate immune signaling in hematopoietic stem cellsは増殖を促進するが競争適性を低下させるCell Stem Cell. 2017; 21:225-240.e5. doi: 10.1016/j.stem.2017.06.013CrossrefMedlineGoogle Scholar
75.Khosravi A, Yanez A, Price JG, Chow A, Merad M, Goodridge HS, Mazmanian SK. 腸内細菌は造血を促進して細菌感染を制御する.Cell Host Microbe. 2014; 15:374-381. doi: 10.1016/j.chom.2014.02.006CrossrefMedlineGoogle Scholar
76.Balmer ML, Schurch CM, Saito Y, Geuking MB, Li H, Cuenca M, Kovtonyuk LV, McCoy KD, Hapfelmeier S, Ochsenbein AF, et al. Microbiota-derived compounds drive steady-state granulopoiesis via MyD88/TICAM signaling.J Immunol. 2014; 193:5273-5283. doi: 10.4049/jimmunol.1400762CrossrefMedlineGoogle Scholar
77.Fisher BM, Smith JG, McCruden DC, Frier BM. ヒトインスリン依存型(1型)糖尿病におけるインスリン誘発性低血糖に対する末梢血細胞およびリンパ球亜集団の反応.Eur J Clin Invest. 1987; 17:208-213. doi: 10.1111/j.1365-2362.1987.tb01237.xCrossrefMedlineGoogle Scholar
78.Binet F, Cagnone G, Crespo-Garcia S, Hata M, Neault M, Dejda A, Wilson AM, Buscarlet M, Mawambo GT, Howard JP, et al. Neutrophil extracellular traps target senescent vasculature for tissue remodeling in retinopathy.Science. 2020; 369:eaay5356. doi: 10.1126/science.aay5356CrossrefMedlineGoogle Scholar
79.Vecchio F, Lo Buono N, Stabilini A, Nigi L, Dufort MJ, Geyer S, Rancoita PM, Cugnata F, Mandelli A, Valle A, et al; DRI_Biorepository Group; Type 1 Diabetes TrialNet Study Group; Manuela Battaglia. 前症状および症候性1型糖尿病の血液および膵臓における異常な好中球シグネチャー.JCI Insight. 2018; 3:e122146. doi: 10.1172/jci.insight.122146.CrossrefMedlineGoogle Scholar
80.Hazra S, Jarajapu YP, Stepps V, Caballero S, Thinschmidt JS, Sautina L, Bengtsson N, Licalzi S, Dominguez J, Kern TS, et al. Long-term type 1 diabetes influence haematopoietic stem cells by reducing vascular repair potential and increase inflammatory monocyte generation in a murine model.Diabetologia. 2013; 56:644-653. doi: 10.1007/s00125-012-2781-0CrossrefMedlineGoogle Scholar
81.Smith MJ, Simmons KM, Cambier JC. 1型糖尿病と糖尿病性腎臓病におけるB細胞.Nat Rev Nephrol. 2017; 13:712-720. doi: 10.1038/nrneph.2017.138CrossrefMedlineGoogle Scholar
82.Tsalamandris S, Antonopoulos AS, Oikonomou E, Papamikroulis GA, Vogiatzi G, Papaioannou S, Deftereos S, Tousoulis D. The role of inflammation in diabetes: current concepts and future perspectives.Eur Cardiol.2019; 14:50-59. doi: 10.15420/ecr.2018.33.1CrossrefMedlineGoogle Scholar
83.Yu X, Rollins D, Ruhn KA, Stubblefield JJ, Green CB, Kashiwada M, Rothman PB, Takahashi JS, Hooper LV. TH17細胞の分化は、概日時計によって制御されている.Science. 2013; 342:727-730. doi: 10.1126/science.1243884CrossrefMedlineGoogle Scholar
84.Wu C, Yosef N, Thalhamer T, Zhu C, Xiao S, Kishi Y, Regev A, Kuchroo VK. 誘導性塩感知キナーゼSGK1による病原性TH17細胞の誘導.Nature. 2013; 496:513-517. doi: 10.1038/nature11984CrossrefMedlineGoogle Scholar
85.Kleinewietfeld M, Manzel A, Titze J, Kvakan H, Yosef N, Linker RA, Muller DN, Hafler DA. 塩化ナトリウムは、病原性TH17細胞の誘導によって自己免疫疾患を駆動する.Nature. 2013; 496:518-522. doi: 10.1038/nature11868CrossrefMedlineGoogle Scholar
86.Hang S, Paik D, Yao L, Kim E, Trinath J, Lu J, Ha S, Nelson BN, Kelly SP, Wu L, et al. Bile acid metabolites control TH17 and Treg cell differentiation.Nature. 2019; 576:143-148. doi: 10.1038/s41586-019-1785-zCrossrefMedlineGoogle Scholar
87.Wu HJ, Ivanov II, Darce J, Hattori K, Shima T, Umesaki Y, Littman DR, Benoist C, Mathis D. Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cell.Immunity. 2010; 32:815-827. doi: 10.1016/j.immuni.2010.06.001CrossrefMedlineGoogle Scholar
88.Tan TG, Sefik E, Geva-Zatorsky N, Kua L, Naskar D, Teng F, Pasman L, Ortiz-Lopez A, Jupp R, Wu HJ, et al. Identifying species of symbiont bacteria from the human gut that alone, can induced intestinal Th17 cells in mice.Proc Natl Acad Sci USA. 2016; 113:E8141-E8150. doi: 10.1073/pnas.1617460113CrossrefMedlineGoogle Scholar
89.Wagner A, Wang C, Fessler J, DeTomaso D, Avila-Pacheco J, Kaminski J, Zaghouani S, Christian E, Thakore P, Schellhaass B, et al. Metabolic modeling of single Th17 cells reveals regulators of autoimmunity.Cell. 2021; 184:4168-4185.e21. doi: 10.1016/j.cell.2021.05.045CrossrefMedlineGoogle Scholar
90.Schnell A, Huang L, Singer M, Singaraju A, Barilla RM, Regan BML, Bollhagen A, Thakore PI, Dionne D, Delorey TM, et al. Stem-like intestinal Th17 cells give rise to pathogenic effector T cell during autoimmunity.Cell. 2021; 184:6281-6298.e23. doi: 10.1016/j.cell.2021.11.018CrossrefMedlineGoogle Scholar
91.Panduro M, Benoist C, Mathis D. Tissue Tregs.Annu Rev Immunol. 2016; 34:609-633. doi: 10.1146/annurev-immunol-032712-095948CrossrefMedlineGoogle Scholar
92.Lavin Y, Winter D, Blecher-Gonen R, David E, Keren-Shaul H, Merad M, Jung S, Amit I. Tissue-resident macrophage enhancer landscapes are shaped by the local microenvironment.Cell. 2014; 159:1312-1326. doi: 10.1016/j.cell.2014.11.018CrossrefMedlineGoogle Scholar
93.Lee YK, Menezes JS, Umesaki Y, Mazmanian SK. 腸内細菌に対する炎症性T細胞応答は実験的自己免疫性脳脊髄炎を促進する.Proc Natl Acad Sci USA. 2011; 108:4615-4622. doi: 10.1073/pnas.1000082107CrossrefMedlineGoogle Scholar
94.Krebs CF, Paust HJ, Krohn S, Koyro T, Brix SR, Riedel JH, Bartsch P, Wiech T, Meyer-Schwesinger C, Huang J, et al. Autoimmune renal disease is exacerbated by S1P-Receptor-1-dependent intestinal Th17 cell migration to the kidney.Immunity. 2016; 45:1078-1092. doi: 10.1016/j.immuni.2016.10.020CrossrefMedlineGoogle Scholar
95.Hou G, Bishu S. Th17 cells in inflammatory bowel disease: an update for the clinician.Inflamm Bowel Dis. 2020; 26:653-661. doi: 10.1093/ibd/izz316CrossrefMedlineGoogle Scholar
96.Robert M, Miossec P, Hot A. The Th17 pathway in vascular inflammation: culprit or consort?Front Immunol. 2022; 13:888763. doi: 10.3389/fimmu.2022.888763CrossrefMedlineGoogle Scholar
97.Yan A, Zhang Y, Wang X, Cui Y, Tan W. Interleukin 35 regulates interleukin 17 expression and T helper 17 in patients with proliferative diabetic retinopathy.Bioengineered. 2022; 13:13293-13299. doi: 10.1080/21655979.2022.2080367CrossrefMedlineGoogle Scholar
98.リーGR. 自己免疫におけるTh17細胞対treg細胞のバランス.Int J Mol Sci. 2018; 19:730. doi: 10.3390/ijms19030730CrossrefMedlineGoogle Scholar
99.Huang J, Zhou Q. Gene biomarkers related to Th17 cells in macular edema of diabetic retinopathy: cutting-edge comprehensive bioinformatics analysis and in vivo validation.Front Immunol. 2022; 13:858972. doi: 10.3389/fimmu.2022.858972CrossrefMedlineGoogle Scholar
100.Marwaha AK, Crome SQ, Panagiotopoulos C, Berg KB, Qin H, Ouyang Q, Xu L, Priatel JJ, Levings MK, Tan R. Cutting edge: increased IL-17-secreting T cells in children with new-onset Type 1 diabetes.J Immunol. 2010; 185:3814-3818. doi: 10.4049/jimmunol.1001860CrossrefMedlineGoogle Scholar
101.Pujadas G, Varin EM, Baggio LL, Mulvihill EE, Bang KWA, Koehler JA, Matthews D, Drucker DJ. 腸管ホルモン受容体GIPRは、エネルギー利用可能性を造血の制御と結びつけている.Mol Metab. 2020; 39:101008. doi: 10.1016/j.molmet.2020.101008CrossrefMedlineGoogle Scholar
102.Shiraishi D, Fujiwara Y, Komohara Y, Mizuta H, Takeya M. Glucagon-like peptide-1 (GLP-1) induces M2 polarization of human macrophages via STAT3 activation.Biochem Biophys Res Commun. 2012; 425:304-308. doi: 10.1016/j.bbrc.2012.07.086CrossrefMedlineGoogle Scholar
103.Vinue A, Navarro J, Herrero-Cervera A, Garcia-Cubas M, Andres-Blasco I, Martinez-Hervas S, Real JT, Ascaso JF, Gonzalez-Navarro H. The GLP-1 analogue lixisenatide decreases atherosclerosis in insulin-resistant mouse by modulating macrophage phenotype.Diabetologia. 2017; 60:1801-1812. doi: 10.1007/s00125-017-4330-3CrossrefMedlineGoogle Scholar
104.Young GA. アンフェタミンによる脳波パワースペクトルへの影響とラットの運動活性との関係.Pharmacol Biochem Behav. 1988; 30:489-492. doi: 10.1016/0091-3057(88)90485-6CrossrefMedlineGoogle Scholar
105.Arakawa M, Mita T, Azuma K, Ebato C, Goto H, Nomiyama T, Fujitani Y, Hirose T, Kawamori R, Watada H. Glucagon-like peptide-1 receptor agonist, exendin-4 による内皮細胞への単球接着の抑制とアテローム性硬化病変の減衰.Diabetes. 2010; 59:1030-1037. doi: 10.2337/db09-1694CrossrefMedlineGoogle Scholar
106.Mantelmacher FD, Fishman S, Cohen K, Pasmanik Chor M, Yamada Y, Zvibel I, Varol C. Glucose-dependent insulinotropic polypeptide receptor deficiency leads to impaired bone marrow hematopoies.J Immunol. 2017; 198:3089-3098. doi: 10.4049/jimmunol.1601441CrossrefMedlineGoogle Scholar
107.Sha S, Liu X, Zhao R, Qing L, He Q, Sun L, Chen L. Effects of glucagon-like peptide-1 analog liraglutide on the systemic inflammation in high-fat-diet-induced mice.Endocrine. 2019; 66:494-502. doi: 10.1007/s12020-019-02081-xCrossrefMedlineGoogle Scholar
108.木村彰、岸本哲也. -6:Treg/Th17バランスの制御因子.Eur J Immunol. 2010; 40:1830-1835. doi: 10.1002/eji.201040391CrossrefMedlineGoogle Scholar
109.Barouch FC, Miyamoto K, Allport JR, Fujita K, Bursell SE, Aiello LP, Luscinskas FW, Adamis AP. 糖尿病におけるインテグリン介在性好中球接着と網膜白質化.Invest Ophthalmol Vis Sci. 2000; 41:1153-1158.MedlineGoogle Scholar
110.Kamiuchi K, Hasegawa G, Obayashi H, Kitamura A, Ishii M, Yano M, Kanatsuna T, Yoshikawa T, Nakamura N. Intercellular adhesion molecule-1 (ICAM-1) polymorphism is associated with diabetic retinopathy in Type 2 diabetes mellitus.Diabet Med. 2002; 19:371-376. doi: 10.1046/j.1464-5491.2002.00694.xCrossrefMedlineGoogle Scholar
111.Adamiec-Mroczek J, Oficjalska-Mlynczak J, Misiuk-Hojlo M. Proliferative diabetic retinopathy-The influence of diabetes control on the activation of the intraocular molecule system.Diabetes Res Clin Pract. 2009; 84:46-50. doi: 10.1016/j.diabres.2009.01.012CrossrefMedlineGoogle Scholar
112.Lebrun LJ, Lenaerts K, Kiers D, Pais de Barros JP, Le Guern N, Plesnik J, Thomas C, Bourgeois T, Dejong CHC, Kox M, et al. Enteroendocrine L cells sense LPS after gut barrier injury to enhance GLP-1 secretion.Cell Rep.2017; 21:1160-1168. doi: 10.1016/j.celrep.2017.10.008CrossrefMedlineGoogle Scholar
113.Priya G, Kalra S. A review of insulin resistance in type 1 diabetes: Is there a place for adjunctive metformin?.Diabetes Ther. 2018; 9:349-361. doi: 10.1007/s13300-017-0333-9CrossrefMedlineGoogle Scholar
114.Mehay D, Bingaman S, Silberman Y, Arnold AC. プロオピオメラノコルチンニューロンに局在するアンジオテンシン-(1-7)Mas受容体は、インスリン感受性をトニックに制御する.FASEB J. 2022; 36:1. doi: 10.1096/fasebj.2022.36.S1.0R781CrossrefGoogle Scholar
115.Lassenius MI, Pietilainen KH, Kaartinen K, Pussinen PJ, Syrjanen J, Forsblom C, Porsti I, Rissanen A, Kaprio J, Mustonen J, et al. Bacterial endotoxin activity in human serum is associated with dyslipidemia, insulin resistance, obesity, and chronic inflammation.Diabetes Care. 2011; 34:1809-1815. doi: 10.2337/dc10-2197CrossrefMedlineGoogle Scholar
このページのトップへ戻る
バック
サーキュレーション・リサーチ
AHAジャーナル
ジャーナル情報
対象者
特徴
リソースと教育
著者・査読者の方へ
ナショナルセンター
7272 Greenville Ave.
ダラス(TX 75231
カスタマー・サービス
1-800-aha-usa-1
1-800-242-8721
現地情報
お問い合わせ
会社概要
AHA/ASAについて
アニュアルレポート
AHA財務情報
採用情報
ショップ
心臓・脳卒中の最新ニュース
AHA/ASA Media Newsroom
グローバルプログラム
サイト紹介
アメリカ心臓協会
米国脳卒中協会
プロフェッショナルハートデイリー
その他のサイト
アクションを起こす
アドボケート
寄付する
プランニング・ギビング
ボランティア
ネット社会
AFibサポート
ガーデンコミュニティ
患者支援ネットワーク
私たちをフォローしてください:
プライバシーポリシー
著作権について
倫理方針
利益相反対策について
リンクポリシー
多様性
採用情報
サプライヤー&プロバイダー
アクセシビリティ宣言
州政府からの資金調達に関するお知らせ
© American Heart Association, Inc. 無断転載を禁じます。無許可での使用は禁止されています。アメリカ心臓協会は、501(c)(3)税制免除団体として認定されています。
*Red Dress ™ DHHS, Go Red ™; AHA; National Wear Red Day ®は登録商標です。
クッキーの設定を管理する
この記事が気に入ったらサポートをしてみませんか?
