2021年神戸大学 化学入試
ニヒコテです。一応化学系の大学院生です。
今回は昨年度の神戸大学の入試問題の解説をやっていこうと思います。いきなり旧帝大やるのがしんどかったので手慣らし程度に神戸大学を選んだだけです。私は神戸大学には1~2回くらいしか行ったことがありません。
Ⅰ(配点:25%)
大問4個の中で一番難しいと思います。反応速度と平衡定数に苦手意識がある学生も多いかと思うので致し方ないところもあります。
問1 条件よりv₁=k₁[I₂][H₂]=k₁×2.00×2.00=4.00k₁
HIの生成速度は1.60×10^4mol/(L・s)ですので、1.60×10^4=4.00k₁
k₁=2.0×10^3L/(mol・s)となります。
また、正反応の平衡定数をKとおくと、平衡状態では正反応と逆反応の速度は等しくなるのでv₁=v₂となります。
これより、K=[HI]^2/([I₂][H₂])=(v₂/k₂)/(v₁/k₁)=k₂/k₁、すなわちk₂=k₁/Kです。
実験3よりK=25ですので、k₂=2.0×10^3/25=8.0×10L/(mol・s)となります。
問2 実験2より、v₂=k₂[HI]^2=80x^2です。(k₂=80、[HI]=xですので)。
v₂はヨウ素の生成速度7.20×10^2mol/(L・s)と等しいので、
7.20×10^2=80x^2より、x=3.0mol/Lとなります。
問3 I₂の分子量は254ですから、762gのI₂のmolは762/254=3.0molと分かります。
また、H₂は1.01×10^5Pa・50L・303Kですので、H₂のmolをn(mol)とすると、気体の状態方程式より、
1.01×10^5×50=n×8.3×10^3×303より、n=2.0molとなります。
問4 やや難問です。
平衡状態に達するまでにI₂とH₂がともにy(mol)反応したとすると、残ったI₂は3.0-y(mol)、H₂は2.0-y(mol)となります。
また、この際に生成したHIは2y(mol)となります。温度が変わらなければ平衡定数は変わりませんから、平衡定数は25のままです。
これより、K=(2y/50)^2/{(3.0-y)/50×(2.0-y)/50}=25となります。
式を整理すると、21y^2ー125y+150=(3yー5)(7yー30)=0より、y=5/3,30/7です。
yはy>0かつ2.0-y<0、すなわち0<y<2.0ですから、y=5/3となります。
これより、I₂:4/3mol、H₂:1/3mol、HI:10/3molですから、気体の合計molは5.0molとなります。
全圧をP(Pa)とすると、気体の状態方程式より、
P×50=5.0×8.3×10^3×1000だから、P=8.3×10^5Paとなります。
物質量の比と圧力の比は等しいので、H₂の分圧をP'とすると、
8.3×10^5:P'=5.0:1/3なので、P'≒5.5×10^4Paとなります。
問5 知識で解けます。全問正解したいところです。
実験1~4の結果から、温度が高いほどア:平衡定数が小さくなっていることより、平衡状態では、温度が高いほどイ:I₂およびH₂の濃度が増大し、ウ:HIの濃度が減少していることが分かる。よって、式①の正反応はエ:発熱反応である。
Ⅱ(配点:25%)
得点源です。全問正解してほしいものです。
問1 暗記推奨レベルの頻出化学反応式です。
2F₂+2H₂O→4HF+O₂となります。
問2 塩素を水に溶かした際の化学反応式は、Cl₂+H₂O→HCl+HClOです(これも頻出)。HClとHClOのClの酸化数はそれぞれ-1、+1となります。
よって、酸化数が大きい方の物質はHClO→次亜塩素酸で、酸化数は+1です。
問3 アルカン・アルケン・アルキンの中で臭素水を脱水できないものは不飽和結合を持たないアルカンのみです。
なのでアルカンであるC₂H₆を選べば正解です。
問4 ヨウ素I₂がヨウ化カリウム水溶液のI⁻に溶解すると、I₃⁻(三ヨウ化物イオン)となります。とりとり。
問5 暗記必須レベルの超重要な化学反応式です。
MnO₂+4HCl→MnCl₂+2H₂O+Cl₂となります。
問6 これを知らないと大学に行ってから困る。当然の知識ですので正解は必須です。
Aは水です。理由は塩化水素を取り除くためです。
Bは濃硫酸です。理由は水蒸気を取り除くためです。
問7 塩素はア:下方置換で採集します(中学校の知識)。
また、塩化ナトリウム水溶液から水酸化ナトリウムを工業的に生成する方法をイオン交換膜法(IEM法)といい、副産物として塩素と水素も発生します。
この際に用いるのはナトリウムイオンを移動させるためのイ:陽イオン交換膜です。
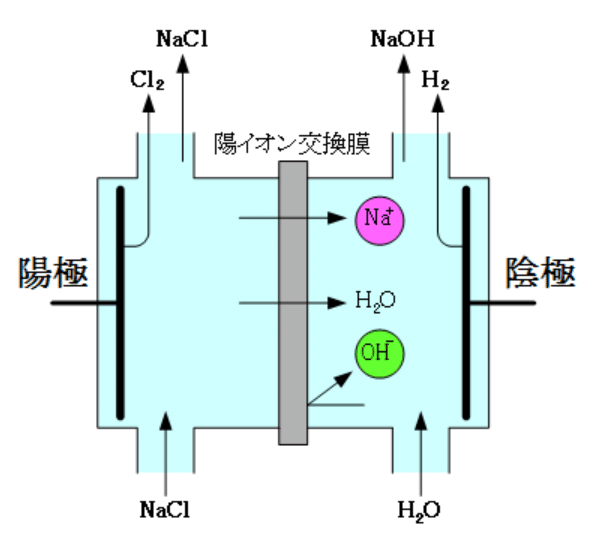
問8 上図より、陰極で水素、陽極で塩素が発生します。
なので陰極:2H₂O+2e⁻→H₂+2OH⁻、陽極:2Cl⁻→Cl₂+2e⁻です。
陰極で起こるのは還元、陽極で起こるのは酸化です。
問9 簡単な計算問題です。
水酸化ナトリウムの生成に関係するのはOH⁻です(Na⁺は陰極陽極で反応に携わらないので考える必要はありません)。
陰極の半反応式の係数より、e⁻:OH⁻=2:2=1:1です。
水酸化ナトリウムの式量は40ですから、電流を流した時間をx(秒)とすると、
{(2.00×x)/9.65×10^4}×1=0.800/40←800mg=0.800g より、x=9.65×10^2秒となります。
Ⅲ(配点:25%)
オゾン分解がしっかり分かっていればそこまで難しい問題ではありません。入試問題に一部訂正があり、I,J,Kは互いに異性体→I,J,Kは同じ分子式と直した上でお答え下さいとの事です(それ故問7は全員正解となりました)。
問1 ヨードホルムはCHI₃です。これ以上もこれ以下もありません。
問2 D,E,Fはいずれも銀鏡反応を示したわけですから、共通して含まれる官能基はアルデヒド基です。
問3 頻出の構造分析の問題です。
C,H,Oの存在比が与えられているので、それぞれを原子量で割ればよいので、C:H:O=(80.6/12):(7.5/1.0):(11.9/16)≒9:10:1となるので、組成式はC₉H₁₀Oです。
C₉H₁₀Oの分子量は134で、D.E.Fの分子量は134なので、求める分子式は組成式と同じC₉H₁₀Oとなります。
問4 Aの分子式はC₁₄H₂₀で、Dの分子量がC₉H₁₀Oです。
Aをオゾン分解(+O₂)することでDとGができるので、Gの分子式は、
C₁₄H₂₀+O₂-C₉H₁₀O=C₅H₁₀Oとなります。GとHは互いに異性体なので分子式は一緒です。
問5 Gはヨードホルム反応を示すので、H₃CーCOーRまたはH₃CーCH(OH)ーR(Rは炭化水素基)のどちらかの構造を内包するはずです。ですが、後者はC原子の数的に不可能(R→C₃H₅は不可能)なので今回は前者の構造の方が当てはまります。前者だとRにはC₃H₇が該当しますので、RはCH₃ーCH₂ーCH₂またはCH₃ーCH(CH₃)ーのどちらかとなればよいわけですから、答えは以下のようになります。
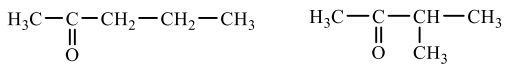
問6 Hはヨードホルム反応を示さないため、H₃CーCOーRまたはH₃CーCH(OH)ーR(Rは炭化水素基)の構造を中に含むことはありません。
また、銀鏡反応も示さないため、Hはケトンとなります。
よって、銀鏡反応を示さないケトンとして考えられる構造は以下の1つのみです。
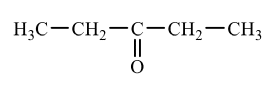
問7 D,E,Fはアルデヒド基とベンゼン環をもつ構造なので、C₉H₁₀OーC₆H₅ーCHO=C₂H₄。
このことからベンゼン環とアルデヒド基以外にはメチル基CH₃を2個持つことが分かります。D,E,Fの示性式はいずれもC₆H₃(CH₃)₂CHOとなります。
また、D,E,Fを酸化させると芳香族の酸化ですから、メチル基もアルデヒド基もカルボキシ基となりますので、I,J,Kの示性式はいずれもC₆H₃(COOH)₃となります。
D,E,F,I,J,KをNMR(核磁気共鳴)させると、ベンゼン環に直接結合していて互いに性質の異なるH原子は、Dは3種類、Kは1種類、それ以外は2種類のわけですから、DとKは以下のようになります。
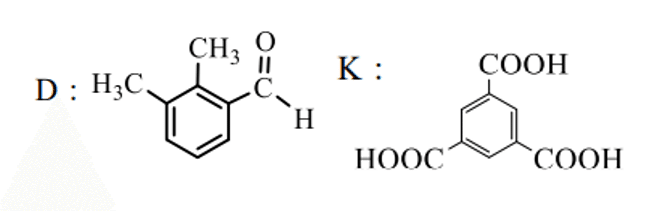
Kが分かればFも分かります。
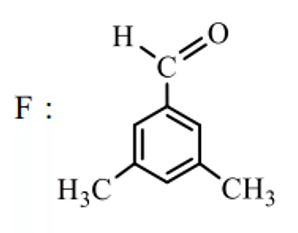
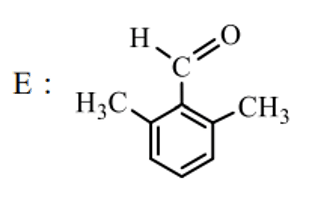
よって、Eは残った以下の構造となります。
Ⅳ(配点:25%)
問6・7はやや難問。それ以外は標準レベルです。ペプチドのアミノ酸配列は苦手な人が多いので是非ともアプローチ方法は押さえてほしいところ。
問1 いずれも知識で埋めることができます。
実験1:~、ペプチド②を構成するアミノ酸の側鎖R中のア:硫黄が反応して黒色沈殿が生じた。
実験2:各ペプチド水溶液に濃硝酸を加えて加熱したところ、ペプチド①と②の両方に含まれるアミノ酸の側鎖Rがもつイ:ベンゼン環がウ:ニトロ化されて黄色になり、~。
実験3:各ペプチドのエタノール溶液に触媒として少量の濃硫酸を加えて加熱し、エ:カルボキシ基のすべてをオ:エステル化したところ、すべてのペプチドで~。
実験6:ペンタペプチドのN末端のアミノ酸は、アミノ基をカ:ヒドロキシ基に置換すると乳酸になった。
実験1は硫黄の検出、実験2はキサントプロテイン反応、実験3は有機範囲のエステル反応、実験6は乳酸の構造CH₃ーCH(OH)ーCOOHを知っていれば簡単です。
問2 実験1より、硫黄があるのでペプチド②にシステイン(C)、また実験2よりベンゼン環があるのでペプチド②にチロシン(Y)が含まれていることが分かります。以上よりC・Yが正解です。
問3 ベンゼン環のH原子1個がニトロニウムイオン(NO₂)に変化するわけですから、分子量は1.0→46となるわけです。なので、n₁=46ー1.0=45となります。
問4 ヒドロキシ基はH原子1個を手放してO原子なり、これがヒドロキシ基COOHのOH部分と結びついてエステル結合(ーCOーOー)を形成するわけですから、分子量は16→44となるわけです。なので、n₂=44ー16=28となります。
問5 ペプチド③の場合、分子増加数はペプチド②の3倍だったので、エステル化が3か所で行われているわけです。
ペプチド②はシステインとチロシンと+αによるトリペプチドですので(実験4のビウレット反応より)、カルボキシ基は3個あり、うち2個はアミド結合形成のために消失するのでカルボキシ基は1個のみとなります。
ペプチド③はジペプチドですから、ペプチド③はペプチド②の3倍多くエステル化するためにはカルボキシ基を4個持たなければなりません(うち1個はアミド結合形成のために消失します)。
以上より、ペプチド③にはアスパラギン酸とグルタミン酸が含まれている(どちらもカルボキシ基を2個もつ酸性アミノ酸です)ということが分かります。
問6 ペプチド①はペプチド③同様、ジペプチドです。ペプチド③はアスパラギン酸とグルタミンⅢによるジペプチドで、ペプチド①とペプチド③の分子量の差が48ですので、ペプチド①の分子量は、
133+147ー18±48となります(ー18はアミド結合形成時の水の脱水分です)。
答えは310または214となりますが、ペプチド①はキサントプロテイン反応を示すため、チロシンを必ず含みます。
となると181(チロシンの分子量)+X(アミノ酸の分子量)-18=214→X=43となるものは存在しないため、ペプチド①の分子量は310となります。
ちなみに181+X-18=310→X=147ならグルタミン酸が該当します(これよりペプチドはグルタミン酸とチロシンによるジペプチドと分かります)。
問7 実験6にペンタペプチドのN末端のアミノ酸は、乳酸のヒドロキシ基をアミノ基に置換したものとあるので、ペンタペプチドの先頭はアラニンだと分かります。
ペプチド①はチロシン+グルタミン酸、ペプチド③はアスパラギン酸+グルタミン酸のジペプチドですので、このアラニンはトリペプチド②のシステイン+チロシン+αの+αに該当するアミノ酸だと分かります。
後は共通するチロシンとグルタミン酸を上手に組み合わせると、
アラニン(A)ーシステイン(C)ーチロシン(Y)ーグルタミン酸(E)ーアスパラギン酸(D)の順になります。
ペンタペプチドなのでアミノ酸は5個結合しているのですが、単純にトリペプチド1個とジペプチド2個を足し合わせるとアミノ酸は7個となってしまうので、共通しているアミノ酸同士を繋げて5個に納める必要があります。これは慣れないと中々難しいです。
次回は旧帝大の中で比較的良心的な名古屋大学の化学の入試問題です。お疲れさまでした!
この記事が気に入ったらサポートをしてみませんか?
