スパイクタンパクの毒性;スパイクタンパクはACE 2の抑制を介して血管内皮機能を損なう: Circulation Researchに掲載された論文から
コロナウイルスは血管を障害する事が知られていますが、スパイクタンパク単独でも同じ問題を起こします。コロナワクチンはスパイクタンパクを抗原として用いているため、コロナウイルスに類似した毒性を持つのです。この事については以前の記事内でも触れましたが、今回は再度その背景を説明していこうと思います。これにはミトコンドリアの働きが関係します。
ミトコンドリアは太古に細胞に寄生した好気性細菌の名残りです。ミトコンドリアの主な機能はATP (アデノシン三リン酸)の産生であり「酸素呼吸」はその副産物でもあります。ATPはいわば「生体のエネルギー源」のようなものです。人間を含む真核生物はミトコンドリアで酸素を用いる機構 (クエン酸回路+電子伝達系) により、嫌気呼吸と比べてはるかに効率よくATPを得る事ができます。細胞質での解糖系による嫌気性分解では1分子のグルコースから2分子のATPしか得られませんが、ミトコンドリアによる好気性分解によって1分子のグルコースから38分子のATPが合成できます。人間や動物が酸素呼吸できるのもミトコンドリアのおかげであり、ミトコンドリアは呼吸とATP産生という「生」に直結する働きを持つのです。
そして、ミトコンドリアのもう一つの大きな働きはアポトーシス (プログラム細胞死) の調節です。ミトコンドリアはアポトーシスのための自爆タンパクの貯蔵庫でもあり、ミトコンドリアの崩壊は細胞死にも繋がります。いわば細胞はその生と死をミトコンドリアという細胞内共生体に握られており、ミトコンドリアの好不調はすなわち細胞の生死に影響するのです。
以下はCirculation Researchに掲載された論文です。Leiらによる国際共同研究です。
SARS-CoV-2 スパイクタンパクは、ACE 2の抑制を介して内皮機能を損なう ACE 2のダウンレギュレーションによる内皮機能の低下
SARS-CoV-2 Spike Protein Impairs Endothelial Function via Downregulation of ACE 2
Lei et al. Circ Res. 2021
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8091897/
SARS-CoV-2(重症急性呼吸器症候群コロナウイルス2)の感染は、Sタンパク質(スパイク糖タンパク質)がACE(アンジオテンシン-変換酵素)2に結合することで成立する。逆説的だが、ACE2は循環器系の保護作用があり、SARS-CoV-1のSタンパク質は感染した肺のACE2レベルを低下させることで肺傷害を促進する。本研究では、Sプロテインが単独でACE2を低下させ、その結果、ミトコンドリア機能を阻害することで、血管内皮細胞(EC)にダメージを与えることを明らかにした。
血管内皮は血管の内表面を構成する薄い細胞の層で、血液の循環する内腔と接しています。血管内皮細胞は心臓から毛細血管まで全ての循環器系の内壁に並んでいます。 毛細血管を構成する細胞は内皮細胞のみです。血管内皮細胞の損傷は血管の障害に直結します。
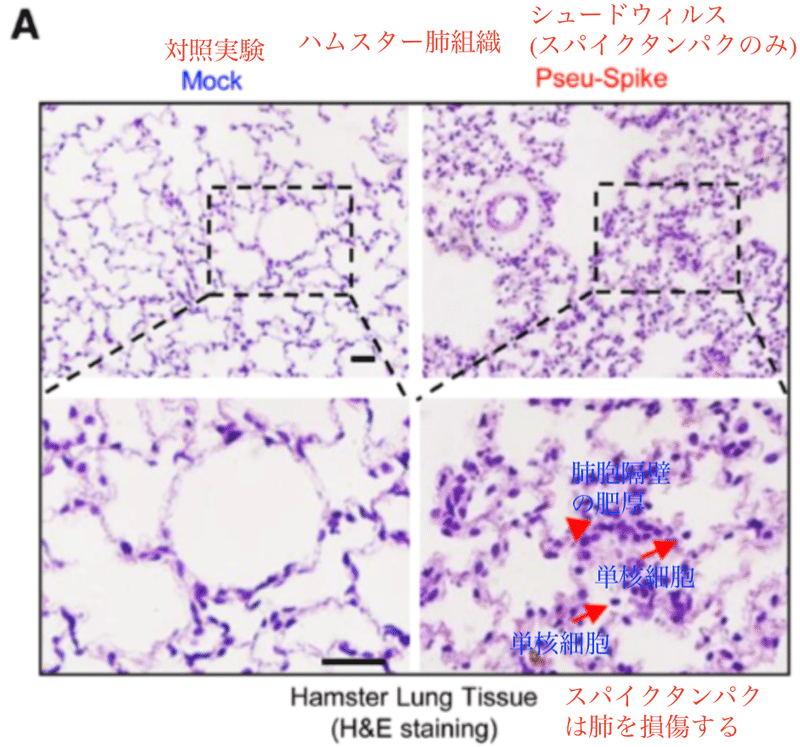
SARS-CoV-2感染は血管内皮の炎症を誘発し、内皮炎を引き起こします。ここではスパイクタンパクのみを発現させるためのシュード(偽 (ぎ))ウイルスをシリアハムスターに気管内投与しています。スパイクタンパクを投与したハムスターでは、肺胞隔壁の肥厚や単核細胞の浸潤の増加など、肺の損傷が明らかになりました (図A)。
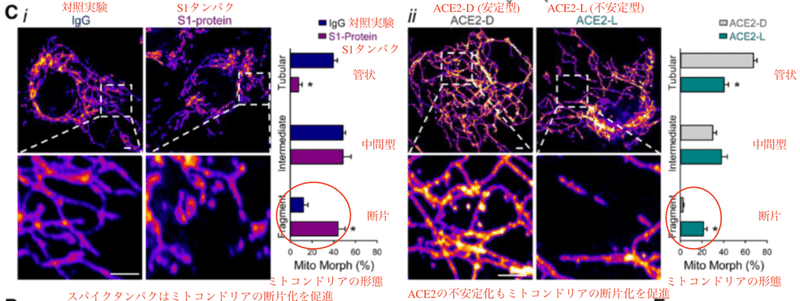
S1タンパク質を投与した血管内皮細胞の共焦点顕微鏡画像を見ると、ミトコンドリアの断片化が進んでいます (図C i)。このようなミトコンドリアの変化がACE2の量の減少によるものかどうかを調べるために、血管内皮細胞でACE2-D (リン酸化を模倣 (S680D) した安定型ACE2変異体) またはACE2-L (脱リン酸化を模倣した (S680L) 不安定型ACE2) を過剰発現させました。図C iiに示すように、ACE2-D (安定型) を持つ血管内皮細胞と比較して、ACE2-L (不安定型) を持つ血管内皮細胞では断片化したミトコンドリアが増えています。
酸素消費率と細胞外酸性化率のアッセイを行ったところ、ACE2-L (不安定型) を過剰発現させた血管内皮細胞は、ACE2-D (安定型) を過剰発現させた血管内皮細胞に比べ基礎的なミトコンドリア呼吸量、ATP産生量、最大呼吸量が減少していました。さらにACE2-L (不安定型) を過剰発現させると、基礎酸性化率、グルコース誘導解糖、最大解糖能、解糖予備能が増加しました。これはACE2が不安定になるとミトコンドリアの働きが低下する事を意味します。
また、S1タンパクを投与した血管内皮細胞はミトコンドリアの機能が低下しました。ACE2-D (安定型) 発現マウスの肺血管内皮細胞では、ミトコンドリア生合成関連遺伝子 (NRF1、HO1、TFAM) の発現レベルが上昇し、解糖関連遺伝子 (HK2、PFKFB3、ENO2 ) の発現レベルが低下していました。
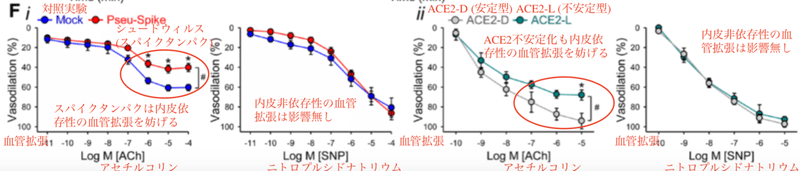
図F i に示すように、アセチルコリンによる内皮依存性の血管拡張は、シュードウイルスによるスパイクタンパクを投与したハムスターから分離した肺動脈では損なわれていましたが、ニトロプルシドナトリウムによる内皮非依存性の血管拡張には影響がありませんでした。さらにACE2-L (不安定型)発現マウスから分離した肺動脈では、ACE2-D (安定型)発現マウスに比べてアセチルコリンによる血管内皮拡張が阻害されていました (図F ii)。
この論文は、スパイクタンパクが単独で血管内皮に損傷を与え、ミトコンドリアの機能を低下させる一方で、解糖系が増加する事を明らかにしました。ACE2はコロナウイルスの受容体であると同時に酵素でもあり、アンジオテンシンII (血管収縮ペプチド) からアンジオテンシン-(1-7) (血管拡張ペプチド) への変換を行います。これらのペプチドの機能は血管の収縮/拡張による血圧の制御です。ACE2の低下は結果として血管の拡張機能を損なわせ、血管を狭め血圧を高くするでしょう。またミトコンドリアの異常からも分かるように血管内皮細胞そのものを障害し、炎症を起こすでしょう。これらがコロナワクチンによる血栓の原因となると考えられます。
#コロナ
*記事は個人の見解であり、所属組織を代表するものではありません。
この記事が気に入ったらサポートをしてみませんか?
