キンメモドキの発光器 ~盗んだタンパク質で光りだす~ 論文紹介
キンメモドキの発光器 ~盗んだタンパク質で光りだす~
論文名 Kleptoprotein bioluminescence: Parapriacanthus fish obtain luciferase from ostracod prey
盗タンパク質による生物発光 キンメモドキはウミホタルを食べてルシフェラーゼを手に入れる
著者名 Manabu Bessho-Uehara, Naoyuki Yamamoto, Shuji Shigenobu, Hitoshi Mori, Keiko Kuwata, Yuichi Oba
掲載誌 SCIENCE ADVANCES
掲載年 2020年
リンク https://advances.sciencemag.org/content/6/2/eaax4942
キンメモドキの生物発光に利用されるルシフェラーゼの由来を明らかにした2020年の論文です。
生物発光とは、生物が光を発することで、ホタルの光が有名ですホタルでは酵素が基質と反応することで光ります。キンメモドキでも同じ様に酵素反応によって青い光を放ちます。この光を放つための酵素と基質はそれぞれ、ルシフェラーゼとルシフェリンと名前が付いています。もともとはホタルの光の研究によって発見され、発光物質であるルシフェリンはルシファー(明けの明星)が名前の由来になっています。ルシフェラーゼはルシフェリンと反応する酵素という意味です。今では、ホタル以外にもいろいろな生物にルシフェラーゼとルシフェリンがあることが分かっていますが、生物によってルシフェリンは全く違う化合物であったり、ルシフェラーゼもその生物が持つルシフェリンとだけ反応するよう変異していたりしています。そのため、ルシフェリンは発光物質、ルシフェラーゼは発光物質を反応させ発光させる酵素ということになります。
ルシフェラーゼは酵素ですので、タンパク質になります。これはルシフェラーゼ遺伝子があり、その遺伝子情報に基づいて細胞内でタンパク質が作られていることを意味しています。実際に、ホタルではホタルルシフェラーゼ遺伝子が発見されています。発光生物は当然ルシフェラーゼ遺伝子を持っていると考えられていますが、実はそうではなかった、というのがこの論文になります。著者たちも驚いたようで、予想外の結果だったと論文で書いています。キンメモドキはウミホタルのルシフェラーゼを食べることで取り込んでいましたが、論文に書かれているように、タンパク質は通常消化されてしまいます。どうして消化されないのか、どうやってルシフェラーゼだけを取り込んでいるのか、不思議でなりません。例えば、キンメモドキが食べることのないホタルのルシフェラーゼを与えてみたらどうなるのでしょうか?ルシフェラーゼを選択的に取り込む機構の発見のヒントになるかもしれません。
この論文の討論では、進化についても触れています。これまで進化というとゲノム中の遺伝子の変異に基づいて考えられていました。しかし、この論文で発見された他の生物のタンパク質をそのまま利用するという方法は、遺伝子の変異に基づかない進化の方法になります。キンメモドキ以外の生物でもこのような現象があるのであれば、この現象を考慮して進化を考えていく必要があるかもしれません。
こちらのサイトに著者の方による日本語での解説が掲載されています。論文には書かれていない裏話的なことも書いてあります。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・キンメモドキからはルシフェラーゼ遺伝子を発見できなかった。
・キンメモドキはエサにしているウミホタルからルシフェラーゼを取り込み、自身の生物発光に利用している。
[背景]
新奇形質の進化的獲得は常に遺伝子変異によって起こるものではありません。ときには、新規形質は別の場所で進化したコンポーネントを「盗む」ことで獲得できます。ヤドクガエルやオオカバマダラは食生活の中で無脊椎動物や植物から毒性のある分子を、ある種のクラゲや魚はエサから生物発光の基質を獲得しています。これらの場合、小さな有機化合物が獲得されます。他の動物はさらに進んで、無傷の細胞小器官や細胞をエサから盗んでいます。ある種のウミウシは、体内で光合成産物を得るために、エサとして食べた藻類から葉緑体を取り込み維持しています(「盗葉緑体」)。扁形動物やクシクラゲと同じように、多くの腹足動物は自身の刺胞細胞として使うために、エサとして食べた刺胞動物から刺胞を盗み保管しています(「盗刺胞」)。しかし、タンパク質は盗むには非常に壊れやすく消化されやすすぎると考えられていました。本研究では、進化的新規形質である生物発光を獲得するためのタンパク質窃盗として、知る限りでは初めての例を報告します。
生物の器官からの発光である生物発光は、一般的に新規形質の進化の例として挙げられます。生物発光をする動物として800属以上があり、そのうち200属くらいが条き類になります。(補足:条き類はシーラカンスやハイギョを含む一部を除いた大部分の硬骨魚のこと。)最近の分子系統解析は条き類の生物発光は独立して27回も進化したことを示唆しています。魚の生物発光は共生細菌または生得的に作られ、その両方のシステムは複数回に渡って進化しました。
一般的に、生物発光反応にはルシフェリンと呼ばれる基質とルシフェラーゼと呼ばれる酵素(タンパク質)、そして補助因子を伴うまたは伴わない酸素分子が必要となります。化合物であるセレンテラジンとヴァルグリンは内因性の生物発光をする魚によって使用されるルシフェリンとして同定されています。セレンテラジンはハダカイワシ目やワニトカゲギス目の深海魚を含む多くの発光海洋生物で見つかっています。これらの動物は、セレンテラジンを生成する貝虫類の捕食によって直接的に、または、貝虫類を捕食する動物の捕食によって間接的にセレンテラジンを獲得していると考えられています。(補足:貝虫類はウミホタルを含む小さな甲殻類のこと。)ウミホタルルシフェリンとも呼ばれるヴァルグリンは、もともとウミホタルの生物発光の基質として発見され、その後、沿岸の発光魚であるハタンポ科、テンジクダイ科、ガマアンコウ科で発見されました。これらの魚はたぶんヴァルグリンをエサである貝虫類から獲得しています。例えば、イサリビガマアンコウは一般的にカリフォルニアの沿岸に生息するものは発光しますが、エサとして適した生物発光をする貝虫類のいないビュージェット湾に生息するものは発光しません。ビュージェット湾のイサリビガマアンコウはヴァルグリンが無いため、発光することができませんが、ヴァルグリンを直接注入する、または、ウミホタルをエサとして与えることで、発光することができます。上記のように、魚のルシフェリンについての知見は増えていく一方で、生物発光魚は内在性のルシフェラーゼを持っていると信じられているにもかかわらず、ルシフェラーゼの遺伝子やタンパク質は内因性の生物発光をする魚から発見されていません。
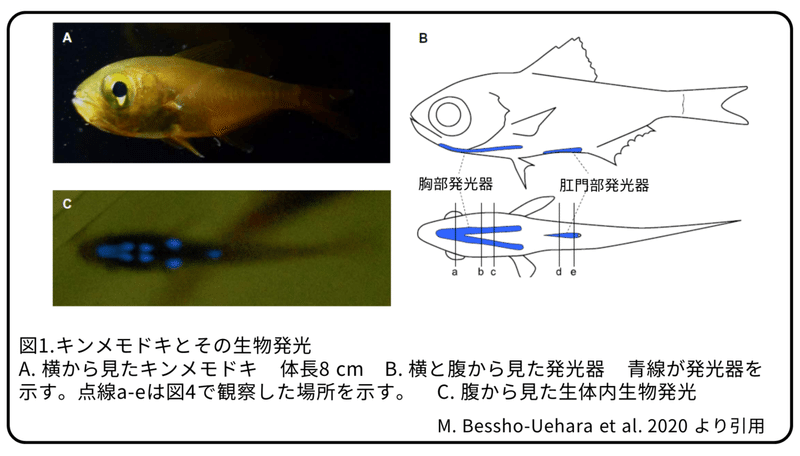
キンメモドキは西太平洋からインド洋にかけて沿岸に分布する浅瀬魚です(図1A,2A)。日中は、岩場やサンゴ礁の下で群泳することが知られている夜行性の魚であるキンメモドキは、腹側に2つの発光器を持っています(図1B,2C,F)。ひとつは、幽門垂の最初のペアから伸び、峡部から胸部の半透明な筋肉の下の腹ビレの基部に位置するY型の胸部発光器で、もう一つは、直腸と肛門にある直線上の肛門部発光器です。1958年に、温水と冷水でキンメモドキの発光器から抽出した溶液を使って、ルシフェリン-ルシフェラーゼ反応による発光が確かめられました。また、この抽出液がウミホタルから抽出した溶液と反応し発光することが発見されました。同時に、キンメモドキのルシフェリンは幽門垂に濃縮されること、このルシフェリンの結晶は化学的にヴァルグリンと同等であることが分かりました(図2D)。キンメモドキの胃の中からウミホタルが見つかったことと合わせて、これらの発見から、キンメモドキはエサとして食べた貝虫類からヴァルグリンを獲得し、生物発光に利用していると考えられました。本研究では、キンメモドキからのルシフェラーゼの同定と、この酵素がこの魚によって生産されたのではなく、エサとして食べた貝虫類から取り込まれたという予想外の結果を報告します。

[結果]
生きているキンメモドキは、頭上からの弱い光に反応して、ぼんやりとした青色の発光を胸部と肛門部から同時に行います(図1C)。この行動は、「カウンターイルミネーション」と名付けられた腹側の生物発光を自身の影を目立たなくするために使うイサリビガマアンコウの行動と似ています。
キンメモドキの発光反応は、発光器からのルシフェラーゼ粗抽出液と幽門垂からのルシフェリン抽出液を混ぜ合わせることで、青色光を再現できることを確かめました(図3A)。ルシフェラーゼ抽出液はヴァルグリンと反応し、以前の報告されたように、ルシフェリン抽出液はウミホタルの粗抽出液と反応しました。生体外での発光スペクトルはキンメモドキとウミホタルの生体内発光スペクトルと一致しました(図3A)。
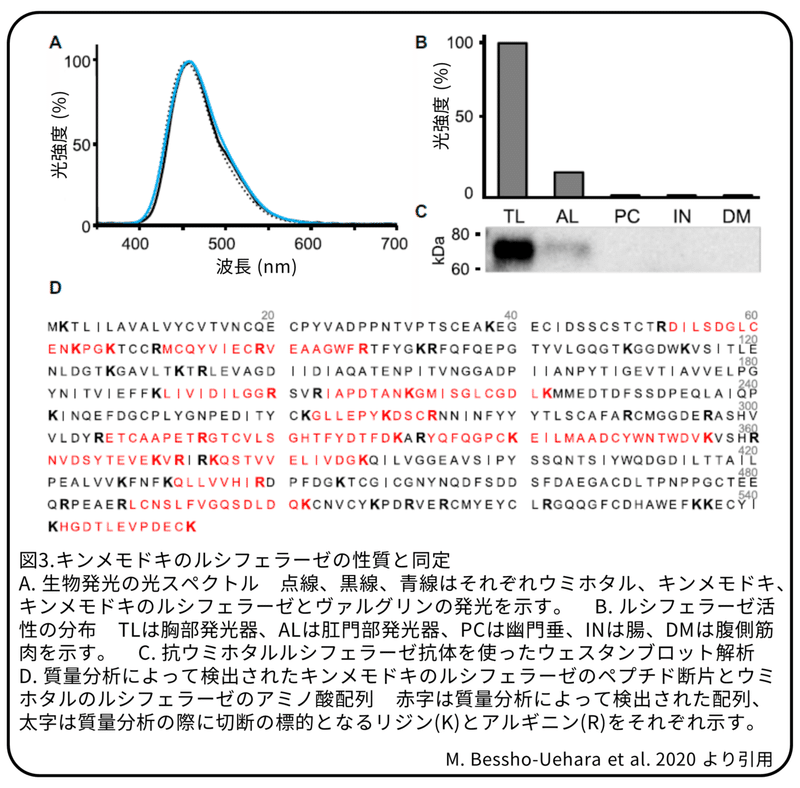
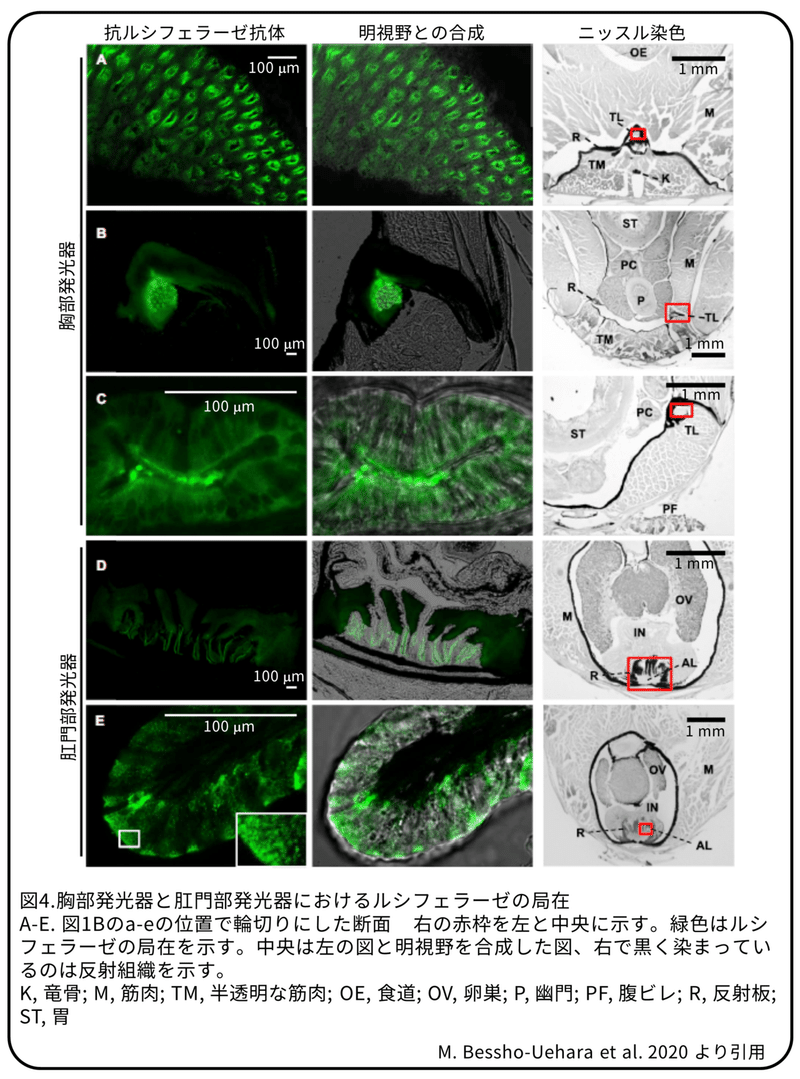
ルシフェラーゼ活性は、主に胸部発光器と肛門部発光器の抽出液から検出されました(図3B)。200個の胸部発光器を材料に、陰イオン交換カラムとサイズ排除クロマトグラフィー技術を使って、粗抽出液の115倍以上の活性を持つ溶液を精製しました。(補足:一連の操作でルシフェラーゼが濃縮されたため活性が上昇した。)質量分析によって、精製されたキンメモドキのルシフェラーゼのペプチド断片のパターンは、発光貝中類であるトガリウミホタルのルシフェラーゼと全長の41%の範囲で正確に一致することが分かりました(図3D)。(補足:質量分析は、タンパク質をいくつかのペプチド断片に分解しその質量などからペプチド断片のアミノ酸配列を決定する方法。)抗ウミホタルルシフェラーゼ抗体を使ったウェスタンブロット解析では、幽門垂、腸、筋肉ではなく胸部発光器と肛門部発光器の抽出液で、抗体反応のバンドがウミホタルルシフェラーゼの大きさと一致することが分かりました(図3C)。これはルシフェラーゼの酵素活性の分布と同じです。免疫組織化学では、発光器の細胞の側膜と細胞基質に陽性反応が見られました(図4)。これらの結果から、キンメモドキはトガリウミホタルとほぼ同一のルシフェラーゼタンパク質を使用していると考えられます。
ウミホタルのルシフェラーゼ遺伝子がキンメモドキのゲノムに含まれているかどうかを調べるために、ウミホタルルシフェラーゼに似た遺伝子または転写産物の有無を調べました。RNA-seq解析では、キンメモドキの2つの発光器または他の器官にはウミホタルルシフェラーゼと考えられる転写産物は見つかりませんでした。(補足:RNA-seq解析は、そこに含まれる全てのmRNAの配列を解析する手法。この場合は、発光器などから全てのmRNAを抽出し配列を解析した。)発光器から抽出したmRNAを使った生体外翻訳分析では、ルシフェラーゼ活性をもったタンパク質は翻訳されませんでした。(補足:生体外翻訳は細胞を壊した溶液にmRNAを加えることで、試験管内で加えたmRNAからタンパク質を翻訳させる方法。)遺伝子特異的なプライマーを使ったPCR分析では、キンメモドキのゲノムからウミホタルルシフェラーゼ遺伝子を増幅できませんでした。これらの結果から、トガリウミホタルからキンメモドキへのルシフェラーゼ遺伝子の水平伝播の可能性は低いと考えられます。(補足:遺伝子の水平伝播は、異なる種の遺伝子が侵入してゲノムに組み込まれること。キンメモドキとウミホタルのルシフェラーゼが同一であったことから水平伝播の可能性が考えられた。)
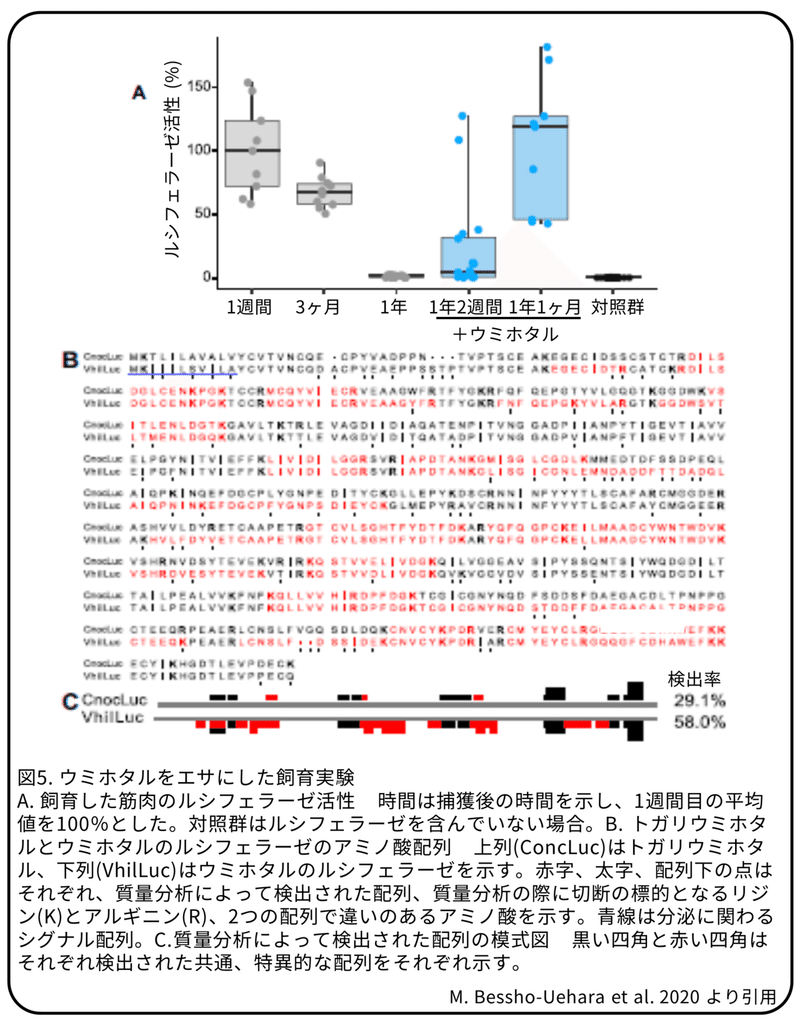
キンメモドキが外来のタンパク質を獲得しているという仮説を検証するために、長期飼育実験を行いました。水槽で発光しない魚の肉をエサとして与え続けたところ、数カ月後にはキンメモドキのルシフェラーゼ活性は減少しました。続けて、トガリウミホタルではなくウミホタルをエサとして数週間与えたところ、発光器のルシフェラーゼ活性が回復しました(図5A)。抗ウミホタルルシフェラーゼ抗体を使った免疫沈降法によって濃縮された溶液を質量分析したところ、ウミホタルをエサとして与えた魚の発光器からウミホタルの持つルシフェラーゼに特徴的なペプチド断片が見つかりました(図5B,C)。この結果から、キンメモドキには外来タンパク質を取り込むシステムが存在することを明らかになりました。
ウミホタルルシフェラーゼの酵素安定性を調べました。ウミホタルから精製したルシフェラーゼと遺伝子技術によって生産されたトガリウミホタルのルシフェラーゼは、タンパク質分解酵素、熱、尿素に対して非常に強い耐性を持っていましたが、還元剤によって活性は失われました。(補足:尿素はタンパク質の立体構造を壊し、還元剤はタンパク質内にあるジスルフィド結合を切断することで酵素活性を失わせる。)
[考察]
本研究では、生きているキンメモドキの生物発光を観察し、この魚とウミホタルの間でルシフェリン-ルシフェラーゼ反応が起こることを確認しました。キンメモドキの発光器から精製したルシフェラーゼは質量分析によって、トガリウミホタルのルシフェラーゼと一致することが分かりました。RNA-seq、ゲノムPCR、生体外翻訳解析の結果から、ルシフェラーゼ遺伝子はこの魚のゲノムには含まれていない可能性が考えられました。飼育実験によって、ルシフェラーゼはエサに由来することが明らかになりました。つまり、キンメモドキの発光器にあるルシフェラーゼはエサであるウミホタルを食べることで供給されています。知る限りでは、これは食物源からの酵素の取り込みと再利用だけでなく、このメカニズムが進化的新規形質である生物発光につながっているという点でも初めての例になります。この「盗まれたタンパク質」は盗葉緑体や盗刺胞と比較することができます。これらの現象との類似性から、本研究によって発見されたこの現象を「盗タンパク質」と名付けることを提案します。
通常であれば、摂取したタンパク質は魚の幽門垂などの消化システムによってアミノ酸やペプチド断片へと分解され栄養素として腸壁から吸収されるため、生物発光をする魚の盗タンパク質は予想外でした。これは、摂取されたタンパク質の本来の構造と酵素活性は、消化管を通過する間に通常は維持されなくなることを意味しています。しかし、完全に分解されないタンパク質を取り込む現象は、いくつかの動物の免疫システムで報告されています。例えば、哺乳類の腸上皮にあるM細胞は、高分子や微生物を飲作用によって細胞に取り込むことで免疫システムに重要な役割を果たしています。(補足:飲作用は細胞が細胞外液を取り込むこと。この場合は細胞外液と同時に高分子などを取り込んでいる。)同様の抗原収集機能はコイ科の魚の腸上皮で報告され、M細胞に似た細胞があるサケ科の魚の腸に存在することが報告されています。タンパク質を取り込むためのこのメカニズムは選択的に機能することはなく、取り込まれたタンパク質は本来の機能を使われることはありませんが、これらの免疫システムはキンメモドキの生物発光における盗タンパク質の役割を担うために進化の過程で取り込まれた可能性があります。ウミホタルルシフェラーゼがキンメモドキにおいて盗タンパク質生物発光に活用された理由の一部は、その高いタンパク質分解耐性と非常に安定した性質にあると考えています。ウミホタルルシフェラーゼを利用した盗タンパク質生物発光は、他の硬骨魚類、例えば、キンメモドキと同様に、生物発光にヴァルグリンを使用し、その発光器が消化管とつながっているテンジクダイ科のツマグロイシモチやクロスジスカシテングダイ、でも並行して進化した可能性があります。
本研究では、発光する浅瀬魚であるキンメモドキがエサであるトガリウミホタルから獲得したウミホタルルシフェラーゼを自身の生物発光に利用していることを明らかにしました。盗タンパク質の利用は生物発光の新規分類ですので、共生細菌または内因性のルシフェラーゼを利用した発光というこれまでの2つの生物発光に付け加える3番目の仕組みになります。これらの結果から、盗タンパク質は生物発光以外の生物的過程でも発見され、標準的なゲノムに基づいた分子進化と並行して進化的革新のもう一つの方法として働いている可能性が考えられます。
よろしくお願いします。
