mCOVID-19 vaccine efficacy and effectiveness—the elephant(not) in the room(メモ)
Lancet Microbe 2021
Published Online
April 20, 2021
https://doi.org/10.1016/
S2666-5247(21)00069-0
Approximately 96 COVID-19 vaccines are at various
stages of clinical development.1
At present, we have the
interim results of four studies published in scientific
journals (on the Pfizer–BioNTech BNT162b2 mRNA
vaccine,2
the Moderna–US National Institutes of
Health [NIH] mRNA-1273 vaccine,3
the AstraZeneca–
Oxford ChAdOx1 nCov-19 vaccine,4
and the Gamaleya
GamCovidVac [Sputnik V] vaccine)5
and three studies
through the US Food and Drug Administration
(FDA) briefing documents (on the Pfizer–BioNTech,6
Moderna–NIH,7
and Johnson & Johnson [J&J] Ad26.
COV2.S vaccines).8
Furthermore, excerpts of these results
have been widely communicated and debated through
press releases and media, sometimes in misleading
ways.9
Although attention has focused on vaccine
efficacy and comparing the reduction of the number
of symptomatic cases, fully understanding the efficacy
and effectiveness of vaccines is less straightforward
than it might seem. Depending on how the effect size
is expressed, a quite different picture might emerge
(figure; appendix).
Vaccine efficacy is generally reported as a relative risk
reduction (RRR). It uses the relative risk (RR)—ie, the
ratio of attack rates with and without a vaccine—which
is expressed as 1–RR. Ranking by reported efficacy gives
relative risk reductions of 95% for the Pfizer–BioNTech,
94% for the Moderna–NIH, 90% for the Gamaleya,
67% for the J&J, and 67% for the AstraZeneca–Oxford
vaccines. However, RRR should be seen against the
background risk of being infected and becoming ill
with COVID-19, which varies between populations and
over time. Although the RRR considers only participants
who could benefit from the vaccine, the absolute risk
reduction (ARR), which is the difference between attack
rates with and without a vaccine, considers the whole
population. ARRs tend to be ignored because they give
a much less impressive effect size than RRRs: 1·3% for
the AstraZeneca–Oxford, 1·2% for the Moderna–NIH,
1·2% for the J&J, 0·93% for the Gamaleya, and 0·84% for
the Pfizer–BioNTech vaccines.
ARR is also used to derive an estimate of vaccine
effectiveness, which is the number needed to vaccinate
(NNV) to prevent one more case of COVID-19 as 1/ARR.
NNVs bring a different perspective: 76 for the Moderna–
NIH, 78 for the AstraZeneca–Oxford, 80 for the Gamaleya,
84 for the J&J, and 117 for the Pfizer–BioNTech vaccines.
The explanation lies in the combination of vaccine
efficacy and different background risks of COVID-19
across studies: 0·9% for the Pfizer–BioNTech, 1% for the
Gamaleya, 1·4% for the Moderna–NIH, 1·8% for the J&J,
and 1·9% for the AstraZeneca–Oxford vaccines.
ARR (and NNV) are sensitive to background risk—
the higher the risk, the higher the effectiveness—as
exemplified by the analyses of the J&J’s vaccine on
centrally confirmed cases compared with all cases:8
both
the numerator and denominator change, RRR does
not change (66–67%), but the one-third increase in
attack rates in the unvaccinated group (from 1·8% to
2·4%) translates in a one-fourth decrease in NNV (from
84 to 64).
See Online for appendix
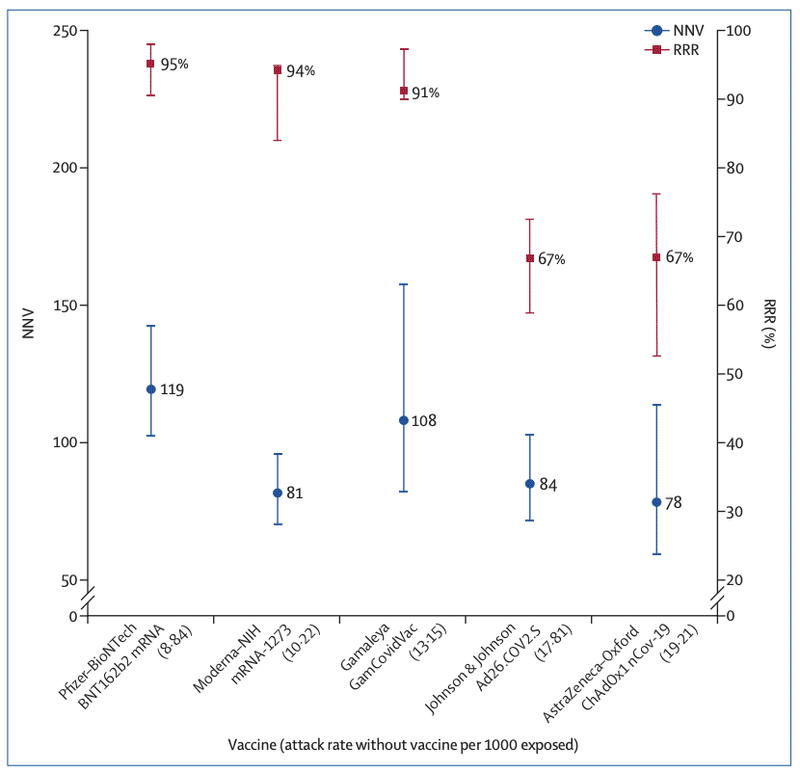
Figure: RRR and NNV with 95% CI ranked by attack rate in the unvaccinated (placebo) group for five
COVID-19 vaccines
The lower the NNV and the higher the RRR, the better the vaccine efficacy. Details are in the appendix (p 3).
RRR=relative risk reduction. NNV=numbers needed to vaccinate. NIH=US National Institutes of Health
There are many lessons to learn from the way studies
are conducted and results are presented. With the use
of only RRRs, and omitting ARRs, reporting bias is
introduced, which affects the interpretation of vaccine
efficacy.10 When communicating about vaccine efficacy,
especially for public health decisions such as choosing
the type of vaccines to purchase and deploy, having a
full picture of what the data actually show is important,
and ensuring comparisons are based on the combined
evidence that puts vaccine trial results in context and not
just looking at one summary measure, is also important.
Such decisions should be properly informed by detailed
understanding of study results, requiring access to full
datasets and independent scrutiny and analyses.
Unfortunately, comparing vaccines on the basis of
currently available trial (interim) data is made even more
difficult by disparate study protocols, including primary
endpoints (such as what is considered a COVID-19
case, and when is this assessed), types of placebo, study
populations, background risks of COVID-19 during the
study, duration of exposure, and different definitions
of populations for analyses both within and between
studies, as well as definitions of endpoints and statistical
methods for efficacy. Importantly, we are left with the
unanswered question as to whether a vaccine with a
given efficacy in the study population will have the same
efficacy in another population with different levels of
background risk of COVID-19. This is not a trivial question
because transmission intensity varies between countries,
affected by factors such as public health interventions
and virus variants. The only reported indication of
vaccine effectiveness is the Israeli mass vaccination
campaign using the Pfizer–BioNTech product. Although
the design and methodology are radically different from
the randomised trial,2
Dagan and colleagues11 report an
RRR of 94%, which is essentially the same as the RRR of
the phase 3 trial (95%) but with an ARR of 0·46%, which
translates into an NNV of 217 (when the ARR was 0·84%
and the NNV was 119 in the phase 3 trial). This means in
a real-life setting, 1·8 times more subjects might need
to be vaccinated to prevent one more case of COVID-19
than predicted in the corresponding clinical trial.
Uncoordinated phase 3 trials do not satisfy public
health requirements; platform trials designed to address
public health relevant questions with a common
protocol will allow decisions to be made, informed
by common criteria and uniform assessment. These
considerations on efficacy and effectiveness are based
on studies measuring prevention of mild to moderate
COVID-19 infection; they were not designed to conclude
on prevention of hospitalisation, severe disease, or
death, or on prevention of infection and transmission
potential. Assessing the suitability of vaccines must
consider all indicators, and involve safety, deployability,
availability, and costs.
We declare no competing interests.
Copyright © 2021 The Author(s). Published by Elsevier Ltd. This is an Open Access
article under the CC BY-NC-ND 4.0 license.
*Piero Olliaro, Els Torreele, Michel Vaillant
piero.olliaro@ndm.ox.ac.uk
Centre for Tropical Medicine and Global Health, Nuffield Department of Medicine,
University of Oxford, Oxford OX3 7FZ, UK (PO); Institute for Innovation and
Public Purpose, University College London, London, UK (ET); Competence Center
for Methodology and Statistics, Luxembourg Institute of Health, Strassen,
Luxemburg (MV)
1 Zimmer C, Corum J, Wee S-L. Covid-19 Vaccine Tracker. https://www.
(accessed March 10, 2021).
2 Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2
mRNA COVID-19 Vaccine. N Engl J Med 2020; 383: 2603–15.
3 Baden LR, El Sahly HM, Essink B, et al. Efficacy and safety of the mRNA-1273
SARS-CoV-2 Vaccine. N Engl J Med 2021; 384: 403–16.
4 Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1
nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of
four randomised controlled trials in Brazil, South Africa, and the UK.
Lancet 2021; 397: 99–111.
5 Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an
rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine:
an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet
2021; 397: 671–81.
6 US Food and Drug Administration. Vaccines and Related Biological Products
Advisory Committee meeting: FDA briefing document. Dec 10, 2020.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/
vaccines-and-related-biological-products-advisory-committee-december10-2020-meeting-announcement (accessed March 10, 2021).
7 US Food and Drug Administration. Vaccines and Related Biological Products
Advisory Committee meeting: FDA briefing document. Dec 17, 2020.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/
vaccines-and-related-biological-products-advisory-committee-december17-2020-meeting-announcement (accessed March 10, 2021).
8 US Food and Drug Administration. Vaccines and Related Biological Products
Advisory Committee meeting: FDA briefing document. Feb 26, 2021.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/
vaccines-and-related-biological-products-advisory-committee-february26-2021-meeting-announcement (accessed March 10, 2021).
9 Olliaro P. What does 95% COVID-19 vaccine efficacy really mean?
Lancet Infect Dis 2021; published online Feb 17. https://doi.org/10.1016/
S1473-3099(21)00075-X.
10 Brown RB. Outcome reporting bias in COVID-19 mRNA vaccine clinical
trials. Medicina (Kaunas) 2021; 57: 199.
11 Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA COVID-19 vaccine in a
nationwide mass vaccination setting. N Engl J Med 2021; published online
Feb 24. https://doi.org/10.1056/NEJMoa2101765

この記事が気に入ったらサポートをしてみませんか?

